Питательная среда для культивирования каллусной культуры болиголова пятнистого (conium maculatum l)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Изобретение представляет собой питательную среду для культивирования каллусной ткани болиголова пятнистого, содержащую компоненты в следующем количестве, мг/л: KNO3 1900; KH2PO4 170; NH4NO3 1650; MgSO4×7H2O 370; CaCl2×2H2O 440; FeSO4×7H2O 37,3; Na2EDTA×2H2O 27,8; KI 0,83; H3BO3 6,2; MnSO4×4H2O 22,3; CoCl2×6Н2О 0,025; CuSO4×5Н2О 0,025; ZnSO4×7H2O 8,6; Na2MoO4×2Н2О 0,25; тиамин-HCl 0,5-1,5; пиридоксин-HCl 0,4-0,6; никотиновая кислота 0,4-0,6; сахароза 30000; агар-агар 10000; НУК 1-3; 6-БАП 0,1-1; вода дистиллированная - остальное. Изобретение позволяет культивировать каллусную ткань, а также получить высокие значения прироста биомассы Conium maculatum. 2 табл., 3 пр.
Реферат
Изобретение относится к области биотехнологии, в частности к культивированию клеточных культур лекарственных растений, и может быть использовано в медицине для получения сырья, содержащего биологически активные вещества, а также при введении в культуру in vitro других представителей лекарственных растений, получение которых затруднено из-за выделения ядовитых соединений в питательную среду.
Область применения - медицинская (фармацевтическая) промышленность, получение нового вида сырья в качестве источника биологически активных веществ растительного происхождения (в частности, алкалоидов) для получения новых высокоэффективных лекарственных препаратов.
Питательная среда содержит KNO3, NH4NO3, CaCl2×2H2O, MgSO4×7H2O, KH2PO4, FeSO4×7H2O, Na2EDTA×2H2O, Н3ВО3, MnSO4×4H2O, ZnSO4×7H2O, KI, Na2MoO42H2O, CuSO4×5H2O, CoCl2×6H2O, никотиновую кислоту, тиамин, пиридоксин, НУК, 6-БАП, сахарозу, агар-агар и воду при заданных соотношениях компонентов. Изобретение позволяет культивировать клеточную культуру Conium maculatum.
Болиголов пятнистый обладает широким спектром фармакологической активности. В народной медицине спиртовые настойки из болиголова применяются в качестве антибактериальных, гемостатических, общеукрепляющих средств, оказывают противовоспалительное, жаропонижающее и др. эффекты.
Известна питательная среда для культивирования каллусной ткани silene vulgaris (moench) garcke (Патент РФ 2169769, МПК C12N 5/04).
Питательная среда для культивирования каллусной ткани silene vulgaris (moench) garcke содержит макро- и микросоли по Мурасиге и Скугу; витамины, мг/л: фолиевую кислоту 0,5; рибофлавин 0,5; биотин 1,0; Са-пантотенат 1,0; пиридоксин 1,0; тиамин хлорид 1,0; никотинамид 2,0; кобаламин 0,0015; кинетин 1,5 мг/л или 6-БАП 0,5 мг/л; 2,4-Д 1,5-2,0 мг/л; сахарозу 1,5%; глюкозу 1,5%; агар 8000 мг/л, воду до 1 л.
Известна питательная среда для культивирования каллусной культуры artemisia annua 1. (Патент РФ, 2393217, МПК C12N 5/04).
Питательная среда для культивирования каллусной ткани Artemisia annua L. содержит агаризованную среду с макро- и микросолями по Мурасиге и Скугу, витамины, сахарозу, в качестве гормонов добавляют 6-БАП (6-бензиламинопурин) и НУК (α-нафтилуксусную кислоту) в соотношении 6-БАП - 0,2/ НУК - 0,5-1,0.
Известна питательная среда для выращивания культуры ткани раувольфии змеиной - продуцента алкалоидов (Патент РФ 2081561, МПК C12N 5/02, C12N 5, А01Н 4).
среде следующего состава (мг/л): KH2PO4-300-500; K2HPO43H2O-300-500; (NH4)2SO4-800-1000; NH4NO3 2500-3800; MgSO47H2O 1000-1500; Ca(NO3)24H2O - 1000-2000; NH4Cl 100-200; FeSO44H2O 60-80; NaEDTA - 100-200; Н3ВО3 10-12; KJ 700-1000; CoCl26H2O - 800-1000; NaMoO42H2O 0,2-0,3; MnSO45H2O - 0,22-0,23; CuSO45H2O 0,015-0,025; ZnSO44H2O - 1,7-8,6; тиамин 1-1,5; агар-агар 65000; сахароза 120000-130000.
Недостатками известных аналогов является их направленность на культивирование определенных видов растений: silene vulgaris, artemisia annua 1. раувольфии змеиной, следовательно, оптимизированная среда для выращивания этих видов не подойдет для выращивания Conium maculatum L.
Дополнительно в среду для культивирования silene vulgaris (moench) garcke добавляют фолиевую кислоту, рибофлавин, биотин, Са-пантотенат, кобаламин и глюкозу, среда для выращивания культуры ткани раувольфии змеиной содержит повышенное содержание сахарозы, это усложняет приготовление питательной среды и увеличивает ее стоимость.
Питательные среды для выращивания каллусной ткани Conium maculatum L из литературных источников нами не выявлены.
Задачей настоящего изобретения является ускорение роста каллусной ткани с высоким выходом биомассы.
Поставленная задача решается следующим образо: культивирование ткани производится на питательной агаризованной среде MS с добавлением витаминов, фитогормонов, сахарозы.
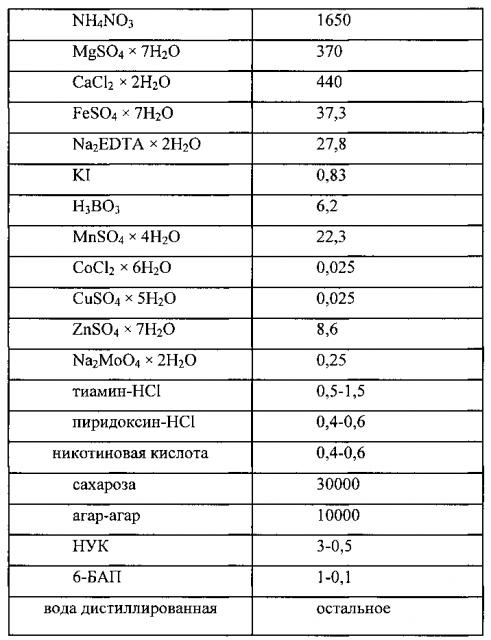
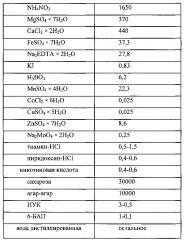
Содержание компонентов в питательной среде Мурасиге-Скуга представлено в таблице 1.
Для приготовления питательной среды готовят концентрат макросолей, при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей, хлорида кальция, хелата железа, витаминов. Макро- и микросоли, хлорид кальция, хелат железа, витамины в виде концентратов смешивают в небольшом количестве воды. Затем к полученной смеси добавляют сахарозу и все тщательно перемешивают. Раствор доводят дистиллированной водой до 1 л. В колбы на 500 мл насыпают по 3 г агара, разливают среду по 300 мл, закрывают фольгой и бумагой стерилизуют в автоклаве 20 мин при 1,2-1,4 атм. В простерилизованную питательную среду в условиях ламинарного бокса добавляют стимуляторы роста 1-3 НУК и 0,1 - 16-БАП, перемешивают и разливают в стерильные культуральные сосуды по 15 мл в каждый.
Ткань пересаживают в возрасте 30 суток. Культивирование каллусной ткани проводится при 26±1°С, влажности - 70%, в темноте.
Прирост каллусной ткани болиголова пятнистого оценивали в виде индекса прироста массы (таблица 2), который рассчитывается по формуле:
,
где m0 - начальная масса, г; m - конечная масса, г.
Технический результат - культивирование каллусной ткани Conium maculatum L, а также получение высоких значений прироста биомассы.
Пример 1
Для приготовления питательной среды готовят концентрат макросолей (KNO3 - 1900 мг/л, NH4NO3 - 1650 мг/л, MgSO4×7H2O 370 мг/л, KH2PO4 - 170 мг/л), при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей (Н3ВО3 - 6,2 мг/л, MnSO4×4H2O - 32,3 мг/л, ZnSO4×7H2O - 8,6 мг/л, Na2MoO4×2H2O - 0,25 мг/л, KI - 0,83 мг/л, CuSO4×5H2O - 0,025 мг/л, CoCl2×6H2O - 0,025 мг/л), Fe-хелата (FeSO4×7H2O - 37,3 мг/л, Na2EDTA×2H2O - 27,8 мг/л), CaCl2×2H2O, витаминов (пиридоксин-HCl - 0,4-0,6 мг/л, тиамин-HCl - 0,5-1,5 мг/л, никотиновая кислота-HCl - 0,4-0,6 мг/л). Макро- и микросоли, Fe-хелат, CaCl2×2H2O, витамины в виде концентратов смешивают в небольшом количестве воды. Раствор доводят дистиллированной водой до 1 л. В колбы на 500 мл насыпают по 3 г агара, по 9 г сахарозы, разливают среду по 300 мл, закрывают фольгой и стерилизуют в автоклаве 20 мин при 1,0 атм. Чашки Петри, сосуды для культивирования, пинцеты и скальпель стерилизуют в течение 2,5 часа в сухожаровом шкафу при 160°С. Затем в стерильную питательную среду в условиях ламинарного бокса добавляют НУК (2 мг/л) и 6-БАП (0,5 мг/л), размещают ее по культуральным сосудам. Ткань высаживают в возрасте 30 суток. Культивирование каллусной культуры проводится при 26±1°С, влажности - 70%, в темноте.
Пример 2
Для приготовления питательной среды готовят концентрат макросолей (KNO3 - 1900 мг/л, NH4NO3 - 1650 мг/л, MgSO4×7H2O 370 мг/л, KH2PO4 - 170 мг/л), при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей (Н3ВО3 - 6,2 мг/л, MnSO4×4H2O - 32,3 мг/л, ZnSO4×7H2O - 8,6 мг/л, Na2MoO4×2H2O - 0,25 мг/л, KI - 0,83 мг/л, CuSO4×5H2O - 0,025 мг/л, CoCl2×6H2O - 0,025 мг/л), Fe-хелата (FeSO4×7H2O - 37,3 мг/л, Na2EDTA×2H2O - 27,8 мг/л), CaCl2×2H2O, витаминов (пиридоксин-HCl - 0,4-0,6 мг/л, тиамин-HCl - 0,5-1,5 мг/л, никотиновая кислота-HCl -0,4-0,6 мг/л). Макро- и микросоли, Fe-хелат, CaCl2×2H2O, витамины в виде концентратов смешивают в небольшом количестве воды. Раствор доводят дистиллированной водой до 1 л. В колбы на 500 мл насыпают по 3 г агара, по 9 г сахарозы, разливают среду по 300 мл, закрывают фольгой и стерилизуют в автоклаве 20 мин при 1,0 атм. Чашки Петри, сосуды для культивирования, пинцеты и скальпель стерилизуют в течение 2,5 часа в сухожаровом шкафу при 160°С. Затем в стерильную питательную среду в условиях ламинарного бокса добавляют НУК (2 мг/л) и 6-БАП (1 мг/л), размещают ее по культуральным сосудам. Ткань высаживают в возрасте 30 суток. Культивирование каллусной культуры проводится при 26±1°С, влажности - 70%, в темноте.
Пример 3
Для приготовления питательной среды готовят концентрат макросолей (KNO3 - 1900 мг/л, NH4NO3 - 1650 мг/л, MgSO4×7H2O 370 мг/л, KH2PO4 - 170 мг/л), при этом каждая из макросолей растворяется последовательно в небольшом количестве воды, а затем объем доводится до 1 л. Аналогично готовятся концентраты микросолей (Н3ВО3 - 6,2 мг/л, MnSO4×4H2O - 32,3 мг/л, ZnSO4×7H2O - 8,6 мг/л, Na2MoO4×2H2O - 0,25 мг/л, KI - 0,83 мг/л, CuSO4×5H2O - 0,025 мг/л, CoCl2×6H2O - 0,025 мг/л), Fe-хелата (FeSO4×7H2O - 37,3 мг/л, Na2EDTA×2H2O - 27,8 мг/л), CaCl2×2H2O, витаминов (пиридоксин-HCl - 0,4-0,6 мг/л, тиамин-HCl - 0,5-1,5 мг/л, никотиновая кислота-HCl - 0,4-0,6 мг/л). Макро- и микросоли, Fe-хелат, CaCl2×2H2O, витамины в виде концентратов смешивают в небольшом количестве воды. Раствор доводят дистиллированной водой до 1 л. В колбы на 500 мл насыпают по 3 г агара, по 9 г сахарозы, разливают среду по 300 мл, закрывают фольгой и стерилизуют в автоклаве 20 мин при 1,0 атм. Чашки Петри, сосуды для культивирования, пинцеты и скальпель стерилизуют в течение 2,5 часа в сухожаровом шкафу при 160°С. Затем в стерильную питательную среду в условиях ламинарного бокса добавляют НУК (1 мг/л) и 6-БАП (0,5 мг/л), размещают ее по культуральным сосудам. Ткань высаживают в возрасте 30 суток. Культивирование каллусной культуры проводится при 26±1°С, влажности - 70%, в темноте.
Питательная среда для культивирования каллусной ткани болиголова пятнистого, характеризующаяся тем, что содержит компоненты в следующем количестве, мг/л:
| KNO3 | 1900 |
| KH2PO4 | 170 |
| NH4NO3 | 1650 |
| MgSO4×7H2O | 370 |
| CaCl2×2H2O | 440 |
| FeSO4×7H2O | 37,3 |
| Na2EDTA×2H2O | 27,8 |
| KI | 0,83 |
| H3BO3 | 6,2 |
| MnSO4×4H2O | 22,3 |
| CoCl2×6Н2О | 0,025 |
| CuSO4×5Н2О | 0,025 |
| ZnSO4×7H2O | 8,6 |
| Na2MoO4×2Н2О | 0,25 |
| тиамин-HCl | 0,5-1,5 |
| пиридоксин-HCl | 0,4-0,6 |
| никотиновая кислота | 0,4-0,6 |
| сахароза | 30000 |
| агар-агар | 10000 |
| НУК | 1-3 |
| 6-БАП | 0,1-1 |
| вода дистиллированная | остальное |