Антитело к аннексину а1
Иллюстрации
Показать всеНастоящее изобретение относится к биохимии, в частности к антителу против аннексина (Аnх-А1) человека, имеющему следующие гипервариабельные участки (CDR): VLCDR1 представляет собой KASENVVTYVS, VLCDR2 представляет собой GASNRYT, VLCDR3 представляет собой GQGYSYPYT, VHCDR1 представляет собой GYTFTNYWIG, VHCDR2 представляет собой DIYPGGDYTNYNEKFKG, и VHCDR3 представляет собой WGLGYYFDY. Кроме того, настоящее изобретение раскрывает клеточную гибридому, депонированную в Европейской коллекции клеточных культур (ECACC) под номером 10060301, которая продуцирует указанное антитело. Антитело согласно настоящему изобретению используют в качестве активного ингредиента в композиции для ингибирования активации Т-клеток, а также для получения лекарственного средства для лечения заболеваний, вызванных аберрантной активацией Т-клеток, таких как, например, ревматоидный артрит или рассеянный склероз. Настоящее изобретение обеспечивает новое моноклональное антитело, специфично ингибирующее активацию Т-клеток без каких-либо неблагоприятных цитотоксических эффектов. 5 н. и 13 з.п. ф-лы, 17 ил., 4 пр.
Реферат
Область изобретения
Настоящее изобретение относится к специфично связывающимся молекулам, в частности к антителам и их фрагментам, которые связываются с аннексином-А1, и к гибридомным линиям клеток, которые производят такие специфично связывающиеся молекулы. Такие специфично связывающиеся молекулы применимы в лечении заболеваний, опосредованных Т-клетками.
Предпосылки создания изобретения
Глюкокортикоиды (ГК) часто применяют для лечения ряда хронических аутоиммунных заболеваний благодаря их способности одновременно блокировать как врожденный, так и приобретенный иммунный ответ. Исследования последних десяти лет, проведенные авторами настоящего изобретения и другими исследовательскими группами, показали, что некоторые из воспалительных эффектов, оказываемых ГК на врожденный иммунный ответ, опосредованы белком Аннексином-1 (Annexin-1, Anx-А1). Было показано, что этот белок осуществляет гомеостатическую регуляцию многих типов клеток, в том числе нейтрофилов, макрофагов и клеток эндотелия. Однако одним аспектом, которому не уделяли никакого внимания, является роль Anx-А1 в адаптивном иммунном ответе. Это вызывает удивление, с учетом того, что, как предполагается, Anx-А1 является одним из вторичных посредников фармакологического действия ГК.
Авторы данного изобретения ранее показали, что Anx-А1 играет гомеостатическую роль в Т-клетках, за счет модулировния интенсивности передачи сигналов рецептором Т-клеток (TCR) (D'Acquisto et al., Blood 109: 1095-1102, 2007). Более того, авторы настоящего изобретения показали, что высокий уровень Anx-А1 снижает порог активации Т-клеток и способствует их дифференцировке в клетки Th1, в то время как у мышей, дефицитных по Anx-А1, наблюдают нарушение активации Т-клеток и более интенсивную дифференцировку в клетки Th2 (D'Acquisto et al., Eur. J. Immunol. 37: 3131-3142, 2007).
В публикации WO 2005/027965 описан механизм, за счет которого апоптотические нейтрофилы доставляют противовоспалительные сигналы к дендритным клеткам, а также идентифицированы антитела, которые препятствуют этому процессу.
Краткое описание изобретения
Авторами настоящего изобретения было идентифицировано моноклональное антитело, обладающее превосходными свойствами в плане специфичного ингибирования активации Т-клеток без каких-либо неблагоприятных цитотоксических эффектов. Такое антитело применимо в лечении заболеваний, опосредованных Т-клетками, например ревматоидного артрита или рассеянного склероза.
Соответственно, настоящее изобретение обеспечивает специфично связывающуюся молекулу, направленную против белка человека Anx-А1, имеющую аминокислотную последовательность, представленную на Фигуре 2А.
Определения
При использовании в настоящей заявке термина «специфично связывающаяся молекула» относится к члену пары молекул, обладающих специфичностью связывания по отношению друг к другу. Члены пары молекул со специфичным связыванием могут быть природными или полностью или частично синтетическими. Один из членов указанной пары молекул имеет на своей поверхности область, которая может представлять собой выступ или полость, которая специфично связывается и, следовательно, является ей комплементарной, с определенной пространственной и полярной структурой другого члена указанной пары молекул. Таким образом, члены такой пары обладают свойством специфичного связывания друг с другом. Примеры типов пар со специфичным связыванием включают антиген-антитело, биотин-авидин, гормон-рецептор гормона, рецептор-лиганд, фермент-субстрат. Настоящее изобретение в целом относится к реакциям типа антиген-антитело. Специфично связывающаяся молекула согласно настоящему изобретению связывается с Anx-A1c большим сродством, чем с другими молекулами, то есть специфично связывается с Anx-А1. Специфично связывающиеся молекулы, которые связываются с Anx-А1, включают антитела к Anx-А1 и их аптамеры. Специфично связывающиеся молекулы согласно настоящему изобретению, как правило, представляют собой антитела. Антитела к Anx-А1 согласно настоящему изобретению функционируют, блокируя активацию Т-клеток и, таким образом, при введении в организм, их можно применять для лечения заболеваний, опосредованных Т-клетками, которые обычно обусловлены аберрантной активацией Т-клеток.
Термин «антитело», используемый в настоящей заявке, относится к молекулам иммуноглобулина и иммунологически активным участкам молекул иммуноглобулина, то есть молекулам, содержащим сайт связывания антигена, который специфично связывается с антигеном, который является природным или частично или полностью получен синтетически. Этот термин также охватывает любой полипептид или белок, имеющий связывающий домен, который представляет собой связывающий домен антитела или гомологичен ему. Антитела могут быть получены из природных источников, или они могут быть частично или полностью синтетическими. Антитела представляют собой полипептиды, которые обычно содержат две идентичные тяжелые цепи и две идентичные легкие цепи, которые меньше, чем тяжелые цепи. У млекопитающих существуют два типа легких цепей, которые называют лямбда (λ) и каппа (κ). Каждая из тяжелых цепей и каждая из легких цепей состоит из вариабельной области и константной области. Вариабельную область тяжелой цепи обозначают как область VH, а вариабельную область легкой цепи обозначают как область VL. В случае легкой цепи каппа область VL может обозначаться как область VK. Каждая из вариабельных областей тяжелых и легких цепей включает в себя три гипервариабельных участка (участка, определяющих комплементарность, complementarity determining regions, CDR), CDR1, CDR2 и CDR3. Их обозначают как VLCDR1, VLCDR2, VLCDR3, VHCDR1, VHCDR2 и VHCDR3 соответственно. Примерами антител являются изотипы иммуноглобулинов (например, IgG, IgE, IgM, IgA и IgD) и их изотипические подклассы; фрагменты, содержащие антигенсвязывающий домен, такие как Fab, F(ab')2, Fv, scFv, dAb, Fd и диатела. Антитела могут быть поликлональными или моноклональными. Моноклональные антитела упоминаются в настоящей заявке как «МАТ».
Подробное описание изобретения
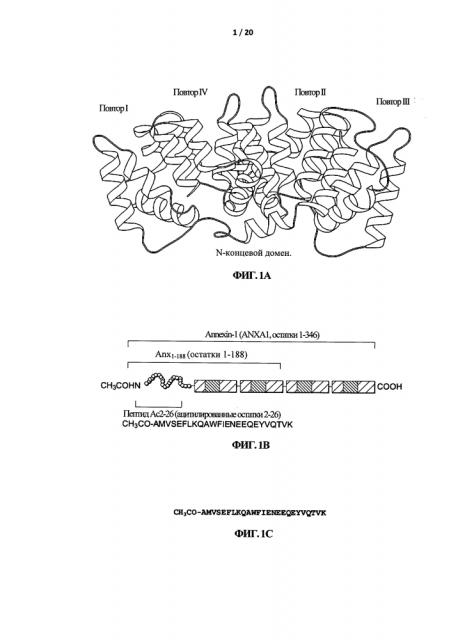
Аннексины представляют собой группу кальций- и фосфолипид-связывающих клеточных белков, также известных как липокортины. Семейство аннексинов состоит из 13 членов, включая Аннексин А1, Аннексин А2 и Аннексин А5. Аннексин А-1 также известен как Аннексин-1 и в данной заявке обозначен "Anx-А1". Аннексин-1 (Anx-А1) представляет собой белок с молекулярной массой 37 кДа, который изначально был описан как посредник действия глюкокортикоидов. За последние несколько лет появились доказательства того, что Anx-А1 выполняет гомеостатическую функцию в приобретенном иммунном ответе, в частности в Т-клетках, за счет изменения интенсивности сигналинга от Т-клеточного рецептора (TCR). Anx-А1 действует как эндогенный ингибитор воспаления в клетках системы врожденного иммунитета in vivo. На Фигуре 1А представлена ленточная диаграмма трехмерной структуры Anx-А1.
У человека присутствуют 8 нуклеотидных последовательностей, кодирующих Anx-А1. Из них транслируются только четыре, и, таким образом, существует четыре изоформы Anx-А1, обозначаемые как ANXA1-002, ANXA1-003, ANXA1-004 и ANXA1-006. Эти последовательности доступны на сайте Ensembl (www.ensembl.org) и обозначены как OTTHUMT00000052664 (ANXA1-002), OTTHUMT00000052665 (ANXA1-003), OTTHUMT00000052666 (ANXA1-004) и OTTHUMT00000052668 (ANXA1-006). Аминокислотная и нуклеотидная последовательности одной из изоформ человеческого Аннексина-1 (Anx-A1), ANXA1-003 приведены на Фигуре 2а. Аминокислотные и нуклеотидные последовательности изоформ ANXA1-002, ANXA1-004 и ANXA1-006 приведены на Фигурах 2b, 2с и 2d соответственно. Как можно видеть на Фигуре 2, изоформы ANXA1-002, ANXA1-004 и ANXA1-006 являются короткими спланированными вариантами ANXA1-003 или вариантами ANXA1-003 с небольшим числом аминокислотных замен.
В ряде исследований показано, что N-концевой пептид Anx-А1, называемый Ас.2-26, действует как биологически активный суррогат целого белка (см., напр., Lim et ah, Ргос Natl Acad Sci USA 95, 14535-9, 1998).
На Фигуре 1B схематично представлены повторы в составе аннексина и локализация такой биологически активной последовательности. Пептид Ас.2-26 представляет собой ацетилированный пептид с последовательностью аминокислотных остатков 2-26 из полноразмерной аминокислотной последовательности Anx-А1, показанной на Фигуре 2. Последовательность пептида Ас.2-26 показана на Фигуре 1С:
СН3СО-AMVSEFLKQAWFIENEEQEYVQTVK.
Биологическое действие Anx-А1 и его производных N-концевых биологически активных пептидов опосредовано членами семейства рецепторов формильных пептидов (FPR, formyl peptide receptor). Anx-A1 оказывает контррегуляторное действие на экстравазацию нейтрофилов и врожденный иммунитет за счет непосредственного связывания и активации одного из членов этого семейства, белка, подобного рецептору формильных пептидов-1 (Formyl Peptide Receptor-Like-1, FPRL-1). Авторами настоящего изобретения ранее было обнаружено, что стимуляция Т-клеток в присутствии hrAnx-A1 повышает уровень активации Т-клеток за счет стимуляции FPRL-1 (D'Acquisto et al., Blood 109: 1095-1102, 2007).
Специфично связывающиеся молекулы согласно настоящему изобретению связываются с Аннексином-1 (Anx-A1). Anx-А1, с которым связывается указанная специфично связывающаяся молекула в основном представляет собой Anx-А1 человека, имеющий полипептидную последовательность, приведенную на Фигуре 2А.
В первом своем аспекте настоящее изобретение обеспечивает специфично связывающуюся молекулу, направленную против белка Anx-А1 человека, имеющего аминокислотную последовательность, приведенную на Фигуре 2А.
Этот аспект настоящего изобретения также распространяется на специфично связывающиеся молекулы, которые содержат гипервариабельные участки (CDR) VLCDR1, VLCDR2, VLCDR3, VHCDR1, VHCDR2 и VHCDR3 специфично связывающейся молекулы согласно первому аспекту настоящего изобретения или аминокислотную последовательность, по меньшей мере на 70% идентичной каждому из соответствующих CDR. Специфично связывающаяся молекула, как правило, представляет собой антитело.
В одном из вариантов реализации специфично связывающаяся молекула содержит гипервариабельные участки (CDR) VLCDR1, VLCDR2, VLCDR3, VHCDR1, VHCDR2 и VHCDR3, каждый из которых имеет соответствующую аминокислотную последовательность, как указано ниже, где
VLCDR1 представляет собой KASENVVTYVS,
VLCDR2 представляет собой GASNRYT,
VLCDR3 представляет собой GQGYSYPYT,
VHCDR1 представляет собой GYTFTNYWIG,
VHCDR2 представляет собой DIYPGGDYTNYNEKFKG,
VHCDR3 представляет собой WGLGYYFDY,
или аминокислотную последовательность, по меньшей мере на 70% идентичную ей.
CDR обозначены в соответствии с комбинацией определения на основе консервативности последовательностей (Kabat et al in "Sequences of Proteins of Immunological Interest", Nat'l. Inst. Health, Bethesda, MD (1987)) и структурного определения (Chothia and Lesk J. Mol Biol. 196:901-17(1987)). Эти варианты определений также впоследствии были описаны в работе Carter et al, Proc Nat'l Acad Sci USA. 89:4285-9 (1992).
Настоящее изобретение также относится к вариантам пептидных последовательностей, упомянутых выше. Используемый в настоящей заявке термин «вариант» относится к белкам, которые имеют сходные аминокислотные последовательности и/или которые сохраняют одинаковые функции. В частности, термин «вариант» охватывает белки или полипептиды, которые содержат одну и более аминокислотную вставку, делецию, замену и т.п. Примером варианта согласно настоящему изобретению является белок, такой как гибридный белок, содержащий пептид, являющийся таким как определено выше, за исключением того, что в нем заменены одна или более аминокислот на одну или более других аминокислот. Как известно специалисту, различные аминокислоты обладают похожими свойствами. Одна или более таких аминокислота в веществе часто может быть заменена на другую одну или более других таких аминокислот с сохранением желаемой активности такого вещества.
Так, аминокислоты глицин, аланин, валин, лейцин и изолейцин часто могут заменять друг друга (аминокислоты с алифатическими боковыми цепями). Среди возможных замен предпочтительны замены, при которых замещают друг друга глицин и аланин (поскольку они имеют относительно короткие боковые цепи) или валин, лейцин и изолейцин (они имеют большие алифатические боковые цепи, которые обладают свойством гидрофобности). Другими аминокислотами, которые часто могут заменять друг друга, являются фенил аланин, тирозин и триптофан (аминокислоты, содержащие ароматические боковые цепи); лизин, аргинин и гистидин (аминокислоты с основными боковыми цепями); аспарагин и глутамин (аминокислоты, с кислыми боковыми цепями) и цистеин и метионин (аминокислоты с серосодержащими боковыми цепями).
Замены такого рода часто называют «консервативными» или «полуконсервативными» аминокислотными заменами. Настоящее изобретение, таким образом, распространяется также на специфично связывающиеся молекулы, содержащие CDR, имеющие аминокислотные последовательности, описанные выше, но включающие одну или более консервативную замену в CDR, такую, что аминокислотные последовательности CDR по меньшей мере на 70% идентичны последовательностям, описанным выше. Например, каждый CDR может содержать 1, 2, 3, 4 или 5 консервативных замен (в зависимости от конкретного CDR), по сравнению с аминокислотной последовательностью CDR, указанной выше. Например, в аминокислотной последовательности VLCDR1, приведенной выше, может содержаться 1, 2 или 3 консервативных замены, в аминокислотной последовательности VLCDR2, приведенной выше, может содержаться 1 или 2 консервативные замены, в аминокислотной последовательности VLCDR3, приведенной выше, может содержаться 1 или 2 консервативные замены, в аминокислотной последовательности VHCDR1, приведенной выше, может содержаться 1, 2 или 3 консервативные замены, в аминокислотной последовательности VHCDR2, приведенной выше, может содержаться 1, 2, 3, 4 или 5 консервативные замены, и в аминокислотной последовательности VHCDR3, приведенной выше, может содержаться 1, 2 или 3 консервативные замены, и последовательность при этом будет сохранять по меньшей мере 70% идентичности последовательностям CDR, приведенным выше.
Для аминокислот используются следующие трехбуквенные и однобуквенные обозначения: глицин (G или Gly), аланин (А или Ala), валин (V или Val), лейцин (L или Leu), изолейцин (I или Ile), пролин (Р или Pro), фенилаланин (F или Phe), тирозин (Y или Tyr), триптофан (W или Trp), лизин (К или Lys), аргинин (R или Arg), гистидин (Н или His), аспарагиновая кислота (D или Asp), глутаминовая кислота (Е или Glu), аспарагин (N или Asn), глутамин (Q или Gln), цистеин (С или Cys), метионин (М или Met), серии (S или Ser) и треонин (Т или Thr). В случае, если аминокислотный остаток может представлять собой аспарагиновую кислоту или асапарагин, могут использоваться обозначения Asx или В. В случае, если аминокислотный остаток может представлять собой глутаминовую кислоту или глутамин, могут использоваться обозначения Glx или Z. Аспарагиновая кислота также подразумевает аспартат, а глутаминовая кислота - глутамат, если в тексте не обозначено иначе.
Указанная выше последовательность белка, например гибридного белка, упомянутого выше, также может содержать делеции или вставки аминокислот. Так, например, аминокислоты, удаление которых не оказывает значительного влияния на активность белка или по меньшей мере не уничтожает указанную активность, могут быть удалены. Такие делеции могут быть выгодны, в случае если они уменьшают общую длину и молекулярный вес полипептида при сохранении его активности. Это может позволить уменьшить количество белка, необходимого для конкретной цели, например могут быть уменьшены размеры доз.
Также можно осуществлять вставки аминокислот в последовательность химерного белка. Это может быть сделано для изменения свойств вещества согласно настоящему изобретению (например, для облегчения идентификации, очистки или экспрессии, как описано выше в отношении гибридных белков).
Также вышеописанная последовательность может содержать аминокислотные замены, которые можно осуществлять для изменения свойств белка (например, для облегчения его определения, очистки или экспрессии). Аминокислотные замены можно осуществлять с использованием любой подходящей техники, например, с помощью направленного мутагенеза или твердофазного синтеза.
Необходимо учитывать, что аминокислотные замены или вставки в рамках данного изобретения можно осуществлять с применением как природных, так и неприродных аминокислот. Вне зависимости от того, используется ли природная или неприродная аминокислота, предпочтительно присутствие только L-аминокислот.
«Идентичность», как известно в данной области, обозначает схожесть двух или более полипептидных последовательностей или двух или более полинуклеотидных последовательностей, которое определяют путем сравнения последовательностей. В данной области идентичность также означает степень родства между полипептидными или полинуклеотидными последовательностями, в зависимости от обстоятельств, которую определяют по совпадению цепей таких последовательностей. Хотя существует целый ряд способов для оценки идентичности между двумя полипептидными или двумя полинуклеотидными последовательностями, способы, обычно применяемые для определения идентичности, представлены в виде компьютерных программ. Популярные компьютерные программы для определения идентичности двух последовательностей включают, но не ограничены перечисленными, пакет программ GCG (Devereux, et al., Nucleic Acids Research, 12, 387 (1984), BLASTP, BLASTN и FASTA (Atschul et al., J. Molec. Biol. 215, 403 (1990)).
Для сравнения аминокислотных последовательностей можно использовать такую программу, как CLUSTAL. Эта программа сравнивает аминокислотные последовательности и находит оптимальное выравнивание за счет введения разрывов в любую из последовательностей при необходимости. Возможно рассчитать идентичность или сходство (идентичность, а также сохранение типа аминокислоты) для оптимального выравнивания. Такие программы, как BLASTx, выравнивают наиболее длинный участок со сходными последовательностями и оценивают уровень идентичности. Таким образом, можно сравнить найденные области со сходными последовательностями, каждая из которых имеет свой уровень идентичности. В данном изобретении рассмотрены оба типа анализа идентичности.
Процент идентичности двух аминокислотных последовательностей или двух нуклеотидных последовательностей определяют при помощи выравнивания последовательностей с целью оптимального сравнения (например, в первую последовательность можно ввести разрывы для лучшего сравнения с другой последовательностью) и для сравнения аминокислотных остатков или нуклеотидов в позициях, соотносящихся друг с другом. «Наилучшее выравнивание» - это такое выравнивание двух последовательностей, которое приводит к максимальному проценту идентичности. Процент идентичности определяется как число одинаковых аминокислотных или нуклеотидных остатков в сравниваемых последовательностях (т.е. % идентичности = число идентичных позиций/общее число позиций × 100).
Определение процента идентичности двух последовательностей может быть усовершенствовано за счет использования математического алгоритма, известного специалистам в данной области техники. Одним из примеров математического алгоритма для сравнения двух последовательностей представляет собой алгоритм Карлина и Альтшула (Karlin and Altschul (1990) Proc. Natl. Acad. Sci. USA 87:2264-2268), модифицированный Карлином и Альтшулом в 1993 (Karlin and Altschul (1993) Proc. Natl. Acad. Sci. USA 90:5873-5877. Программы NBLAST и XBLAST (Altschul, et al. (1990) J. Mol. Biol. 215:403-410) включают такой алгоритм. Для получения нуклеотидных последовательностей, гомологичных нуклеиновым кислотам данного изобретения, нуклеотидный поиск BLAST может осуществляться с помощью программы NBLAST, счет = 100, длина слова = 12. Для получения аминокислотных последовательностей, гомологичных белковым молекулам данного изобретения, поиск белков BLAST может осуществляться с помощь программы XBLAST, счет = 50, длина слова = 3. Для получения выравниваний с пропусками с целью сравнения можно использовать Gapped BLAST, как описано у Альтшула и др. (Altschul et al. (1997) Nucleic Acids Res. 25:3389-3402). В качестве альтернативы можно использовать PSI-Blast для проведения повторного поиска, который выявляет отдаленные сходства между молекулами (Id). При использовании программ BLAST, Gapped BLAST и PSI-Blast можно использовать параметры по умолчанию в соответствующих программах (например, XBLAST и NBLAST). См. http://www.ncbi.nlm.nih.gov. Другим примером математического алгоритма, используемого для сравнения последовательностей, представляет собой алгоритм Миерса и Миллера (Myers and Miller, CABIOS (1989)). Программа ALIGN (версия 2.0), которая представляет собой часть пакета программ выравнивания последовательностей CGC, включает в себя этот алгоритм. Другие алгоритмы для анализа последовательностей, известные в данной области техники, включают ADVANCE ADAM, как описано у Тореллиса и Роботти (Torellis и Robotti (1994) Comput. Appl. Biosci., 10:3-5); и FASTA, описанный у Пирсона и Липмана (Pearson и Lipman (1988) Proc. Natl. Acad. Sci. 85:2444-8). В FASTA параметр ktup представляет собой контрольную опцию, которая позволяет настраивать чувствительность и скорость поиска.
Как правило, аминокислотная последовательность участков CDR специфично связывающейся молекулы согласно настоящему изобретению по меньшей мере на 70% идентична аминокислотным последовательностям CDR, описанным выше, при анализе с использованием параметров по умолчанию компьютерной программы BLAST (Atschul et al., J. Mol. Biol. 215, 403-410 (1990)), предоставленной HGMP (Human Genome Mapping Project), на аминокислотном уровне. Как правило, каждая из последовательностей CDR имеет по меньшей мере 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере 99% идентичности на уровне аминокислот с последовательностями, приведенными выше. Как правило, каждая из последовательностей CDR специфично связывающейся молекулы согласно настоящему изобретению имеет уровень идентичности аминокислотной последовательности CDR, как указано выше. Кроме того, любой 1, 2, 3 4 или 5 из участков CDR специфично связывающейся молекулы согласно настоящему изобретению имеет такой уровень идентичности аминокислотных последовательностей CDR, как указано выше.
Специфично связывающаяся молекула согласно настоящему изобретению, как правило, представляет собой антитело, в большинстве случаев, моноклональное антитело. В одном варианте реализации моноклональное антитело согласно настоящему изобретению является гуманизированным.
Моноклональное антитело согласно настоящему изобретению может быть гуманизировано за счет модификации его аминокислотной последовательности. Способы уменьшения иммуногенности специфично связывающихся молекул настоящего изобретения могут включать пересадку CDR на каркасную часть подходящего антитела или ремоделирование остатков поверхности вариабельной области, например, за счет сайт-направленного мутагенеза и других стандартно используемых технологий молекулярной биологии (Roguska et al Protein Eng. 9895-904 (1996)).
Другие применимые способы включают идентификацию возможных эпитопов для Т-клеток в составе молекулы и их последующее удаление, например, с помощью сайт-направленного мутагенеза (деиммунизация). Если предполагается применять специфично связывающуюся молекулу в качестве терапевтического средства, может потребоваться ее гуманизация. Если необходимо, можно провести гуманизацию участков CDR или окружающей их каркасной последовательности.
Существуют технологии рекомбинантной ДНК, позволяющие на основе моноклональных и других антител получать другие антитела или химерные молекулы, которые сохраняют специфичность исходного антитела. Такие способы могут включать присоединение ДНК, кодирующей вариабельную область иммуноглобулина или гипервариабельный участок (CDR) антитела к константным областям или к константным областям вместе с каркасными участками других иммуноглобулинов. См., например, ЕР-А-184187, GB 2188638 А или ЕР-А-239400. Гибридому или другие клетки, продуцирующие антитела, можно подвергнуть генетической мутации или другим изменениям, которые могут изменять или могут не изменять специфичность связывания продуцируемых антител.
Поскольку антитела могут быть модифицированы различными способами, термин «антитело» должен охватывать любые специфично связывающиеся молекулу или вещество, имеющие связывающий домен с требуемой специфичностью. Таким образом, этот термин охватывает фрагменты антитела, производные, функциональные эквиваленты и гомологи антител, гуманизированные антитела, в том числе любой полипептид, содержащий связывающий домен иммуноглобулина, либо природные, либо полностью или частично синтетические. Таким образом, в объем данного термина также входят химерные молекулы, содержащие связывающий домен иммуноглобулина, или его эквивалент, «слитый» с другим полипептидом. Клонирование и экспрессия химерных антител описаны в патентах ЕР-А-0120694 и ЕР-А-0125023. Гуманизированное антитело может представлять собой модифицированное антитело, имеющее вариабельные области нечеловеческого, например мышиного антитела, и константную область человеческого антитела. Способы получения гуманизированных антител описаны, например, в патенте США №5225539.
Специфично связывающаяся молекула согласно настоящему изобретению может представлять собой фрагмент антитела. Было показано, что фрагменты целого антитела могут выполнять функцию связывания антигенов. Примерами связывающихся фрагментов являются (I) Fab-фрагмент, состоящий из доменов VL, VH, CL и CH1; (II) Fd-фрагмент, состоящий из доменов VH и CH1; (III) Fv-фрагмент, состоящий из областей VL и VH одного антитела; (IV) фрагмент dAb (Ward, E.S. et al, Nature 341:544-546 (1989)), который состоит из домена VH; (V) изолированные участки CDR; (VI) Р(ab')2-фрагменты, бивалентный фрагмент, состоящий из двух связанных Fab-фрагментов, (VII) одноцепочечные молекулы Fv (scFv), в которых домен VH и домен VL связаны между собой пептидным линкером, благодаря которому два домена ассоциируют с образованием сайта связывания антигена (Bird et al., Science 242:423-426 (1988); Huston et al., PNAS USA 85:5879-5883 (1988)); (VIII) биспецифичные одноцепочечные димеры Fv (PCT/US 92/09965) и (IX) «диатела», мультивалентные или мультиспецифичные фрагменты, сконструированные в результате «слияния» генов (WO 94/13804; P. Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)). Как правило, фрагмент представляет собой Fab-фрагмент, F(ab')2- или Fv-фрагмент или молекулу scFv.
Диатела представляют собой мультимеры полипептидов, каждый из которых содержит первый домен, содержащий связывающую область легкой цепи иммуноглобулина и второй домен, содержащий связывающую область тяжелой цепи иммуноглобулина, при этом эти два домена связаны (например, посредством пептидного линкера), но не способны ассоциировать друг с другом с образованием антигенсвязывающего сайта: антигенсвязывающий сайт образуются в результате ассоциации первого домена одного полипептида в составе мультимера со вторым доменом другого полипептида в составе такого мультимера (WO 94/13804).
В случае применения биспецифичных антител они могут представлять собой обычные биспецифичные антитела, которые могут быть получены различными способами (Hollinger & Winter, Current Opinion Biotechnol. 4:446-449 (1993)), например получены химическим способом или от гибридных гибридом, или могут представлять собой любой из биспецифичных фрагментов антител, упомянутых выше. Может быть предпочтительно применение димеров scFv или диател, а не целых антител. Диатела и scFv могут быть сконструированы без области Fc, с применением только вариабельных доменов, что потенциально снижает эффект анти-идиотипических реакций. Другие формы биспецифичных антител включают одноцепочечные «Янусины» (Janusins), описанные в работе Traunecker et al., EMBO Journal 10:3655-3659 (1991).
Также можно применять биспецифичные диатела, в противоположность биспецифичным целым антителам, поскольку их легко можно сконструировать и экспрессировать в E. coli. Диатела (и многие другие полипептиды, такие как фрагменты антител) с соответствующей специфичностью связывания можно легко отобрать из библиотек с помощью фагового дисплея (WO 94/13804). Если одна ветвь диатела должна оставаться постоянной, например со специфичностью, направленной против антигена X, то можно создать библиотеку, в которой варьируют другую ветвь, и осуществить селекцию антитела с соответствующей специфичностью.
Моноклональное антитело VJ-4B6 продуцируется клеточной линией гибридомы VJ-4B6-E5-B10-D4, депонированной 3 июня 2010 года в Европейской коллекции клеточных культур (ЕСАСС), Агентство по охране здоровья, Центр аварийной готовности и реагирования, Портон, Солсбери, SP4 0JG, Соединенное Королевство, в соответствии с Будапештским договором, под номером доступа 10060301.
Депонирование было осуществлено Фульвио Д'Аквисто (Fulvio D'Acquisto, Queen Магу and Westfield College, Centre for Biochemical Pharmacology, Charterhouse Square, London EC1M 6BQ). Депозитор уполномочил Заявителя сослаться на депонированный материал в настоящей заявке и дал свое безоговорочное и безотзывное согласие на то, чтобы депонированный материал стал доступным для общественности в соответствии с Правилом 31 (l)(d) Европейской патентной конвенции.
Клеточная линия гибридомы VJ-4B6-E5-B10-D4 продуцирует моноклональные антитела VJ-4B6, которые специфично связываются с Аннексином-А1. Моноклональные антитела VJ-4B6 согласно настоящему изобретению относятся к изотипу IgG2b.
Антитело VJ-4B6 было получено против полноразмерного белка Anx-А1 человека, имеющего аминокислотную последовательность, приведенную на Фигуре 2А.
Последовательность ДНК и аминокислотная последовательность вариабельной области легкой цепи антитела VJ-4B6 приведена на Фигуре 11. На Фигуре 12 показана аминокислотная последовательность вариабельной области легкой цепи VJ-4B6 с обозначенными участками CDR. На Фигуре 12 также показаны несколько первых аминокислот константной области легкой цепи VJ-4BO.
Последовательность ДНК и аминокислотная последовательность вариабельной области тяжелой цепи антитела VJ-4B6 приведена на Фигуре 13. На Фигуре 14 приведена последовательность аминокислот вариабельной области тяжелой цепи из VJ-4B6 с обозначенными участками CDR. На Фигуре 14 также показаны несколько первых аминокислот константной области тяжелой цепи VJ-4B6.
Гипервариабельные участки (CDR) антитела VJ-4B6 являются следующими:
VLCDR1 представляет собой KASENVVTYVS,
VLCDR2 представляет собой GASNRYT,
VLCDR3 представляет собой GQGYSYPYT,
VHCDR1 представляет собой GYTFTNYWIG,
VHCDR2 представляет собой DIYPGGDYTNYNEKFKG,
VHCDR3 представляет собой WGLGYYFDY.
Настоящее изобретение охватывает специфично связывающиеся молекулы, которые имеют участки CDR антитела VJ-4B6, как описано в настоящей заявке, а также специфично связывающиеся молекулы, которые имеют CDR, по меньшей мере на 70% идентичные одному или более CDR антитела VJ-4B6, как описано в настоящей заявке.
Настоящее изобретение также охватывает специфично связывающие молекулы, которые имеют либо вариабельную область легкой цепи, вариабельную область тяжелой цепи, или как вариабельную область легкой цепи, так и вариабельную область тяжелой цепи антитела VJ-4B6.
Таким образом, в конкретном варианте реализации настоящее изобретение обеспечивает специфично связывающиеся молекулы в соответствии с первым аспектом изобретения, включающие полипептид, имеющий аминокислотную последовательность, приведенную на Фигуре 11 и/или Фигуре 13.
В этом варианте реализации настоящее изобретение также охватывает некоторые фрагменты антител, включающие вариабельную область легкой цепи, которая имеет аминокислотную последовательность, показанную на Фигуре 11, и/или вариабельную область тяжелой цепи с аминокислотной последовательностью, показанной на Фигуре 13. Например, этот вариант реализации охватывает фрагменты Fab, F(ab')2 или Fv и молекулы scFv.
Настоящее изобретение также охватывает специфично связывающиеся молекулы в соответствии с первым аспектом настоящего изобретения, включающие полипептид, имеющий последовательность аминокислот, как показано на Фигуре 12 и/или Фигуре 14.
В конкретном варианте реализации настоящее изобретение обеспечивает специфично связывающуюся молекулу в соответствии с первым аспектом настоящего изобретения, продуцируемую клеточной линией гибридомы, депонированной в Европейской коллекции клеточных культур (ЕСАСС) 3 июня 2010 года под номером 10060301.
Во втором аспекте настоящее изобретение относится к клеточной линии гибридомы, которая продуцирует специфично связывающуюся молекулу, направленную против белка Anx-А1 человека, имеющую аминокислотную последовательность, приведенную на Фигуре 2А.
В конкретном варианте реализации настоящее изобретение относится к клеточной линии гибридомы в соответствии со вторым аспектом настоящего изобретения, депонированной в Европейской коллекции клеточных культур (ЕСАСС) 3 июня 2010 года полномером 10060301.
В третьем своем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей специфично связывающуюся молекулу согласно настоящему изобретению.
Композиция в соответствии с этим аспектом изобретения может быть приготовлена для применения любым удобным способом. Фармацевтическая композиция согласно настоящему изобретению наряду со специфично связывающейся молекулой согласно настоящему изобретению обычно содержит фармацевтически приемлемый носитель, эксципиент, разбавитель, адъювант, наполнитель, буфер или стабилизатор. Такие носители включают, но не ограничены перечисленными, физиологический раствор, буферный раствор, декстрозу, липосомы, воду, глицерин, полиэтиленгликоль, этанол и их комбинации. Такой фармакологический препарат может быть в любой приемлемой форме, в зависимости от желаемого способа введения ее пациенту.
Фармацевтическая композиция может быть обеспечена в единичной дозированной форме, как правило, представленной в запечатанном контейнере, и может представлять собой часть набора. Такой набор, как правило (хотя и необязательно), включает инструкции по применению. Он может включать в себя некоторое количество указанных лекарственных форм.
Фармацевтическая композиция может быть адаптирована для введения любым подходящим способом, например путем перорального (в том числе буккального или подъязычного), ректального, назального, местного (в том числе буккального, подъязычного или трансдермального), вагинального или парентерального (в том числе подкожного, внутримышечного, внутривенного или внутрикожного) способа. Такие фармакологические препараты могут быть получены любым способом, известным в области фармацевтики, например путем смешивания активного ингредиента с носителем (носителями) или наполнителем (наполнителями) в стерильных условиях.
Фармацевтические композиции, адаптированные для перорального введения могут быть представлены в виде отдельных форм, таких как капсулы или таблетки; в виде порошков или гранул, в виде растворов, сиропов или суспензий (в водных или неводных жидкостях; или как съедобная пена, крем или эмульсия).
Подходящие эксципиенты для таблеток или твердых желатиновых капсул включают лактозу, кукурузный крахмал или его производные, стеариновую кислоту или ее соли.
Подходящие эксципиенты для применения в мягких желатиновых капсулах включают, например, растительные масла, воск, жиры, полутвердые или жидкие полиолы и т.п.
Эксципиенты, которые можно использовать для приготовления растворов и сиропов, включают, например, воду, полиолы и сахара. Для приготовления суспензий можно применять масла (например, растительные масла) (для получения суспензии масла в воде или воды в масле).
Фармацевтические композиции, адаптированные для трансдермального приема, могут быть представлены в виде отдельных пластырей, предназначенных для того, чтобы оставаться в тесном контакте с эпидермисом реципиента в течение продолжительного периода времени. Например, активный ингредиент может доставляться из пластыря через ионтофорез, как в целом описано в журнале «Фармакологические исследования» (Pharmaceutical Research, 3(6):318 (1986)).
Фармакологические препараты, адаптированные для местного приема, могут быть представлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для инфекций глаза или других наружных тканей, например полости рта и кожи, предпочтительно локальное применение препаратов в виде мази или крема. Если активный ингредиент входит в состав мази, его можно применять с парафиновой или водорастворимой мазевой основой. В качестве альтернативы