Способы и композиции для лечения персистирующих инфекций
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к иммунологии, и может быть использована композиция для лечения персистирующей инфекции, ангиоиммунобластической лимфомы или нодулярной с лимфоидным преобладанием лимфомы Ходжкина. Композиция содержит ингибитор активности или экспрессии PD-1. Группа изобретений относится также к композиции, содержащей антиген-специфичную Т-клетку, приведенную в контакт с соединением, которое понижает экспрессию или активность PD-1. Использование данной группы изобретений позволяет блокировать уровень экспрессии PD-1, что приводит к повышенной пролиферации CD8+ Т-клеток. 2 н. и 19 з.п. ф-лы, 8 ил., 1 табл., 14 пр.
Реферат
ЗАЯВЛЕНИЕ О ФЕДЕРАЛЬНО-СПОНСИРУЕМЫХ ИССЛЕДОВАНИЯХ
Данное изобретение было сделано при поддержке правительства США в рамках грантов Национального Института Здоровья (NIH) AI39671 и CA84500. Правительство имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В целом, настоящее изобретение относится к способам и композициям для лечения персистирующей инфекции и рака.
УРОВЕНЬ ТЕХНИКИ
Несмотря на то, что развитие профилактических вакцин значительно снизило процент смертности от вирусных инфекций, использование указанных вакцин против вирусов, вызывающих персистирующие инфекции (например, вирус гепатита С), имело ограниченный успех. В отличие от вирусов, которые вызывают острые и самокупирующиеся инфекции, иммунный ответ, который устанавливается против микробов, вызывающих персистирующие инфекции, часто неустойчив и не достаточен для удаления инфекции. Как результат, инфекционный микроб остается внутри инфицированного субъекта длительное время, необязательно нанося постоянный ущерб организму.
Большим препятствием для устранения микробов, вызывающих персистирующие инфекции, является способность данных микробов обходить иммунную систему организма хозяина. Например, некоторые вирусы и паразиты подавляют у хозяина экспрессию молекул, необходимых для Т-клеточного распознавания инфекционных клеток. Персистирующие инфекции также вызывают функциональную недостаточность антигенспецифических CD8+ Т-клеток, которые являются жизненно необходимыми для контроля и устранения вирусных инфекций. Несмотря на то, что комбинация терапевтических вакцин с цитокиновыми адъювантами была обнадеживающей, получаемые иммунные ответы не устраняли патоген.
Таким образом, нужны улучшенные способы лечения, предотвращения или ослабления персистирующих инфекций.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способы и композиции для лечения, предотвращения или уменьшения, или альтернативно, смягчения одного или более симптомов персистирующей инфекции или рака. Изобретение основано на открытии, что антигенспецифические CD8+ T-клетки становятся функционально толерантными ("истощенными") к инфекционному агенту, в результате индукции полипептида 1 программированной смерти (PD-1). Соответственно, при уменьшении экспрессии или активности PD-1, PD-L1 или PDL-2 пролиферация функционально толерантных CD8+ T клеток, продукция цитокинов, и скорость удаления инфекционного агента (например, вирусного, бактериального, грибкового, паразитарного, микоплазменного или ракового) увеличивается, так что иммунный ответ, специфичный к инфекционному агенту, усиливается.
Соответственно, изобретение предоставляет способ ослабления или предотвращения симптома персистирующей инфекции (например, вирусной инфекции, бактериальной инфекции, грибковой инфекции, микоплазменной инфекции и паразитарной инфекции) или рака путем введения нуждающемуся в этом субъекту (например, человеку) соединения, которое уменьшает активность или экспрессию члена CD28-подобного семейства (например, PD-1, CTLA-4, BTLA и их функционального фрагмента или варианта) или лигандов CD28-подобного семейства (например, PD-L1 или PD-L1). Альтернативно, субъекту вводят антигенспецифические Т-клетки или В-клетки, на которые действовали соединением, которое снижает экспрессию или активность полипептида PD-1 в клетках. Например, антигенспецифические Т-клетки или В-клетки являются специфичными к вирусному антигену. Т-клетки или В-клетки происходят из аутологичного источника или происходят из другого субъекта того же вида или другого вида, нежели чем субъект, получающий лечение.
Кроме того, изобретение включает способ увеличения цитотоксической активности Т-клетки (например, анергической Т-клетки или Т-клетки, имеющей увеличенную толерантность к антигенам) взаимодействием Т-клетки с соединением, которое уменьшает активность или экспрессию полипептида PD-1.
Во всех вышеизложенных аспектах изобретения персистирующие вирусные инфекции являются результатом таких инфекций как вирус гепатита, вирус иммунодефицита человека (ВИЧ), Т-лимфотоксический вирус человека (HTLV), вирус герпеса, вирус Эпштейна-Барр или вирус папилломы человека. Персистирующие вирусные инфекции могут также включать в себя инфекции, вызванные латентным вирусом. Раковые заболевания включают в себя лимфопролиферативные нарушения, такие как ангиоиммунобластная лимфома и нодулярная с лимфоидным преобладанием лимфома Ходжкина. Желательно, чтобы соединение изобретения увеличивало антигенспецифический иммунный ответ путем увеличения цитотоксической Т-клеточной активности (например, увеличение цитотоксической продукции цитокинов, таких как INFγ,TNFα, IL-2, увеличение Т-клеточной пролиферации или увеличение выведения вирусов) у субъекта, получающего лечение. Например, соединение уменьшает экспрессию или активность PD лиганда 1 (PD-L1) или PD лиганда 2 (PD-L2) или уменьшает взаимодействие между PD-1 и PD-L1 или взаимодействие между PD-1 и PD-L2. Типичные соединения включают в себя антитела (например, анти-PD-1 антитело, анти-PD-L1 антитело, и анти-PD-L2 антитело), молекулы РНКи (например, анти-PD-1 РНКи молекулы, анти-PD-L1 РНКи и анти-PD-L2 РНКи), антисмысловые молекулы (например, анти-PD-1 антисмысловая РНК, анти-PD-L1 антисмысловая РНК и анти-PD-L2 антисмысловая РНК), доминантно-негативные белки (например, доминантно-негативный PD-1 белок, доминантно-негативный PD-L1 белок, и доминантно-негативный PD-L2 белок) и малые молекулы-ингибиторы. Антитела включают в себя моноклональные антитела, гуманизированные антитела и Ig-слитые белки. Типичное анти-PD-L1 антитело содержит клон EH12.
В дополнение к соединению, которое уменьшает PD-1 экспрессию или активность, субъекту, получающему лечение, может также быть введена вакцина, которая может содержать или не содержать адъювант или первую бустер-инъекцию. При желании, субъекту вводят второе соединение, такое как противовирусное соединение (например, видарабин, ацикловир, ганцикловир, валганцикловир, нуклеозид - аналог ингибитора обратной транскриптазы (NRTI), такой как AZT (зидовудин), ddI (диданозин), ddC (залцитабин), d4T(ставудин), или 3ТС (ламивудин), ненуклеозидный ингибитор обратной транскриптазы (NNRTI), такой как невирапин или делавирдин, ингибитор протеаз, такой как саквинавир, ритонавир, индинавир или нелфинавир, рибавирин и интерферон), противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, антинеопластическое соединение или анальгетик. Второе соединение также может быть соединением, которое снижает экспрессию или активность цитотоксического Т-лимфоцитарного антигена 4 (CTLA-4), или В- и Т-лимфоцитарным аттенюатором (BTLA). Другие типичные соединения, которое могут быть введены субъекту, представляют собой анти-CTLA-4 антитела, анти-BTLA антитела, анти-CD28 антитела, анти-ICOS антитела, анти-ICOS-L антитела, анти-B7-1 антитела, анти-B7-2 антитела, анти-B7-H3 антитела или анти-B7-H4 антитела.
Настоящее изобретение далее предоставляет способ идентификации соединения-кандидата, которое бы изменяло активность или экспрессию полипептида PD-1, который включает в себя стадии: (а) воздействие на клетку, экспрессирующую PD-1 ген, (например, PD-1 гибридный ген) соединением-кандидатом; (b) измерение экспрессии или активности PD-1 в клетке (например, путем измерения экспрессии PD-1 мРНК или белка); (с) сравнение экспрессии или активности PD-1 в клетке с указанной экспрессией или активностью в контрольной клетке, на которую не действовали соединением. Увеличение или уменьшение экспрессии или активности PD-1 указывает на соединение-кандидат, как пригодное для изменения активности или экспрессии полипептида PD-1.
Альтернативно, метод скрининга может включать в себя стадии: (а) воздействие на Т-клетку, которая избыточно экспрессирует PD-1 ген, соединением-кандидатом; (b) определение цитотоксической активности Т-клетки; (с) сравнение цитотоксической активности Т-клетки с данной активностью в контрольной клетке, на которую не действовали соединением. Увеличение или уменьшение данной активности указывает на соединение-кандидат, как пригодное для изменения активности или экспрессии полипептида PD-1. Цитотоксическая активность включает в себя продукцию цитокинов, Т-клеточную пролиферацию и удаление вирусов.
Изобретение далее предоставляет способ скрининга, включающий в себя стадии: (а) воздействие на полипептид PD-1 соединением-кандидатом; (b) определение того, взаимодействует ли соединение-кандидат с полипептидом PD-1; (с) идентификация соединения-кандидата, как пригодного для изменения активности или экспрессии PD-1. Желательно, чтобы соединение-кандидат взаимодействовало с полипептидом PD-1 и снижало его активность.
Соединение-кандидат, установленное методами скрининга, описанными в настоящем документе, может уменьшать взаимодействие между PD-1 и PD-L1 или взаимодействие между PD-1 и PD-L2. Клетка, используемая в любом из методов скрининга, описанных в настоящем документе, включает в себя клетки млекопитающих, таких как клетки грызунов или клетки человека. Клетка является иммунной клеткой, такой как Т-клетка. Желательно, чтобы полипептид PD-1, применяемый в данных методах скрининга, представлял собой человеческий полипептид PD-1.
В настоящем документе также предоставлен способ диагностики субъекта, имеющего персистирующую инфекцию или рак или с повышенным риском их иметь, включающий в себя стадии: (а) предоставление образца, содержащего иммунные клетки (например, Т-клетку или В-клетку) субъекта, и (b) измерение экспрессии или активности PD-1 в образце. Увеличение экспрессии или активности PD-1 по сравнению с соответствующей экспрессией или активностью в контрольном образце идентифицирует субъекта, как имеющего персистирующую инфекцию или рак или с повышенным риском их иметь. Желательно, чтобы стадия (b) включала в себя иммунные клетки, специфически идентифицирующие антигены, такие как вирусный антиген, бактериальный антиген, паразитарный антиген или грибковый антиген.
Также описан способ выбора лечения для субъекта, имеющего или с повышенным риском иметь персистирующую инфекцию или рак. Данный метод включает в себя стадии: (а) предоставление пробы, содержащей иммунные клетки (например, Т-клетку или В-клетку) от субъекта, и (b) измерение экспрессии или активности PD-1 в иммунных клетках, так что увеличение экспрессии или активности PD-1 по сравнению с данной экспрессией или активностью в контрольном образце идентифицирует субъекта, как имеющего персистирующую инфекцию или рак или с повышенным риском их иметь; (с) выбор метода лечения для субъекта, у которого диагностированы персистирующая инфекция или рак или существует высокий риск их иметь, так что лечение включает в себя соединение, которое снижает экспрессию или активность PD-1. Желательно, чтобы стадия (b) включала в себя иммунные клетки, специфически идентифицирующие антигены, такие как вирусный антиген, бактериальный антиген, паразитарный антиген или грибковый антиген.
Образцы, полученные от субъектов, включают в себя пробы крови, биопсии тканей, образцы костного мозга. Кроме того, контрольные клетки могут быть получены от субъекта, у которого не обнаружена персистирующая инфекция или нет ее повышенного риска.
Далее, изобретение предоставляет композицию, которая содержит: (а) соединение, которое снижает уровень или активность PD-1; и (b) второй компонент, такой как противовирусное соединение, противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, анальгетик, анти-CTLA-4 антитело, анти-BTLA антитело, анти-CD28 антитело, анти-ICOS антитело, анти-ICOS-L антитело, анти-B7-1 антитело, анти-B7-2 антитело, анти-B7-H3 антитело или анти-B7-H4 антитело.
Изобретение также предоставляет набор, который содержит (а) соединение, которое снижает или активность PD-1; и (b) инструкции по отпуску соединения субъекту. Альтернативно, набор содержит (а) первый компонент, который снижает уровень или активность PD-1; (b) второй компонент, такой как противовирусное соединение, противобактериальное соединение, противогрибковое соединение, противопаразитарное соединение, противовоспалительное соединение, анальгетик, анти-CTLA-4 антитело, анти-BTLA антитело, анти-CD28 антитело, анти-ICOS антитело, анти-ICOS-L антитело, анти-B7-1 антитело, анти-B7-2 антитело, анти-B7-H3 антитело или анти-B7-H4 антитело; и (с) инструкции по отпуску первого соединения и второго соединения субъекту.
Настоящее изобретение предоставляет значительные преимущества по сравнению со стандартными терапиями для лечения, предотвращения и уменьшения, или, альтернативно, ослабления одного или более симптомов персистирующих инфекций. Введение терапевтического агента, который снижает уровень или активность PD-1, увеличивает CD8+ T-клеточную цитотоксичность, которая в свою очередь увеличивает иммунный ответ на инфекционный агент, способный вызвать персистирующую инфекцию. Кроме того, способы скрининга соединения-кандидата, предоставленные настоящим изобретением, предусматривают идентификацию новых лекарств, которые изменяют процесс повреждения, скорее, чем просто смягчают симптомы.
За исключением определенных иным образом, все технические и научные термины, использованные в настоящем документе, имеют то же значение, что и обычно понимаемо специалистом с обычными навыками в области, к которой принадлежит изобретение. Хотя способы и материалы, похожие или эквивалентные тем, которые описаны в настоящем документе, могут быть использованы на практике или при тестировании настоящего изобретения, подходящие способы и материалы описаны далее. Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем документе, включены целиком в виде ссылок. В случае конфликтования настоящее патентное описание, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются только иллюстрациями и не мыслятся в качестве ограничений.
Другие особенности и преимущества изобретения станут очевидными из последующего детального описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
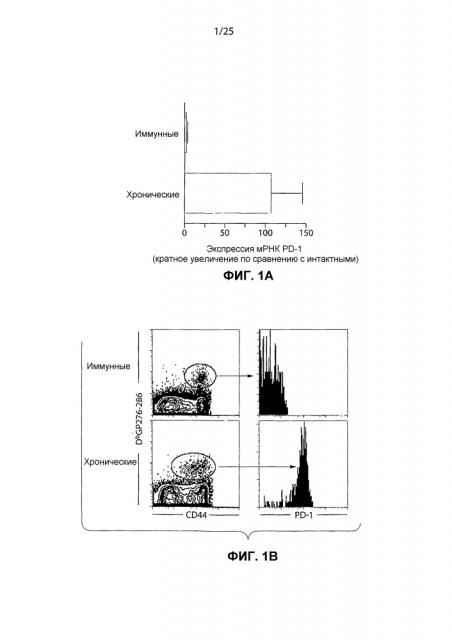
Фиг.1А представляет собой столбчатую диаграмму, изображающую уровни PD-1 мРНК в DbGP33-41 и/или DbGP276-286 специфических Т-клетках интактных трансгенных мышей, Армстронг-иммунных мышей, зараженных вирусом лимфатического хориоменингита (LCMV) (приблизительно 30 дней постинфекции), или CD4-истощенных LCMV-C1-13 инфицированных мышей (приблизительно 30 дней постинфекции), измеренные с помощью анализа генных панелей.
Фиг.1В представляет собой серию изображений эксперимента проточной цитометрии, показывающих поверхностную экспрессию PD-1 на CD8+ тетрамер+ Т-клетках у LCMV Армстронг-иммунных мышей и у CD4-истощенных LCMV-C1-13 инфицированных мышей, 60 дней постинфекции. Анергические CD8+ Т-клетки экспрессируют высокий уровень полипептида PD-1 на поверхности клетки спустя приблизительно 60 дней хронической инфекции, вызванной вирусом LCMV-C1-13 (отмечены как "хронические"), но вирус-специфические CD8+ Т-клетки не экспрессируют полипептид PD-1 после устранения острой LCMV Армстронг инфекции (отмечены как "иммунные").
Фиг.1С представляет собой серию изображений эксперимента проточной цитометрии, показывающих наличие PD-L1 на лимфоцитах хронически инфицированных и неинфицированных мышей. Показано, что экспрессия PD-L1 является самой высокой на спленоцитах, которые инфицированы вирусом.
Фиг.2А представляет ряд диаграмм разброса, показывающие, что, если С1-13 инфицированные мыши получали лечение с 23 по 37 день после инфицирования, то наблюдалось приблизительно 3-х кратное увеличение количества DbNP396-404 специфических и DbGP33-41 специфических CD8 Т-клеток, по сравнению с контрольной группой, не получавшей лечение. Для определения функциональных изменений, измеряли продукцию IFN-γ и TNF-α в ответ на 8 различных LCMV эпитопов.
Фиг.2В представляет собой диаграмму разброса, показывающую, что если измерить все известные CD8 T-клеточные специфичности, то наблюдается увеличение в 2,3 раза общего количества LCMV-специфических CD8 T-клеток.
Фиг.2С представляет собой серию графиков проточной цитометрии, на которых представлена продукция IFN-γ и TNF-α в ответ на восемь различных LCMV эпитопов.
Фиг.2D представляет собой диаграмму разброса, показывающую, что более вирус-специфические CD8 T-клетки у мышей, получавших лечение, имеют способность продуцировать TNF-α.
Фиг.2Е представляет собой серию столбчатых диаграмм, показывающую, что блок PD-L1 также приводит к увеличению вирусного контроля в селезенке, печени, легких и сыворотке крови.
Фиг.3А представляет собой график, на котором показано увеличение DbGP33-41 и DbGP276-286 специфических CD8 Т-клеток (отмеченных как "GP33" и "GP276") у CD4 истощенных С1-13 инфицированных мышей, которые получали анти-PD-L1 (обозначены как "αPD-L1") с 46 по 60 день постинфекции, по сравнению с контролем (обозначенным как "untx"), который показывает, что мыши, получавшие анти-PD-L1, имели приблизительно в 7 раз больше DbGP276-286 специфических селезеночных CD8 Т-клеток и приблизительно в 4 раза больше DbGP33-41 специфических селезеночных CD8 Т-клеток, чем контрольные мыши.
Фиг.3В представляет собой серию изображений, на которых показана повышенная частота встречаемости DbGP33-41 и DbGP276-286 специфических CD8+ Т-клеток в селезенке CD4 истощенных С1-13 инфицированных мышей, получавших анти-PD-L1 (обозначены как "αPD-L1 Tx") с 46 по 60 день постинфекции, по сравнению с контролем (обозначенным как "untx").
Фиг.3С представляет собой серию изображений, на которых показана увеличенная пролиферация DbGP276-286 специфических CD8+ Т-клеток у мышей, получавших анти-PD-L1, измеренная путем поглощения BrdU и экспрессии Ki67.
Фиг.3D представляет собой график, на котором показано, что мыши с высоким уровнем размножения CD8+ Т-клеток демонстрируют существенный ответ мононуклеарных клеток периферической крови (PBMC), как показано путем сравнения DbGP276-286 специфических CD8+ Т-клеток в PBMC и DbGP276-286 специфических CD8+ Т-клеток в селезенке.
Фиг.4А представляет собой серию графиков, на которых показано увеличение DbGP276-286 и DbGP33-41 специфических CD8+ Т-клеток, продуцирующих IFN-γ, у мышей, получавших анти-PD-L1, по сравнению с контролем. Повышенную частоту встречаемости DbNP396-404, KbNP205-212, DbNP166-175 и DbGP92-101 специфических CD8+ Т-клеток также обнаружили у мышей, получавших анти-PD-L1.
Фиг.4В представляет собой график, на котором показано, что у мышей, получавших анти-PD-L1, 50% DbGP276-286 специфических CD8+ Т-клеток продуцируют IFN-γ, по сравнению с 20% DbGP276-286 специфических CD8+ Т-клеток у мышей контрольной группы.
Фиг.4С представляет собой серию графиков, на которых показано, что хронически инфицированные мыши, получавшие анти-PD-L1, продуцируют более высокий уровень TNF-α, чем хронически инфицированные мыши, не получавшие анти-PD-L1, но, однако, они продуцируют более низкий уровень TNF-α, чем иммунные мыши, инфицированные вирусом LCMV Армстронга.
Фиг.4D представляет собой график, на котором показано, что лечение мышей, инфицированных LCMV-С1-13, с помощью анти-PD-L1 восстанавливает ex vivo литическую активность вирус-специфических Т-клеток, измеренную по высвобождению 51Cr, по сравнению с инфицированными мышами, не получавшими лечения.
Фиг.4E представляет собой серию графиков, на которых показано уменьшение вирусных титров в различных органах после лечения α-PD-L1 мышей, инфицированных LCMV-С1-13. Вирусные титры снижались приблизительно в 3 раза в селезенке, в 4 раза в печени, в 2 раза в легких и в 2 раза в сыворотке крови через 2 недели анти-PD-L1 лечения, по сравнению с мышами, не получавшими лечения.
Фиг.5А представляет собой серию изображений проточной цитометрии, на которых показана поверхностная экспрессия PD-1, использующая 10 ВИЧ тетрамеров, специфичных к доминантным эпитопам, целевых при хронической инфекции клада С ВИЧ. В процентах показан процент тетрамер+ клеток, которые являются PD-1+.
Фиг.5В представляет собой серию графиков, на которых показано что процентное содержание и MFI PD-1 значительно возрастают на ВИЧ-специфических CD8 Т-клетках, по сравнению с общей популяцией CD8 Т-клеток (р<0,0001), при противоретровирусной терапии интактных субъектов, и PD-1 увеличивается в общей популяции CD8 Т-клеток у ВИЧ-инфицированных, по сравнению с ВИЧ-серонегативным контролем (р=0,0033 и р<0,0001, соответственно). В исследование были включены 120 ВИЧ тетрамерных мазков от 65 ВИЧ-инфицированных субъектов и 11 ВИЧ-серонегативных контролей.
Фиг.5С представляет собой серию графиков, на которых показаны среднее процентное содержание и MFI экспрессии PD-1 на тетрамер+ клетках в зависимости от специфичности эпитопа.
Фиг.5D представляет собой график, на котором изображены вариации процентного содержания PD-1+клеток в различных эпитоп-специфических популяциях у субъектов с множественными определяемыми ответами. Горизонтальные линии показывают среднее процентное значение PD-1+ ВИЧ тетрамер+ клеток у каждого субъекта.
Фиг.6А представляет собой серию графиков, на которых показано отсутствие корреляции между количеством ВИЧ-специфических CD8 Т-клеток, установленным по окраске тетрамера, и по вирусной нагрузкой плазмы крови, тогда как есть положительная корреляция как между процентным содержанием так и между MFI PD-1 на тетрамер+ клетках и вирусной нагрузкой плазмы крови (р=0,0013 и р<0,0001, соответственно).
Фиг.6В представляет собой серию графиков, на которых показано отсутствие корреляции между количеством ВИЧ тетрамер+ клеток и общим количеством CD4, в то время как существует обратная зависимость между процентным содержанием и MFI PD-1 на ВИЧ тетрамер+ клетках и общим количеством CD4 (р=0,0046 и р=0,0150, соответственно).
Фиг.6С представляет собой серию графиков, на которых показано, что процентное содержание и MFI PD-1 в общей популяции CD8 Т-клеток находятся в прямой связи с вирусной нагрузкой плазмы крови (р=0,0021 и р<0,0001, соответственно).
Фиг.6D представляет собой серию графиков, на которых показано, что процентное содержание и MFI экспрессии PD-1 в общей популяции CD8 Т-клеток находятся в обратной связи с общим количеством CD4 (р=0,0049 и р<0,0006, соответственно).
Фиг.7А представляет собой серию изображений эксперимента проточной цитометрии, представляющих показательное фенотипическое окрашивание B*4201 TL9-специфических CD8 Т-клеток от субъекта SK222, у которого 98% B*4201 TL9-специфических CD8 Т-клеток являются PD-1+.
Фиг.7В представляет собой график, иллюстрирующий обобщение фенотипических данных субъектов, у которых >95% ВИЧ-специфических CD8 Т-клеток являются PD-1+. Исследовали от 7 до 19 образцов для каждого из указанных фенотипических маркеров. Горизонтальные линии обозначают среднее процентное содержание тетрамер+ PD-1+ клеток, которые являлись положительными на указанный маркер.
Фиг.8А представляет собой серию изображений эксперимента проточной цитометрии, на которых показаны результаты исследования пролиферации у B*4201 положительного субъекта. Через 6 дней стимуляции пептидом процентное содержание B*4201 TL9-специфических CD8 Т-клеток возросло с 5,7% до 12,4% в присутствии анти-PD-L1 блокирующего антитела.
Фиг.8В представляет собой линейчатый график, на котором изображены данные исследования суммарной пролиферации, которые показывают значительное увеличение пролиферации ВИЧ-специфических CD8 Т-клеток в присутствии анти-PD-L1 блокирующего антитела (n=28, p=0,0006, парный t-критерий Стьюдента).
Фиг.8С представляет собой столбчатую диаграмму, на которой показаны различные эффекты PD-1/PD-L1 блокирования на пролиферацию ВИЧ-специфических CD8 Т-клеток у индивидуальных пациентов. Белыми столбцами показано кратное увеличение тетрамер+ клеток в присутствии только пептида, черными столбцами показано кратное увеличение тетрамер+ клеток в присутствии пептида плюс анти-PD-L1 блокирующего антитела. Субъекты, у которых CFSE исследование проводили более чем для одного эпитопа, отмечены звездочкой, квадратом и треугольником.
ПОДРОБНОЕ ОПИСАНИЕ
Применение антибиотиков и вакцин в последние десятилетия значительно снизило уровень смертности от микробных инфекций. Однако успех возможностей противомикробного лечения ограничен из-за способности некоторых инфекционных агентов обходить иммунную систему организма хозяина и, в свою очередь, вызывать персистирующую инфекцию. Например, иммунный ответ, который устанавливается против вирусов, таких как вирус гепатита или ВИЧ, является недостаточным для удаления инфекционного агента, который остается в инфицированном субъекте. При данных инфекциях антигенспецифические CD8+ Т-клетки становятся функционально толерантными к инфекционному агенту в состоянии, известном как "толерантность" или "истощение". Толерантные Т-клетки теряют свою цитотоксическую активность, т.е. свою способность продуцировать цитокины, пролиферировать и удалять инфекционный агент.
Настоящее изобретение основано на неожиданном открытии, что Т-клеточная толерантность сопровождается индукцией экспрессии PD-1. и что экспрессия PD-1 имеет связь с определенными типами лимфопролиферативных заболеваний. Таким образом, изобретение предоставляет способы увеличения Т-клеточной цитотоксичности путем взаимодействия Т-клетки с агентом, который снижает экспрессию или активность PD-1, PD-1 лиганда (PD-L1) или PD-1 лиганда 2 (PD-L2). Более подробно, изобретение предоставляет способы лечения или предотвращения персистирующей инфекции или лимфопролиферативных заболеваний (например, раковых заболеваний, таких как ангиоиммунобластическая лимфома и нодулярная с лимфоидным преобладанием лимфома Ходжкина) путем введения субъекту антигена, который снижает экспрессию или активность PD-1. Снижение экспрессии или активности PD-1, PD-L1 или PD-L2 приводит к увеличению цитотоксической Т-клеточной активности, увеличению специфического иммунного ответа на инфекционный агент. Представленные в настоящем документе результаты показывают, что введение антител, блокирующих лиганд-1 программируемой смерти (PD-L1), увеличивает цитотоксическую активность толерантных Т-клеток. В частности, нарушение PD-1 передачи сигнала вызывает распространение толерантных CD8+ Т-клеток, усиленную продукцию цитокинов и увеличенное удаление вирусов из организма.
Кроме того, CD8+ Т-клетки, образованные при персистирующих инфекциях CD4 истощенных мышей, пролиферировали и восстанавливали многие свои функции при лечении анти- PD-L1. Для того чтобы Т-клетки реагировали на чужеродные белки, антигенпредставляющие клетки (APC) должны дать два сигнала покоящимся Т-лимфоцитам. Первый сигнал, который придает специфичность иммунному ответу, передается через Т-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, представленного в связи с главным комплексом гистосовместимости (MHC). Второй сигнал, называемый костимуляцией, стимулирует Т-клетки к пролиферации и становлению функциональными. Костимуляция не является ни антигенспецифической, ни MHC-ограниченной, и обеспечивается одним или двумя определенными полипептидами на клеточной поверхности, экспрессируемыми АРС. Если Т-клетки стимулируются только через Т-клеточный рецептор, без получения дополнительного костимулирующего сигнала то они становятся не отвечающими, истощенными или погибают, что приводит к ослаблению иммунного ответа.
Белки CD80(B7-1) и CD86 (B7-2), экспрессируемые на АРС, являются критическими костимуляторными полипептидами. В то время как B7-2 играет главную роль в первичном иммунном ответе, B7-1 активируется позднее в ходе иммунного ответа для продления первичного Т-клеточного ответа или костимуляции вторичного Т-клеточного ответа. Полипептиды В7 способны давать иммунным клеткам костимуляторные или ингибиторные сигналы для стимулирования или ингибирования иммунных клеточных реакций. Например, при связывании с костимуляторным рецептором PD-L1 (B7-4) вызывает костимуляцию иммунных клеток или, если он представлен в растворимой форме, то ингибирует костимуляцию иммунных клеток. При связывании с ингибиторным рецептором молекулы B7-4 могут передавать ингибиторный сигнал иммунной клетке. Типичные члены семейства B7 включают в себя B7-1, B7-2, B7-3 (распознаваемый антителом BB-I), B7h (PD-Ll) и B7-4, а также их растворимые фрагменты и производные. Члены семейства B7 связываются с одним или более рецептором на иммунной клетке, такими как CTLA4, CD28, ICOS, PD-I и/или другими рецепторами и в зависимости от рецептора способны передать ингибиторный сигнал или костимуляторный сигнал иммунной клетке.
CD28 представляет собой рецептор, который экспрессируется на покоящихся Т-клетках. После передачи сигнала через Т-клеточный рецептор, лигирования CD28 и преобразования стимулирующий сигнал стимулирует Т-клетки к пролиферации и секреции IL-2. CTLA4 (CD152), рецептор гомологичный CD28, не представлен на покоящихся Т-клетках, но его экспрессия стимулируется после Т-клеточной активации. CTLA4 играет роль в отрицательной регуляции Т-клеточного ответа. ICOS, полипептид, относящийся к CD28 и CTLA4, участвует в продукции IL-10. PD-1, рецептор с которым связываются PD-L1 и PD-L2, также быстро активируется на поверхности Т-клеток. PD-1 также экспрессируется на поверхности В-клеток (в ответ на анти-IgM) и на субпопуляциях тимоцитов и миелоидных клеток.
Захват PD-1 (например, путем образования перекрестных связей или агрегации) приводит к передаче ингибиторного сигнала в иммунную клетку, дающего в результате уменьшение иммунного ответа, сопровождающегося увеличением толерантности иммунной клетки. Члены семейства PD-1 связываются с одним или более рецепторами, таким как PD-L1 и PD-L2 на антигенпредставляющих клетках. PD-L1 и PD-L2, которые представляют собой человеческие PD-1 лигандные полипептиды, являются членами семейства В7 полипептидов. Каждый лиганд PD-1 содержит сигнальную последовательность, домен IgV, домен IgC, трансмембранный домен и короткий цитоплазматический хвост. Данные лиганды экспрессируются в плаценте, селезенке, лимфатических узлах, тимусе и сердце. PD-L2 также экспрессируется в поджелудочной железе, легких, печени, в то время как PD-L1 экспрессируется в фетальной печени, на активированных Т-лимфоцитах и эндотелиальных клетках. Оба PD-1 лиганда активируются на активированных моноцитах и дендритных клетках.
ОПРЕДЕЛЕНИЯ
Используемым в настоящем документе термином "персистирующая инфекция" обозначают инфекцию, при которой инфекционный агент (например, вирус, бактерия, паразит, микоплазма или грибок) не удаляется или не уничтожается в инфицированном хозяине, даже после активации иммунного ответа.
Персистирующие инфекции могут быть хроническими инфекциями, латентными инфекциями или медленными инфекциями. В то время как острые инфекции являются относительно кратковременными (длящимися от нескольких дней до нескольких недель) и устраняются из организма иммунной системой, персистирующие инфекции могут длится месяцами, годами или даже на протяжении всей жизни. Данные инфекции также могут возникать вновь через продолжительный период времени, включая в себя стадии латентной и продуктивной инфекции без истребления клеток или даже избыточного повреждения клеток хозяина. Инфекционные агенты также могут быть обнаружены в хозяине (например, внутри специфических клеток инфицированных субъектов) даже после того, как иммунный ответ разрешился, с помощью специальных методов. Млекопитающих диагностируют как имеющих персистирующую инфекцию, согласно любому стандартному способу, известному в данной области техники и описанному, например, в патентах США № 6368832, 6579854 и 6808710 и публикациях патентных заявок США № 20040137577, 20030232323, 20030166531, 20030064380, 20030044768, 20030039653, 20020164600, 20020160000, 20020110836, 20020107363 и 20020106730, которые включены в виде ссылок в настоящий документ. Например, у субъекта может быть диагностирована персистирующая хламидийная инфекция после определения видов хламидии в биологической пробе от данного субъекта ПЦР анализом. Млекопитающих не нужно диагностировать на персистирующую инфекцию, чтобы проводить лечение согласно данному изобретению. Микробные агенты, способные вызвать персистирующую инфекцию включают в себя вирусы (например, вирус папилломы, вирус гепатита, вирус иммунодефицита человека и вирус герпеса), бактерии (например, виды Escherichia coli и Chlamydia), паразиты (например, Plasmodium, виды Leishmania, виды Schistosoma, виды Trypanosoma, виды Toxoplasma) и грибы.
Под термином "облегчение симптома персистирующей инфекции" понимают улучшение любого из состояний или симптомов, связанных с персистирующей инфекцией до или после того, как она проявляется. Альтернативно, облегчение симптома персистирующей инфекции может подразумевать снижение инфекционной микробной (например, вирусной, бактериальной, грибковой, микоплазменной или паразитарной) нагрузки у субъекта, относительно данной нагрузки в контроле без лечения. По сравнению с эквивалентным контролем без лечения, указанное снижение или степень профилактики составляет, по меньшей мере, 5%, 10%, 20%, 40%, 50%, 60%, 80%, 90%, 95% или 100% при измерении любым стандартным методом. Предпочтительно, персистирующая инфекция полностью устраняется согласно измерению любым стандартным методом, известным в данной области техники, и в таком случае персистирующую инфекцию расценивают как излеченную. Пациент, который получает лечение от персистирующей инфекции, является тем, у кого медицинский работник диагностировал данное состояние. Диагноз может быть установлен любыми подходящими способами. Диагноз и мониторинг может включать в себя, например, определение уровня микробной нагрузки в биологической пробе (например, образец ткани, проба крови или проба мочи), определение уровня идентификационного маркера микробной инфекции в биологической пробе, обнаружение симптомов, связанных с персистирующей инфекцией, или обнаружение иммунных клеток, вовлеченных в иммунный ответ, типичный для персистирующих инфекций (например, определение антигенспецифических Т-клеток, которые являются толерантными). Пациент, у которого предотвращено развитие персистирующей инфекции, может получить или не получить данный диагноз. Специалист в данной области понимает, что данные пациенты могли быть подвергнуты тем же самым стандартным тестам, что и описанные выше, или они могли быть определены без обследования, как имеющие высокий риск, вследствие наличия одного или более факторов риска (например, история семьи или воздействие инфекционного агента).
В настоящем документе под "PD-1" понимают полипептид, который образует комплекс с белками PD-L1 или PD-L2 и таким образом вовлекается в иммунный ответ, такой как костимуляция Т-клеток. Белки PD-1 изобретения являются, по существу, идентичными обнаруженным в природе PD-1 (смотри, например, Ishida и др. EMBO J. 11: 3887-3895, 1992, Shinohara и др. Genomics 23:704-706, 1994; и патент США № 5698520, включенный в виде ссылки в настоящий документ). Передача PD-1сигнала может уменьшить, например, CD8+ Т-клеточную цитотоксичность путем уменьшения Т-клеточной пролиферации, продукции цитокинов или уменьшением удаления вирусов. Согласно настоящему изобретению, полипептид PD-1 уменьшает CD8+ Т-клеточную цитотоксичность, по меньшей мере, на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или более чем на 100% ниже контрольных значений при измерении любым стандартным методом.
Под "PD-1 геном" понимают нуклеиновую кислоту, которая кодирует белок PD-1.
Под "PD-1 гибридным геном" понимают PD-1 промотор и /или весь или часть PD-1 кодирующий регион, связанный со второй гетерозиготной нуклеиновой последовательностью. В предпочтительных воплощениях вторая гетерозиготная последовательность нуклеиновых кислот является репортерным геном, который представляет собой ген, экспрессия которого может быть анализирована; репортерные гены включают в себя, без ограничения, те, которые кодируют глукоронидазу (GUS), люциферазу, хлорамфениколтрансацетилазу (САТ), зеленый флуоресцентный белок (GFP), щелочную фосфатазу и бета-галактозидазу.
Под "уменьшением экспрессии или активности PD-1" понимают уменьшение уровня или биологической активности PD-1 относительно уровня или биологической активности PD-1 в контроле без лечения. Согласно настоящему изобретению указанный уровень или активность снижаются, по меньшей мере, на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% или даже более чем на 100% относительно контроля без лечения. Например, биологическая активность PD-1 уменьшается, если уменьшается связывание PD-1 с PD-L1, PD-L2 или с ними обоими, что вызывает умень