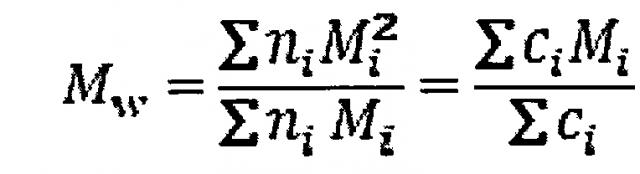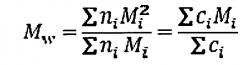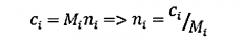Композиции, содержащие глюкан
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и фармацевтики, а именно к иммуностимулирующей композиции в форме геля, имеющей температуру плавления перехода геля в золь выше 37°C и включающей от 0,1 до 6% растворимого бета-глюкана, который получен из дрожжей и содержит основную цепь из β-(1,3)-связанных остатков глюкозы и боковые цепи, включающие два или более β-(1,3)-связанных остатков глюкозы, при этом боковые цепи присоединены к основной цепи β-(1,6)-связью, и по существу не содержит повторяющихся β-(1,6)-связанных остатков глюкозы; и гелеобразующий агент, который представляет собой карбоксиметилеллюлозу или геллановую камедь, а также к способу ее получения и применения для облегчения заживления раны или язвы, для лечения мукозита слизистой оболочки полости рта, для лечения рака и для обеспечения пролиферации клеток кожи in vitro. Группа изобретений обеспечивает синергетический эффект между глюканом и гелеобразующим агентом. 7 н. и 21 з.п. ф-лы, 5 пр., 5 табл., 9 ил.
Реферат
Настоящее изобретение относится к новым композициям, включающим гелеобразующие агенты и глюканы, и к их применению в качестве лекарственного средства, в качестве изделия медицинского назначения, в качестве средства, входящего в состав изделия медицинского назначения, в качестве нутрицевтика, косметического продукта или тому подобное. В предпочтительном варианте, такие композиции также применяют в качестве первичной повязки на рану, которую можно непосредственно накладывать на поверхность раны или которая может быть представлена в виде подложки для образования композиционного материала. Также описаны способы применения композиций, содержащих глюкан, для лечения ран. Кроме того, в настоящей заявке предложены раневые повязки и наборы.
Глюканы представляют собой гетерогенную группу полимеров глюкозы, встречающихся, в частности, в клеточных стенках растений, бактерий, грибов и простейших. Глюканы имеют основную цепь, и в некоторых случаях боковые цепи, которые, в зависимости от происхождения глюкана, включают β(1,3), β(1,4) и/или β(1,6)-связанные группы глюкозы. В зависимости от источника и способа выделения, бета-глюканы имеют различную степень разветвленности и тип связи в основной цепи и боковых цепях. Частота и тип связи в боковой цепи в значительной степени соответствует биологической активности молекулы. Глюканы также значительно различаются по молекулярной массе, а также по тенденции к агрегации цепей, и обе эти характеристики существенны для профиля эффективности этих молекул. Многие глюканы, происходящие из грибов и дрожжей, в своем нативном состоянии нерастворимы в воде, но могут быть переведены в растворимую форму путем кислотного гидролиза или путем дериватизации с помощью введения чужеродных групп, таких как фосфат, сульфат, амин, карбоксиметилцеллюлоза и т.д.
В Европе, Азии и США бета-глюканы, в частности из пекарских дрожжей, уже давно используются в качестве кормовых добавок для животных, в косметике, в качестве пищевой добавки для человека, например, в качестве иммуномодуляторов при лечении ран и в качестве активного ингредиента в кремах для кожи. Глюканы применяют при лечении рака, как показано в международной публикации WO 02/058711. Бета-глюканы, в этом контексте, рассматриваются как иммуностимуляторы, повышающие активность лейкоцитов, отчасти за счет индукции хорошо регулируемых и локальных воспалительных реакций. Их применение в лечении воспалительных заболеваний кишечника также было описано в международной публикации WO 2009/063221. Применение глюканов в лечении ран описано в ЕР 815144 и в патенте США 6875754, а применение глюканов в лечении астмы и аллергии описано в патенте США 12/528, 215.
Глюканы злаковых обычно включают неразветвленные цепи из β(1,3) и значительную долю β(1,4)-связей, а дрожжевые глюканы состоят из преимущественно β(1,3)-связанных остатков глюкозы с β(1,6)-связями, выступающими в качестве точки ветвления для боковых цепей, которые могут включать как β(1,3), так и β(1,6)-связанные остатки глюкозы. Другие молекулы, которые относят к глюканам, включают курдлан, представляющий собой в основном линейную молекулу, состоящую из β(1,3)-связанных остатков глюкозы без боковых ветвей. Лентинан представляет собой глюкан с β(1,3)-связанной основной цепью, но включающей одиночные β(1,6)-связанные остатки глюкозы, присоединенные по существу регулярно к основной цепи, что создает подобную расческе структуру этой молекулы. Одиночные β(1,6)-связанные остатки глюкозы, присоединенные к основной цепи, аналогичны точке связывания β(1,3,6), но никакие другие молекулы к этой точке связывания не присоединяется, и, таким образом, глюканы, такие как лентинан не имеют боковых цепей. Другие примеры глюканов этой группы включают склероглюкан, ламинарин и шизофиллан.
Различные варианты ветвления и длины, а также структуры боковых цепей обуславливают различия во вторичной и третичной структуре и, следовательно, в биологической активности. Структура глюканов более высокого порядка значительно варьирует, и молекулярная масса, растворимость и размер частиц оказывают влияние на активность в целом непредсказуемым образом. Некоторые продукты являются чрезвычайно мощными индукторами провоспалительных цитокинов в клетках-мишенях, тогда как другие имеют противоположное действие, полностью ингибируя высвобождение цитокинов. Для многих нерастворимых бета-глюкановых продуктов характерна индукция целого ряда воспалительных реакций, так, например, показано, что инъекция композиции из нерастворимого бета-глюкана ассоциирована с формированием гранулемы, индукцией артрита и повышенной восприимчивостью к грамотрицательному сепсису. С другой стороны, не показано, что такие отрицательные побочные эффекты связаны с растворимыми бета-глюканами, но известно, что их эффективность в качестве иммуностимуляторов существенно варьирует.
Было показано (см. WO 95/30022), например, что глюкановый продукт, полученный из дрожжей, модифицированных путем обработки глюканазой для селективного удаления (1,6)-связанных боковых цепей, более эффективно стимулирует иммунную систему рыб, чем с продукт с интактными (1,6)-связанными боковыми цепями.
Глюканы имеют большой потенциал в качестве терапевтических средств и вспомогательных веществ, но широкий спектр структурной изменчивости, проблемы, связанные с анализом таких больших и сложных молекул и отсутствие понимания механизма действия и рецепторов этих молекул обуславливает по-прежнему существующую большую потребность в усовершенствованном глюкановом продукте, в частности, продукте, эффективном для лечения ран.
Бета-глюканы известны как компоненты так называемого патоген-ассоциированного молекулярного паттерна (ПАМП), поскольку они находятся на поверхности ряда патогенных (микро)организмов, в частности грибов. У высших организмов, соответственно, сформировался механизм распознавания таких типов структур для обнаружения и уничтожения вредителей, принадлежащих к данному классу организмов. У млекопитающих клетки так называемого врожденного иммунитета экспрессируют специфические рецепторы, распознающие бета-глюканы, и одним из таких наиболее известных рецепторов является Dectin-1, но другие рецепторы также участвуют в распознавании или в сигнальном каскаде, индуцируемом бета-глюканами, и среди них - рецепторы CD11b/CD18 (CR3) и toll-подобные рецепторы 2 и 4 (TLR2 и TLR4). Клетки, участвующие в распознавании бета-глюканов, включают типичные фагоциты врожденного иммунитета, т.е. моноциты, макрофаги, дендритные клетки и гранулоциты, а также клетки природных киллеров, а также ряд эндотелиальных клеток и клетки, специфичные для других тканей, способны экспрессировать рецепторы бета-глюканов.
Важным этапом в стимуляции биологического ответа в клетках-мишенях является первоначальное связывание с рецептором и, кроме того, по-видимому, способность препарата бета-глюкана опосредовать перекрестное связывание достаточного количества рецепторов для запуска соответствующего пути передачи сигнала в клетке. В настоящем изобретении предложен продукт, обладающий способностью индуцировать специфический тип биологической активности. Это отличает его от нерастворимых продуктов, которые могут индуцировать массовый ответ за счет образования перекрестных связей с большим количеством рецепторов с последующим их фагоцитированием, что вследствие нерастворимой (или «кристаллоподобной») природы глюкана приводит к лизосомальным разрывам внутри клетки, которые вызывают активацию инфламмасомы NLRP. Нерастворимые бета-глюканы также могут индуцировать образование АФК (активных форм кислорода), что также вызывает активацию инфламмасомы, приводящую к неблагоприятной воспалительной реакции. В настоящем изобретении предложены бета-глюкановые продукты, которые способны вызывать значительный воспалительный ответ, активирующий некоторые иммунные механизмы, но без активации инфламмасомы, характерной для ряда (агрегированных нерастворимых) бета-глюкановых продуктов.
Глюкановые продукты обычно представлены в форме частиц или, в некоторых случаях, полностью растворимы в водных растворах, которые в свою очередь, либо представляют собой прозрачную жидкость, как описано, например, в патенте США 5322841, или, в некоторых случаях, образуют вязкий раствор, как описано в Steiner et al (Prog Colloid Polymer Science 77, 1988). Растворимые бета-глюканы в форме истинного геля нетипичны, особенно среди глюканов дрожжей, но было установлено, что продукты в форме геля согласно настоящему изобретению обеспечивают высокую биологическую активность, в частности в заживлении ран, по сравнению с другими глюкановыми продуктами. В дополнение к прекрасному профилю эффективности фармацевтического или медицинского изделия, при заживлении ран чрезвычайно важно применять фармацевтические или медицинские изделия таким образом, чтобы обеспечить увлажнение раны. Кроме того, готовые продукты должны покрывать рану и предпочтительно прилипать к ней, чтобы избежать инфекции и обеспечить профиль введения, который врач считает целесообразным для конкретного типа раны. Как правило, глюканы в виде частиц в полурастворимой или в жидкой форме не отвечают этим основным требованиям либо по причине того, что они не являются эффективными, либо по причине того, что они находятся в состоянии, которое не применимо для заживления ран, или по обеим причинам. Композиция, содержащая глюкан, согласно настоящему изобретению совмещает эти необходимые характеристики, что делает ее применимой для всех случаев, в которых может найти соответствующее применение композиция глюкана в виде геля. В дополнение к локальному применению, другие варианты применения включают пероральное введение и/или введение через слизистую оболочку, например, в лечении заболеваний желудочно-кишечного тракта или полости рта. Превосходные адгезионные свойства композиции, содержащей глюкан, в соответствии с настоящим изобретением делают возможным покрытие слизистой оболочки в месте действия и, таким образом, ускоряют процесс заживления. Таким образом, композиция, содержащая глюкан, согласно изобретению также может найти особое применение при лечении воспаления слизистой оболочки рта.
Неожиданно авторы настоящего изобретения обнаружили, что комбинация бета-глюкана и гелеобразующего агента приводит к синергетическому эффекту и, следовательно, улучшает заживление раны. Вне связи с какой-либо конкретной теорией, возможное объяснение этого синергетического эффекта может быть связано с оптимизированной презентацией бета-глюкана паттерн-распознающим рецепторам (ПРР, англ. pattern recognition receptors, PRR) на поверхности иммунных клеток. Такие ПРР представляют собой белки, экспрессируемые на клеточной мембране клеток врожденного иммунитета. Такие ПРР распознают патоген-ассоциированные молекулярные паттерны (ПАМП), связанные с патогенными микроорганизмами и клеточным стрессом. ПАМП направляют фагоциты и антиген-презентирующие клетки на дальнейшее созревание и активируют дополнительную группу эффекторных функций. Таким образом, гранулоциты и макрофаги, которые не были стимулированы ПАМП, не будут в достаточной степени способными убивать и разрушать клетки-мишени и клетки микроорганизмов. ПАМП также играют основополагающую роль в иммунитете, обеспечивая возникновение реакций на соответствующие стимулы (например, микроорганизмы), а не на собственные антигены.
Тремя ключевыми рецепторами ПРР, которые, как известно, участвуют в распознавании ПАМП, являются рецептор комплемента 3 (CD11b/CD18), гетеродимер Toll-подобного рецептора 2 и 6, а также рецептор Dectin-1. Эффективная стимуляция этих рецепторов является важным этапом в активации иммунной системы и приводит к изменению состояния всех задействованных клеток. На основании положительных результатов для комбинации такого бета-глюкана и гелеобразующего агента представляется, что гелеобразующий агент может выступать в качестве средства для правильной ассоциации и поперечного связывания бета-глюканов с ПРР, расположенными на таких рецепторах, таким образом, улучшая эффективность каскада, опосредующего заживление ран.
Таким образом, в одном аспекте настоящее изобретение относится к композиции, содержащей глюкан и гелеобразующий агент, причем такая композиция имеет температуру плавления (гель в золь) выше 37°С. Гелеобразующий агент предпочтительно содержит, или состоит из, или по существу состоит из одного или более углеводов/полисахаридов (отличных от глюкана) и присутствует в концентрации, которая обеспечивает стабилизацию структуры геля. Глюкан присутствует в композиции в виде геля и, следовательно, является растворимым, в отличие от глюкана в форме частиц. В предпочтительном варианте глюкан сам по себе образует гель при растворении в воде в концентрации ≥1% (например, 1,5-6%) при 25°C и нейтральном pH.
В комбинации с гелеобразующим агентом концентрация бета-глюканового компонента может быть уменьшена до ≥0,1% и желаемые свойства геля могут быть получены путем добавления гелеобразующего агента. Верхний предел содержания бета-глюкана будет определяться концентрацией и природой добавляемого гелеобразующего агента, но обычно он составляет менее 4%. Конечный продукт, содержащий комбинацию бета-глюкана и гелеобразующего агента, готовят таким образом, чтобы обладал желаемыми свойствами заживления ран, как описано выше. Примеры включают 1 или 2% растворимого дрожжевого бета-глюкана в сочетании с 1 или 1,5% высокомолекулярной карбоксиметилцеллюлозы, которые образуют стабильный гель и обладают улучшенной способностью к заживлению ран, по сравнению с их применением в отдельности. При их смешивании с гелеобразующим агентом происходит упорядочивание молекулярной организации бета-глюкана с образованием оказывающего благоприятный эффект надмолекулярного типа организации. При фармацевтическом применении нового геля организация бета-глюкана в таком геле стабилизируется в форме, которая делает возможным перекрестное связывание рецепторов на поверхности популяции клеток-мишеней, что обуславливает желаемую иммуностимулирующую активность, лишенную негативных эффектов препарата агрегированного нерастворимого бета-глюкана. В предпочтительном варианте глюкан представляет собой дрожжевой глюкан и имеет усредненную молярную массу для одиночной цепи от 15000 до 50000 г/моль и усредненную молярную массу в водном растворе для агрегатов от 4 до 20×105 г/моль.
«Одиночная цепь» относится к отдельной молекуле глюкана, то есть такой, в которой гликозильные остатки ковалентно связаны. «Агрегаты» образуются в результате взаимодействий посредством водородных связей и определяют надмолекулярную или более высокого порядка структуру. Такие ассоциации менее постоянны, чем в случае образования ковалентной связи, но описанные в настоящей заявке способы обеспечивают образование агрегатов с опознаваемой структурой, средняя молярная масса которых может быть исследована с использованием способов, указанных в настоящей заявке. «Водный раствор», как правило, имеет pH 7.
Следует понимать, что водный раствор может иметь форму геля. Гели согласно настоящему изобретению предпочтительно представляют собой водные растворы, то есть гидрогели. Гелевые композиции предпочтительно представляют собой гидратированные гидроколлоиды. Гидратированные гидроколлоиды могут быть и эластичными, и вязкими. Гидроколлоиды обычно образуют гель, когда предпочтительнее образуются внутри- или межмолекулярные водородные, чем водородные связи с водой, в достаточной степени для преодоления энтропийных затрат.
Гелеобразующий агент предпочтительно представляет собой полимер, который сам способен образовывать гидрогель в водном растворе и в комбинации с глюканом может повышать гелеобразующие свойства глюканового компонента.
Примерами предпочтительных гелеобразующих агентов являются агенты, полученные из целлюлозы, бактериальные или водорослевые гидрогели, альгинаты, геллановая камедь, а также полимеры целлюлозы и их производные, такие как карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза и фталат гидроксипропилметилцеллюлозы. Некоторые из таких гелей также включают дополнительные компоненты, такие как серебро. Таким образом, гелеобразующие агенты предпочтительно представляют собой полисахариды, отличные от глюкана. Гелеобразующие агенты предпочтительно представляют собой гидроколлоиды и подходящие гидроколлоиды могут быть белковой природы, а не на основе Сахаров. Во всех случаях гелеобразующие агенты могут представлять собой природные агенты, агенты, полученные на их основе с помощью химических или других способов обработки или полностью синтетические агенты.
В качестве гелеобразующих агентов можно применять камеди, такие как трагакантавая и ксантановая камедь, альгинат натрия, желатин и геллановая камедь. Вещество из этой группы, геллановую камедь, продукт бактериального происхождения, также известную под торговыми названиями AppliedGel, Phytagel или Gelrite, часто применяют в качестве загустителя, эмульгатора и стабилизатора. Геллановая камедь представляет собой анионную деацетилированную внеклеточную полисахаридную камедь с высокой молекулярной массой, получаемую в виде продукта ферментации по чистой культуры Pseudomonas elodea с тетрасахаридным повторяющимся звеном из одной α-L-рамнозы, одной β-D-глюкуроновой кислоты и двух β-D-глюкозных остатков. Тетрасахаридный повтор имеет следующую структуру: D-Glc(β1→4)D-GlcA(β1→4)D-Glc(β1→4)L-Rha(α1→3)]n. Тетрасахаридные звенья соединены друг с другом с помощью (α1→3)-гликозидной связи. Точная молекулярная формула геллановой камеди может слегка варьировать (например, в зависимости от степени, в которой глюкуроновая кислота нейтрализована с помощью различных солей). Геллановая камедь обладает характерными свойствами температурозависимого зависимого и катион-индуцированного гелеобразования. Существуют три основные формы продукта на основе геллановой камеди, которые были охарактеризованы и которые отличаются по 1) содержанию полисахаридов, 2) проценту O-ацетильных заместителей у полисахарида и 3) содержанием белка (в том числе остатков нуклеиновых кислот и других органических источников азота). Она доступна в двух формах (с высоким или низким содержанием ацильных групп). Ацильные групп оказывают значительное влияние на характеристики геля. Формы с высоким содержанием ацильных групп образуют мягкие, очень эластичные и нехрупкие гели, в то время как формы с низким содержанием ацильных групп образуют прочные, неэластичные и хрупкие гели. Геллановая камедь практически не токсична для крыс при введении в виде единичной высокой дозы (5 г/кг массы тела) с пищей или через зонд.
Такие продукты как карбоксиметилцеллюлоза или метилцеллюлоза относятся к группе гелеобразующих агентов, полученных из целлюлозы, которая представляет собой полимер β-D-глюкозы, который ориентирован - CH2OH-группами с образованием длинной неразветвленной цепи. Целлюлоза является основным структурным материалом растений. Целлюлоза может быть модифицирована с замещением некоторых или всех гидроксильных групп на другие группы, такие как метоксидные группы (-OCH3) и карбоксиметильную (-CH2-COOH) группы. Метилцеллюлозу получают синтетическим способом путем нагревания целлюлозы с каустическим раствором (например, раствором гидроксида натрия) и обработкой хлористым метилом. Могут быть получены различные виды метилцеллюлозы, в зависимости от числа замещенных гидроксильных групп. Карбоксиметилцеллюлоза (КМЦ) образуется в результате реакции целлюлозы со щелочью и хлоруксусной кислотой. Различные препараты КМЦ могут иметь различную степень замещения, но обычно она составляет 0,6-0,95 производных на мономерное звено. Молекулы КМЦ несколько короче, в среднем, чем нативная целлюлоза с неравномерным распределением заместителей, образующим области с высокой и низкой степенью замещения. Большинство КМЦ быстро растворяются в холодной воде и в основном их применяют для регулирования вязкости без гелеобразования, поскольку КМЦ при обычных концентрациях не образует гель даже в присутствии ионов кальция. Способность КМЦ регулировать вязкость позволяет применять ее в качестве загустителя, стабилизатора фазы и эмульсии и суспендирующего агента. КМЦ также можно применять с учетом ее водоудерживающей способности, так как она остается высокой даже при низкой вязкости, особенно при использовании ее в форме соли Ca2+. Карбоксиметилцеллюлозу (КМЦ) или целлюлозную камедь часто применяют в виде ее натриевой соли, карбоксиметилцеллюлозы натрия.
Альгинат является самым распространенным морским биополимером и после целлюлозы самым распространенным биополимером в мире. Основной источник альгината находится в клеточных стенках и во внутриклеточном пространстве бурых водорослей, таких как гигантские ламинарии (Macrocystis pyrifera). Альгинаты также синтезируют некоторые бактерии (например, виды Pseudomonas и Azotobacter). Альгинаты представляют собой соли и сложные эфиры альгиновой кислоты. Химическими компонентами альгината являются случайные последовательности цепей из β-D-маннуроновой и α-L-гулуроновой кислот, соединенных 1→4 связями. Альгинаты нерастворимы в воде, но легко поглощают воду. Применение альгината в качестве иммобилизующего агента в большинстве вариантов применений основано на его способности образовывать термостабильные прочные гели, которые могут образовываться и затвердевать при комнатной температуре. В большинстве случае используют образование альгинатного геля с ионами кальция.
Другими гелеобразующими агентами, применяемыми в соответствии с настоящим изобретением, являются, но не ограничены ими, карбомеры; гидрофильные полимеры, такие как полиэтиленоксид, сополимеры полиоксиэтилена-полиоксипропилена и поливиниловый спирт.
Комбинацию согласно настоящему изобретению можно применять для получения эффективных содержащих глюкан композиций в форме геля с использованием в качестве исходного вещества любого растворимого глюкана. Наблюдаемый синергетический эффект означает, что при данной концентрации глюкана композиция в форме геля будет демонстрировать необходимую активность. Растворимые глюкановые продукты известны специалисту в данной области, и некоторые из них являются коммерчески доступными. Глюкан обычно получают из дрожжей, предпочтительно из Saccharomyces cerevisiae. Основная молекулярная структура глюкана представляет собой обычно β-1,3-основную цепь (каркас, то есть цепь из молекул глюкозы, соединенных β-1,3 связями), в дополнение к β-1,3-боковым цепям (то есть цепь из по меньшей двух молекул глюкозы, соединенных β-1,3-связями) и точки связывания β-1,3,6-связи, в которых боковые цепи присоединяется к основной цепи. Кроме того, глюканы из дрожжей включают β-1,6-связи, которые быть связаны с к боковыми цепями или непосредственно с основной цепью. Также встречаются и другие типы связи, но на сравнительно низком уровне. Другие виды дрожжей, которые могут служить источником для глюкана, включают пивные дрожжи, Candida sp., например, Candida albicans, Candida cloacae, Candida tropicalis, Candida utilis, Hansenula sp., например, Hansenula wingei, Hansenula arni, Hansenula henricii и Hansenula americana, Histoplasma sp., Kloeckera sp., Kluyveromyces sp., например, Kluyveromyces lactis, Kluyveromyces fragilis, Kluyveromyces polysporus, Pichia sp., Rhodotorula sp., Saccharomyces sp., например, Kluyveromyces Saccharomyces delbruekii, Saccharomyces rosei, Saccharomyces microellipsodes, Saccharomyces carlsbergensis или различные штаммы Saccharomyces, такие как Saccharomyces cerevisiae R4 (NRRL Y-15903) и R4 Ad (ATCC No. 74181), Schizophyllum sp., Schizosaccharomyces sp., например, Schizosaccharomyces pombe, Torula sp. И Torulopsis sp.
Однако глюканы могут быть получены и из других подходящих источников, например, глюканы бактерий, грибов или злаков. Отсутствие гелеобразующей способности у бета-глюкана как такового может быть компенсировано способностью к гелеобразованию таких агентов, как КМЦ, как описано выше, с получением продукта с желаемыми свойствами для заживления ран. Терапевтическая активность различных глюканов хорошо известна в данной области, и композицию согласно настоящему изобретению можно применять для повышения активности глюканов в целом, в частности в заживлении ран, при этом, как было показано авторами настоящего изобретения, физическая форма и межмолекулярная структура глюканового продукта имеет особенное значение. Вне связи с какой-либо теорией, эмпирическое правило заключается в том, что чем выше усредненная молярная масса основной цепи глюкана, применяемого в композициях настоящего изобретения, тем более эффективные гели могут быть получены.
Боковые цепи гелеобразующего глюкана согласно настоящему изобретению обычно содержат 2 или более β(1,3)-связанных звеньев глюкозы. Согласно настоящему изобретению, одиночные молекулы, присоединенные к основной цепи, не рассматриваются как «боковые цепи».
Гелеобразующие глюканы, предпочтительно, имеют боковые цепи, например, состоящие из или по существу состоящие из β(1,3)-связанных глюкозных звеньев (например, боковые цепи из по меньшей мере 2, 5, 10 или 20 связанных остатков глюкозы). В дополнение к β(1,3)-связанным боковым цепям глюканы могут также иметь одну или более β(1,6)-соединенные боковые цепи. Изменяя структуру цепи, можно изменить характеристики конечного продукта. Существует много различных способов изменения глюканов, в том числе путем ферментативной обработки, применения кислот, таких как муравьиная кислота или соляная кислота, или различных оснований, а также с использованием других способов. Предпочтительными являются глюканы, обработанные кислотой (например, муравьиной кислотой) или с использованием фермента или любым другим подходящим способом для того, чтобы значительно уменьшить или устранить число повторяющихся (1,6)-связанных молекул глюкозы в составе глюкана. Такие (1,6)-связанные глюкозильные группы, как правило, встречаются в боковых цепях бета-глюканов, полученных из дрожжей. Полученные в результате глюканы содержат β(1,3)-основные цепи и β(1,3)-боковые цепи, которые присоединены к ним одной β(1,6)-связью, которая не отщепляются при указанной обработке.
Предпочтительные глюканы по существу не содержат повторяющихся β(1,6)-связанных остатков глюкозы. Одиночные (1,6)-связи в точках ветвления β(1,3,6)-точки ветвления) не образуют «повторяющиеся» β(1,6)-связанные глюкозильные звенья. «По существу не содержит» означает менее 6%, предпочтительно менее 4% и наиболее предпочтительно менее 3% от общего глюкозных звеньев.
Некоторые варианты обработки, такие как ферментативная обработка, могут оставлять в боковых цепях нерасщепленными до 4 бета-1,6-связанных, но обычно 2 бета-1,6-связанных звеньев глюкозы. Такие молекулы также «по существу не содержат» повторяющиеся бета-1,6-связанные звенья глюкозы.
Распределение связей в составе предпочтительных глюканов можно представить следующим образом:
| Тип связанного остатка глюкозы | % |
| β(1,3) | 80-98 |
| β(1,6) | 0-6 |
| β(1,3,6) | 1-8 |
| концевой | 0,01-6 |
β(1,3,6) относится к остаткам точки ветвления, которые соединены (1,3)-связью с основной цепью и участвуют в (1,6)-присоединении боковой цепи.
Глюкан может быть представлен в форме одной экстрагированной фракции, двух или более различных фракций с различными средними молекулярными массами.
Глюканы предпочтительно не дериватизированы в терминах химических модифицирующих групп.
Молярная масса глюканов может быть определена различными способами. В случае растворимого глюкана молярную массу удобно оценивать с помощью анализа SEC-MALS-RI (эксклюзионная хроматография с детекцией многоуглового светорассеяния и показателя преломления), такой анализ позволяет определить усредненное значение молярной массы (MW) для образца, а также распределение различных молекулярных массы в образце. В настоящем изобретении усредненную молекулярную массу (Mw) определяли следующим образом:
,
где ni число молекул с молярной массой Mi. Концентрация по массе ci молекул с молярной массой Mi пропорциональна молярной массе Mi и числу молекул ni.
Концентрацию по массе для каждого отрезка на хроматограмме измеряют с помощью детектора показателя преломления, а молярную массу для каждого отрезка на хроматограмме измеряют с помощью детектора многоуглового светорассеяния в сочетании с детектором угла преломления. Расчеты основаны на теории светорассеяния.
В частности, средняя молекулярная масса (для одиночных цепей) определяют с помощью SEC-MALS-RI в DMAc с 0,5% LiCl (диметилацетамид с 0,5% хлоридом лития), предполагая, что значение dn/dc для глюкана в этом растворителе составляет 0,12. Растворитель DMAc/LiCl полностью растворяет указанный глюкан в форме одиночной цепи, и таким образом последующий анализ с помощью SEC-MALS-RI с применением DMAc с 0,5% LiCl в качестве элюента позволяет оценить распределение молекулярных масс на уровне одной цепи. В целом, анализ глюкана в DMAc/LiCl включает растворение сухого глюкана в растворителе в концентрации от примерно 3 мг/мл при перемешивании раствора при комнатной температуре в течение ночи и нагревании его при 100°C в течение 1 ч перед анализом с помощью SEC-MALS-RI с применением колонок PIgelPLgel Mixed-A LS и DMAc/c 0,5% LiCl в качестве элюента. Усредненная молярная масса для глюкана в форме одной цепи составляет предпочтительно от 15000 до 50000 г/моль, более предпочтительно от 25000 до 45000 г/моль, наиболее предпочтительно от 30000 до 40000 г/моль.
В водном растворе усредненная молекулярная масса для структур в основном более высокого порядка и агрегатов глюкана составляет предпочтительно 4-20×105 г/моль, более предпочтительно 5-15×105 г/моль и наиболее предпочтительно 6-12×105 г/моль. Такие средние значения предпочтительно рассчитывают, исключая очень большие агрегаты, то есть те, молекулярная масса которых выше 1,0×107 г/моль. Анализ глюкана в водном растворе включает разбавление гель-раствора до примерно 3 мг/мл в 0,1 M NaNO3/0,02% NaNa3, нагревание до 100°C в закрытой стеклянной пробирке в течение 30 мин, охлаждение до комнатной температуры, фильтрацию через 0,2 мкм шприцевой фильтр и последующий анализ методом SEC-MALS-RI с использованием колонок TSKgel G5000 PWXL + TSKgel G4000 PWXL и 0,1 M NaNO3/0,02% NaN3 в качестве элюента. Схожая схема с использованием, например, 0,05 M Na2SO4/0,01 M ЭДТА в качестве растворителя/элюента дает эквивалентные результаты. Сопоставление значений молярной массы для одиночных цепей и структур более высокого порядка/агрегатов в водном растворе дает хорошее представление о молекулярной и надмолекулярнрй структуре предпочтительных глюканов, применяемых в составах согласно настоящему изобретению.
Описанные выше глюкановые гели являются примерами глюканов в соответствии с настоящим изобретением. Такие глюкановые продукты характеризуются тем, что они существуют в форме геля при 25°C и при pH между 4 и 8. Такие глюкановые гели также характеризуются профилем вязкости, примером которого является температура плавления гелей (гель-золь) выше 30°C и примерно до 80°C, предпочтительно выше нормальной температуры тела.
Точку плавления геля глюканового продукта, т.е. температуру перехода гель→золь, удобно определять путем измерений небольших колебаний деформации с использованием реометра Stresstech HR или подобного прибора, и изучения изменений вязкоупругих свойств при охлаждении (70→10°) и нагреве (10→70°C) раствора глюкана. Другим способом определения приблизительной температуры плавления геля является измерение вязкости геля (например, с использованием ротационного вискозиметра) при последовательном увеличении температуры до момента по существу утраты вязкости и превращения геля в раствор.
Предпочтительные глюканы согласно настоящему изобретению вызывают экспрессию ФНОα и CXCL2/MIP2α в мышиных перитонеальных макрофагах. Слабая индукции ФНОα проявляется также в миелоидных дендритных клетках человека, полученные из моноцитов периферической крови.
Влияние предпочтительных бета-глюканов на высвобождение ФНОα является дозозависимым и, по-видимому, уменьшается при концентрации глюкана выше определенного порогового значения, например,. 2-4 мкг/мл, в случае клеточной линии RAW, сверхэкспрессирующей бета-рецептор глюкана Dectin-1. Продуктам настоящего изобретения свойственна индукция ФНОα и CXCI-2 от умеренной до низкой степени. Как ФНОα, так и CXCL-2 играют важную роль в заживлении ран. Мышиный хемокин CXCL2 стимулирует миграцию клеток и ангиогенез, и он может быть использован в качестве суррогатного маркера ангиогенной активности в воспалительной грануляционной ткани.
Предпочтительные глюканы согласно настоящему изобретению не вызывают значительного усиления экспрессии IP-10 (CXCI-10). IP-10 является членом семейства хемокинов альфа- или семейства хемотаксических цитокинов цистеин- аминокислота X -цистеин (CXC). Высокий уровень экспрессии IP-10 был обнаружен при ряде хронических воспалительных заболеваний у человека, в том числе при псориазе, распространенном воспалительном заболевании кожи. Пациенты в целом демонстрируют аномальный ответ, связанный с заживлением ран, характеризующийся более интенсивной воспалительной фазой и длительной и дезорганизованной грануляционной фазой с нарушением формирования кровеносных сосудов. Глюканы согласно настоящему изобретению не должны усиливать ЛПС-индуцированную экспрессию IP10 в дендритных клетках человека, и предпочтительно они ингибируют ЛПС-индуцированную экспрессию IP-10 в макрофагах, взятых у мышей db/db. Это означает, что предпочтительные глюканы в соответствии с настоящим изобретением запускают полезные элементы процесса заживления ран, и при этом они подавляют ингибиторы, тем самым удлиняя фазу заживления.
Кроме того, гелевые глюканы согласно настоящему изобретению предпочтительно активируют систему комплемента.
Композиции, содержащие глюкан, согласно настоящему изобретению высокоэффективны in vivo в качестве ранозаживляющих агентов, как показано в Примерах.
Глюкан, применяемый в композиции согласно настоящему изобретению, может представлять собой более эффективный вариант, в частности, растворимые бета-глюканы, обладающие способностью индуцировать дифференцировку миелоидных дендритных клеток человека по направлению к воспалительному фенотипу, значительно стимулировать секрецию ФНО-альфа, а также индуцировать продукцию G-CSF и IL-10 дендритными клетками. Во всех случаях секреция СХСl-10 должна сохраняться по существу на базовом уровне и на нее не оказывают влияние способы обработки, описанные в настоящей заявке, т.е. объединение с гелеобразующим агентом. Этот факт является важным, и он демонстрирует, что предпочтительный глюкан стимулирует секрецию специфического набора или комбинации цитокинов. Предпочтительный глюкан может также стимулировать макрофаги, взятые у мышей с диабетом (db/db) к секреции PGE 2 и GM-CSF.
Глюкановый гель, применяемый в Примерах в соответствии с настоящим изобретением, представляет собой гель на водной основе, и хотя гелевая форма может быть подтверждена путем визуального осмотра, профиль неньютоновской вязкости и псевдопластичная и тиксотропная природа глюканового геля может быть также определена путем измерения вязкости, например, с помощью ротационного вискозиметра. 2% глюкановый гель, используемый в Примерах, имеет вязкость по меньшей мере 1000 сПз, предпочтительно по меньшей мере 1500 сПз, измеренную при 25°C и скорости вращения 10 об./мин с использованием программируемого вискозиметра Brookfield DV-II+ Pro с малым адаптером для образцов и шпинделем SC4-31 (соответствует скорости сдвига 3,40 сек-1). Измерить вязкость такого псевдопластического и тиксотропного геля можно с помощью повышения/понижения скорости (англ. up-down rate ramp) например, начиная с 2 об/мин с увеличением до 10 об/мин с шагом 2 об/мин и с последующим понижением скорости до исходного значения с шагом 2 об/мин. Данные такого эксперимента могут показать как псевдопластические (снижение вязкости с увеличением скорости сдвига), так и тиксотропные (снижение вязкости в момент сдвига) характеристики геля, а также позволяют измерить, например, вязкость при 10 об/мин.
Глюканы с указанными выше предпочтите