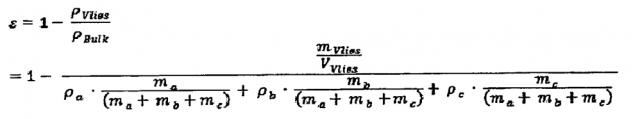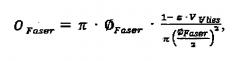Биоразлагаемый нетканый материал для медицинских целей
Иллюстрации
Показать всеГруппа изобретений относится к медицине, конкретно к биоразлагаемому нетканому материалу, содержащему (i) по меньшей мере один полимер для индуцирования первичного гемостаза, (ii) по меньшей мере один непротеиногенный низкомолекулярный водорастворимый активатор вторичного гемостаза и (iii) по меньшей мере один непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза. Описан способ получения биоразлагаемого нетканого материала, по которому (i) флюидизированный исходный материал для волокон при необходимости вместе с добавками подают в сосуд, (ii) сосуд приводят во вращение, (iii) флюидизированный исходный материал для волокон центробежными силами выдавливается из сосуда, вследствие чего образуются волокна или элементарные нити, и (iv) из волокон или элементарных нитей формируют биоразлагаемый нетканый материал. Описано применение биоразлагаемого нетканого материала, который сформирован так, чтобы человеческие фибробласты могли проникать в нетканый материал и в ходе заживления раны могла образовываться соединительная ткань. 3 н. и 10 з.п. ф-лы, 4 ил., 3 пр.
Реферат
Настоящее изобретение относится к биоразлагаемому нетканому материалу, к способу получения такого биоразлагаемого нетканого материала, а также к применению такого биоразлагаемого нетканого материала в качестве кровоостанавливающего средства для местного применения.
В хирургии часто возникают местные кровотечения в мягких тканях, которые не могут быть остановлены обычными способами остановки кровотечения, такими как прямое сдавливание, сшивание, наложение скобок или каутеризация. Благодаря эффективной остановке кровотечения при операционных вмешательствах может быть заметно уменьшено число требуемых трансфузий, а также улучшена визуализация операционного поля и сокращена продолжительность операции. Дополнительно благодаря эффективной остановке кровотечения может быть снижена смертность и заболеваемость пациентов во время операционных вмешательств и после них. В связи с этим в качестве пассивных кровоостанавливающих средств для местного применения были разработаны губки, пленки, газы и порошки из коллагена, целлюлозы и/или желатина.
Особенный недостаток в случае порошковых форм представляет собой то обстоятельство, что вследствие электростатических эффектов они часто прилипают к перчаткам и инструментам оперирующих врачей и поэтому их трудно использовать. Кровоостанавливающее действие таких губок, а также пленок и газов основано на агрегации тромбоцитов на поверхности белка или целлюлозы, из которых они состоят. Благодаря этому образуется тромб и делается возможной эффективной закупорка повреждения. В случае коллагеновых кровоостанавливающих средств следует принимать во внимание, что люди числом от 2 до 4% от общей численности населения проявляют аллергическую реакцию на бычий коллаген [A.K. Lynn, I.V. Yannas, W. Bonfield; Antigenicity and immunogenicity of collagen; J. Biomed. Mater. Res. B Appl. Biomater. 2004; 71(2); 343-354]. Материалы, основанные на целлюлозе, содержат регенерированную окисленную целлюлозу. В литературе имеются указания, что они резорбируются не так хорошо, как материалы, основанные на коллагене и желатине. В нескольких исследованиях было показано, что остатки окисленной целлюлозы могли обнаруживаться при повторной операции (ревизии) [Y. Tomizawa; Clinical benefits and risk analysis of topical hemostats: a review; J. Artif. Organs. 2005; 8(3); 137-142]. Свойства желатина позволяют применять его также в случае ран с неправильной конфигурацией. Когда такое кровоостанавливающее средство фиксируют по месту кровотечения, оно адаптируется к форме раны и набухает, вследствие чего в ограниченном пространстве появляется тампонирующий эффект. Набухший желатин уменьшает кровотечение и образует стабильную матрицу, вокруг которой вследствие контактной активации образуется тромб. В основном распространены материалы, основанные на желатине бычьего и свиного происхождения.
Недостаток в случае применения во время операционных вмешательств состоит в высокой липкости пропитанных кровью материалов к хирургическим инструментам [S. Srinath; Topical hemostatic agents in surgery: A surgeon′s perspective; Aorn Journal. 2008; 88(3) 2-11]. Губки, в общем случае, изготавливают лиофильной сушкой и специальными способами пенообразования. Однако в данном случае недостаток состоит в том, что в ходе заживления раны фибробласты могут проникнуть в губки и набухший порошок только с трудом или даже не могут проникать в них. В целом, в случае таких полностью пассивных кровоостанавливающих средств на основе коллагена, желатина и особенно в случае целлюлозы наблюдается большое число случаев осложнений при применении. Остатки материалов могут вызывать по месту применения реакции на чужеродные тела, хронические воспаления и/или инфекции, которые в свою очередь благоприятствуют гранулемообразованию и препятствуют оптимальному излечению. В случае полностью пассивных кровоостанавливающих средств гранулемы были обнаружены в самых разных местах применения [H.E. Achneck, B. Sileshi, R.M. Jamiolkowski, D.A. Albala, M.L. Shapiro, J.H. Lawson; A comprehensive review of topical hemostatic agents: Efficacy and recommendations for use; Anals of Surgery. 2010; 251(2). 217-228].
Свертывание крови подразделяют на первичный гемостаз и вторичный гемостаз. Существенную стадию первичного гемостаза представляет собой агрегация тромбоцитов, которая ведет к первому перекрыванию кровотечения. Вторичный гемостаз представляет собой сложный каскадный процесс, в конце которого благодаря протеазе тромбина из фибриногена высвобождается фибрин, который за счет поперечного сшивания образует стабильную фибриновую сетку. Вторичный гемостаз может инициироваться, в частности, ионами кальция, то есть фактором IV.
Был предложен ряд активных кровоостанавливающих средств на основе коллагеновых губок, содержащих тромбин, чтобы при контакте с кровью активировать фибринообразование из фибриногена. Такие активные кровоостанавливающие средства проявляют биологическую активность и непосредственно вмешиваются в более поздние фазы сложного каскадного процесса для индуцирования тромба по месту кровотечения. Вследствие этого должна достигаться быстрая остановка кровотечения. Эффективная остановка кровотечения тромбином предполагает наличие фибриногена в крови пациентов, поэтому она не происходит в случае пациентов с афибриногенемией. При этом следует посмотреть критически на то, что, в частности, при применении тромбина человека тромбин должен быть обработан так, чтобы был надежно исключен перенос вирусов, таких как ВИЧ и вирус гепатита C. Кроме того, был обнаружен потенциал бычьего и человеческого тромбина в отношении индуцирования антител (до 94% случаев) [H. Seyedejad, M. Imani, T. Jamieson, A.M. Seifalian; Topical haemostatic agents; British Journal of Surgery; 2008; 95; 1197-1225]. Хотя у многих пациентов отсутствуют клинические аномалии после образования антител, аномалии были обнаружены в тесте на свертываемость крови, которые в исключительных случаях имели даже фатальные последствия (анафилаксия, коагулопатия) [Y. Wai, V. Tsui, Z. Peng, R. Richardson, D. Oreopoulos, S.M. Tarlo; Anaphylaxis from topical bovine thrombin during haemodialysis and evaluation of sensitization among dialysis poulation; Clin. Exp. Allergy; 2003; 33; 1730-1734; M. Pope, K.W. Johnston; Anaphylaxis after thrombin injection of a femoral pseudoaneurysm: recommendations for prevention; J. Vasc. Surg; 2000; 32; 190-191; K. Tadokoro, T. Ohtoshi, S. Takafuiji, K. Nakajima, S. Suzuki, K. Yamamoto et al.; Topical thrombin-induced IgE-mediated anaphylaxis: RAST analysis and skin-test studies; J. Allergy Clin. Immunol. 1991; 88; 620-629]. При применении бычьего тромбина в случае человека дополнительно были обнаружены сильные реакции иммунной защиты.
В человеческом организме в качестве антагонистов к вторичному гемостазу содержится протеаза плазмина. Плазмин расщепляет фибриновые сетки на фрагменты малого размера. Процесс фибринолиза противодействует вторичному гемостазу.
Недостаток кровоостанавливающих нетканых материалов, известных к настоящему времени, состоит в том, что остановка кровотечения во многих случаях происходит недостаточно быстро и эффективно. Недостаток кровоостанавливающих нетканых материалов предшествующего уровня техники состоит, в частности, в том, что действие вторичного гемостаза уменьшается аутологичной протеазой плазмина и таким образом ограничивается кровоостанавливающее действие кровоостанавливающих нетканых материалов.
Таким образом, задача настоящего изобретения состоит в разработке улучшенного биоразлагаемого нетканого материала, в котором, в частности, устранены указанные ранее недостатки. В частности, предпочтительно должен быть разработан биоразлагаемый нетканый материал, оказывающий более сильное кровоостанавливающее действие, чем кровоостанавливающие нетканые материалы предшествующего уровня. Биоразлагаемый нетканый материал одновременно должен быть простым при применении и возможно более дешевым в изготовлении.
В частности, нетканый материал должен быть разработан так, чтобы активировать как первичный, так и вторичный гемостаз, а образовавшаяся фибриновая сетка была дополнительно стабилизирована. Кроме того, нетканый материал должен быть сформирован так, чтобы человеческие фибробласты могли проникать в нетканый материал, чтобы таким образом в ходе заживления раны могла образовываться соединительная ткань. Нетканый материал по возможности не должен содержать выделенные из человеческой крови белки, чтобы заведомо избежать переноса возбудителей инфекций, в частности вирусов человека.
Следующая цель состоит в том, чтобы нетканый материал предпочтительно был сформирован так, чтобы значение pH нетканого материала было стабилизировано в физиологически нейтральной области значений pH, так чтобы заживление ран не могло быть ухудшено вследствие смещения значения pH.
К тому же нетканый материал должен предоставлять возможность для противоинфекционной модификации, так чтобы можно было осуществлять местную защиту нетканого материала от микробиального заселения.
Эти задачи решаются за счет разработки биоразлагаемого нетканого материала по п. 1 формулы изобретения.
В соответствии с этим настоящее изобретение относится к биоразлагаемому нетканому материалу, содержащему (i) по меньшей мере один полимер для индуцирования первичного гемостаза, (ii) по меньшей мере один непротеиногенный низкомолекулярный водорастворимый активатор вторичного гемостаза и (iii) по меньшей мере один непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза.
Кроме того, настоящее изобретение относится к способу получения такого биоразлагаемого нетканого материала, по которому (i) флюидизированный исходный материал для волокон при необходимости вместе с добавками подают в сосуд, (ii) сосуд приводят во вращение, (iii) флюидизированный исходный материал для волокон центробежными силами выдавливается из сосуда, вследствие чего образуются волокна (1) или элементарные нити (1) и (iv) из волокон (1) или элементарных нитей (1) формируют биоразлагаемый нетканый материал.
Кроме того, настоящее изобретение относится к применению такого биоразлагаемого нетканого материала в качестве кровоостанавливающего средства для местного применения.
Под биоразлагаемым материалом в данном случае понимают материалы, в частности полимеры, и компоненты, которые разлагаются и in vivo резорбируются. При этом материалы удаляются путем естественного обмена веществ. Это может осуществляться благодаря простым процессам фильтрования продуктов разложения или посредством их метаболизации.
Биоразлагаемый нетканый материал содержит (i) полимер для индуцирования первичного гемостаза.
Полимер для индуцирования первичного гемостаза предпочтительно выбирают из группы, в которую входят коллаген, желатин, карбоксиметилцеллюлоза, оксицеллюлоза, карбоксиметилдекстран и их смеси. Эти полимеры могут быть легко получены и являются особенно хорошо приемлемыми для формирования кровоостанавливающего нетканого материала или волокон для кровоостанавливающего нетканого материала. Нетканый материал содержит по меньшей мере один непротеиногенный низкомолекулярный водорастворимый активатор вторичного гемостаза.
Активатор гемостаза является непротеиногенным, если он не содержит α-аминокислот, пептидов и олигопептидов и предпочтительно совсем не содержит пептидов.
Активатор является низкомолекулярным, если его молекулярная масса составляет меньше 1000 г/моль. Молекулярная масса активатора предпочтительно составляет меньше 800 г/моль, более предпочтительно меньше 500 г/моль и наиболее предпочтительно меньше 200 г/моль.
Активатор вторичного гемостаза предпочтительно является водорастворимым, если растворимость активатора вторичного гемостаза в воде при температуре 25°C составляет по меньшей мере 100 мг в литре, предпочтительно по меньшей мере 500 мг в литре, более предпочтительно по меньшей мере 1000 мг в литре и наиболее предпочтительно по меньшей мере 2000 мг в литре.
Активатор вторичного гемостаза действует предпочтительно кровоостанавливающим образом, то есть он является приемлемым, чтобы противодействовать кровотечению у пациента терапевтически. Активатор вторичного гемостаза предпочтительно поддерживает аутологичный гемостаз, так что он приводит к более быстрой остановке кровотечения.
Согласно предпочтительному варианту осуществления активатор вторичного гемостаза представляет собой по меньшей мере одну соль кальция. Растворимость этой по меньшей мере одной соли кальция в воде при температуре 25°C предпочтительно составляет больше 2 г/л. По меньшей мере одну соль кальция предпочтительно выбирают из группы, в которую входят хлорид кальция, ацетат кальция, дигидрат сульфата кальция, лактат кальция и их смеси. Соли кальция являются особенно простыми в применении при формировании нетканого материала по настоящему изобретению. Кроме того, они легко преобразуются в организме пациента.
Доля активатора вторичного гемостаза предпочтительно находится в интервале от 0,1 до 20% масс., более предпочтительно в интервале от 0,5 до 15% масс. и наиболее предпочтительно в интервале от 1 до 10% масс. в расчете на массу нетканого материала.
Нетканый материал содержит по настоящему изобретению непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза.
Ингибитор фибринолиза является непротеиногенным, если он не содержит α-аминокислот, пептидов и олигопептидов и предпочтительно совсем не содержит пептидов.
Ингибитор фибринолиза является низкомолекулярным, если его молекулярная масса составляет меньше 1000 г/моль. Молекулярная масса ингибитора фибринолиза предпочтительно составляет меньше 800 г/моль, более предпочтительно меньше 500 г/моль и наиболее предпочтительно меньше 200 г/моль.
Ингибитор фибринолиза предпочтительно является водорастворимым, если растворимость ингибитора фибринолиза в воде при температуре 25°C составляет предпочтительно по меньшей мере 100 мг в литре, более предпочтительно по меньшей мере 500 мг в литре, еще более предпочтительно по меньшей мере 1000 мг в литре и наиболее предпочтительно по меньшей мере 2000 мг в литре.
Согласно предпочтительному варианту осуществления настоящего изобретения непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза представляет собой аналог лизина. Непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза предпочтительно представляет собой амфотерную аминокислоту. Непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза предпочтительно представляет собой α-аминокислоту. Согласно предпочтительному варианту осуществления между аминогруппой и карбоксигруппой α-аминокислоты находятся по меньшей мере пять атомов углерода и более предпочтительно точно пять атомов углерода. По меньшей мере один непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза предпочтительно выбирают из группы, в которую входят 6-аминогексановая кислота, 4-аминометилбензойная кислота, транс-4-аминометилциклогексилкарбоновая кислота и их смеси. Эти вещества оказались предпочтительно приемлемыми для получения кровоостанавливающего нетканого материала или получения волокон для кровоостанавливающего нетканого материала. Одновременно эти вещества являются приемлемыми для пациентов в медицинском отношении и, следовательно, являются приемлемыми для применения в материалах медицинского назначения.
По настоящему изобретению может быть предусмотрено также, что количество непротеиногенного низкомолекулярного водорастворимого ингибитора фибринолиза выбирают так, что он в области поверхности биоразлагаемого нетканого материала оказывает буферирующее действие, стабилизирующее значение pH, причем ингибитор предпочтительно поддерживает значение pH в интервале от 6 до 8.
Буферирующее действие за счет ингибитора фибринолиза является особенно предпочтительным, так как при этом не требуется вносить в биоразлагаемый нетканый материал дополнительное вещество в качестве буферного вещества.
Доля ингибитора фибринолиза предпочтительно находится в интервале от 0,1 до 20% масс., более предпочтительно в интервале от 0,5 до 15% масс. и наиболее предпочтительно в интервале от 1 до 10% масс. в расчете на массу нетканого материала. При этих значениях доли ингибитора фибринолиза как фибринолиз ингибируется в достаточной степени, так и значение pH удерживается в области, предпочтительной для остановки кровотечения.
Согласно предпочтительному варианту осуществления волокна биоразлагаемого нетканого материала содержат (i) полимер для индуцирования первичного гемостаза, (ii) непротеиногенный низкомолекулярный водорастворимый активатор вторичного гемостаза и/или (iii) непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза. При этом предпочтительно (i) полимер для индуцирования первичного гемостаза, (ii) непротеиногенный низкомолекулярный водорастворимый активатор вторичного гемостаза и/или (iii) непротеиногенный низкомолекулярный водорастворимый ингибитор фибринолиза гомогенно распределяют в волокнах нетканого материала.
Более предпочтительно можно производить волокна, уже содержащие активатор вторичного гемостаза и ингибитор фибринолиза. Благодаря этому сокращаются расходы при формировании нетканого материала и получают просто устроенный однородный кровоостанавливающий нетканый материал.
Кроме того, может быть предусмотрено, что кровоостанавливающий нетканый материал содержит по меньшей мере одно противоинфекционное активное вещество.
Это по меньшей мере одно противоинфекционное активное вещество предпочтительно представляет собой по меньшей мере один антибиотик.
Волокна биоразлагаемого нетканого материала предпочтительно содержат по меньшей мере одно противоинфекционное активное вещество. При этом по меньшей мере одно противоинфекционное активное вещество может находиться также на поверхности нетканого материала.
По меньшей мере одно противоинфекционное активное вещество предпочтительно является водорастворимым. По меньшей мере одно противоинфекционное активное вещество предпочтительно является водорастворимым, если растворимость по меньшей мере одного противоинфекционного активного вещества в воде при температуре 25°C составляет предпочтительно по меньшей мере 100 мг в литре, более предпочтительно по меньшей мере 500 мг в литре, еще более предпочтительно по меньшей мере 1000 мг в литре и наиболее предпочтительно по меньшей мере 2000 мг в литре.
По меньшей мере одно противоинфекционное активное вещество предпочтительно содержится в нетканом материале в фармацевтически эффективном количестве.
Особенное преимущество состоит в том, что по меньшей мере одно противоинфекционное активное вещество внедряют в нетканый материал при получении биоразлагаемого нетканого материала. Например, с этой целью по меньшей мере одно противоинфекционное активное вещество может быть введено в волокнистый материал для получения биоразлагаемого нетканого материала. Такие нетканые материалы в дальнейшем дополнительно противодействуют воспалениям и инфекциям у пациента.
По настоящему изобретению может быть предусмотрено также, что биоразлагаемый нетканый материал содержит малорастворимое в воде буферное вещество. Это буферное вещество может, например, содержаться в волокнах нетканого материала, в которых при необходимости может быть гомогенно распределено.
Буферное вещество предпочтительно является малорастворимым, если растворимость буферного вещества в воде при температуре 25°C составляет меньше 10 г и более предпочтительно меньше 5 г. Растворимость буферного вещества в воде при температуре 25°C находится предпочтительно в интервале от 1 мг/л до 1 г/л и более предпочтительно в интервале от 5 до 500 мг/л.
Согласно предпочтительному варианту осуществления буферное вещество выбирают из группы, в которую входят карбонат кальция, карбонат магния, основной карбонат магния и их смеси.
Дополнительное буферное вещество помогает при установке приемлемого для остановки кровотечения значения pH в крови пациентов в среде, непосредственно окружающей введенный в рану биоразлагаемый нетканый материал.
В другом варианте осуществления настоящего изобретения может быть предусмотрено, что биоразлагаемый нетканый материал содержит индикатор pH. При этом предпочтительно волокна нетканого материала могут содержать индикатор pH.
Точка перехода этого индикатора pH предпочтительно находится в области значений pH, меньших 7,4. Индикатор pH предпочтительно представляет собой бромкрезоловый пурпурный или бромтимоловый синий.
Посредством индикатора pH можно визуально контролировать ситуацию в области раны или необходимость осуществления других терапевтических мероприятий для обеспечения быстрой остановки кровотечения.
Соответственно более предпочтительному варианту осуществления настоящего изобретения средний размер ячеек, образуемых волокнами сухого нетканого материала, составляет по меньшей мере 50 мкм. Средний размер ячеек, образуемых волокнами сухого нетканого материала, находится предпочтительно в интервале от 50 до 500 мкм и более предпочтительно в интервале от 100 до 200 мкм.
Благодаря размеру ячеек соответственно указанным интервалам облегчается врастание фибробластов. Это способствует более быстрому заживлению ран при использовании биоразлагаемого нетканого материала по настоящему изобретению.
По настоящему изобретению может быть предусмотрено также, что средний диаметр волокон биоразлагаемого нетканого материала находится в интервале от 0,5 до 500 мкм, предпочтительно в интервале от 2 до 300 мкм и более предпочтительно в интервале от 5 до 200 мкм.
Эти значения диаметра волокон являются достаточными, чтобы предотвращать разрыв отдельных волокон и образовывать достаточную поверхность биоразлагаемого нетканого материала для того, чтобы отдавать активные вещества в достаточной концентрации.
Биоразлагаемый нетканый материал по настоящему изобретению может быть использован, например, в качестве кровоостанавливающего средства для местного применения.
Настоящее изобретение частично основано на том неожиданном факте, что благодаря комбинации активатора вторичного гемостаза с ингибитором фибринолиза в качестве водорастворимых ингредиентов биоразлагаемого нетканого материала удается улучшить кровоостанавливающее действие.
Как уже было указано, в человеческом организме в качестве антагонистов к вторичному гемостазу содержится протеаза плазмина, которая расщепляет фибриновые сетки на фрагменты малого размера.
Процесс фибринолиза противодействует вторичному гемостазу. Образование плазмина индуцируется активаторами плазминогена.
Плазмин может ингибироваться аминокислотными аналогами L-лизина (K. Aktories, U. Förstermann, W. Forth; Allgemeine und spezielle Pharmakologie und Toxikologie; Elsevier, Urban&Fischer Verlag, 9. Auflage, 2006; 547). Среди них известны, в частности, α-аминокислоты, в которых между аминогруппой и карбоксигруппой должно находиться пять атомов углерода. Имеющиеся в продаже кровоостанавливающие препараты, содержащие антифибринолитическое вещество апротинин, имеют существенные недостатки. Бычий апротинин может вызывать анафилактические реакции [R.N. Kaddoum, E.J. Chidiac, M.M. Zestos, S.D. Rajan, A. Baraka; An anaphylactic reaction after primary exposure to an aprotinin test dose in a child with a severe milk allergy; J. Cardiothorac. Vasc. Anesth.; 2007; 21; 243-244]. От 0,9 до 2,6% от числа пациентов, которых лечили бычьим апротинином, при повторном применении показали реакции повышенной чувствительности [W. Dietrich, A. Ebell, R. Busley, A. Boulesteix; Aprotinin and anaphylaxis: analysis of 12403 exposures to aprotinin in cardiac surgery; Ann. Thorac. Surg.; 2007; 84; 1144-1150].
В рамках настоящего изобретения неожиданно было найдено, что ингибиторы фибринолиза, такие как, например, аналоги лизина, могут быть использованы в качестве водорастворимых (и, следовательно, растворимых в крови) ингредиентов кровоостанавливающих нетканых материалов для улучшения кровоостанавливающего действия нетканых материалов.
Кроме того, настоящее изобретение частично основано на том неожиданном эффекте, что аналоги лизина в качестве низкомолекулярных ингибиторов фибринолиза при внедрении в соответствующем количестве в нетканый материал поддерживают значения pH поверхности и среды, непосредственно окружающей нетканый материал, в области значений pH, являющихся физиологически приемлемыми и приблизительно нейтральными.
На предшествующем уровне техники отсутствует кровоостанавливающий материал для местного применения в форме губок, тканей или нетканых материалов, который наряду с индуцированием первичного и вторичного гемостаза одновременно ингибирует фибринолиз образовавшейся фибриновой сетки.
По настоящему изобретению разработан биоразлагаемый нетканый материал, который активирует как первичный, так и вторичный гемостаз и в случае которого образовавшаяся фибриновая сетка дополнительно стабилизируется благодаря ингибированию фибринолиза.
На предшествующем уровне техники также отсутствует кровоостанавливающий материал для местного применения, который в среде, непосредственно окружающей кровоостанавливающий материал, за счет буферной добавки целенаправленно устанавливает значение pH в нейтральной области и, таким образом, благодаря этому мероприятию также стимулирует остановку кровотечения.
Значение pH раневого экссудата влияет на процесс заживления раны. Для оптимального заживления раны предпочтительным является нейтральное значение pH (J. Dissemond; Die Bedeutung des pH-Wertes für die Wundheilung; HARTMANN wundForum 1/2006; 15-19). В связи с этим установка значения pH в требуемой области по настоящему изобретению предпочтительна также при применении нетканых материалов по настоящему изобретению. С этой целью на нетканый материал наносят растворимое буферное вещество. Особенное преимущество и особое комбинационное действие достигается тогда, когда в качестве буферного вещества выступает собственно сам применяемый низкомолекулярный ингибитор фибринолиза. С этой целью на поверхность нетканого материала необходимо наносить только достаточное количество ингибитора, так чтобы он оказывал буферирующее действие, стабилизирующее значение pH, непосредственно в области поверхности нетканого материала.
Биоразлагаемый нетканый материал по настоящему изобретению предпочтительно может быть получен описанным в данном тексте способом получения биоразлагаемого нетканого материала.
При таком способе (i) флюидизированный исходный материал для волокон при необходимости вместе с добавками подают в сосуд, (ii) сосуд приводят во вращение, (iii) флюидизированный исходный материал для волокон центробежными силами выдавливается из сосуда, вследствие чего образуются волокна (1) или элементарные нити (1), и (iv) из волокон (1) или элементарных нитей (1) формируют биоразлагаемый нетканый материал. Сосуд, в который подают флюидизированный исходный материал для волокон при необходимости вместе с добавками, предпочтительно представляет собой прядильную турбинку.
Этот способ получения может быть реализован особенно просто и с низкими затратами.
При этом может быть предусмотрено, что получаемые волокна или элементарные нити из вращающегося сосуда улавливают в виде материала плоской формы благодаря тому, что во множестве областей материала плоской формы образуются места соединений между двумя или несколькими волокнами.
Это мероприятие служит также для того, чтобы реализовывать способ получения просто и с низкими затратами.
Кроме того, может быть предусмотрено, что нетканый материал, предпочтительно материал плоской формы, по меньшей мере на одной стадии восстановительной терапии пропитывают и/или покрывают по меньшей мере одной жидкой средой, причем в качестве жидкой среды предпочтительно применяют биологически разлагаемые полимерные материалы и/или воскоподобные материалы.
Биоразлагаемые нетканые материалы по настоящему изобретению могут быть получены способом центробежного формования, например, соответственно DE 10 2007 011 606 A1, WO 2011/116848 и DE 10 2007 044 648 A1, просто и с низкими затратами.
Получаемые в прядильной турбинке волокна или элементарные нити можно просто улавливать в некотором состоянии благодаря тому‚ что во множестве областей материала плоской формы образуются места соединений между двумя или несколькими волокнами.
На возможной стадии восстановительной терапии материал плоской формы по настоящему изобретению по многим свойствам может быть адаптирован к специфическим вариантам применения.
Посредством сшивания материала можно изменять механические и, в частности, химические свойства биоразлагаемого нетканого материала. Например, в зависимости от степени сшивания материала можно задавать резорбтивные свойства для применения в медицинских целях.
Материалы плоской формы по настоящему изобретению на стадии восстановительной терапии можно пропитывать и/или покрывать жидкими средами. Для этого могут быть выбраны предпочтительно, но не исключительно, другие биологически разлагаемые полимерные материалы или также воскоподобные материалы.
Описанным ранее способом по настоящему изобретению можно простым образом получать волокнистые материалы плоской формы для биоразлагаемых нетканых материалов по настоящему изобретению, в которых средняя толщина волокон составляет от 0,5 до 500 мкм.
Для получения частично сшитого материала в волокнах сшивающий агент предпочтительно прибавляют уже к прядильному раствору. Однако сшивание может быть осуществлено также и дополнительно в случае уже сформованных волокон путем приведения в контакт со сшивающим агентом, представляющим собой газ или раствор.
В отношении уже готового материала из нерегулярно ориентированных волокон по настоящему изобретению может быть осуществлено другое сшивание, которое определяет конечную степень сшивания волокон в материале плоской формы и, следовательно, скорость его биологического разложения.
Для сшивания имеются различные способы, причем способ ферментативного сшивания, применение комплексообразователей или химические способы являются предпочтительными.
В случае химического сшивания сшивание осуществляют посредством одного или нескольких реагентов, предпочтительно альдегидами, выбранными из формальдегида и диальдегидов, изоцианатами, диизоцианатами, карбодиимидами, алкилдигалогенидами. Кроме того, могут быть использованы гидрофильные ди- и триоксираны, такие как, например, 1,4-бутандиолдиглицидиловый эфир, глицеринтриглицидиловый эфир и производные полиэтиленгликоля. При этом более предпочтительно применяют полиэтиленгликольдиглицидиловый эфир. Наряду со сшиванием производные полиэтиленгликоля показали положительное свойство в отношении избегания нежелательной адгезии, например адгезивных перикардитов в случае операций на сердце [W.F. Konertz, M. Kostelka, F.W. Mohr et al.; Reducing the incidence and severity of pericardial adhesions with a sprayable polymeric matrix; Ann. Thorac. Surg.; 2003; 76; 1270-1274].
В частности, в случае медицинского применения рекомендуется после сшивания удалять избыточный сшивающий агент из материала плоской формы или материала из нерегулярно ориентированных волокон.
Как было описано ранее, сшивающий агент предпочтительно прибавляют уже к прядильному раствору и затем с готовым материалом плоской формы, так сказать на второй стадии, осуществляют другое сшивание до требуемой степени сшивания.
По настоящему изобретению может быть предусмотрено, что пористость ε биоразлагаемого нетканого материала задают или рассчитывают по следующей формуле:
,
где ρVlies означает плотность неуплотненного биоразлагаемого нетканого материала, ρBulk означает плотность волокон биоразлагаемого нетканого материала, mVlies означает массу биоразлагаемого нетканого материала, VVlies означает объем биоразлагаемого нетканого материала, ρa означает плотность волокнообразующего полимера, ρb означает плотность активатора вторичного гемостаза, ρc означает плотность ингибитора фибринолиза, ma означает массу волокнообразующего полимера в нетканом материале, mb означает массу активатора вторичного гемостаза в нетканом материале, а mc означает массу ингибитора фибринолиза в нетканом материале.
Если биоразлагаемый нетканый материал содержит также другие компоненты, такие как, например, дополнительное буферное вещество или антибиотики, а пористость биоразлагаемого нетканого материала должна иметь определенное значение, то необходимо принимать во внимание также другие параметры по указанному ранее образцу, то есть массы (md, me, …) и плотности (ρd, ρe, …) дополнительных компонентов.
По настоящему изобретению площадь поверхности волокон OFaser предпочтительно рассчитывают или задают по следующей формуле:
где ⌀Faser означает средний диаметр волокон.
В дальнейшем тексте примеры осуществления настоящего изобретения пояснены четырьмя схематичными фигурами, при этом без ограничения настоящего изобретения. В примерах осуществления выражения "нетканый материал" и "нетканый холст" используются синонимично. При этом показано:
на фиг. 1: нетканый материал по настоящему изобретению из желатина с сухим противомикробным веществом;
на фиг. 2: нетканый материал по настоящему изобретению из желатина с влажным противомикробным веществом в воде;
на фиг. 3: нетканый материал по настоящему изобретению из желатина с противомикробным покрытием;
на фиг. 4: нетканый материал по настоящему изобретению из желатина с противомикробным веществом и с противомикробным покрытием.
ПРИМЕР ОСУЩЕСТВЛЕНИЯ 1
На фиг. 1 и 2 показан в качестве первого примера осуществления нетканый материал по настоящему изобретению из желатина с сухим противомикробным веществом (см. фиг. 1) и нетканый материал по настоящему изобретению из желатина с влажным противомикробным веществом (см. фиг. 2). Нетканый холст содержит волокна 1 или элементарные нити 1, которые в виде материала из нерегулярно ориентированных волокон лежат друг над другом и друг с другом сшиты. Согласно фиг. 2, относящейся к влажному состоянию, можно видеть, что влажные волокна 1 вследствие действия жидкости искривлены сильнее, чем в сухом состоянии.
Нетканый материал из желатина с противомикробным веществом, показанный на фиг. 1 (сухой) и на фиг. 2 (влажный; через шесть часов в дистиллированной воде), получают способом центробежного формования описанным далее образом.
Сначала получают 24%-ный раствор желатина. Для применения может быть выбран, например, желатин типа A PIGSKIN производства компании GELITA AG, использованный в данном примере осуществления. Желатин перемешивают в воде. Значение pH устанавливают посредством NaOH (номер продукта: 3306576, Sigma-Aldrich, Германия) равным 7,4. К раствору желатина прибавляют 1% масс. хлорида кальция (номер продукта: 102382, Merck, Германия), 1% масс. карбоната кальция (номер продукта: C4830, Sigma-Aldrich, Германия), 1% масс. глицерина (номер продукта: 01873, Sigma-Aldrich, Германия) и 0,5% масс. 6-аминогексановой кислоты (номер продукта: 800145, Merck, Германия).
Затем раствору желатина дают стоять приблизительно в течение часа для набухания. Далее раствор желатина обрабатывают при 60°C в ванне с ультразвуковым полем и затем выдерживают в течение около 1 часа при температуре от 80 до 85°C. В полученном таким образом горячем растворе желатина при перемешивании растворяют 6% масс. сульфата гентамицина (номер продукта: 345814, Merck, Германия).
Выдержанный при температуре от 80 до 85°C раствор желатина посредством впрыскивающего насоса подают в качестве исходного материала для волокон в сосуд устройства для центробежного формования соответственно DE 102005048939 A1. Вторым впрыскивающим насосом в сосуд одновременно подают полиэтиленгликольдиглицидиловый эфир (номер продукта: 475696, Sigma-Aldrich, Германия).
Сосуд имеет температуру около 120°C и вращается с частотой 4500 об/мин. В сосуде имеются выемки, выполненные в виде отверстий диаметром 0,3 мм. Под действием центробежной силы исходный материал для волокон выдавливается через выемки и преобразуется в волокна 1, которые протягиваются вытяжным устройством. Вытяжное устройство находится ниже сосуда.
Диаметр волокон определяли посредством микроскопа Zeiss Stemi 2000-C. Для этого определяли среднее значение из 10 отдельных измерений.
Для определения поверхностной плотности использовали образцы нетканого материала размером 10×10 см2. Массу определяли на микроана