Способ получения антиген-специфических цитотоксических клеток, обладающих активностью против клеток рака молочной железы
Иллюстрации
Показать всеИзобретение относится к биотехнологии, белковой инженерии и медицине. Описан способ получения антиген-специфических цитотоксических клеток, обладающих противоопухолевой активностью против клеток рака молочной железы. Настоящее изобретение обеспечивает генерацию in vitro антиген-специфических клонов T-клеток с активностью CD8+ T-клеток и T-хелперов 1 типа, необходимую для формирования эффективного противоопухолевого ответа против клеток рака молочной железы. Изобретение может быть использовано в медицине. 1 з.п. ф-лы, 2 ил., 4 табл.
Реферат
Изобретение относится к биотехнологии, белковой инженерии и медицине, конкретно к способу стимуляции антиген-специфических клеток с цитотоксической активностью против аутологичных клеток рака молочной железы.
Злокачественные опухоли молочной железы (20,1%) являются ведущей онкологической патологией у женского населения России по данным на 2009 год [29]. При сравнении данного показателя с 1999 годом к 2009 наблюдался рост заболеваемости раком молочной железы (РМЖ) на 15,9%. В возрастной группе от 30 до 59 лет злокачественные новообразования молочной железы имеют наибольший удельный вес (15,2%) при сравнении с лицами пожилого возраста, где РМЖ составляет 8,5% в структуре онкологической заболеваемости. Эти данные указывают на важнейшее социальное значение данной патологии у женщин репродуктивного возраста и раннего постменопаузального возраста. В структуре смертности женщин также наибольший удельный вес имеют злокачественные новообразования молочной железы (17,4%). В возрастной группе 30-39 лет смертность от РМЖ занимает 2 место (17,2%), уступая только смертности от рака шейки матки (23,2%). В возрастной группе 40-49 лет РМЖ выходит на первое место у женщин в структуре смертности от онкологических заболеваний (26,3%). В старших возрастных группах сохраняется ведущее место РМЖ как причины смерти: в возрасте 50-59 лет - 24,8%, в возрасте 60-69 лет - 18,7% [29]. Перечисленные данные указывают на несостоятельность современных методов диагностики, лечения и профилактики рака молочной железы. Все это делает актуальным поиск новых способов лечения, которые будут направлены как на первичный очаг онкологического процесса, так и на циркулирующие и диссеминированные опухолевые клетки, которые являются основной причиной развития метастазов и рецидивов заболевания.
Клетки, связанные с врожденным и приобретенным иммунитетом, играют ведущую роль в регуляции опухолевого роста [11]. На сегодняшний день, раковый процесс связывают с хроническим воспалением из-за присутствия в микроокружении опухоли клеток врожденного иммунного ответа, которые секретируют вещества, стимулирующие ангиогенез и пролиферацию раковых клеток [5, 20]. Однако растет число фактов, указывающих на то, что у некоторых пациентов с онкопроцессом возрастает усиливается (приобретенный) иммунный ответ, специфически направленный против антигенных белков, экспрессирующихся в различных опухолях. T-клетки, которые секретируют цитокины, такие как интерферон-γ (ИФНγ), вызывают острое воспаление, которое приводит к увеличению цитотоксических T-клеток (ЦТЛ), разрушению опухолевой ткани и возможно ограничению развития или даже элиминации раковой опухоли [12]. Адаптивный T-клеточный ответ, который необходим для узнавания антигена, осуществляется как цитотоксическими CD8+ T-клетками, так и CD4+ T-клетками. CD4+ T-клетки-хелперы (Th) могут секретировать различные цитокины, участвующие в регуляции и распространении острого воспалительного ответа. В организме человека выделяют несколько фенотипов T-клеток-хелперов, отличающихся по выполняемой ими функции и секреции цитокинов: Th1 клетки секретируют цитокины, такие как ИФНγ, ФНОα и ИЛ-2, и поддерживают функционирование ЦТЛ и разрушение опухоли; Th2 клетки секретируют цитокины, такие как ИЛ-10, ИЛ-4 и ИЛ-5, и ограничивают пролиферацию ЦТЛ; Th17 клетки секретируют ИЛ-17 и действуют при аутоиммунных заболеваниях; и Трег клетки секретируют ИЛ-10 и TGF-β, которые подавляют иммунный ответ [23].
Рядом авторов было показано, что в лимфатических узлах при онкопатологии, в том числе и при раке молочной железы, присутствуют инфильтрирующие T-лимфоциты и дендритные клетки (ДК), причем уменьшение количества ДК непосредственно коррелирует с увеличенным количеством метастазов в лимфатические узлы и плохим прогнозом выживания [16, 15]. Уменьшение циркулирующих T-клеток также коррелирует с плохим прогнозом выживания [4]. Все существующие доказательства показывают развитие недостаточности местного и системного иммунного ответа при прогрессировании роста опухоли молочной железы [4, 16]. Kohrt H.E. с соавторами исследовали клеточный состав дренирующих лимфатических узлов при раке молочной железы. [16]. Ими показано, что в лимфатических узлах больных РМЖ снижено содержание как CD4+, так и CD8+ T-клеток при сравнении со здоровой группой, при повышенном содержании в подмышечном лимфатическом узле (ЛУ) CD1a ДК. Содержание CD1a ДК резко снижается (больше, чем в 4 раза) при наличии метастазов в ЛУ. Снижение количества популяции CD4+ T-клеток было в 10 раз выше, чем CD8+ T-клеток в сторожевых ЛУ. Причем это снижение популяции CD4+ клеток наблюдалось не зависимо от вовлечения ЛУ в онкологический процесс. Авторами было высказано предположение, что эти изменения не являются отражением опухолевой инвазии. Таким образом, активация антиген-презентирующих клеток (а именно дендритных клеток) и дифференцировки и пролиферации T-клеток - включая ЦТЛ и Th1 клетки, стимулирующих иммунный процесс, который способствует развитию опухоли, в сторону активного (острого), способствующего разрушению опухоли, на сегодняшний день рассматривается одним из перспективных методов борьбы с опухолевой прогрессией.
Среди антиген-презентирующих клеток, именно дендритные рассматриваются как наиболее мощные клетки для захвата и презентации различных видов антигенов [2]. ДК характеризуются способностью захватывать АГ, экспрессией молекул ГКНС I и II класса и молекул-костимуляторов, таких как В7-1 (CD80), В7-2 (CD86), CD40, адгезивными молекулами CD11b, CD11c и внутриклеточными адгезивными молекулами (ICAMs)-ICAM-1 (CD54), и их жизненно важной ролью в запуске иммунного ответа [27]. В последнее десятилетие интенсивно изучаются их функции и иммунотерапевтический потенциал. В зависимости от происхождения АГ (внутриклеточный или внеклеточный), его презентация может происходить в комплексе с ГКНС I или II соответственно. Однако возможен механизм кросс-презентации, когда внеклеточный АГ презентируется в комплексе с ГКНС I класса. При взаимодействии с T-клеточным рецептором, в зависимости от экспрессии I или II класса молекул ГКНС будут активироваться CD8+ или CD4+ T-клетки соответственно [1]. Взаимодействие между ДК и наивными T-клетками обеспечивается 2 основными сигналами. Первый сигнал - это уже упоминавшееся взаимодействие комплекса ГКГС-пептид с T-клеточным рецептором. Вторым сигналом является взаимодействие костимуляторных молекул, экспрессирующих на поверхности АПК, таких как В7-1 (CD80), В7-2 (CD86) и др., с костимуляторными молекулами на поверхности T-клеток, например CD28 для упоминавшихся рецепторов В7-1 и В7-2. В отсутствие костимуляторного сигнала не происходит активации T-клеток, и они становятся толерогенными или входят в состоянии анергии. Кроме того, активация T-хелперов является ключевым моментом для запуска иммунного ответа активированными АГ-специфическими эффекторными клетками и для вовлечения клеток во врожденный иммунный ответ [14].
При взаимодействии ДК-T-клетки третьим сигналом, который определяет путь дифференцировки T-клеток, являются цитокины, которые содержатся в микроокружении взаимодействующих клеток. На сегодняшний день известно, что семейство интерферонов (ИФН) играет важную роль в регуляции и связывании клеток врожденного и приобретенного иммунитета и, как было недавно показано, играет облигатную (необходимую) роль в удалении опухоли [12]. Источником эндогенного ИФНγ в организме являются активированные НК, НКТ и T-клетки. Такие цитокины, как ИЛ-12 и ИЛ-18, регулируют продукцию ИФНγ как во врожденном, так и в приобретенном иммунных ответах и формируют цитотоксический тип иммунного ответа [10]. При этом ИЛ-18 сильнее, чем ИЛ-12, усиливает продукцию IFNγ T-клетками и цитотоксическими НК-клетками, а также их пролиферацию [3]. Помимо влияния на продукцию цитокина, ИЛ-12 оказывается влияние на активацию, дифференцировку и выживаемость ЦТЛ in vivo, в его присутствии значительно возрастает литическая способность CD8+ T-клеток [26]. ИЛ-12 также оказывает влияние на мобилизацию внутриклеточного кальция и дегрануляцию ЦТЛ при контакте со специфическими таргетными клетками. На мышиных моделях было показано, что продукция перфорина, порообразующего белка, не зависела от присутствия или отсутствия ИЛ-12, однако продукция гранзима В - грануло-ассоциированной сериновой протеазы, активирующая каскад каспаз внутри клетки-мишени, являющаяся инициатором апоптоза клеток - сильно зависела от добавления ИЛ-12. При этом уровень продукции гранзима В коррелировал с уровнем цитотоксического потенциала клеток [8]. Основываясь на перечисленных данных, использование таких цитокинов, как ИЛ-12 и ИЛ-18, является перспективным для культивирования клеток и стимуляции эндогенной продукции данных цитокинов с целью модуляции иммунного ответа.
Если роль ГКНС I-связанных CD8+ лимфоцитов в уничтожении опухолевого процесса давно известна, то только в последние годы наблюдается более глубокое понимание роли ГКНС II-связанных CD4+ T-клеток в противоопухолевом иммунитете. Можно выделить несколько причин для этого. Во-первых, концептуально более просто представить ЦТЛ, хорошо известные для запуска прямого киллинга клеток, пораженных вирусом, поражающим и запускающим киллинг опухолевых клеток. Во вторых, солидные опухоли редко экспрессируют молекулы HLA II класса, в отличие от молекул HLA I класса, которые делают опухолевые клетки видимыми для прямого поражения CD8+ T-клетками. И последнее, в ранних исследованиях на мышах показана более выраженная зависимость резекции опухоли от ЦТЛ, и относительная легкость получения CD8+ T-клеток из опухоли укрепила репутацию ЦТЛ как первичных эффекторов противоопухолевого иммунитета [17]. Однако постепенно накопленные знания указывают, что Th-клетки не только важны для противоопухолевой активности, но также иногда способны опосредовать резекцию опухоли без видимого участия CD8+ ЦТЛ [14, 9]. Также было показано, что Th сами непосредственно могут запускать апоптоз опухолевых клеток через Fas/FasL или TRAIL-опосредованный механизм апоптоза [25, 28]. Также Th-клетки способствуют активации ЦТЛ посредством 3 основных механизмов: во-первых, классический механизм, Th-клетки участвуют в аутокринной/паракринной секреции T-клеточного ростового фактора ИЛ-2, который в большинстве случаев требуется ЦТЛ, но который они сами не секретирую; во-вторых, это одновременный контакт 3 клеток - АПК (ДК), ЦТЛ и Th-клетки, который обеспечивает специфическую активацию Th, и они уже стимулируют повышающую регуляцию CD40L, вызывая дальнейшую активацию ДК, и уже только потом активируют ЦТЛ; и в-третьих, был определен растворимый фактор семейства ФНО, который называется TRANCE (ФНО-связанный стимулирующий активацию цитокин), который оказывается важным для CD40-независимого механизма помощи T-клеткам [17].
Уникальная иммуномодулирующая активность ДК сделала их привлекательной моделью для иммунотерапевтической модуляции иммунного ответа как in vitro, так и с последующим возможным использованием in vivo [17]. ДК способны доставлять опухолевые АГ, полученные из различных источников, что позволяет эффективно привлекать клетки приобретенного иммунного ответа для запуска элиминации опухоли. Однако в начальных исследованиях были получены данные, указывающие на функциональную несостоятельность ДК, полученных от пациентов с онкологической патологией [22, 18]. Поэтому использование наивной популяции для модуляции противоопухолевого иммунного ответа вызывает ряд сомнений. Лучшим выходом считается получение функционально компетентных ДК из клеток-предшественников ex vivo с последующей нагрузкой их опухолевыми антигенами. В различных моделях in vitro ДК получают из прилипающей фракции мононуклеарных клеток, выделенных из цельной периферической крови. Для получения незрелых ДК, способных к захвату и презентации антигена, в среду добавляют различные цитокины, например рчГМ-КСФ и рчИЛ-4. Для созревания ДК применяют либо определенный набор цитокинов, таких как TNFα, IFNα, IL-15, IFNγ, PGE2 и т.д., либо отдельное использование какого-либо цитокина с митогенными стимулами (ЛПС, ФГА и т.д.) [2].
Опухолевые клетки экспрессируют на своей поверхности антигены, которые могут быть потенциальной мишенью для запуска цитотоксического ответа. ДК способны доставлять опухолевые АГ, полученные из различных источников, что позволяет эффективно привлекать клетки приобретенного иммунного ответа для запуска элиминации опухоли. Для активации ДК могут использоваться источники опухолевых антигенов: РНК, ДНК, рекомбинантные белки, лизаты опухолевых клеток и т.д. [21]. Для рационального выбора источника опухолевого антигена для ДК необходимо учитывать ряд факторов, а именно:
1) определенные пептидные/ДНК/РНК молекулы несут эпитопы, специфичные к определенному HLA типу, и соответственно, их применение приводит к ограничению развития эффективного иммунного ответа в зависимости от HLA типа человека;
2) наличие ограниченного набора хорошо охарактеризованных опухоль-ассоциированных антигенов;
3) при использовании определенных пептидных/ДНК/РНК молекул происходит ограничение репертуара T-клеточных клонов и, соответственно, ограничение возможности иммунной системе развивать сильный поликлональный противоопухолевый ответ.
Однако, несмотря на эти ограничения, ведутся активные исследования активации ДК с использованием плазмидных векторов, несущих ДНК/РНК опухолевого антигена или его отдельных эпитопов. Использование ДНК-конструкций позволяет прицельно модулировать иммунный ответ против опухолевых клеток, экпрессирующих определенные антигены, при этом в одну плазмиду возможно включение эпитопов из нескольких генов (в том числе отличающихся по специфичности к гаплотипу HLA), кодирующих различные антигены. После обработки в клетке осуществляется экспрессия антигенов в их нативной форме, что облегчает процессинг и презентацию их иммунной системе. Использование моноэпитопных ДНК-конструкций является наиболее специфичным методом нацеливания T-клеток против раковых клеток. Использование полиэпитопных конструкций позволяет запускать поликлональную реакцию T-клеток, обеспечивающих запуск более мощного иммунного ответа против различных раковых клеток, составляющих опухоль, а кроме того, позволяет преодолевать возможную потерю экспрессии данного эпитопа в опухолевых клетках. Дополнительное проведение HLA-типирования позволяет выбирать только те эпитопы, которые увеличивают шанс развития специфического CD8+ или CD4+ T-клеточного ответа, или обоих одновременно. Также данный способ уменьшает риск возникновения аутоиммунных реакций, т.к. используются только эпитопы опухолевого белка, исключая возможность развития перекрестной реакции на собственные ткани.
Известен способ, включающий получение ДК и нагрузку их полиэпитопной pVax1/pet-neu конструкцией, несущей HLA-A*0201-специфичные эпитопы белка Her2 [24]. В работе использовались мононуклеарные клетки периферической крови условно здоровых доноров. Дендритные клетки получали из прилипающей фракции МНК при добавлении в культуру 50 нг/мл гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) и 0,5 нг/мл интерлейкина (ИЛ)-4. Через 7 дней 100 тыс. ДК трансфецировались 1 мкг pVax1/pet-neu с использованием трансфецирующего реагента «Effecten» (Qiagen). Трансфецированные ДК облучали и добавляли в культуру лимфоцитов (неприлипшая фракция МНК) в соотношении ДК/МНК=1:5. Далее, совместную культуру инкубировали в течение 5 дней. Далее, в течение 10 дней продолжали культивирование в присутствии ИЛ-2 (20 МЕ/мл) с заменой среды и цитокина каждые 3 дня. Для постановки цитотоксического теста клетки-мишени C1R-A2 (клеточная линия, стабильно трансфецированная геном HLA-A*0201 и неэкспрессирующая другие типы молекул HLA) метились 150 мк Ci51Cr, помещались в 96-луночные круглодонные планшеты и потом, когда необходимо, нагружались пептидом (1 мкмоль/л) в течение 90 минут. Эффекторы добавлялись к таргетным клеткам в различных соотношениях и инкубировались в течение 6 часов. После инкубации собирались супернатанты и измерялась радиоактивность на гамма счетчике. Процент специфического лизиса рассчитывался как (эксперимент спонтанный/максимум спонтанный 51Cr)×100. Исследователями было показано, что уровень ЦТЛ ответа варьировал в зависимости от донора, иммуногенности эпитопа опухоль - ассоциированного гена Her2, а также от соотношения таргетных и эффекторных клеток.
Описанный способ получения антиген-активированных дендритных клеток достаточно длителен (12 суток), требует использования большого количества рекомбинантных цитокинов (рчГМ-КСФ, рчИЛ-4 и рчИЛ-2), что ведет к значительному удорожанию технологии, так и обладает недостаточной цитотоксической активностью.
Новой задачей является создание эффективного и экономичного способа получения антигенспецифических цитотоксических лимфоцитов из мононуклеарных клеток периферической крови больных раком молочной железы, обладающих достаточной эффективностью для индукции цитотоксического ответа против аутологичных опухолевых клеток in vitro.
Сущность изобретения
Из прилипающей фракции мононуклеарных клеток периферической крови человека получают последовательно незрелые и зрелые ДК с использованием рчГМ-КСФ+рчИЛ-4 и рчФНОа соответственно. Антигенную активацию зрелых ДК проводят с помощью магнитной трансфекции, используя различные полиэпитопные конструкции ["Polyepitope constructs and methods for their preparation and use", Application No.: 61/311,981, дата подачи 09.03.2010, international publication number: WO 2011/110953 A2]. Далее, неприлипшую фракцию мононуклеарных клеток периферической крови культивируют с антиген-активированными ДК в соотношении 10:1. Для улучшения модуляции специфического противоопухолевого иммунного ответа в совместную культуру МНК и ДК добавляют рчИЛ-12 и рчИЛ-18, что позволяет повысить потенциал цитотоксической активности мононуклеарных антиген-специфических клеток, обуславливая цитотоксическую направленность T-клеток при их пролиферации и дифференцировки в эффекторные клетки.
Принципиальным отличием разработанного способа от прототипа является:
1. Использование рчФНОа для созревания культуры дендритных клеток, что позволяет сократить процесс созревания ДК до 4-5 суток.
2. Использование рчИЛ-12 и рчИЛ-18 при сокультивировании ДК и МНК, что повышает эффективность стимуляции и направленную дифференцировку наивных T-клеток в T-хелперы 1 типа,
3. Применение протоколов активации и созревания ДК, включающих использование полиэпитопных моно- или полииммунногенных конструкций, что активирует ДК против наиболее иммуногенных эпитопов основных опухоль-ассоциированных антигенов РМЖ, тем самым увеличивая специфический цитотоксический ответ, предупреждая возможное развитие цитотоксических процессов против собственных клеток организма, неэкспрессирующих данные АГ, а также сокращает стадию получения зрелых антиген-активированных ДК до 4-5 суток.
Соответственно, настоящее изобретение относится к способу получения антиген-специфических цитотоксических клеток, обладающих противоопухолевой активностью против клеток рака молочной железы, включающий следующие стадии:
а) выделение мононуклеарных клеток (МНК) из периферической крови пациента;
б) культивирование МНК с разделением клеток на прилипающую и неприлипающую фракции;
в) выращивание прилипающей фракции МНК в присутствии ростовых факторов с получением зрелых дендритных клеток (ДК);
г) трансфекция зрелых ДК экспрессионными плазмидами, содержащими ДНК-вакцинными конструкциями, кодирующими универсальные и HLA-A*0201-специфичные эпитопы основных опухоль-ассоциированных антигенов, узнаваемые цитотоксическими T-лимфоцитами (ЦТЛ) и T-клетками-хелперами (Th);
д) совместное культивирование зрелых ДК, полученных на стадии г), и неприлипающей фракции МНК в присутствии рекомбинантного человеческого интерлейкина-12 и рекомбинантного человеческого интерлейкина-18.
В предпочтительном варианте реализации в качестве ростовых факторов при выращивании прилипающей фракции МНК используют гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) человека и интерлейкин-4 (ИЛ-4) человека.
Предлагаемое изобретение повышает эффективность генерации цитотоксических клеток, а также позволяет сократить сроки сокультивирования ДК и МНК, что в итоге приводит к снижению стоимости способа.
Техническим результатом изобретения является генерация in vitro антиген-специфических клонов T-клеток с активностью CD8+ T-клеток и T-хелперов 1 типа, необходимых для формирования эффективного противоопухолевого ответа против клеток рака молочной железы.
Краткое описание графических материалов.
Фиг.1 - Экспрессия перфорина в совместной культуре МНК больных раком молочной железы и аутологичных трансфецированных ДК. Результаты представлены в виде среднего и ошибки среднего;
Фиг.2 - Продукция ИФН-гамма в совместной культуре МНК больных раком молочной железы и ДК, активированных лизатом аутологичных опухолевых клеток ДК
Примеры осуществления изобретения
Выделенная из периферической крови больных раком молочной железы прилипающая фракция мононуклеарных клеток культивируется в концентрации 1 млн/мл в полной среде, содержащей 10% эмбриональной телячьей сыворотки, 2 мМ L-глютамина, 10 мМ HEPES, 5×10-5 мМ 2-меркаптоэтанола, 80 мкг/мл гентамицина, 100 мкг/мл ампициллина в атмосфере 5% CO2 при 37°C с добавлением рчГМ-КСФ (50 нг/мл) и рчИЛ-4 (100 нг/мл). Через 96 часа культивирования для созревания незрелых дендритных клеток в культуру вносится рчФНО-α в дозе 25 нг/мл. Через 24 часа после добавления ФНО-α проводится магнитная трансфекция полученных зрелых ДК различными полиэпитопными конструкциями, универсальной или HLA-А*0201-специфичной ["Polyepitope constructs and methods for their preparation and use", Application No.: 61/311,981, дата подачи 09.03.2010, international publication number: WO 2011/110953 A2], с использованием реагентов коммерческого набора компании «Promokine» согласно инструкции производителя.
| Таблица 1 | |
| Краткое описание основных ДНК-конструкций, содержащих эпитопы опухоль-ассоциированных антигенов при раке молочной железы. | |
| Плазмида | Краткое описание |
| Плазмида U | Универсальная конструкция содержит набор эпитопов белка Her2/neu, узнаваемых ЦТЛ и Тх и специфичных широкому спектру наиболее распространенных гаплотипов человека. |
| Плазмида A | HLA-A*0201-специфическая конструкция содержит HLA-A*0201-специфичные эпитопы основных опухоль-ассоциированных антигенов для стимуляции высокоэффективных специфических ЦТЛ и Тх. |
| Плазмида p5 | Нативный вектор pDNAVACCultra 5 не содержит вставок иммуногенных пептидов. |
Использованные в экспериментах плазмиды имели следующие последовательности:
Плазмида U:
Плазмида A:
Полученные дендритные клетки культивируются с неприлипшей фракцией мононуклеарных клеток в соотношении 1:10 с добавлением рчИЛ-12 в дозе 10 нг/мл и рчИЛ-18 в дозе 100 нг/мл в течение 72 часов.
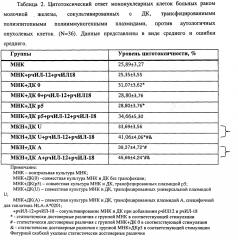
Способность полученных трансфецированных плазмидами ДК стимулировать прямую цитотоксическую активность против опухолевых клеток, как аутологичных, так и специфической линии, оценивалась по уровню высвобождения внутриклеточного фермента (лактатдегидрогеназы) с помощью коммерческого набора фирмы «Promega» согласно протоколу производителя. Если коротко, то для праймирования опухолевых антигенов полученные ДК, трансфецированные плазмидами, совместно культивировали с неприлипшей фракцией МНК в соотношении 1:10. Также оценивался цитотоксический ответ МНК в зависимости от добавления в культуру рчИЛ-18 и рчИЛ-12. Во все группы через 48 часов сокультивирования вносились аутологичные опухолевые клетки. Показано достоверное повышение значения цитотоксичности, что служит показателем активации противоопухолевых цитотоксических клеток, необходимых для уничтожения опухолевых клеток (табл.2, 3).
При сравнении способности ДК, трансфецированных различными вариантами плазмид (универсальной и HLA-A*0201-специфической), праймировать МНК и, соответственно, стимулировать цитотоксическую активность МНК, были получены результаты, показывающие эффективность применения данного протокола для получения функционально зрелых антиген-нагруженных ДК (табл.2). А именно: аллельспецифическая конструкция, содержащая HLA-A*0201-специфичные ЦТЛ и Тх пептидные эпитопы различных опухоль-ассоциированных антигенов рака молочной железы, достоверно выше стимулирует цитотоксическую активность прилипшей фракции МНК при сравнении с группами контроля (МНК и МНК+ДК0). Добавление рчИЛ-12 и рчИЛ-18 статистически достоверно увеличивает цитотоксический потенциал ДК, трансфецированных как универсальной плазмидой, так и аллель-специфической, по сравнению со всеми группами контроля (МНК+рчИЛ-12+рчИЛ18, МНК+ДК0+рчИЛ-12+рчИЛ18, МНК+ДКр5+рчИЛ-12+рчИЛ-18) и спонтанными группами антиген-активированных ДК.
На основании полученных результатов можно сделать вывод, подтверждающий эффективность применения данного протокола для получения зрелых дендритных клеток, способных стимулировать цитотоксический потенциал МНК против аутологичных опухолевых клеток. Добавление в совместную культуру МНК и антиген-активированных ДК рчИЛ-12 и рчИЛ-18 является эффективным способом усиления генерации специфических цитотоксических клеток мононуклеарного происхождения.
При сравнении цитотоксического ответа МНК, праймированных дендритными клетками, трансфецированными универсальной или HLA-A*0201-специфичной плазмидой против аутологичных опухолевых клеток получены статистически достоверные различия при дополнительной стимуляции цитокинами рчИЛ-12 и рчИЛ-18 (табл.3).
| Таблица 3 | |
| Сравнение цитотоксического ответа неприлипшей фракции МНК против аутологичных опухолевых клеток (N=40). Данные представлены в виде среднего и ошибки среднего. | |
| Группы антиген-активированных ДК | Уровень цитотоксического ответа МНК против аутологичных опухолевых клеток |
| МКН+ДК U+рчИЛ-12+рчИЛ-18 | 41,06±4,06 |
| МКН+ДК A+рчИЛ-12+рчИЛ-18 | 45,66±4,24 |
| Примечание: | |
| МНК+ДК(U) - совместная культура МНК и ДК, трансфецированных универсальной плазмидой U; | |
| МНК+ДК(A) - совместная культура МНК и ДК, трансфецированных плазмидой A, специфичной для гаплотипа HLA-A*0201; | |
| +рчИЛ-12+рчИЛ-18 - сокультивирование МНК и ДК при добавлении рчИЛ12 и рчИЛ-18 |
Таким образом, в результате проведенных исследований разработан способ генерации противоопухолевых цитотоксических клеток с помощью антиген-активированных аутологичных дендритных клеток и рчИЛ-12 и рчИЛ-18 in vitro.
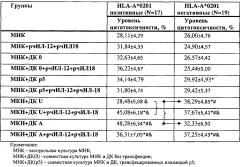
Существуют данные, согласно которым пептиды, представляемые с помощью ДК, могут стимулировать CD8+ T-клеточный ответ, ограниченный молекулами HLA I класса и HLA-A2. Для этого группа больных РМЖ делилась в зависимости от HLA гаплотипа. В каждой отдельной выборке пациентов оценивался цитотоксический потенциал МНК, активированных ДК, трансфецированными плазмидами (универсальной и несущей HLA-A*0201-специфические эпитопы опухоль-ассоциированных антигенов). Результаты показаны в табл.4.
Полученные данные показывают, что в группе HLA-A*0201-позитивных больных ДК, нагруженные специфической HLA-A*0201-связанной плазмидой, достоверно выше стимулируют цитотоксический ответ МНК против аутологичных опухолевых клеток, как в сравнении с другими контрольными группами (МНК, ДК0, ДКр5), в спонтанных культурах и при стимуляции цитокинами (рчИЛ-12, рчИЛ-18), а также достоверно выше модулируют цитотоксический ответ по сравнению с ДК, нагруженными плазмидами, несущие универсальные эпитопы ОАА, независимо от гаплотипа HLA-A*0201. В группе HLA-A*0201-негативных больных РМЖ только в стимулированных цитокинами группах сокультивируемых МНК и ДК, трансфецированных универсальной и специфической плазмидами, получены статистически достоверные различия со всеми группами контроля. В спонтанных группах, только ДК, трансфецированные плазмидой, несущей универсальные эпитопы, показана достоверно лучшая стимуляция цитотоксической активности неприлипшей фракции мононуклеарных клеток по сравнению с группами МНК и ДК0.
Исследования возможности модуляции цитотоксического ответа мононуклеарных клеток против аутологичных опухолевых клеток у больных раком молочной железы, несущих разные аллели HLA, показали, что стимулирующая активность ДК, трансфецированных универсальной плазмидой (несет неспецифические по HLA-A*0201 эпитопы пептидов), лучше проявляется в группе HLA-A*0201-негативных пациентов. Для ДК, трансфецированных аллель-специфической плазмидой, стимулирующая активность ДК показана достоверно выше в группе больных, несущих аллель HLA-A*0201.
Цитотоксические CD8+ T-клетки осуществляют свою активность против инфицированных или измененных собственных клеток через дегрануляцию и высвобождение особых литических молекул. Основными, среди них, являются перфорин и гранзим B. Вкратце, при взаимодействии цитотоксической и опухолевой клетки происходит узнавание последней через комплексы ГКНС I класса-пептид, активация внутриклеточных цитотоксических гранул и высвобождение ферментов в область межклеточного взаимодействия. Перфорин является основным порообразующим белком, который при полимеризации образует «туннели» в таргетной клетке, через которые основной литический компонент данной системы - гранзим B - проникает внутрь клетки и запускает внутриклеточный каскад каспаз, приводящий в итоге к апоптозу таргетной клетки. Существуют данные, указывающие, что отсутствие белка перфорина делает невозможным проникновение гранзима В внутрь клетки и, соответственно, удаление поврежденных или измененных клеток [7, 30].
Помимо CD8+ T-клеток, в запуске цитотоксического ответа принимают участие CD4+ T хелперы 1 типа. Помимо опосредующего влияния на функцию CD8+ T-клеток, они способны продуцировать цитокин ИФНγ, необходимый для элиминации опухоли.
Для оценки потенциальной цитотоксической активности мононуклеарных клеток, больных раком молочной железы, культивированных с антиген-стимулированными дендритными клетками, определяли содержание внутриклеточного мономерного белка перфорина и продукцию ИФНγ (фиг.1, 2). Для этого неприлипшая фракция МНК сокультивировалась с ДК, трансфецированными различными вариантами плазмид в течение 96 часов. Для оценки потенциальной антиген-активированной продукции перфорина и иммунорегуляторного цитокина ИФНγ через 48 часов после начала сокультивирования в часть культур клеток добавлялись лизат аутологичных опухолевых клеток и иммунорегулирующие цитокины (рчИЛ-12 и рчИЛ-18). Таким образом, в ходе культивирования МНК дважды «встречались» с опухолевыми антигенами: первый раз, при представлении им опухолевого антигена ДК, трансфецированными плазмидами, несущими иммуногенные эпитопы опухоль-ассоциированных антигенов, и второй раз - при повторном добавлении лизата аутологичных опухолевых клеток в совместную культуру МНК и ДК. Результате показаны на фиг.1.
При исследовании перфорин-продуцирующей способности совместной культуры МНК и антиген-активированных ДК не получено достоверных различий между спонтанными и стимулированными группами клеток. Во всех группах отмечено достоверное увеличение стимуляции внутриклеточного образования белка перфорина в ответ на сокультивирование МНК и ДК, трансфецированных аллель-специфическими плазмидами, а также в ответ на сокультивирование МНК и ДК, трансфецированных универсальной плазмидой при всех стимуляциях, кроме изолированного использования рчИЛ-12 и рчИЛ-18.
Таким образом, совместное культивирование зрелых аутологичных антиген-активированных дендритных клеток и неприлипающей фракции мононуклеарных клеток совместно с рчИЛ-12 и рчИЛ-18, при повторном добавлении лизата или без него, приводит к достоверному повышению содержания перфорин-позитивных клеток с потенциальной цитотоксической активностью.
Эти данные показаны на фиг. 2.
Под действием аутологичных ДК, трансфецированных различными типами плазмид, получено статистически достоверное увеличение продукции иммунорегуляторного цитокина ИФНγ по сравнению с нативной популяцией МНК по всем группам стимуляций. Повторное добавление лизата не оказывает достоверного влияния на продукцию цитокина, а добавление рчИЛ-12 и рчИЛ-18 статистически достоверно повышает продукцию ИФНγ по сравнению со спонтанной и стимулированной только лизатом группами. В стимулированной цитокинами группе показано статистически достоверное влияние ДК, трансфецированных универсальной плазмидой, на продукцию ИФНγ при сравнении как с контрольными группами (МНК и ДК0), так и с ДК, трансфецированными HLA-A*0201-специфической плазмидой.
Полученные данные по продукции иммунорегуляторного цитокина ИФНγ подтверждают результаты цитотоксического теста о возможности модуляции иммунного ответа с помощью разработанного протокола в сторону Т-хелпер 1 го типа.
Источники информации
Все перечисленные ниже источники полностью включены в настоящее описание путем ссылки.
1. Ackerman A.L. and Cresswell P. Cellular mechanisms governing cross-presentation of exogenous antigens. // Nat Immunol. - 2004. - Vol.5 - p.678-684.
2. Banchereau J. and Palucka A.K. Dendritic cells as therapeutic vaccines against cancer. // Nat Rev Immunol. - 2005. - Vol.5. - p.296-306.
3. Barbulescu K, Becker C, Schlaak JF, et al. IL-12 and IL-18 differentially regulate the transcriptional activity of the human IFN-gamma promoter in primary CD4+ T lymphocytes. // J Immunol. - 1998. - №160. - P.3642-3647.
4. Blake-Mortimer JS, Sephton SE, Carlson RW, Stites D, Spiegel D Cytotoxic T lymphocyte count and survival time in women with metastatic breast cancer. // Breast J. - 2004. - Vol.10, - p.195-199.
5. Coussens L.M. and Werb Z. Inflammation and cancer. // Nature. - 2002. - Vol.420 (6917). - p.860-867.
6. Coventry BJ, Morton J. CD1a-positive infiltrating-dendritic cell density and 5-year survival from human breast cancer. // Br J Cancer. - 2003. - Vol.89. - p.533-538.
7. Cullen SP, Brunet M, Martin SJ Granzymes in cancer and immunity. // Cell Death and Differentiation. - 2010. - №17. - P.616-623.
8. Curtsinger JM, Gerner MY, Lins DC, Mescher MF. Signal 3 availability limets the CD8 T cell response to a solid tumor. // J Immunol. - 2007. - Vol.178. - p.6752-6760.
9. Daniel D, et al. CD4 T cell-mediated antigen-specific immunotherapy in a mouse model of cervical cancer. // Cancer Res. - 2005. - Vol.65 - p.2018-2025.
10. De Jong E.C., Smits H.H., Kapsenberg M.L. Dendritic cell-mediated T cell polarization. // Springer Semin Immun. - 2004. - №26. - P.289-307.
11. Disis M.L. Immune regulation of cancer. // J Clin Oncol. - 2010. - Vol.28. - p.4531-4538.
12. Dunn G.P., Koebel C.M. and Schreiber R.D. Interferons, immunity and cancer immunoediting. // Nat Rev Immunol. - 2006. - Vol.6 (11). - p.836-848.
13. Georgiannos SN, Renaut A, Goode AW, Sheaff M. The immunophenotype and activation status of the lymphocytic infiltrate in human breast cancers, the role of the major histocompatibility complex in cell-mediated immune mechanisms, and their association with prognostic indicators. // Surgery. - 2003. - Vol.134. - p.827-834.
14. Hung K., Hayashi R., Lafond-Walker A., Lowenstein C., Pardoll D., Levitsky H. The Central Role of CD4+ T Cells in the Antitumor Immune Response. // J Exp Med. - 1998. - Vol.188 (12). - 2357-2368.
15. Iwamoto M, Shinohara H, Miyamoto A, Okuzawa M, Mabuchi H, et al. Prognostic value of tumor-infiltrating dendritic cells expressing CD83 in human breast carcinomas. // Int J Cancer. - 2003. - Vol.104. - p.92-97.
16. Kohrt HE, Nouri N., Nowels K., Johnson D., Holmes S., Lee P.P. Profile of immune cells in axillary lymph nodes predicts disease-free survival in breast cancer. // PLoS Med. - 2005. - Vol.2 (e284). - p.904-919.
17. Koski G.K., Cohen P.A., Roses R.E., Xu S., Czerniecki B.J. Reengineering dendritic cell-based anti-cancer vaccines. // Immunol Rev. - 2008. - Vol.222. - p.256-276.
18. Lee H. The Clinical Impact of the Dendritic Cell-based Cancer Vaccine: the Role in the Inflammatory Tumor Micro-environment. // Chonnam Medical Journal. - 2010. - Vol.46. - p.1-6.
19. Liyanage UK, Moore TT, Joo HG, Tanaka Y, Herrmann V, et al. Prevalence of regulatory T cells is increased in peripheral blood and tumor microenvironment of patients with pancreas or breast adenocarcinoma. // J Immunol. - 2002. - Vol.169. - p.2756-2761.
20. Mantovani A. Inflammation and cancer: the Macrophage connection. // Medicina. - 2007. - Vol.67 (Supl. II). - p.32-34.
21. Palucka K. et al. Recent developments in cancer vaccines. // J Immunol. - 2011. - N 186 (3). - p.1325-1331.
22. Pinzon-Charry A, Maxwell T, López JA. Dendritic cell dysfunction in cancer: a mechanism for immunosuppression. // Immunol Cell Biol. - 2005. - Vol.83. - p.451-61.
23. Sallusto F, Lanzavecchia A: Heterogeneity of CD4+ memory T cells: Functional modules for tailored immunity. // Eur J Immunol. - 2009. - Vol.39. - p.2076-2082.
24. Scardino A., Alimandi M., Correale P., et al. A Polyepitope DNA Vaccine Targeted to Her-2/ErbB-2 Elicits a Broad Range of Human and Murine CTL Effectors to Protect against Tumor Challenge. // Cancer Res. - 2007. - Vol.67 (14). - p.7028-7036.
25. Schattner EJ, et al. CD41 T-cell induction of Fas-mediated apoptosis in Burkitt′s lymphoma В cells. // Blood. - 1996. - Vol.88. - p.1375-1382.
26. Schmidt CS, Mescher MF. Peptide antigen priming of naive, but not memory, CD8 T cells requires a third signal that can be provided by IL-12. // J Immunol. - 2002. - Vol.68. - р.5521-5529.
27. Steinman M.R. The dendritic cell and its role in immunogenicity. // Annu. Rev. Immunol. - 1991. - Vol.9. - p.271-96.
28. Thomas WD, Hersey P. TNF-related apoptosis-inducing ligand (TRAIL) induces apoptosis in Fas ligand-resistant melanoma cells and mediates CD4 T cell killing of target cells. // J Immunol. - 1998. - Vol.161. - p.2195-2200.
29. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность). // Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М.: ФГУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России». - 2011. - 260 с.: ил.
30. Trapani J.A. and Smyth M.J. Function