Штамм paraphoma sp. - продуцент феосферида а
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к получению биологически активных веществ и может быть использовано для получения феосферида А. Штамм гриба Paraphoma sp., депонированный в ФГБНУ ВИЗР под регистрационным номером VIZR 1.46, предлагается как продуцент феосферида А. Изобретение позволяет повысить выход феосферида А. 2 пр.
Реферат
Изобретение относится к биотехнологии, в частности к получению биологически активных веществ, и может быть использовано для получения феосферида А различного назначения, как для сельскохозяйственного производства, так и для медицинских целей.
Многие микромицеты способны образовывать соединения с противоопухолевой активностью (Tsuruo et al., 1985 [1]; Strobel, 2003 [2]; Rai et al., 2009 [3]; Kharwar et al., 2011 [4]; Evidente et al., 2013 [5]; Kornienko et al., 2015 [6]). Одно из них - феосферид А, которое обладает противоопухолевой активностью, селективно ингибируя активность белка STAT3 в концентрации IC50=6,1×10-4 М (Bromberg et al., 1999 [7]; Maloney et al., 2006 [8]). В настоящее время изучаются свойства и механизм действия этого вещества.
В качестве продуцентов феосферида А известны штамм FA 39 неидентифицированного эндофитного гриба, имеющий по результатм секвенирования гена большой субъединицы рибосомальной ДНК 97% гомологии с видом Phaeosphaeria avenaria (Maloney et al., 2006 [8]), Phoma sp. №19 (Poluektova, Berestetskiy, 2014 [9]), Paraphaeosphaeria neglecta FT462 (Li et al., 2015 [10]). За прототип принят штамм штамм FA 39.
При культивировании FA 39 на среде, содержащей кукурузную, рисовую крупу, пшеничные хлопья Fiber One (General Mills Sales, Inc.) и 0.1% дрожжевой экстракт, выход феосферида А составил 1.01 г/кг (Maloney et al., 2006 [8]). Колбы со средой инокулировали агаровыми блоками 3-дневной культуры гриба FA 39. Гриб культивировали в течение семи дней при 25°С. По окончании культивирования, полученный материал (32.4 г) экстрагировали метанолом и переэкстрагировали (выход 15.61 г/кг субстрата). Фракционирование экстракта хроматографическими методами на силикагеле позволило получить фракцию, содержащую феосферид А как основной компонент. Дальнейшая очистка этой фракции методом высокоэффективной жидкостной хроматографии позволила получить 32.8 мг чистого феосферида А с выходом 1.01 г/кг субстрата (Maloney et al., 2006 [8]).
Недостатком данного штамма-продуцента феосферида А является недостаточно высокий уровень его образования.
Задачей изобретения является получение нового штамма-продуцента, превосходящего штамм FA 39 по продуктивности образования феосферида А. Поставленная задача была решена путем отбора наиболее продуктивных штаммов.
Исходным материалом для отбора высокопродуктивных штаммов был природный изолят Phoma sp. №19, выделенный из пораженных пятнистостью листьев Cirsium arvense, собранных в п. Восточное, Хабаровского р-на Хабаровского края, 24.08.2006. На основании изучения морфолого-культуральных свойств, гриб был предварительно идентифицирован как Phoma sanguinolenta (Tode) Desm. по определителю Boerema (Boerema, 2004 [11]). Экстракт из мицелия этого гриба продемонстрировал фитотоксическую активность (Берестецкий, Курленя, 2014 [12]).
Штамм cf Paraphoma sp. 1.46 (ВИЗР) был отобран как наиболее продуктивный из различных морфологических вариантов Phoma sp. №19. Для селекции по признаку образования феосферида А был получены колонии различных морфологических вариантов Phoma sp. №19 на КГА. Содержание феосферида А в микроэкстрактах гриба, полученных по методике (Smedsgaard J., 1997 [13]), определяли методом ВЭЖХ. Штамм 1.46 был отобран как наиболее продуктивный и депонирован в Государственной коллекции микроорганизмов ФГБНУ ВИЗР.
Идентификация вида гриба была проведена на основании совокупности морфолого-культуральных признаков. Дополнительная идентификация была проведена молекулярным способом. По результатам мультилокусного анализа региона ITS и генов LR5 и TEF штамму было присвоено название cf Paraphoma sp. 1.46 (ВИЗР). Нуклеотидные последовательности внутренних транскрибируемых спейсеров (ITS) рибосомальных генов размером 575 пар нуклеотидов, генов 28S rRNA и TEF 1-alpha gene размером 854 и 459, соответственно, задепонированы в базе данных GenBank (Banklt 1840305).
Гриб обладает умеренным ростом на стандартных агаризованных питательных средах (картофельно-глюкозном агаре (КГА), мальтозном агаре (МА), овсяном агаре (OA) и агаре Чапека с витаминами (ЧА) в темноте при 24°С. Гриб образует на КГА колонии слегка приподнятые, оливково-серые, бархатистые с ровными краями серо-голубого цвета. Средний диаметр колонии 57.75 мм. На среде OA колонии распростертые, паутинисто-бархатистые светло-серого цвета с ровными краями. По краю наблюдался красный пигмент. Средний диаметр колонии 56.75 мм. Колонии на МА оливково-серого цвета, слегка приподнятые, с пушистым мицелием. Края колонии ровные, темно-оливкового цвета. Средний диаметр колонии 43.5 мм. На агаризованной среде Чапека наблюдали слегка приподнятые бархатистые колонии серого цвета, с ровными краями светло-серого цвета. Реверс оливково-серого цвета с темно-оливковыми краями. Средний диаметр колонии 54.5 мм. Ни на одной питательной среде спороношения гриба не выявлено. При культивировании в условиях искусственного освещения гриб выделяет в агаризованную среду красный пигмент.
Хранение штамма осуществляется в пробирках на скошенном картофельно-глюкозном агаре в бытовом холодильнике при температуре +5-8°С.
Пример 1. Получение экстракта из культуры cf Paraphoma sp. 1.46 на перловой крупе
В качестве субстрата для твердофазного культивирования гриба использовали перловую крупу. В 25 1-литровых конических колб вносили по 150 г крупы и 100 мл воды. Стерилизацию зернового субстрата проводили автоклавированием в течение 30 минут при 121°С. Относительная влажность субстрата 40±5%. Субстрат инокулировали двумя блоками (5 мм в диаметре), вырезанными из края посевной культуры cf Paraphoma sp. 1.46. Гриб культивировали 30 суток в темноте при температуре 24°С. Колбы встряхивали каждые 2 суток для предотвращения слипания субстрата. Колонизированный грибом субстрат высушивали током стерильного воздуха. Объединенный сухой материал (3.75 кг) экстрагировали 50%-ным водным ацетоном (10 л). После упаривания ацетона водную вытяжку экстрагировали гексаном (5 л), отбрасывая органический слой. Затем водную фазу экстрагировали этилацетатом (2.5 л×3). Объединенный экстракт обезвоживали фильтрованием через безводный сернокислый натрий и упаривали на ротационном испарителе при температуре не выше 40°С. Выход экстракта составил 2.84 г/кг субстрата.
Пример 2. Получение феосферида А из экстракта мицелия cf Paraphoma sp. 1.46
Фракционирование экстракта проводили на концентрирующих патронах Chromabond С-18 ее (Macherey-Nagel, Германия) с массой сорбента 10000 мг. Сухой остаток, растворенный в ацетонитриле, вносили партиями по 1 г в патрон, предварительно кондиционированный 20 мл ацетонитрила и 30 мл 0.1%-ной муравьиной кислоты. Фракционирование экстракта проводили системой растворителей ацетонитрил - 0.1%-ная муравьиная кислота в соотношении 0:100; 25:75; 50:50; 100:0, объемом 70 мл. Фракция, содержащая феосферид А была получена в системе ацетонитрил - 0.1%-ная муравьиная кислота в соотношении 50:50. Дальнейшее разделение фракции проводили при помощи полупрепаративной ВЭЖХ на хроматографе BUCHI, на патроне PuriFlash-25 SiHC (Interchim, Франция) с массой сорбента 40 г с использованием предпатрона с предварительно сорбированным на силикагеле экстрактом. Разделение экстракта производили в системе гексан-этилацетат (в градиенте от 0 до 80% этилацетата) со скоростью потока 50 мл/мин, детектирование фитотоксина проводили на длине волны 260 нм. В результате разделения был получен феосферид А чистотой более 96%. Выход феосферида А составил 1.9 г/кг субстрата.
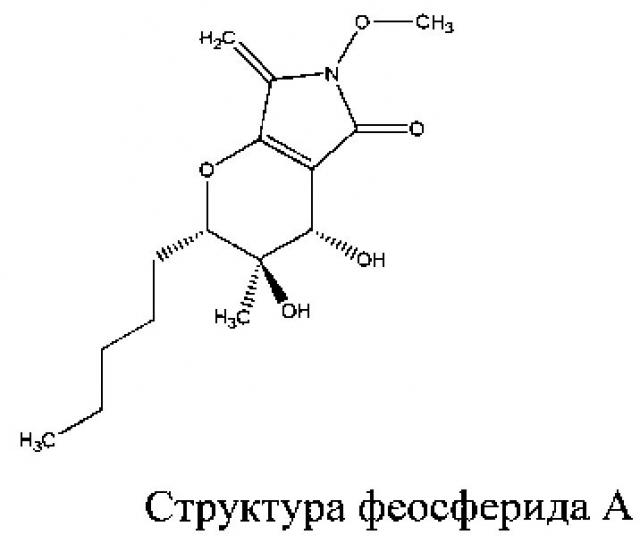
Идентификация фитотоксина была проведена спектрометрическими методами. Съемку ультрафиолетовых спектров фитотоксина осуществляли в ацетонитриле на приборе Beckman Coulter DU 800, масс-спектры вещества снимали методом ВЭЖХ - МС на приборе Thermo Scientific TSQ Quantum Access (тройной квадрупольный масс-спектрометр), оснащенном диодно-матричным и масс-детектором. Ионизацию образца осуществляли методом электрораспыления. Съемку 1Н- и 13С-ЯМР-спектров фитотоксина осуществляли на спектрометре Bruker AVANCE III 400 Ultrashield Plus на частоте 400.1 и 100.6 МГц (Bruker, Германия), соответственно. Образец растворяли в дейтерированном диметилсульфоксиде. Были сняты следующие виды спектров: протонный спектр 1Н; углеродный спектр, 13С; углеродный спектр 13С DEPT; двумерный протон-протонный спектр 1Н-1Н COSY; двумерный протон-протонный спектр 1Н-1Н ROESY; двумерный углерод-протонный спектр 1Н-13С HMQC; двумерный углерод-протонный спектр 1Н-13С НМВС. Полная информация о молекулярной структуре феосферида А была получена из рентгеноструктурного анализа. Было установлено, что феосферид А в кристалле существует в виде энантиомерной пары (Abzianidze et al., 2015 [14]).
Таким образом, штамм гриба cf Paraphoma sp. 1.46 интересен как высокопродуктивный продуцент феосферида А. Продуктивность штамма позволяет получить феосферид А в количестве 1.9 г/кг, что на 47% превышает продуктивность штамма FA 39.
Литература
1. Tsuruo Т., Oh-hara Т., Iida Н., Tsukagoshi S., Sato Z., Matsuda I., Iwasaki S., Okuda S., Shimizu F., Sasagawa K., Fukami M., Fukuda K., Arakawa M. Rhizoxin, a macrocyclic lactone antibiotic, as a new antitumor agent against human and murine tumor cells and their vincristine-resistant sublines. Cancer Research. 1986. V. 46. P. 381-385.
2. Strobel G.A. Endophytes as sources of bioactive products. Microbes and Infection. 2003. 5. P. 535-544.
3. Rai M., Deshmukh P., Gade A., Ingle A., G.J., Irinyi L. Phoma Saccardo: Distribution, secondary metabolite production and biotechnological applications. Critical Reviews in Microbiology. 2009. V. 35 (3). P. 182-196.
4. Kharwar R.N., Mishra A., Gond S.K., Stierle A., Stierle D. Anticancer compounds derived from fungal endophytes: their importance and future challenges. Nat. Prod. Rep. 2011. V. 28, 1208-1228.
5. Evidente A., Kornienko A., Cimmino A., Andolfi A., Lefranc F., Mathieu V., Kiss R. Fungal metabolites with anticancer activity. Nat. Prod. Rep. 2014. View Article Online.
6. Kornienko A., Evidente A., Vurro M., Mathieu V., Cimmino A., Evidente M., Otterlo W.A.L., Dasari R., Lefranc F., Kiss R. Toward a Cancer Drug of Fungal Origin. Published online in Wiley Online Library (wileyonlinelibrary.com). DOI 10.1002/med.21348.
7. Bromberg J.F., Wrzeszczynska M.H., Devgan G., Zhao Y., Pestell R.G., Albanese C., Darnell J.E. STAT3 as an Oncogene. Cell. 1999. V. 98. P. 295-303.
8. Maloney K.N., Hao W., Xu J., Gibbons J., Hucul J., Roll D., Brady S.F., Schroeder F.C, Clardy J. Phaeosphaeride A, an inhibitor of STAT3-dependent signaling isolated from an endophytic fungus. Org Lett. 2006. P. 4067-4070.
9. Poluektova E.V., Berestetskiy A.O. Isolation and characterization of phytotoxins produced by phoma sp. 19. book of proceedings 7th world congress on allelopathy. Complex interactions in a changing climate. Congress held in Vigo, Spain. July, 28 - August, 1, 2014. P. 114.
10. Li C.S., Ding Y., Yang B.J., Miklossy G., Yin H.Q., Walker L.A., Turkson J., Cao S. A new metabolite with a unique 4-pyranone-γ-lactam-1,4-thiazine moiety from a hawaiian-plant associated fungus. Org Lett. 2015.
11. Boerema G.H., de Gruyter J., Noordeloos M.E., Hamers M.E.C. Phoma identification manual. CABI Publishing. 2004. 470 p.
12. Берестецкий А.О., Курленя А.С. Антимикробные свойства фитопатогенных микромицетов. Микология и Фитопатология. 2014. 48 (2). С. 123-134.
13. Smedsgaard J. Micro-scale extraction procedure for standardized screening of fungal metabolite production in cultures. J Chromatogr A. 1997. V. 760 (2). P. 264-270.
14. Abzianidze V.V., Poluektova E.V., Bolshakova K.P., Panikorovskii T.L., Bogachenkov A.S. and Berestetskiy A.O. Crystal structure of natural phaeosphaeride A. Acta Cryst. 2015. V. E71. P. 625-626.
Штамм гриба Paraphoma sp., депонированный в ФГБНУ ВИЗР под регистрационным номером VIZR 1.46 - продуцент феосферида А.