Имплантируемый матриксный материал для регенеративной медицины и способ его получения (варианты)
Иллюстрации
Показать всеИзобретения относятся к медицине, в частности к новому матриксному материалу для тканевой биоинженерии и регенеративной медицины и способам его получения. Матриксный материал разработан на основе растительного полисахарида - пектина со степенью этерификации не более 50% и белков внутриклеточного матрикса - коллагенов I и IV типов, который содержит указанные компоненты в следующих концентрациях: 0,5 - 2,0 вес.%, 0,1 - 1,5 вес.% и 0,01 - 0,5 вес.% соответственно. Способ получения имплантируемого матриксного материала для регенеративной медицины в форме гидрогеля заключается в смешивании при температуре не выше 5°С уксуснокислого раствора коллагена I типа до конечной концентрации 0,1-1,5 вес.% с раствором коллагена IV типа до конечной концентрации 0,01-0,1 вес.%, затем полученную смесь смешивают с предварительно приготовленным инициатором гелеобразования, включающим раствор хлорида кальция в концентрации, обеспечивающей процесс гелеобразования, нетоксичную буферную систему в количестве, обеспечивающем нейтрализацию смеси, и раствор хлорида натрия до физиологической концентрации; после чего вводят раствор пектина со степенью этерификации не выше 50% до конечной концентрации 0,5-2,0 вес.% и формируют гель путем повышения температуры смеси до физиологической. Также изобретение относится к способу получения имплантируемого матриксного материала для регенеративной медицины в форме гидрогеля, который заключается в смешивании при температуре не выше 5оС уксуснокислого раствора коллагена I типа до конечной концентрации 0,1-1,5 вес.% с раствором коллагена IV типа до конечной концентрации 0,01-0,1 вес.%, затем полученную смесь нейтрализуют, стабилизируют нетоксичной буферной системой и добавляют хлорид натрия до физиологической концентрации, после чего прибавляют раствор пектина со степенью этерификации не выше 50% до конечной концентрации 0,5 - 2,0 вес.%, получая жидкую композицию, из которой формируют гель. Изобретение позволяет получить биосовместимые имплантируемые материалы, обладающие низкой скоростью биодеградации и способностью стимулировать регенеративный процесс, в частности восстановление нервных проводников после травмы мозга. 3 н. и 7 з.п. ф-лы, 8 ил.
Реферат
Изобретения относятся к медицине, в частности к новому матриксному материалу для тканевой биоинженерии и регенеративной медицины и способам его получения. Основной областью применения материала является реконструктивная терапия травм нервной системы и патологий, сопровождающихся нейродегенерацией. Материал может также применяться и для реконструктивной терапии повреждений других органов и тканей.
Аналогами настоящего изобретения являются различные биосовместимые полимерные материалы, предназначенные для тканевой инженерии и реконструктивной терапии. Среди аналогов могут быть рассмотрены изобретения, защищенные патентами РФ №2188206, МПК C07K 14/78, C07K 1/36, A61K 38/39, A61P 9/08, опубл. 2002 г., №2249462, МПК A61K 38/39, A61K 35/12, опубл. 2005 г., №2321597, МПК С08В 37/00, С08L 5/00, A61K 31/715, A61K 31/724, опубл. 2008 г.
Некоторые из перечисленных изобретений основаны на создании биосовместимого матрикса на основе компонентов, представленных исключительно различными формами коллагенов - ключевых белков внеклеточного матрикса (патенты №2188206 и №2249462). Такие материалы несмотря на продемонстрированные репарационные свойства имеют ряд существенных недостатков. Одним из недостатков материалов на основе коллагенов разных типов является их высокая скорость биодеградации в организме. В техническом решении, защищенном патентом РФ №2249462, заявлено, что полученный гетерогенный матрикс из препаратов коллагена двух классов позвоночных животных, представленный в виде двухфазной полимерной системы (твердые сферы в растворе денатурированного коллагена) согласно описанию изобретения обладает регулируемой скоростью деградации в организме. Однако ни в описании технического решения, ни в примерах, приведенных авторами изобретения, не указано, каким образом была решена известная проблема быстрой биодеградации имплантируемых коллагенов. Авторами изобретения также не продемонстрированы результаты экспериментов, позволяющих оценить скорость биодеградации данного материала. Ни в описании патента, ни в научных публикациях авторов изобретения, находящихся в открытом доступе, не указано об использовании методических подходов, позволяющих оценить скорость биодеградации коллагенов в области имплантации. В то время как из известных технических решений, описанных в научной литературе, скорость деградации коллагенов удается снизить посредством введения ковалентных сшивок между цепями полимера, а также введением коллагенов в сочетании с медленно деградирующими полимерами (такими как альгинат, хитозан, агароза). Данные способы являются единственными из описанных в научной и технической литературе. Другим недостатком материалов на основе коллагенов является отсутствие способности ограничивать формирование глиомезодермального рубца и цист с плотной оболочкой, которые возникают при естественном репарационном процессе после травматического повреждения мозга за счет миграции и адгезии клеток нейроглии и соединительной ткани. Данный недостаток коллагеновых материалов связан с высокими адгезионными свойствами в отношении клеток нейроглии и соединительной ткани. Структуры формирующегося рубца хотя и способствуют восстановлению целостности мозга, тем не менее формируют непреодолимый барьер для роста и регенерации отростков нервных клеток.
Известны матриксные гелевые материалы на основе гиалуроновой кислоты - углевода, формирующего аморфное вещество внеклеточного матрикса животных. Такие гели поддерживают жизнеспособность и аксональный рост нейронов дорзального ганглия цыпленка (Horn E.M., Beaumont M., Shu X.Z. et al. Influence of cross-linked hyaluronic acid hydrogels on neurite outgrowth and recovery from spinal cord injury //Journal of Neurosurgery-Spine. 2007. V. 6. P. 133-140).
Однако имплантация данных гиалуроновых гелей в область травмы спинного мозга крыс не способствует регенерации последнего. Внедрение гиалуронового геля в область повреждения коры головного мозга крысы ингибирует формирование глиального шрама, позволяет обеспечить миграцию клеток внутрь геля, но не поддерживает аксональный рост (Cui F.Z., Tian W.M., Hou S.P., et al. Hyaluronic acid hydrogel immobilized with RGD peptides for brain tissue engineering //Journal of Material Science: Materials in Medicine. 2006. Vol.17. P. 1393-1401). Этого недостатка лишены те же гели, но модифицированные с помощью иммобилизованных RGD-пептидов. В такие гели проникают не только различные клетки, но и активно прорастают регенерирующие аксоны.
Таким образом, без введения дополнительных компонентов или химической модификации, гиалуронат не способствует регенерации нервной системы. Другим ее недостатком, также как и других природных материалов животного происхождения, является быстрая биодеградация. Гели, состоящие только из гиалуроновой кислоты, полностью деградируют при подкожной имплантации уже через 2 недели (Hahn M.S., Teply B.A., Stevens M.M. et al. Collagen composite hydrogels for vocal fold lamina propria restoration //Biomaterials. 2006. Vol.27. P. 1104-1109).
Известны матриксы на основе альгинатов - полисахаридов, получаемые из бурых водорослей. Полимеры альгиновой кислоты легко образуют высокогидрофильные, иммунологически инертные и биосовместимые гели при добавлении к ним ионов кальция. Эти гели в отличие от гелей на основе гиалуроновой кислоты биодеградируют медленно в организме млекопитающих, однако при их имплантации в область травмы мозга они не обеспечивают рост аксонов и, соответственно, регенерацию нервных путей. Для придания таким материалам нейрорегенеративных свойств из гелей получают пористые губки, путем лиофильного высушивания материала (Suzuki K., Suzuki Y., Ohnishi K. et al. Regeneration of transected spinal cord in young adult rats using freeze-dried alginate gel //Neuroreport. 1999. Vol.10. P. 2891-2894). Только в таком виде материал на основе альгината стимулировал рост аксонов в поврежденном спинном мозге крыс, однако исследователям не удалось достигнуть существенного нейрорепаративного эффекта, который бы позволил значительно восстановить двигательную активность животных, регистрируемую по стандартной шкале оценки восстановления двигательной активности. Другим недостатком альгинатов является их низкие скорости набухания и растворения, что затрудняет их применение при процедурах получения матриксных материалов.
Наиболее близким техническим решением по количеству существенных признаков является имплантируемая пористая матрица для регенеративной медицины, формируемая из биологически совместимого полимера или полимерной смеси, в частности для этого используют растительные полисахариды и белки внеклеточного матрикса. Формирование матрицы ведут путем уплотнения частиц полимера и частиц хлорида натрия с использованием прессования. Затем из прессованного полимера удаляют частицы хлорида натрия растворением. В одном из вариантов матрицы после удаления из нее хлорида натрия поверхность покрывают белками внеклеточного матрикса, в том числе коллагенами I и IV типов (п. РФ №2392287, МПК С08J 9/26, A61L 27/56, опубл. 2010 г.).
К недостаткам данной матрицы следует отнести:
- она не предназначена для использования в качестве консолидирующего матрикса для реконструктивной и регенеративной терапии травм мозга, поскольку не препятствует формированию плотного глиомезодермального рубца и цист с плотной оболочкой в области травматического повреждения мозга;
- высокую пористость матрицы, которая обеспечивает после имплантации быстрое проникновение в ее структуру клеток, обладающих высокой миграционной и ремоделирующей матрикс способностью, что является нежелательным, поскольку приводит к высокой скорости биодеградации имплантата, который разрушается до момента прохождения медленных процессов восстановления поврежденных тканей, наблюдаемых при нейрорегенерации;
- механические свойства жесткого пористого матрикса хуже имитируют естественный внеклеточный матрикс мягких тканей по сравнению с таковым, представляющим собой гидрогель;
- имплантирование матрикса возможно только путем сложной хирургической операции, затрагивающей неповрежденные участки тела, поскольку необходимы процедуры диссекции тканей для получения открытого операционного поля;
- сложность способа приготовления матрикса, особенно в случаях получения композиционного матрикса, поскольку предусматривает процедуры прессования, циклы промывки растворителем и нанесения на подготовленные пористые поверхности других компонентов композиции, в связи с чем невозможно инъекционное низко травматическое введение материала и формирование матрикса непосредственно в участке имплантации.
Задачей настоящей группы изобретений является создание нового матриксного материала для регенеративной медицины, предназначенного, в частности, для реконструктивной терапии травм мозга, который обеспечивает регенерацию нервных проводников, обладает низкой скоростью биодеградации в организме млекопитающих, сопоставимой со скоростью регенерации, и способного ограничивать формирование плотных рубцов и крупных цист в очаге ремоделирования тканей.
Поставленная задача решается созданием нового имплантируемого матриксного материала для регенеративной медицины, на основе биосовместимой полимерной смеси из растительного полисахарида и белков внеклеточного матрикса коллагенов I и IV типов, в которой согласно изобретению в качестве растительного полисахарида используют пектин со степенью этерификации не более 50%, причем конечные концентрации компонентов в матриксном материале находятся в диапазоне, вес. %:
пектин со степенью этерификации не более 50% - 0,5-2,0,
коллаген I типа - 0,1-1,5,
коллаген IV типа - 0,01-0,5.
Кроме традиционных препаратов коллагена IV в имплантируемом матриксном материале также используют препарат его NCl-гексамеров.
Использование пектина со степенью этерификации не более 50% позволяет получать стабильные матриксы в форме гидрогелей, легко имплантируемые в области травматических повреждений, которые способны эффективно заселяться клетками регенерирующего участка и стимулировать регенерацию нервных проводников. Применение пектина в композиции с белками внеклеточного матрикса придает материалу низкую скорость биодеградации в организме и препятствует формированию плотных рубцов, поскольку уменьшает в составе композиции с белками их адгезионные свойства и таргетинг клеток, за счет которых формируются плотные структуры рубцов. Использование пектина со степенью этерификации не более 50% позволяет сформировать упорядоченные матриксные структуры типа «egg-box», в которые могут быть вовлечены и обратимо иммобилизованы за счет электростатических взаимодействий другие компоненты материала. Применение пектина со степенью этерификации, превышающей 50%, не обеспечивает формирование стабильных гидрогелей.
Введение пектина в концентрации ниже 0,5% не позволяет получать стабильные гидрогели, пригодные для создания имплантируемого матриксного материала, а превышение концентрации пектина более 2,0% в составе материала приводит к образованию плотного матрикса с большим модулем упругости, что не обеспечивает эффективное проникновение клеток и их отростков, необходимое для регенерации тканей.
Введение в состав материала коллагена I типа в количестве 0,1-1,5% способствует достижению заявленного технического результата, при этом использование концентраций менее 0,1% не обеспечивает материал необходимыми адгезионными свойствами, что не способствует росту нервных проводников и не обеспечивает эффективную регенерацию. Кроме того, снижение концентрации ниже указанного значения не придает имплантируемому материалу стабильность. Превышение концентрации коллагена I типа более 1,5% в составе композиции так же, как и в случае с пектином, приводит к формированию плотного матрикса с большим модулем упругости, что не обеспечивает эффективное проникновение клеток и их отростков, необходимое для регенерации тканей.
Использование в составе имплантируемого матриксного материала коллагена IV типа в конечных концентрациях 0,01-0,5% обеспечивает реализацию регенераторного потенциала клеток, приближает состав композиционного матрикса к таковому в развивающихся эмбриональных структурах, для которых характерны активная миграция клеток вдоль путей, маркированных коллагеном данного типа, что стимулирует, в частности, регенерацию нервных проводников. Снижение концентрации ниже 0,01% не является эффективным стимулом для роста отростков клеток, а превышение концентрации более 0,5% подавляет их рост.
Применение в составе имплантируемого матриксного материала коллагена IV типа в форме препарата его NC1-гексамеров, повышает эффективность применения коллагена IV типа как матриксного компонента, стимулирующего миграцию клеток и рост их отростков.
Заявленный технический результат достигается также способами получения имплантируемого матриксного материала.
Заявленный имплантируемый матриксный материал для регенеративной медицины в форме гидрогеля получают смешиванием при температуре не выше 5оС уксуснокислого раствора коллагена I типа до его конечной концентрации в матриксном материале 0,1-1,5% с раствором коллагена IV типа до его конечной концентрации в матриксном материале 0,01-0,5%. Затем полученную смесь смешивают с предварительно приготовленным инициатором гелеобразования, включающим раствор хлорида кальция в концентрации, обеспечивающей процесс гелеобразования, нетоксичную буферную систему в количестве, обеспечивающем нейтрализацию смеси, и раствор хлорида натрия до физиологической концентрации; после чего в полученную смесь вводят раствор пектина со степенью этерификации не выше 50% до конечной концентрации 0,5-2,0% и формируют гель путем повышения температуры смеси до физиологической.
Последовательность процедур смешения компонентов является принципиально важной, поскольку именно это обеспечивает достижение заявленного результата. Отклонение от данной схемы, в частности смешивание уксуснокислого раствора коллагена I типа непосредственно с раствором пектина, вызывает выпадение в осадок обоих компонентов, что не приводит к формированию матриксного материала в форме гидрогеля. А первичное смешивание раствора пектина с инициатором гелеобразования приводит к быстрому формированию геля и невозможности введения в его состав белков внеклеточного матрикса, что не позволяет получить композиционный материал.
Смешивание уксуснокислого раствора коллагена I типа до его конечной концентрации в матриксном материале 0,1-1,5% с раствором коллагена IV типа до его конечной концентрации в матриксном материале 0,01-0,1%, с последующим введением в полученную смесь предварительно приготовленного инициатора гелеобразования, при температуре выше 5оС приводит к быстрому формированию белкового геля, что не позволяет включить в его состав пектин.
Использование в составе инициатора гелеобразования хлорида кальция, который в конечной концентрации в матриксном материале составляет 1-10 мМ, обеспечивает процесс гелеобразования и позволяет сформировать упорядоченные матриксные структуры типа «egg-box», которые образуют гелевый матрикс посредством ассоциации молекул пектина с низкой степенью этерификации. Введение в состав инициатора гелеобразования нетоксичной буферной системы в количестве, обеспечивающем нейтрализацию смеси коллагенов, приводит к формированию гелей за счет ассоциации молекул коллагенов.
В качестве нетоксичной буферной системы в способе могут быть использованы, в частности, NaOH-N-2-гидроксиэтипиперазин-N′-этансульфоновая кислота (HEPES), NaOH-N-2-гидроксиэтилпиперазин-N′-3-пропансульфоновая кислота (EPPS).
Введение хлорида натрия в состав инициатора необходимо для создания физиологических условий, изотонических по отношению к клеткам млекопитающих.
Формирование гидрогелей стимулируется повышением температуры до физиологических значений, характерных для организма млекопитающего.
Лиофильное высушивание сформированного матриксного материала в форме гидрогеля позволяет получить пористый матриксный материал в форме губки, что способствует расширению области его применения, поскольку такой матрикс обеспечивает большую скорость заселения клетками, их ускоренную миграцию внутрь материала, что может являться преимуществом при создании биоискусственных аналогов тканей в лабораторных условиях.
Заявленный технический результат достигается также вторым способом получения имплантируемого матриксного материала для регенеративной медицины в форме гидрогеля, заключающегося в смешивании при температуре не выше 5оС уксуснокислого раствора коллагена I типа до конечной концентрации 0,1-1,5% с раствором коллагена IV типа до конечной концентрации 0,01-0,1%. Затем в смесь белков внеклеточного матрикса добавляют хлорид натрия до физиологической концентрации и нетоксичную буферную систему в количестве, обеспечивающем нейтрализацию смеси. После нейтрализации к смеси добавляют раствор пектина со степенью этерификации не выше 50% до конечной концентрации 0,5-2,0% и только после этого формируют гель.
Смешивание белков внеклеточного матрикса с хлоридом натрия до физиологической концентрации и с нетоксичной буферной системой в количестве, обеспечивающем нейтрализацию смеси, позволяет затем ввести раствор пектина и получить жидкую композицию, которую в последующем формируют в гелевый матрикс различными способами.
В одном из вариантов формирование геля проводят путем наслаивания на поверхность жидкой композиции раствора инициатора гелеобразования, включающего хлорид кальция в концентрации, обеспечивающей процесс гелеобразования, нетоксичную буферную систему, поддерживающую нейтральный рН и хлорид натрия до физиологической концентрации в матриксном материале, с последующим повышением температуры до физиологической.
Это позволяет получать имплантируемые матриксные материалы различной геометрии, поскольку предварительно подготовленную жидкую композицию можно поместить в различные сосуды, сформировать ровные поверхности и только затем выполнить процедуру формирования геля путем создания условий для гелеобразования. Это важно как при проведении научных исследований биосовместимых материалов, так и для создания имплантатов различной формы и назначения.
В другом варианте формирование геля производят путем введения жидкой композиции непосредственно в область имплантации в организм реципиента. Наличие свободных ионов кальция в жидкой среде организма и температура близкая к 37оС обеспечивают условия формирования геля непосредственно в области имплантации. Это позволяет отказаться от диссекции тканей для получения открытого операционного поля и избрать менее травматичный способ введения имплантируемой конструкции путем инъекции.
Примеры осуществления изобретений.
Для приготовления материала используют стерильные компоненты.
Пример 1.
Предварительно готовят инициатор гелеобразования путем смешивания 4 мкл 10М NaOH, 300 мкл 1M HEPES (титрованного раствором гидроксида натрия до рН 7,4), 300 мкл 5M NaCl, 60 мкл 1M CaCl2, 2,736 мл деионизованной воды
Для приготовления 10 мл имплантируемого матриксного материала в асептических условиях смешивают при температуре 0оС 1,1 мл раствора коллагена I типа с концентрацией 4,5 мг/мл, приготовленного на 0,03 М уксусной кислоте; 0,5 мл раствора коллагена IV типа в виде NC1-гексамеров концентрацией 1 мг/мл и 3,4 мл инициатора гелеобразования. Затем вводят 5 мл раствора пектина концентрацией 3% со степенью этерификации 30%, тщательно перемешивают и проводят формирование геля в термостате при температуре 37оС. Полученный матриксный материал представляет собой прозрачный гель, который содержит 1,5% пектина со степенью этерификации 30%, 0,5% коллагена I типа, 0,05% коллагена IV типа.
Пример 2.
Предварительно готовят инициатор гелеобразования путем смешивания 9 мкл 10М NaOH, 300 мкл 1M HEPES (титрованного раствором гидроксида натрия до рН 7,4), 300 мкл 5M NaCl, 100 мкл 1M CaCl2, 1,691 мл деионизованной воды.
Для приготовления 10 мл имплантируемого матриксного материала в асептических условиях смешивают при температуре 5оС 2,5 мл раствора коллагена I типа с концентрацией 6 мг/мл, приготовленного на 0,03 М уксусной кислоте; 0,1 мл раствора коллагена IV типа концентрацией 1 мг/мл и 2,4 мл инициатора гелеобразования. Затем вводят 5 мл раствора пектина концентрацией 4% со степенью этерификации 50%, тщательно перемешивают и проводят формирование геля в термостате при температуре 37оС. Полученный матриксный материал представляет собой прозрачный гель, содержащий 2% пектина со степенью этерификации 50%, 1,5% коллагена I типа, 0,01% коллагена IV типа.
Пример 3.
Предварительно готовят инициатор гелеобразования путем смешивания 4 мкл 10М NaOH, 300 мкл 1M EPPS (титрованного раствором гидроксида натрия до рН 7,4), 300 мкл 5M NaCl, 40 мкл 1M CaCl2, 1,356 мл деионизованной воды.
Для приготовления 10 мл имплантируемого матриксного материала в асептических условиях смешивают при температуре 5оС 1 мл раствора коллагена I типа с концентрацией 1 мг/мл, приготовленного на 0,03 М уксусной кислоте; 2 мл раствора коллагена IV типа концентрацией 2,5 мг/мл и 2,0 мл инициатора гелеобразования. Затем вводят 5 мл раствора пектина концентрацией 1% со степенью этерификации 10%, тщательно перемешивают и проводят формирование геля в термостате при температуре 37оС. Полученный матриксный материал представляет собой прозрачный гель, содержащий 0,5% пектина со степенью этерификации 10%, 0,1% коллагена I типа, 0,5% коллагена IV типа.
Пример 4.
Для приготовления 10 мл имплантируемого матриксного материала в асептических условиях в чашке Петри смешивают при температуре 0оС 1,1 мл раствора коллагена I типа с концентрацией 4,5 мг/мл, приготовленного на 0,03 М уксусной кислоте; 0,5 мл раствора коллагена IV типа в виде NC1-гексамеров концентрацией 1 мг/мл. К полученной смеси прибавляют 300 мкл 1M HEPES (титрованного раствором гидроксида натрия до рН 7,4), 4 мкл 10М NaOH, 300 мкл 5M NaCl, 2,796 мл деионизованной воды. Затем вводят 5 мл раствора пектина концентрацией 3% со степенью этерификации 30%, тщательно перемешивают. На поверхность полученной жидкой композиции аккуратно наслаивают равный объем раствора, содержащего 12 мМ хлорид кальция, 150 мМ NaCl, 50 мМ HEPES (рН 7,4), затем проводят формирование геля в термостате при температуре 37оС. Полученный матриксный материал сформированный в виде пласта геля с гладкими ровными поверхностями содержит 1,5% пектина со степенью этерификации 30%, 0,5% коллагена I типа, 0,05% коллагена IV типа.
Пример 5.
Для приготовления 10 мл имплантируемого матриксного материала в асептических условиях смешивают при температуре 5оС 1 мл раствора коллагена I типа с концентрацией 1 мг/мл, приготовленного на 0,03 М уксусной кислоте; 2 мл раствора коллагена IV типа концентрацией 2,5 мг/мл и нейтрализуют, добавляя к полученной смеси 300 мкл 1М HEPES (титрованного раствором гидроксида натрия до рН 7,4), 4 мкл 10М NaOH, 300 мкл 5М NaCl, 1,396 мл деионизованной воды. Затем вводят 5 мл раствора пектина концентрацией 3% со степенью этерификации 30%, тщательно перемешивают и заполняют полученной жидкой композицией шприц. После чего жидкую композицию вводят крысам путем выполнения инъекции в область имплантации. Через 1 и 10 суток после имплантации животных выводили из эксперимента путем декапитации. Образцы тканей, из области имплантации, исследовали на наличие сформированного матриксного материала. Исследования показали, что как при подкожной имплантации, так и в случае имплантации в область травматического повреждения спинного мозга введенная жидкая композиция формировала матриксный материал, представляющий собой гель. При исследовании гистологических срезов данных образцов на сроке 10 суток после имплантации наблюдали фрагменты имплантированного матриксного материала, содержащие клеточные элементы.
Пример 6. Матриксный материал получают согласно примеру 2, затем проводят его лиофильное высушивание. В результате чего в сформированном геле образуются поры, а сам готовый продукт представляет собой биополимерную губку.
Для доказательства функциональной работоспособности заявленных изобретений проводили следующие эксперименты. Результаты экспериментов демонстрируются фигурами 1-8.
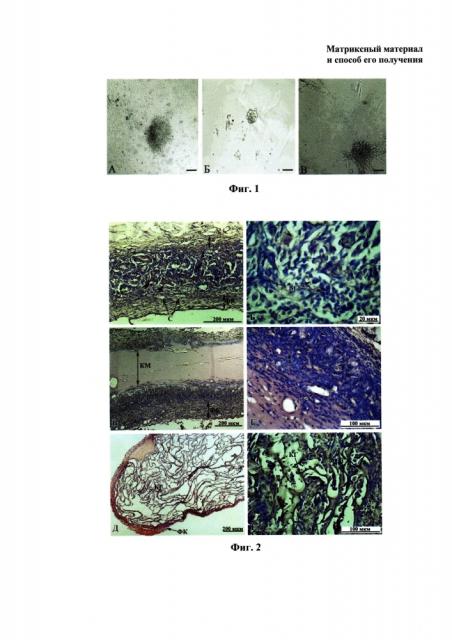
На фиг. 1. представлены результаты культивирования нейральных стволовых клеток фетального мозга крыс на различных подложках, где: фиг. 1А - на полистироле, фиг. 1Б - на пектине, фиг. 1В - на матриксном (заявляемом) материале в форме гидрогеля.
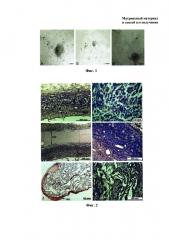
На фиг. 2. представлена морфология имплантатов на основе пектинового гидрогеля (фиг. 2А и фиг. 2Б), заявляемого матриксного материала (фиг. 2В и фиг. 2Г), коллагена (фиг. 2Д и 2Е) на препаратах-срезах через 10 дней после подкожной имплантации крысам. На фиг. 2 использованы следующие обозначения: КГ - коллагеновая губка, КМ - композиционный матриксный материал, М - макрофаги, ФК - фиброзная капсула, С - сосуды.
На фиг. 3. представлена морфология имплантатов на основе пектинового (фиг. 3А, фиг. 3Б), заявляемого матриксного материала (фиг. 3В, фиг. 3Г, фиг. 3Д, фиг. 3Е) на сроках 1 месяц после подкожной имплантации (фиг. 3А, фиг. 3В, фиг. 3Г), 3 месяца после имплантации (фиг. 3Б, фиг. 3Д, фиг. 3Е). На фиг. 3 использованы следующие обозначения: КМ - композиционный матриксный материал, М - мышцы, ФК - фиброзная капсула. Двойная стрелка на фиг. 3Б обозначает область имплантации.
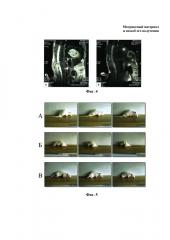
На фиг. 4. представлены изображения спинного мозга крыс на магниторезонансных томограммах через 4 дня после острой спинальной травмы и имплантации коллагеновой губки (фиг. 4А) и заявляемого матриксного материала (фиг 4Б).
На фиг. 5. представлены изображения покадровой видеосъемки различных групп экспериментальных животных в процессе движения, где: фиг 5А - из контрольной группы, фиг. 5Б - из группы «Пектиновый гель» и фиг. 5В - из группы «Матриксный материал» на 60 день после спинальной сегментэктомии.
На фиг. 6. представлен внешний вид задних конечностей крыс из контрольной группы (фиг. 6А), группы «Пектиновый гель» (фиг. 6Б) и группы «Матриксный материал» (фиг. 6В) на 60 день после сегментэктомии спинного мозга.
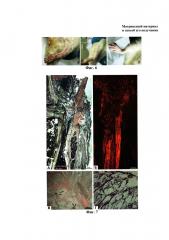
На фиг. 7. представлено гистологическое строение спинного мозга крыс из экспериментальной группы «Матриксный материал» через 3 месяца после операции. Окраска гематоксилином и эозином (фиг. 7А, фиг. 7Г); иммуногистохимическое выявление β-III-тубулина, вторичные антитела, конъюгированные с Alexa Fluor 546 (фиг. 7Б, фиг. 7В). Изображения получены методом светлого поля (фиг. 7А, фиг. 7Г), эпифлуоресцентной микроскопии (фиг. 7Б) и конфокальной лазерной сканирующей микроскопии (фиг. 7В - слитое изображение, полученное в проходящем свете и отраженном свете). Фиг. 7А - общий вид; фиг. 7Б - область, обозначенная прямоугольником на фиг. 7А; фиг. 7В - область рубца, стрелками указаны отростки нервных клеток, прорастающие в гель; фиг. 7Г - макрофаги в области рубца, где: М - макрофаги; НС - нейрональные структуры.
На фиг. 8. представлено гистологическое строение спинного мозга крыс из контрольной группы через 3 месяца после операции. Фиг. 8А - общий вид, окраска гематоксилином и эозином; фиг. 8Б, фиг. 8В - область, обозначенная прямоугольником на фиг. 8А; фиг. 8Б - иммуногистохимическое выявление β-III-тубулина (вторичные антитела, конъюгированные с Alexa 546); фиг. 8В - окраска ядер DAPI. Изображения получены методом светлого поля (фиг. 8А), эпифлуоресцентной микроскопии (фиг. 8Б, фиг. 8В). Где: НВ - нервные волокна, СК - стенка капсулы.
Для оценки биосовместимости материалов in vitro проводили культивирование нейральных стволовых клеток фетального мозга крыс с использованием в качестве матриксной подложки образцов, полученных по примеру 1. В качестве контроля клетки наносили на дно лунок планшета из полистирола или инкубировали на поверхности геля, сформированного из раствора пектина. Результаты культивирования нейральных стволовых клеток представлены на Фиг. 1. На Фиг. 1А представлен результат культивирования клеток на полистироле, где были обнаружены отдельные клетки униполярной, биполярной и триангулярной формы с короткими отростками, однако большинство клеток сохраняли сферическую форму, а значительная часть клеток формировала типичные конгломераты клеток - нейросферы. В культуре нейральных клеток на поверхности гидрогеля, сформированного из раствора пектина (Фиг. 1Б), практически не наблюдали рассеянных отростчатых клеток, вместе с тем, как и в предшествующем случае, для данного образца было отмечено формирование плотных нейросфер с редким высеванием клеток по периферии; формирование отростков и выраженных признаков дифференцировки не было отмечено для клеток, культивированных на данном материале. В культуре нейральных стволовых клеток на поверхности матриксного материала в форме гидрогеля (Фиг. 1 В) наблюдали формирование типичных нейросфер, однако характер распластывания клеток на периферии нейросфер на поверхности субстрата и морфология отростков значительно отличались от таковых контрольных культур. Так, в культуре нейральных клеток на матриксном материале наблюдали формирование длинных отростков, простирающихся на значительные расстояния от границ нейросфер. Жизнеспособность клеток во всех трех культурах достоверно не отличалась. Это доказывает, что полученный матриксный материал способен поддерживать жизнеспособные культуры клеток, не является токсичным и обеспечивает формирование длинных отростков нервных проводников.
В другом эксперименте проверяли скорость биодеградации материалов. Для этой цели из образцов, полученных по примеру 4, с помощью специального пробойника высекали диски диаметром 0,5 см, которые имплантировали подкожно крысам. В эксперименте использовали 36 белых крыс-самок линии Wistar массой около 250 г. Животных содержали в стандартных условиях вивария. Животных вводили в наркоз внутримышечным введением смеси золетила (2 мг/кг) и ксилазина (4 мг/кг). На спине выстригали шерсть и обрабатывали операционное поле раствором йода на 70% спирте. Разрезали кожу парамедиально и тупым рассечением делали карманы. В каждый карман помещали по одному имплантату. Каждому животному имплантировали 4 диска. В качестве контроля одной группе животных имплантировали диски, сформированные из пектина, а другой группе проводили имплантацию стерильной коллагеновой губки. Кожу ушивали шелком. Рану повторно обрабатывали спиртовым раствором и тетрациклином. Сразу после операции и в последующие три дня вводили подкожно профилактическую дозу антибиотика (цефтриаксон 40 мгк/г).
Животных выводили из эксперимента на сроках 10 дней, 1 месяц, 3 месяца глубоким эфирным наркозом. Извлекали имплантаты, фиксировали в 4% параформальдегиде, приготовленном на фосфатном буфере, в течение суток. Образцы отмывали фосфатным буфером и переводили в абсолютный этанол через серию водных растворов этанола. Заливали в парафин по стандартной методике. Изготавливали поперечные срезы толщиной 5 мкм. Окрашивали гематоксилином-эозином для выявления общей морфологии.
В течение всего срока эксперимента не было отмечено ухудшения состояния животных. Ни одно животное не погибло. В области имплантации не наблюдали макроскопических признаков воспаления - покраснения, отека.
Через 10 дней после имплантации были выявлены существенные различия в морфологии имплантатов из пектина и заявляемого матриксного материала. Пектиновый матрикс в значительной степени деградировал. В него проникли клетки, сформировали новую ткань, окружавшую островки еще недеградировавшего матрикса (Фиг. 2А, 2Б). Имплантат окружала капсула толщиной 99±18 мкм, состоявшая из фибробластов и синтезируемых ими коллагеновых волокон (Фиг. 2А). В этом слое фибробластов выявлялись многочисленные сосуды. Они являлись источником макрофагов, заселявших имплантат (Фиг. 2Б).
Разработанный матриксный материал деградировал в гораздо меньшей степени через 10 дней после имплантации (Фиг. 2В). В области имплантации сохранялась значительная часть имплантированного материала. Отчетливо выделялась центральная часть имплантата, не заселенная клетками. На периферии происходила активная инфильтрация имплантата клетками, в первую очередь фибробластами. Клетки заселяли имплантат не хаотично, а проникали в него друг за другом, образуя цепочки клеток, параллельные краю имплантата. Имплантат окружала рыхлая фиброзная капсула толщиной 104±10 мкм. Наблюдалась активная васкуляризация не только соединительной ткани, окружающей имплантат, но и самого матрикса (Фиг. 2Г). Через 10 дней после имплантации наблюдали процесс инфильтрации коллагенового имплантата нейтрофилами, макрофагами и фибробластами. При этом этот процесс шел неравномерно. В одних случаях (28%) в раннем периоде после имплантации коллагеновый имплантат был обильно инфильтрован клетками (фиг. 2Д), в других случаях (72%) не наблюдали значительной инфильтрации материала клетками, фрагмент коллагенового имплантата был окружен плотной фиброзной капсулой толщиной 48±12 мкм (фиг. 2Е). Через 1 месяц фрагменты коллагенового имплантата уже не выявлялись в области имплантации.
В области имплантации пектинового и разработанного матриксного материала клетки, ответственные за воспалительную реакцию, были немногочисленны. Выявлялись единичные лимфоциты, нейтрофилы не выявлялись. Очевидно, воспалительная реакция на собственно процесс имплантации к этому сроку уже завершилась. Имплантированные матриксы являлись иммуногически инертными и не вызывали существенной воспалительной реакции.
Через 1 месяц после имплантации пектиновый матрикс был в значительной степени резорбирован и замещен собственными тканями реципиента. На данном сроке наблюдали преобразование ткани, сформированной в области имплантации. Ткань приобретала сетчатый вид (Фиг. ЗА). Ячейки этой сетки местами сливались в полости, выстланные веретеновидными узкими клетками - фиброцитами. Внутри полостей присутствовали отростчатые клетки со слабоокрашенной цитоплазмой, округлым или овальным ядром - фибробласты. Фиброзная капсула уменьшилась, ее толщина составляла 32±12 мкм. Через 3 месяца ремоделированная зона имплантации уменьшилась в размере, при этом сохраняла ту же морфологию, что и на сроке 1 месяц (Фиг. 3Б). Фиброзная капсула, окружающая имплантат, полностью исчезла.
В разработанном матриксе через 1 месяц после имплантации количество клеток увеличилось, они равномерно заселили матрикс (Фиг. 3В, 3Г). Матриксный материал медленно деградировал, через 3 месяца его количество в области имплантации сократилось, но все еще оставалось существенным. Фибробласты, заселившие матрикс, ремоделировали имплантированный материал, изменяя его морфологию, в результате чего ткань, сформированная на месте имплантата, начала приобретать сетчатый вид (Фиг. 3Д). На фиг. 3Е представлена морфология области имплантации через 3 месяца на большем увеличении, на которой хорошо различимы фрагменты матриксного материала, окруженные клетками. Фиброзная капсула, окружавшая имплантат, уменьшилась. Ее толщина составляла 47±22 мкм.
Коллагеновая губка, имплантированная подкожно, была резорбирована в течение 2-4 недель. Через 1 месяц фрагменты коллагеновой губки уже не выявлялись в области имплантации. Через 10 дней после имплантации наблюдали процесс инфильтрации коллагеновой губки нейтрофилами, макрофагами и фибробластами. При этом этот процесс шел неравномерно. В одних случаях (28%) в раннем периоде после имплантации (10 дней) губка была обильно инфильтрована клетками (Фиг. 2В), в других случаях (72%) практически не наблюдали инфильтрации материала клетками, а фрагмент коллагеновой губки был окружен плотной фиброзной капсулой толщиной 48±12 мкм (Фиг. 2Д).
Из представленных результатов следует, что заявляемый матриксный материал, получаемый разработанными способами, обладает низкой скоростью биодеградации в организме млекопитающих, является биосовместимым и не токсичным in vivo.
Для итоговой оценки работоспособности заявляемых изобретений был проведен эксперимент, в ходе которого образцы матриксного материала, полученные по примеру 1, имплантировали в область травматического повреждения спинного мозга крыс. В качестве контроля одной группе животных имплантировали материал, сформированный из пектина, а другой группе проводили имплантацию стерильной коллагеновой губки.
Модель острой травмы спинного мозга создавали путем удаления фрагмента спинного мозга длинной 2 мм на уровне 12 грудного - 1 поясничного позвонка, согласно работам