Состав с отсроченным высвобождением для уменьшения частоты мочеиспускания и способ его применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к урологии, и может быть использована для уменьшения частоты мочеиспускания. Для этого вводят эффективное количество фармацевтической композиции, содержащей ацетаминофен в дневной дозировке от 1 мг до 2000 мг, либо ацетаминофен в дневной дозировке от 50 мг до 2000 мг и один или несколько антимускариновых агентов, либо ацетаминофен и один или несколько антидиуретиков, причем фармацевтическая композиция может иметь различное время высвобождения. Это обеспечивает эффективное подавление сокращений гладкой мускулатуры мочевого пузыря. 3 н. и 22 з.п. ф-лы, 2 ил., 9 табл., 8 пр.
Реферат
Настоящая заявка претендует на приоритет заявки на патент США с порядковым номером 13/487 343, поданной 4 июня 2012, заявки на патент США с порядковым номером 13/423 949, поданной 19 марта 2012, и заявки на патент США с порядковым номером 13/343 349, поданной 4 января 2012.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка относится, главным образом, к способам и композициям для подавления сокращения мышц и, в частности, к способам и композициям для подавления сокращений гладкой мускулатуры мочевого пузыря.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сократительная мышца (детрузор) представляет собой слой стенки мочевого пузыря, состоящий из гладких мышечных волокон, организованных в спиральные, продольные и круговые пучки. Растяжение мочевого пузыря дает парасимпатической нервной системе сигнал на сокращение детрузора. Это стимулирует мочевой пузырь вытолкнуть мочу через мочеиспускательный канал.
Для выхода мочи из мочевого пузыря как внутренний сфинктер, управляемый вегетативной нервной системой, так и внешний сфинктер, управляемый сознанием человека, должны находиться в открытом состоянии. Проблемы с этими мышцами могут приводить к недержанию мочи. Если количество мочи достигает 100% абсолютной емкости мочевого пузыря, внешний сфинктер перестает управляться сознанием человека и моча немедленно выбрасывается из мочевого пузыря.
В мочевом пузыре взрослого человека обычно удерживается примерно 300-350 мл мочи (рабочий объем), но полностью заполненный мочевой пузырь взрослого человека может вмещать примерно до 1000 мл (абсолютный объем), причем этот объем неодинаков у разных людей. По мере накопления мочи, морщины, образующиеся при сжатии стенки мочевого пузыря (складки), разглаживаются, и стенка мочевого пузыря утончается и растягивается, позволяя мочевому пузырю удерживать большее количество мочи без значительного повышения внутреннего давления.
Большинство индивидуумов обычно начинает ощущать позывы к мочеиспусканию, когда объем мочи в мочевом пузыре достигает примерно 200 мл. На этом этапе субъект при желании может легко воздерживаться от мочеиспускания. Если мочевой пузырь продолжает наполняться, желание осуществить мочеиспускание становится сильнее и его становится труднее игнорировать. В конце концов мочевой пузырь наполнится до такой степени, что потребность в мочеиспускании становится непреодолимой, и субъект не сможет больше игнорировать его. У некоторых индивидуумов, эта настоятельная потребность осуществить мочеиспускание возникает, когда мочевой пузырь заполнен менее чем на 100% от своего рабочего объема. Такие усиленные позывы к мочеиспусканию могут мешать нормальной деятельности человека, включая способность непрерывно спать в течение продолжительных периодов времени, достаточных для отдыха. В некоторых случаях упомянутые усиленные позывы к мочеиспусканию могут быть связаны с медицинскими состояниями, такими как доброкачественная гиперплазия простаты или рак простаты у мужчин, или беременность у женщин. Однако усиленные позывы к мочеиспусканию возникают также у индивидуумов, как мужского, так и женского пола, у которых отсутствуют другие медицинские состояния.
Соответственно, существует потребность в композициях и способах лечения мужчин и женщин, страдающих позывами к мочеиспусканию, когда мочевой пузырь заполнен мочой менее чем на 100% своего рабочего объема. Указанные композиции и способы необходимы для подавления мышечных сокращений, чтобы позывы к мочеиспусканию возникали, когда объем мочи в мочевом пузыре превышал примерно 100% его рабочего объема.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Один из аспектов настоящей заявки относится к способу уменьшения частоты мочеиспускания. В одном из вариантов осуществления, этот способ включает введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, включающей первый обезболивающий агент, выбранный из группы, состоящей из аспирина, ибупрофена, напроксена натрия и ацетаминофена, где эта фармацевтическая композиция представляет собой состав с отсроченным высвобождением, и где указанный первый обезболивающий агент вводят перорально в дневной дозировке от 5 мг до 2000 мг.
В другом варианте осуществления, способ по настоящему изобретению включает введение субъекту, которому это необходимо, эффективного количества фармацевтической композиции, включающей несколько действующих ингредиентов, где в число этих действующих ингредиентов входят: (1) один или несколько обезболивающих агентов и/или (2) один или несколько антимускариновых агентов, и где упомянутые один или несколько обезболивающих агентов вводят перорально в общей дневной дозировке от 5 мг до 2000 мг. В некоторых вариантах осуществления упомянутые один или несколько обезболивающих агентов выбраны из группы, состоящей из аспирина, ибупрофена, напроксена натрия и ацетаминофена. Примеры антимускариновых агентов включают, не ограничиваясь этим, оксибутинин, солифенацин, дарифенацин, фесотеродин, толтеродин, троспиум и атропин.
Еще один аспект настоящей заявки относится к фармацевтической композиции, включающей: один или несколько обезболивающих агентов, выбранных из группы, состоящей из аспирина, ибупрофена, напроксена и ацетаминофена; одного или нескольких антидиуретиков; а также фармацевтически приемлемого носителя, где указанная композиция обеспечивает отсроченное высвобождение как минимум одного из указанных одного или нескольких обезболивающих агентов.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
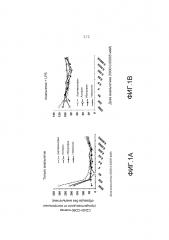
Фиг. 1A и Фиг. 1B представляют собой диаграммы, показывающие, что обезболивающие средства регулируют экспрессию костимулирующих молекул макрофагами Raw 264 в отсутствии (Фиг. 1A) или в присутствии (Фиг. 1B) LPS. Клетки культивировали в течение 24 часов в присутствии только анальгетика или анальгетика совместно с LPS, вырабатываемым Salmonella typhyiurium (0,05 мкг/мл). Результаты выражены в средних процентных долях CD40+CD80+клетки.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Помещенное ниже подробное описание изобретения приведено для того, чтобы дать возможность каждому специалисту в данной области техники воспроизвести и применить настоящее изобретение. С целью объяснения дана конкретная номенклатура препаратов, чтобы обеспечить полное понимание настоящего изобретения. Однако специалисту в данной области техники должно быть ясно, что эти конкретные подробности не являются необходимыми для практической реализации изобретения. Описание конкретных вариантов осуществления приведено только в качестве типовых примеров. Предполагается, что настоящее изобретение не ограничено показанными вариантами осуществления, но должно соответствовать наиболее широкой возможной области, согласующейся с принципами и элементами, раскрытыми в настоящей заявке.
В настоящей заявке термин «эффективное количество» означает количество, необходимое для достижения намеченного результата.
В настоящем описании термины «обезболивающий», «обезболивающий агент» или «анальгетик» относятся к агентам, соединениям или препаратам, применяемым для облегчения боли, и включает противовоспалительные соединения. Примеры обезболивающих и/или противовоспалительных агентов, соединений или препаратов включают, не ограничиваясь этим, следующие вещества: нестероидные противовоспалительные средства (NSAIDs), салицилаты, аспирин, салициловую кислоту, метилсалицилат, дифлунизал, салсалат, олсалазин, сульфасалазин, производные пара-аминофенола, ацетанилид, ацетаминофен, фенацетин, фенаматы, мефенамовую кислоту, меклофенамат, меклофенамат натрия, производные гетероарилуксусной кислоты, толметин, кеторолак, диклофенак, производные пропионовой кислоты, ибупрофен, напроксен натрия, напроксен, фенопрофен, кетопрофен, флурбипрофен, оксапрозин; еноловые кислоты, производные оксикама, пироксикам, мелоксикам, теноксикам, ампироксикам, дроксикам, пивоксикам, производные пиразолона, фенилбутазон, оксифенбутазон, антипирин, аминопирин, дипирон, коксибы, целекоксиб, рофекоксиб, набуметон, апазон, индометацин, сулиндак, этодолак, изобутилфенил пропионовую кислоту, люмиракоксиб, эторикоксиб, парекоксиб, вальдекоксиб, тиракоксиб, этодолак, дарбуфелон, декскетопрофен, ацеклофенак, ликофелон, бромфенак, пранопрофен, локсопрофен, пироксикам, нимесулид, цизолирин, 3-формиламино-7-метилсульфониламино-6-фенокси-4H-1-бензопиран-4-он, мелоксикам, лорноксикам, d-индобуфен, мофезолак, амтолметин, пранопрофен, толфенамовую кислоту, флурбипрофен, супрофен, оксапрозин, залтопрофен, алминопрофен, тиапрофеновую кислоту, их фармакологически приемлемые соли, гидраты и сольваты.
В настоящей заявке термины «коксиб» и «ингибитор COX» относятся к композиции соединений, которые способны ингибировать активность или экспрессию ферментов COX2, или способны подавлять или уменьшать тяжесть сильной воспалительной реакции, включая боль и опухание.
Мочевой пузырь имеет две важных функции: хранение мочи и опорожнение. Хранение мочи происходит при низком давлении, т.е. детрузор во время фазы заполнения расслаблен. Опорожнение мочевого пузыря требует координированного сокращения детрузора и расслабления сфинктеров мочевыводящих путей. Нарушение функции хранения может приводить к симптомам нижних мочевыводящих путей, например, неотложным позывам к мочеиспусканию, учащенному мочеиспусканию и острому недержанию, т.е. компонентам синдрома гиперактивности мочевого пузыря. Синдром гиперактивного мочевого пузыря, который может возникать из-за неуправляемых сокращений гладкой мускулатуры мочевого пузыря (детрузора) во время фазы хранения мочи, является часто встречающейся и плохо освещенной проблемой, распространенность которой оценили только в последнее время.
Один из аспектов настоящей заявки относится к способу уменьшения частоты мочеиспускания путем введения человеку, которому это необходимо, фармацевтической композиции, представляющей собой состав с отсроченным высвобождением. Эта фармацевтическая композиция включает один или несколько обезболивающих агентов и, необязательно, один или несколько антимускариновых агентов.
В настоящей заявке термин «отсроченное высвобождение» относится к лекарственным средствам, для которых нехарактерно немедленное разрушение и высвобождение действующего ингредиента (ингредиентов) в организм. В некоторых вариантах осуществления, термин «отсроченное высвобождение» используется в отношении лекарственных составов, имеющих профиль высвобождения, характеризующийся заранее определенной задержкой высвобождения лекарственного средства после введения. В некоторых вариантах осуществления составы с отсроченным высвобождением включают кишечнорастворимое покрытие, которое представляет собой барьер, нанесенный на пероральный лекарственный препарат, который препятствует высвобождению лекарственного средства, до того, как препарат достигнет тонкого кишечника. Составы с отсроченным высвобождением, например, с кишечнорастворимым покрытием, препятствуют растворению в желудке препаратов, оказывающих раздражающее действие на желудок, например, аспирина. Такие покрытия применяются также для защиты действующих веществ, нестабильных в присутствии кислот, от действия кислоты в желудке, вместо этого доставляя их в среду с основными значениями pH (значения pH в кишечнике составляют 5,5 и более), где активные вещества не разрушаются и оказывают желаемое действие.
Термин «пульсирующее высвобождение» описывает один из вариантов отсроченного высвобождения и используется в настоящей заявке в отношении лекарственных составов, которые обеспечивают быстрое импульсное высвобождение лекарственного средства в течение короткого периода времени сразу же после заранее установленного периода задержки, что обеспечивает «пульсирующий» профиль действующего вещества в плазме после введения лекарственного средства. Составам можно придавать такие свойства, чтобы они обеспечивали высвобождение в форме одного импульса или ряда импульсов через установленные промежутки времени после введения.
Большинство кишечнорастворимых покрытий действуют за счет того, что они образуют поверхность, которая является стабильной при сильно кислых значениях pH, имеющихся в желудке, но быстро разрушается при менее кислых (относительно более основных) значениях pH. Поэтому препараты с кишечнорастворимым покрытием не будут растворяться в кислом желудочном соке (pH~3), но растворение произойдет в щелочной (pH 7-9) среде тонкого кишечника. Примеры материалов для кишечнорастворимого покрытия включают, не ограничиваясь этим, сополимеры метилакрилат-метакриловая кислота, ацетат сукцинат целлюлозы, фталат гидроксипропил метил целлюлозы, ацетат сукцинат гидроксипропил метил целлюлозы (ацетат сукцинат гипромеллозы), поливинил ацетат фталат (PVAP), сополимеры метил метакрилат-метакриловая кислота, альгинат натрия и стеариновую кислоту.
В некоторых вариантах осуществления фармацевтическую композицию по настоящему изобретению вводят перорально в форме нескольких лекарственных составов, предназначенных для обеспечения отсроченного высвобождения. Пероральные дозированные формы с отсроченным высвобождением включают, например, таблетки, капсулы, каплеты (капсуловидные таблетки) и могут также включать большое число гранул, шариков, порошков или пеллет, которые могут быть или не быть заключены в капсулы. Таблетки и капсулы представляют собой наиболее традиционные пероральные дозированные формы, и в них применяются твердые фармацевтические носители.
В составах с отсроченным высвобождением на гранулы, таблетки или капсулы может быть нанесено барьерное покрытие, которое способствует задержке растворения и сопутствующего высвобождения лекарственного средства в кишечник. Как правило, барьерное покрытие содержит один или несколько полимеров, которые заключают в корпус, окружают или формируют слой или защитную пленку вокруг терапевтической композиции или активного ядра.
В некоторых вариантах осуществления, действующие агенты поступают в организм в составе, который обеспечивает отсроченное высвобождение в заранее определенный момент времени после введения. Задержка высвобождения может составлять до примерно 10 минут, примерно 20 минут, примерно 30 минут, примерно 1 часа, примерно 2 часов, примерно 3 часов, примерно 4 часов, примерно 5 часов, примерно 6 часов или более.
Композиция с отсроченным высвобождением может включать 100% общей дозы данного действующего агента, вводимого в одной единице дозированной лекарственной формы. В качестве альтернативы, композиция с отсроченным высвобождением может быть включена в качестве компонента в состав с комбинированным профилем высвобождения и может обеспечивать примерно 30-95% общей дозировки действующего агента (агентов), которые предполагается доставить с помощью данной фармацевтической композиции. Например, компонент с немедленным высвобождением может обеспечивать примерно 5-70% или примерно 50% от общей дозы действующего агента (агентов), которые предполагается доставить с помощью данного фармацевтического состава. В альтернативных вариантах осуществления, компонент с отсроченным высвобождением обеспечивает примерно 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90 или 95% от общей дозы действующего агента (агентов), которые предполагается доставить с помощью данного состава.
Состав с отсроченным высвобождением обычно включает барьерное покрытие, которое задерживает высвобождение действующего ингредиента (ингредиентов). Барьерное покрытие может состоять из целого ряда различных материалов, в зависимости от цели, с которой оно применяется. Кроме того, состав может включать несколько барьерных покрытий, которые способствуют достижению необходимого профиля высвобождения. Покрытия могут представлять собой покрытия из сахара, пленочные покрытия (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, акриловых сополимеров, полиэтиленгликолей и/или поливинилпирролидона) или покрытия на основе сополимера метакриловой кислоты, ацетатфталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетатсукцината гидроксипропилметилцеллюлозы, поливинилацетата фталата, шеллака и/или этилцеллюлозы. Кроме того, состав может дополнительно включать материал, вызывающий задержку во времени, например, глицерилмоностеарат или глицерилдистеарат.
В некоторых вариантах осуществления, состав с отсроченным высвобождением включает кишечнорастворимое покрытие, которое состоит из одного или нескольких полимеров, способствующих высвобождению действующих агентов в ближних или удаленных участках желудочно-кишечного тракта. В настоящей заявке, термин «кишечнорастворимое полимерное покрытие» означает покрытие, включающее один или несколько полимеров, и имеющее pH-зависимый или pH-независимый профиль высвобождения. Как правило, такое покрытие устойчиво к растворению в кислой среде желудка, но растворяется или разрушается в последующих участках желудочно-кишечного тракта, например, тонком кишечнике или ободочной кишке. Кишечнорастворимое полимерное покрытие, как правило, препятствует высвобождению действующих агентов, пока не пройдет определенное время, после выхода лекарственного препарата из желудка, т.е. обеспечивает задержку высвобождения примерно в 3-4 часа после введения.
pH-зависимые кишечнорастворимые покрытия, включающие один или несколько pH-зависимых или pH-чувствительных полимеров, которые поддерживают их структурную целостность при низких значениях pH, например, в желудке, но растворяются в среде с высоким значением pH в последующих областях желудочно-кишечного тракта, например, в тонком кишечнике, где высвобождается лекарственное содержимое. Для целей настоящего изобретения, термин «pH-зависимый» определяется, как имеющий характеристики (например, растворимость), которые меняются в зависимости от значения pH окружающей среды. Типовые примеры pH-зависимых полимеров включают, не ограничиваясь этим, сополимеры метакриловой кислоты, сополимеры метакриловая кислота-метилметакрилат (например, EUDRAGIT® L100 (тип A), EUDRAGIT® S100 (тип B), Rohm GmbH, Germany); сополимеры метакриловая кислота-этилакрилат (например, EUDRAGIT® L100-55 (тип C) и дисперсия сополимера EUDRAGIT® L30D-55, Rohm GmbH, Germany); сополимеры метакриловая кислота-метилметакрилат и метилметакрилат (EUDRAGIT® FS); терполимеры метакриловой кислоты, метакрилата и этилакрилата; ацетатфталаты целлюлозы (CAP); фталат гидроксипропилметилцеллюлозы (HPMCP) (например, HP-55, HP-50, HP-55S, Shinetsu Chemical, Japan); поливинилацетатфталаты (PVAP) (например, COATERIC®, OPADRY® кишечный белый OY-P-7171); ацетатсукцинаты целлюлозы (CAS); ацетатсукцинат гидроксипропилметилцеллюлозы (HPMCAS), например, HPMCAS LF Grade, MF Grade, HF Grade, в т.ч. AQOAT® LF и AQOAT® MF (Shin-etsu Chemical, Japan); шеллак (например, MarcoatTM 125 и MarcoatTM 125N); карбоксиметилэтилцеллюлозу (CMEC, Freund Corporation, Japan), ацетатфталаты целлюлозы (CAP) (например, AQUATERIC®); ацетаттримеллитаты целлюлозы (CAT); а также смеси двух или нескольких перечисленных полимеров в массовых соотношениях от примерно 2:1 до примерно 5:1, например, смесь EUDRAGIT® L100-55 и EUDRAGIT® S100 в массовом отношении от примерно 3:1 до примерно 2:1, или смесь EUDRAGIT® L30D-55 и EUDRAGIT® FS в массовом отношении от примерно 3:1 до примерно 5:1.
pH-зависимые полимеры, как правило, демонстрируют характеристическое значение pH, которое является оптимальным для растворения. В некоторых вариантах осуществления pH-зависимые полимеры демонстрируют оптимальное значение pH примерно от 5,0 до 5,5, примерно от 5,5 до 6, примерно от 6,0 до 6,5 или примерно от 6,5 до 7,0. В других вариантах осуществления, pH-зависимый полимер демонстрирует оптимальное значение pH≥5,0, ≥5,5, ≥6,0, ≥6,5 или ≥7,0.
В других вариантах осуществления кишечнорастворимое покрытие может включать один или несколько pH-независимых полимеров. Эти полимеры могут обеспечить высвобождение лекарственного вещества через определенный период времени, независимо от значения pH. Для целей настоящего изобретения, «pH-независимый» определяется как имеющий характеристики (например, растворимость), на которые практически не влияет значение pH. Профили высвобождения pH-независимых полимеров часто именуют «управляемыми временем» или «зависимыми от времени».
pH-независимый полимер может быть нерастворимым или растворимым в воде. Типовые примеры нерастворимых в воде полимеров включают, не ограничиваясь этим, нейтральные эфиры метакриловой кислоты с небольшими фрагментами триметиламмонийэтилметакрилат хлорида (например, EUDRAGIT® RS и EUDRAGIT® RL); нейтральные дисперсии сложных эфиров без каких-либо функциональных групп (например, EUDRAGIT® NE30D и EUDRAGIT® NE30); полимеры целлюлоз, например, этилцеллюлозы, гидроксиэтил целлюлозы, ацетата целлюлозы или их смеси, а также другие продукты, образующие pH-независимое покрытие. Типовые примеры растворимых в воде pH-независимых полимеров включают OPADRY® amb.
В некоторых вариантах осуществления, pH-независимые полимеры содержат один или несколько полисахаридов, которые устойчивы к разрушению как в желудке, так и в тонком кишечнике. Такие полимеры могут разрушаться только в ободочной кишке, которая содержит большое количество микрофлоры, вырабатывающей ферменты, которые способны разрушать такое полисахаридное покрытие, высвобождая лекарственное содержимое регулируемым и зависимым от времени образом.
В некоторых вариантах осуществления методика получения покрытий включает смешивание одного или нескольких pH-зависимых и одного или нескольких pH-независимых полимеров. Смешивание pH-зависимых и pH-независимых полимеров может уменьшить скорость высвобождения действующих ингредиентов, когда достигается оптимальное значение pH для растворения растворимого полимера.
В некоторых вариантах осуществления, «управляемый временем» или «зависимый от времени» профиль высвобождения можно получить с применением нерастворимого в воде корпуса капсулы, содержащей один или несколько действующих агентов, где этот корпус капсулы закрыт с одного из концов нерастворимой, но проницаемой и способной к набуханию пробкой из гидрогеля. При контакте с жидкой средой желудочно-кишечного тракта или растворяющей средой пробка набухает, самопроизвольно выталкивается из капсулы и высвобождает лекарственное средство по прошествии заранее установленного времени задержки, которое можно регулировать, например, положением и размером пробки. Капсульный корпус может быть дополнительно покрыт внешним pH-зависимым кишечнорастворимым покрытием, предохраняющим капсулу от контакта с внешней средой, пока она не достигнет тонкого кишечника. Подходящие материалы пробки включают, например, полиметакрилаты, разрушаемые прессованные полимеры (например, HPMC, поливиниловый спирт), застывшие расплавы полимеров (например, глицерилмоноолеата) и полимеры, способные разрушаться под действием ферментов (например, полисахариды, такие как амилоза, арабиногалактан, хитозан, хондроитина сульфат, циклодекстрин, декстран, гуаровая камедь, пектин и ксилан).
В других вариантах осуществления можно разработать капсулы или двухслойные таблетки, которые включают ядро, содержащее лекарственное вещество, покрытое разбухающим слоем, и внешнее нерастворимое, но полупроницаемое полимерное покрытие или мембрану. Время задержки до разрушения можно регулировать за счет изменения проницания и механических свойств полимерного покрытия и характеристик набухания набухающего слоя. Как правило, набухающий слой включает один или несколько компонентов, способных к набуханию, например, набухающих гидрофильных полимеров, которые набухают и удерживают воду в своей структуре.
Типовые примеры материалов, способных набухать в воде, включают, не ограничиваясь этим, полиэтиленоксид (например, имеющий среднюю молекулярную массу от 1 000 000 до 7 000 000, например, POLYOX®), метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу; полиалкиленоксиды со среднемассовой молекулярной массой от 100000 до 6 000000, включая, но не ограничиваясь этим, поли(метиленоксид), поли(бутиленоксид); поли(гидроксиалкилметакрилат) со средней молекулярной массой от 25000 до 5 000000; поли(виниловый спирт) с низким содержанием ацетальных остатков, который сшит глиоксалем, формальдегидом или глутаровым альдегидом и имеет степень полимеризации от 200 до 30000; смеси метилцеллюлозы, поперечно-сшитого агара и карбоксиметилцеллюлозы; сополимеры, образующие гидрогели, полученные путем формирования дисперсии тонкоизмельченного сополимера малеинового ангидрида со стиролом, этиленом, пропиленом, бутиленом или изобутиленом, поперечно-сшитого с использованием 0,001-0,5 молей насыщенного сшивающего реагента на моль малеинового ангидрида в упомянутом сополимере; CARBOPOL®, т.е. кислые карбоксиполимеры с молекулярной массой от 450000 до 4 000000; полиакриламиды CYANAMER®; поперечно-сшитые, набухающие в воде полимеры инден-малеиновый ангидрид; GOODRITE®, т.е. полиакриловые кислоты с молекулярной массой от 80000 до 200000; привитые сополимеры крахмала; AQUA-KEEPS®, т.е. полимеры акрилатов и полисахаридов, состоящие из конденсированных фрагментов глюкозы, например, диэфирные поперечно-сшитые полиглюканы; карбомеры, имеющие вязкость от 3000 до 60000 мПа в форме 0,5%-1% масса/объем водных растворов; простые эфиры целлюлозы, например, гидроксипропилцеллюлозу, имеющую вязкость примерно 1000-7000 мПа в форме 1% масса/масса водного раствора (25°C); гидроксипропил метилцеллюлозу, имеющую вязкость примерно 1000 или более, предпочтительно 2500 или более, максимум до 25 000 мПа в форме 2% масса/объем водного раствора; поливинилпирролидон, имеющий вязкость примерно 300-700 мПа в виде 10% масса/объем водного раствора при 20°C; а также их комбинации.
Кишечнорастворимый слой может дополнительно включать средство против прилипания, например, тальк или глицерилмоностеарат. Кроме того, кишечнорастворимый слой может включать один или несколько пластификаторов, в т.ч., но не ограничиваясь этим, триэтилцитрат, ацетилтриэтилцитрат, ацетилтрибутилцитрат, полиэтиленгликольацетилированные моноглицериды, глицерин, триацетин, пропиленгликоль, эфиры фталевой кислоты (например, диэтилфталат, дибутилфталат), диоксид титана, оксид железа (III), касторовое масло, сорбитол и дибутилсебацинат.
В другом варианте осуществления, в составах с замедленным высвобождением применяются проницаемые для воды, но нерастворимые пленочные покрытия, которые окружают действующий ингредиент и в которых применяется осмотический агент. Вода из пищеварительного тракта медленно проникает через пленку в ядро, ядро набухает, пока не разрывается пленка, что приводит к высвобождению действующих ингредиентов. Свойства пленочного покрытия можно регулировать для обеспечения различной скорости проникания воды или времени высвобождения.
В качестве альтернативы, время высвобождения лекарственного средства можно регулировать за счет времени задержки до разрушения лекарственной формы, зависящего от баланса между устойчивостью и толщиной нерастворимой в воде полимерной мембраны (например, из этилцеллюлозы, EC), на дне которой содержатся заранее определенные микропоры, и количеством набухающего эксципиента, например, гидроксипропилцеллюлозы с низкой степенью замещения (L-HPC) и гликолята натрия. После перорального приема, жидкость из желудочно-кишечного тракта проникает через микропоры, вызывая набухание соответствующих эксципиентов, что порождает внутреннее давление, высвобождающее компоненты капсулы, включая первый корпус капсулы, содержащий набухающие материалы, второй корпус капсулы, содержащий лекарственное вещество, и внешнее покрытие, соединенное с первым корпусом капсулы.
В других вариантах осуществления лекарственные средства могут высвобождаться при действии осмотических механизмов. В качестве примера, капсула может содержать одну осмотическую ячейку или 2, 3, 4, 5 или 6 пушпульных осмотических ячеек, заключенных в капсулу из твердого желатина, где каждая из двухслойных пушпульных ячеек содержит слой, развивающий осмотическое давление, и слой лекарственного вещества, причем оба слоя окружены полупроницаемой мембраной. В этой мембране просверлены одно или несколько отверстий, ведущих в слой лекарственного вещества. Мембрана может быть дополнительно покрыта pH-зависимым кишечнорастворимым покрытием, которое препятствует высвобождению до выхода лекарственной формы из желудка. Желатиновая капсула растворяется сразу же после приема внутрь. Как только осмотическая ячейка (ячейки) попадает в тонкий кишечник, кишечнорастворимое покрытие разрушается, что позволяет жидкости проходить через полупроницаемую мембрану и вызывать набухание осмотического отсека, который оказывает давление на лекарство и заставляет лекарственное средство выходить через отверстие (отверстия) со скоростью, точно управляемой скоростью прохождения воды через полупроницаемую мембрану. Высвобождение лекарственного средства может осуществляться с постоянной скоростью в течение периода времени до 24 часов или более.
Слой, развивающий осмотическое давление, включает один или несколько осмотических агентов, создающих движущую силу для перемещения воды через полупроницаемую мембрану в ядро средства доставки. Один из классов осмотических агентов включает набухающие в воде гидрофильные полимеры, именуемые также «осмополимерами» и «гидрогелями», в число которых входят, не ограничиваясь перечисленным, гидрофильные виниловые и акриловые полимеры, полисахариды, например, альгинат кальция, полиэтиленоксид (PEO), полиэтиленгликоль (PEG), полипропиленгликоль (PPG), поли(2-гидроксиэтил метакрилат), поли(акриловая) кислота, поли(метакриловая) кислота, поливинилпирролидон (PVP), поперечно-сшитый PVP, поливиниловый спирт (PVA), сополимеры PVA/PVP, сополимеры PVA/PVP с гидрофильными мономерами, например, метилметакрилатом и винилацетатом, гидрофильные полиуретаны, включающие крупные блоки PEO, натрий кросскармелоза, каррагинан, гидроксиэтилцеллюлоза (HEC), гидроксипропилцеллюлоза (HPC), гидроксипропил метил целлюлоза (HPMC), карбоксиметилцеллюлоза (CMC) и карбоксиэтил целлюлоза (CEC), альгинат натрия, поликарбофил, желатин, ксантановая камедь и натрий крахмал гликолят.
Другой класс осмотических агентов включает осмогены, которые способны впитывать воду, создавая градиент осмотического давления через полупроницаемую мембрану. Типовые примеры осмогенов включают, не ограничиваясь этим, неорганические соли, например, сульфат магния, хлорид магния, хлорид кальция, хлорид натрия, хлорид лития, сульфат калия, фосфат калия, карбонат натрия, сульфит натрия, сульфат лития, хлорид калия и сульфат натрия; сахара, например, декстрозу, фруктозу, глюкозу, инозит, лактозу, мальтозу, маннит, раффинозу, сорбит, сахарозу, трегалозу и ксилит; органические кислоты, например, аскорбиновую кислоту, бензойную кислоту, фумаровую кислоту, лимонную кислоту, малеиновую кислоту, себациновую кислоту, сорбиновую кислоту, адипиновую кислоту, этилендиаминтетрауксусную кислоту, глутаминовую кислоту, п-толуолсульфоновую кислоту, янтарную кислоту и винную кислоту; мочевину; а также их смеси.
Материалы, подходящие для формирования полупроницаемой мембраны, включают различные разновидности акриловых полимеров, виниловых полимеров, эфирных полимеров, полиамидов, поли(сложных эфиров) и производных целлюлозы, которые проницаемы для воды и нерастворимы в воде при физиологически разумных значениях pH, или, которые можно сделать нерастворимыми в воде с помощью химических превращений, например, сшивания.
В другом варианте осуществления, в составе с отсроченным высвобождением применяется непроницаемое для воды покрытие таблетки, за счет которого вода проникает через регулируемое отверстие в покрытии, до тех пор, пока ядро не разрушится. Когда таблетка разрушается, содержащееся в ней лекарственное вещество высвобождается немедленно или в течение продолжительного периода времени. Эту и другие методики можно модифицировать, чтобы получить заранее определенный период задержки до начала высвобождения лекарственного вещества.
Могут применяться различные методики нанесения покрытия на гранулы, шарики, порошки или пеллеты, таблетки, капсулы или их комбинации, содержащие действующие агенты, с целью получения ряда различных профилей высвобождения. В некоторых вариантах осуществления, фармацевтическая композиция имеет форму таблетки или капсулы, содержащей единственный слой покрытия. В других вариантах осуществления, фармацевтическая композиция имеет форму таблетки или капсулы, содержащей несколько слоев покрытия.
В некоторых вариантах осуществления, фармацевтическая композиция по настоящему изобретению включает несколько действующих ингредиентов, выбранных из группы, состоящей из анальгетиков, антимускариновых агентов, антидиуретиков и спазмолитиков. Примеры спазмолитиков включают, не ограничиваясь перечисленными, карисопродол, бензодиазепины, баклофен, циклобензаприн, метаксалон, метокарбамол, клонидин, аналоги клонидина и дантролен. В некоторых вариантах осуществления, фармацевтическая композиция включает один или несколько анальгетиков. В других вариантах осуществления, фармацевтическая композиция включает (1) один или несколько анальгетиков и (2) один или несколько других действующих ингредиентов, выбранных из группы, состоящей из антимускариновых агентов, антидиуретиков и спазмолитиков. В другом варианте осуществления, фармацевтическая композиция включает (1) один или два анальгетика и (2) один или два антимускариновых агента. В другом варианте осуществления, фармацевтическая композиция включает (1) один или два анальгетика и (2) один или два антидиуретика. В следующем варианте осуществления, фармацевтическая композиция включает (1) один или два анальгетика и (2) один или два спазмолитика. В еще одном варианте осуществления фармацевтическая композиция включает (1) один или два аналгетика, (2) один или два антимускариновых агента и (3) один или два антидиуретика.
В одном из вариантов осуществления предусмотрено немедленное высвобождение нескольких действующих ингредиентов. В другом варианте осуществления предусмотрено отсроченное высвобождение нескольких действующих ингредиентов. В следующем варианте осуществления предусмотрено как немедленное, так и отсроченное высвобождение нескольких действующих ингредиентов (например, первая часть каждого действующего ингредиента предназначена для немедленного высвобождения, и вторая часть каждого действующего ингредиента предназначена для отсроченного высвобождения). В еще одном варианте осуществления предусмотрено немедленное высвобождение некоторых из действующих ингредиентов и отсроченное высвобождение некоторых других действующих ингредиентов (например, предусмотрено немедленное высвобождение действующих ингредиентов A, B, C и отсроченное высвобождение действующих ингредиентов C и D).
В некоторых вариантах осуществления фармацевтическая композиция включает немедленно высвобождающийся компонент и компонент, который высвобождается в отсроченном режиме. Немедленно высвобождающийся компонент может включать один или несколько действующих ингредиентов, выбранных из группы, состоящей из анальгетиков, антимускариновых агентов, антидиуретиков и спазмолитиков. Компонент, который высвобождается в отсроченном режиме, может включать один или несколько действующих ингредиентов, выбранных из группы, состоящей из анальгетиков, антимускариновых агентов, антидиуретиков и спазмолитиков. В некоторых вариантах осуществления немедленно высвобождающийся компонент и компонент, высвобождающийся в отсроченном режиме, включают одни и те же действующие ингредиенты. В других вариантах осуществления немедленно высвобождающийся компонент и компонент, высвобождающийся в отсроченном режиме, включают разные действующие ингредиенты. В еще одном варианте осуществления немедленно высвобождающийся компонент и компонент, высвобождающийся в отсроченном режиме, включают один или несколько общих действующих ингредиентов.