Замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения и способы их применения
Иллюстрации
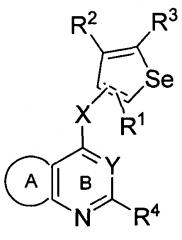
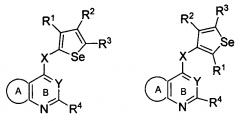
Показать всеИзобретение относится к селенофеновому соединению формулы (I)
или его фармацевтически приемлемой соли, сольвату или гидрату. Кольцо А представляет собой сопряженное бензольное кольцо; 6-членное ароматическое сопряженное кольцо, содержащее один атом азота; 5-членное ароматическое сопряженное кольцо, содержащее один или два гетероатома, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода, или серы, или селена; такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, селенофен, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; где кольцо А замещено одной, двумя или более группами, независимо друг от друга выбираемыми из водорода, амино, тиола, С1-6 алкила и С1-6 алкокси. Y представляет собой N. X представляет собой О или NR6, в котором R6 выбирают из водорода, С1-6 алкила и галогеноС1-6 алкила. X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца. R1, R2, R3 и R4 независимо друг от друга выбирают из водорода, нитро, С1-6 алкила, С1-4 алкоксикарбонила, аминокарбонила и аминоС1-6 алкила. Также предложена группа конкретных соединений, способы получения селенофенового соединения и фармацевтическая композиция. Изобретение позволяет получить селенофеновые соединения, используемые для лечения, ингибирования или контроля клеточного пролиферативного нарушения у теплокровного животного. 5 н. и 24 з.п. ф-лы, 1 ил., 2 табл., 31 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к замещенным 4-(селенофен-2(или 3)-иламино)пиримидиновым соединениям; способам их получения; способам лечения рака и способам изготовления фармацевтических композиций для лечения или ингибирования, или контроля рака.
Уровень техники изобретения
Рак представляет собой заболевание, возникающее вследствие патологического роста ткани. Определенные типы рака обладают способностью ограниченного распространения в тканях и также метастазирования в удаленные органы. Это заболевание может проявляться в широком выборе различных органов, тканей и клеточных типов. В силу вышесказанного, термин "рак" обозначает совокупность более чем тысячи различных заболеваний. У более чем 4,4 миллиона человек во всем мире выявлен диагноз рак молочной железы, рак толстой кишки, рак яичников, рак легких или рак предстательной железы, и свыше 2,5 миллионов человек умерли от этих тяжких заболеваний. В одних только Соединенных Штатах Америки свыше 1,25 миллионов новых случаев и свыше 500 000 смертей от рака было зафиксировано в 2005 г. Абсолютное большинство новых случаев этого заболевания будет представлено раком толстой кишки (-100 000), легких (-170 000), молочной железы (-210 000) и предстательной железы (-230 000). Как частота встречаемости, так и широта распространения рака прогнозируются возрастающими, приблизительно, на 15% в течение следующих десяти лет, показывающих среднюю скорость роста 1,4% (American Cancer Society, Cancer Facts and Figures 2005; http://www.cancer.org).
Лечение рака представлено двумя основными типами, либо радикальное, либо паллиативное. Главные радикальные типы лечения рака представляют собой хирургическое вмешательство и облучение. Эти варианты лечения, как правило, являются успешными только тогда, когда рак обнаружен на стадии ранней локализации. Если заболевание развилось до местнораспространенного рака или метастатического рака, эти типы лечения являются менее эффективными и лечение нацелено на временное ослабление симптома и поддерживание хорошего качества жизни. Большинство общепринятых лечебных протоколов в любом методе лечения включают комбинацию хирургического вмешательства, лучевую терапию и/или химиотерапию.
Цитотоксические лекарственные препараты (также известные как циторедуктивные агенты) применяют при лечении рака либо в качестве радикального лечения, либо с целью продления жизни или временного ослабления симптомов. Цитотоксические препараты могут быть скомбинированы с лучевой терапией и/или хирургическим вмешательством, как в случае неоадьювантного лечения (первоначальная химиотерапия нацелена на сокращение опухоли, благодаря чему оказание помощи посредством местной терапии, такой как хирургическое вмешательство и облучение, более эффективно) или как в случае адьювантной химиотерапии (применяется в сопряжении или после хирургического вмешательства и/или местной терапии). Комбинации различных лекарственных препаратов зачастую более эффективны, чем индивидуальные лекарственные препараты: они могут обеспечивать преимущество усиленного отклика в определенных опухолях, уменьшать развитие устойчивости к лекарственным препаратам и/или увеличивать выживаемость. По этим причинам применение комбинированных схем приема цитотоксических лекарств при лечении многих типов рака является широко распространенным. Цитотоксические вещества, принятые к применению в настоящее время, реализуют различные механизмы блокировки быстрого роста и вызывают клеточную гибель. Вообще, их можно подразделить на следующие группы, основываясь на механизме их действия: микротрубочковые модуляторы, которые препятствуют полимеризации или деполимеризации микротрубочек (например, доцетаксел, паклитаксел, винбластин, винорелбин); антиметаболиты, включая нуклеозидные аналоги и другие ингибиторы ключевых клеточных метаболических путей (например, капецитабин, гемцитабин, метотрексат); вещества, которые непосредственно взаимодействуют с ДНК (например, карбоплатин, циклофосфамид); антрациклиновые ДНК-интеркаляторы, которые препятствуют функционированию ДНК-полимеразы и Топо-изомеразы II (например, доксорубицин, эпирубицин); и неантрациклиновые ингибиторы активности Топо-изомеразы (например, топотекан, иринотекан и этопозид). Даже если различные цитотоксические лекарственные препараты воздействуют посредством различных механизмов действия, каждый, как правило приводит, по меньшей мере, к временному сокращению опухоли. Цитотоксические вещества продолжают выполнять роль важного компонента в онкологическом арсенале вооружения, предназначенного для использования в борьбе с раком. Большинство лекарственных препаратов, в настоящее время проходящих последний этап Фазы II и Фазу III клинических испытаний, сфокусированы на известных механизмах действия (тубулинсвязывающие вещества, антиметаболиты, взаимодействующие с ДНК при процессах ее функционирования), и на поэтапно возрастающих улучшениях известных классов лекарственных препаратов (например, таксаны или камптотецины). Небольшое количество цитотоксических лекарственных препаратов, основанных на новых механизмах действия, появилось в последнее время. Принципы действия этих цитотоксических препаратов включают ингибирование ферментов, задействованных в модификации ДНК (например, гистондеацетилаза (HDAC)), ингибирование белков, вовлеченных в движение микротрубочек и развитие клеточного цикла (например, кинезины, aurora киназа (серин/треонин-протеинкиназа)), и новые индукторы метаболического пути апоптоза (например, ингибиторы bcl-2).
Даже если цитотоксические вещества продолжают оставаться на передовой важной позиции в подходах лечения пациентов с сильно развившимися солидными опухолями, их ограниченная эффективность и узкоограниченные терапевтические свойства в результате проявляются в существенных побочных эффектах. Кроме того, фундаментальное научное исследование рака привело к изучению менее токсичных методов лечения, основанных на специфических механизмах, являющихся главными в развитии опухоли. Такие исследования могут привести к эффективной терапии, сопровождающейся улучшением качества жизни онкологических пациентов. Таким образом, появился новый класс терапевтических веществ, относящихся к цитостатикам. Цитостатики направляют свое воздействие на стабилизацию опухоли и, как правило, ассоциируются с более ограниченным и менее отягощающим профилем побочного эффекта. Их усовершенствование осуществляется в результате идентификации специфических генетических изменений, вовлеченных в развитие рака и на основе понимания, какие белки активируются при раке, такие как тирозин-киназа и серин/треонин-киназа.
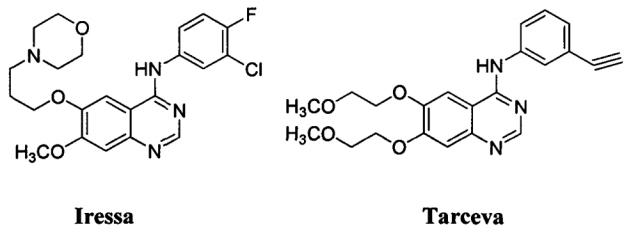
Сверхэкспрессия EGFR встречается с высокой частотой в человеческих эпителиальных злокачественных новообразованиях, и его активация играет существенную роль в проявлении и развитии злокачественных новообразований человека, поскольку сигнальные метаболические пути EGFR связаны с клеточной пролиферацией, повышением выживаемости и ингибированием апоптоза. Вследствие этого, EGFR представляет собой очень привлекательную молекулярную мишень для терапии рака. В течение последних 20 лет многочисленные низкомолекулярные ингибиторы и моноклональные антитела, нацеленные на EGFR, успешно разрабатывались. Производные 4-анилинохиназолинов, Iressa (Гефитиниб) и Tarceva (Эрлотиниб) (Фиг. 1), представляют собой два селективных ингибитора EGFR, одобренных FDA в 2003 и 2004 гг., для лечения местнораспространенного или метастатического немелкоклеточного рака легких (NSCLC). Клинические данные показывают, что 10-20% от всех пациентов с NSCLC частично реагируют на эти два ингибитора EGFR, но только Эрлотиниб продлевал жизнь пациентов с рецидивным NSCLC. Кроме того, у большинства пациентов, которые реагировали на первичное лечение, со временем развивалась устойчивость к ингибиторам EGFR. Таким образом, существует крайне необходимая медицинская потребность в разработке и обнаружении новых, с широким терапевтическим индексом и более сильнодействующих соединений с противоопухолевой активностью.
Фигура 1: Химические структуры Iressa и Tarceva
Техническая проблема, которую надо решить, в соответствии с настоящим изобретением, следовательно, может быть представлена как предоставление новых соединений, обладающих достаточно хорошей противораковой активностью или ингибиторной активностью в отношении EGFR тирозин-киназ или других киназ, таким образом предоставляя новые терапевтические возможности для лечения заболеваний, в частности, рака и других пролиферативных нарушений.
Сущность изобретения
Настоящее изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения формулы (I) и их фармацевтически приемлемые соли.
В другом аспекте, изобретение предоставляет геометрические изомеры/оптические изомеры/диастереомеры, гидраты соединений формулы (I).
В другом аспекте, изобретение предоставляет способ получения соединений формулы (I).
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно 4-(селенофен-2(или 3)-иламино)пиримидиновое соединение, выбираемое из вышеуказанных формулы (I) и его производных, в комбинации, по меньшей мере, с одним фармацевтически приемлемым эксципиентом/носителем/разбавителями.
В другом аспекте, изобретение предоставляет фармацевтические композиции, включающие, по меньшей мере, одно 4-(селенофен-2(или 3)-иламино)пиримидиновое соединение, выбираемое из вышеуказанных формулы (I) и его производных, в комбинации, по меньшей мере, с одним фармацевтически приемлемым эксципиентом/носителем/разбавителями и, по меньшей мере, с одним противоопухолевым веществом.
В другом аспекте, настоящее изобретение предоставляет способ лечения или ингибирования, или контролирования клеточного пролиферативного нарушения, в частности, рака у пациента, нуждающегося в таком лечении, включающий введение пациенту эффективного количества соединения формулы (I) или его композиций, как определено выше.
В другом аспекте, настоящее изобретение предоставляет способ лечения или контролирования роста опухоли или злокачественного новообразования посредством блокирования развития кровеносных сосудов или посредством ингибирования формирования сосудистых капилляров при введении, по меньшей мере, одного селенофенового соединения формулы (I) или его солей, или его композиций, как определено выше.
Описание чертежей
Фигура 1: Соединение 27 ингибирует формирование капилляроподобных эндотелиальных трубочек in vitro. Эндотелиальные клетки умбиликальной вены человека (Human umbilical vein endothelial cells (HUVECs)) наносили ровным слоем на поверхность чашки Петри, покрытую Cultrex, в присутствии либо только 10 нг/мл человеческого рекомбинантного фактора роста фибробласт (human recombinant Fibroblast Growth Factor (FGF)) (B), либо совместно с соединением 27 в количестве 0,5, 1,0, 2,5 и 5 мкг/мл C, D, E и F, соответственно. Клетки при наличии лечебной обработки оставляли для образования эндотелиальных капиллярных микротрубочек на 16 ч при 37°С. Панель A представляет формирование капилляроподобных эндотелиальных трубочек в ячейках с контрольной средой, обработанной 0,1% ДМСО.
Подробное описание изобретения
Изобретение сейчас будет подробно описано в связи с некоторыми предпочтительными и необязательными вариантами осуществления изобретения, таким образом эти различные его аспекты могут быть полнее поняты и приняты во внимание.
В настоящем изобретении используется селенофен в качестве основы структуры вместо бензольного кольца в 4-фениламинохиназолине для существенного увеличения его активности для возможного лечения на стадии ранней диагностики и для существенного увеличения эффективности при лечении на поздней стадии рака. Причина, по которой селенофеновая кольцевая система была выбрана вместо ароматической фениловой кольцевой системы заключается в том, что селен, будучи наиболее большим атомом в пятичленном кольце, может иметь сходство с фениловым кольцом по форме и размеру, и может приобретать структуру фенилового кольца в пространстве. Рецепторы, задействованные в распознавании 4-фениламинохиназолина, например, в гефитинибе, также могут распознаваться 4-селенофениламинохиназолином для биологического отклика. К тому же, селен в виде металлоорганического соединения может обладать противораковыми свойствами. Селен представляет собой хорошо идентифицируемый эссенциальный, присутствующий в следовых количествах рассеянный элемент в организме человека, в дозах 55-90 мкг, необходимых для поддержания полезного для здоровья режима питания людей (K.M. Aumann et. al., Org. Biomol. Chem., 2007, 5, 1276-1281). Вследствие этого селен может быть включен в виде металлоорганического соединения посредством того, что ароматическая селенофеновая кольцевая система замещает ароматическую фениловую систему, с существенным возрастанием эффективности.
Предложенные новые аналоги с заместителями в селенофеновой кольцевой системе будут приобретать конформацию, которая соответствует рецепторам мембраны опухолевой клетки, при специфических конформационных перестройках (Specific Conformational Perturbation (SCP)), предоставляя возможность физиологической реакции. С этим новым дизайном все молекулы в предварительно организованной специфической конформации в процессе действия связываются с рецепторами на сто процентов синхронизированно.
Это обернется предоставлением возможности высокой специфичности с большим диапазоном Терапевтического Индекса (TI). Обычно, для лечения онкологических пациентов большее значение терапевтического индекса является предпочтительным. Это объясняется тем, что в одном случае надо бы начать схему лечения с очень высокой максимальной переносимой дозы (Maximum Tolerated Dose (MTD)), такой, чтобы именно сами раковые клетки поражались бы сильно при первом химиотерапевтическом лечении. В противном случае, выжившие раковые клетки будут устранять повреждения ДНК и впоследствии метастазировать в другие ткани или органы. Кроме того, раковые клетки, выжившие после первого лечения, станут устойчивыми ко второму или последующим повторениям химиотерапии в случае таковой необходимости. И кроме того, из-за ослабления иммунной системы после первой химиотерапии субоптимальная доза, которая должна быть введена при втором лечебном воздействии, внесет вклад в токсичность больше, чем в лечебный эффект.
В качестве составной части работы по разработке новых противораковых соединений двадцать девять 4-селенофен-2(или 3)-иламинопиримидиновых соединений формулы (I) были получены и протестированы на их эффективность против трех раковых клеточных линий. Было установлено, что эти 4-селенофен-2(или 3)-иламинохиназолиновые соединения формулы (I) показали хорошее ингибирующее действие по отношению к A549 (легкое), DU145 (предстательная железа) и HT29 (толстая кишка) раковым клеточным линиям in vitro. Изобретатели сделали поразительное открытие, что аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 5) формулы (I) демонстрирует примерно в четыре раза большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании клеточной линии A549 рака легких. Подобным образом аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 5) показал на клеточной линии A549 величину IC50, равную 4,6 мкΜ, в сравнении с 16,6 мкΜ, которую проявил гефитиниб. Также было установлено, что аналог 4-селенофен-2(или 3)-иламинохиназолина (соединение 1) формулы (I) демонстрирует примерно в два раза большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании клеточной пролиферации клеточной линии A549 рака легких. Этот аналог (соединение 1) показал на той же клеточной линии рака легких величину IC50, равную 9,08 мкΜ, в сравнении с 16,6 мкΜ, которую проявил гефитиниб. Следовательно, новые аналоги (соединение 1 и соединение 5) являются значительно более лучшими, чем реализуемый на рынке лекарственный препарат гефитиниб (Iressa), по показателю эффективности в условиях in vitro. Итак, более поразительно, что эти два аналога (соединение 1 и соединение 5) аналогичным образом демонстрируют в несколько раз большую активность in vitro по сравнению с гефитинибом (Iressa) при ингибировании раковых клеточных линий DU145 (предстательная железа) и HT29 (толстая кишка), и эти результаты в итоге суммированы в Таблице 1.
Как можно видеть из Таблицы 2, соединение 21 было в шестнадцать, пятнадцать и в семнадцать раз активнее, чем Iressa в отношении клеток карциномы молочной железы (MDA-MB-231), гепатоцеллюлярных (HepG2) и цервикальных (HeLa) клеток карциномы, соответственно. Таким же образом, соединение 27 в равной мере более активно, чем Iressa в тех же самых трех карциномных клеточных линиях, тестированных in vitro.
На основании показанного на Фигуре 1, очевидно, что соединение 27 действует как препятствующее развитию кровеносных сосудов путем существенного ингибирования формирования эндотелиальных капилляров дозазависимым образом.
Даже если выбранные соединения использовали для наглядного доказательства настоящего изобретения, изобретение охватывает все соединения формулы (I) и их производные.
Таким образом, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные нижеследующей формулой (I) и их фармацевтически приемлемые соли.
формула (I)
в которой:
кольцо А представляет собой арил или гетероарил, или гетероциклоалкил; арил представляет собой сопряженное бензольное кольцо и гетероарил представляет собой 6-членное ароматическое сопряженное кольцо, содержащее один, два или три атома азота; или гетероарил представляет собой 5-членное ароматическое сопряженное кольцо, содержащее один или несколько гетероатомов, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода, или серы, или селена; такие кольца включают пиридин, пиридазин, пиразин, пиримидин, тиофен, фуран, пиррол, селенофен, пиразол, имидазол, оксазол, изоксазол, тиазол и изотиазол; обычно, гетероциклоалкил представляет собой моно- или бициклический, насыщенный гетероциклический радикал, имеющий общее количество атомов углерода 3-10 и вплоть до 2 гетероатомов и/или гетерогрупп, независимо друг от друга выбираемых из группы, состоящей из N, O, S, SO и SO2;
кольцо А представляет собой, необязательно, замещенное одной, двумя или более группами, независимо друг от друга выбираемыми из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила, и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом;
Y представляет собой N или C-R5, в котором R5 выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила;
X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца;
X выбирают из NR6, O, S, S(O), S(О2); в котором R6 выбирают из водорода, амино, С1-6 алкила, галогеноС1-6 алкила;
R1, R2, R3 и R4
выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила; и кольца арила, гетероарила и гетероциклоалкила; кольца арила, гетероарила и гетероциклоалкила, необязательно, замещенного галогеном, гидроксилом, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом.
В предпочтительном варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3) иламино)пиримидиновые соединения, представленные нижеследующей формулой (I),
формула (I)
в которой X может быть присоединен либо во 2-м, либо в 3-м положении селенофенового кольца и выбирается из нижеследующих;
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых X представляет собой NR6;
в которых R6 выбирают из водорода, амино, С1-6 алкила, галогеноС1-6 алкила.
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых X представляет собой O;
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых Y представляет собой N;
В другом варианте осуществления, изобретение предоставляет селенофеновые соединения формулы (I), в которых Y представляет собой C-R5;
в которых R5 представляет собой
выбираемый из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные нижеследующей формулой (I), в которой кольцо A представляет собой, необязательно, замещенный арил или, необязательно замещенный гетероарил; необязательно замещенная арильная группа представляет собой 6-членное ароматическое кольцо, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-селенофен-2(или 3)-иламинохиназолин. Например, 6-членное ароматическое кольцо является замещенным или незамещенным бензолом. 6-членное ароматическое кольцо выбирают из замещенного или незамещенного бензольного кольца, имеющего нижеследующую структуру;
в которой * указывает место присоединения к кольцу B формулы I и выбирается из нижеследующих:
в которой:
R7, R8, R9 и R10
независимо друг от друга выбирают из водорода, галогена, гидрокси, формила, карбоновой кислоты, амино, нитро, циано, сульфоновой кислоты, тиола, тригалогенометила, сульфаниламида, С1-6 алкила, С1-6 вторичного алкила, С1-6 третичного алкила, С2-6 алкенила, С2-6 алкинила, С1-4 алкилкарбонила, С1-4 алкоксикарбонила, аминокарбонила, С1-6 алкиламинокарбонила, ди(С1-6 алкил)аминокарбонила, галогеноС1-6 алкила, гидроксиС1-6 алкила, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкила, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкила, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкила, ди(С1-6 алкил)аминоС1-6 алкила, С1-6 алкилсульфинила, С1-6 алкилсульфонила и фенила, бензила, пятичленного гетероароматического кольца, содержащего один или несколько гетероатомов, выбираемых из серы, кислорода, азота и селена, при условии, что присутствует не более одного атома кислорода или серы, или селена; фенил или 5-членное гетероароматическое кольцо, необязательно, замещены галогеном, гидрокси, формилом, карбоновой кислотой, амино, нитро, циано, сульфоновой кислотой, тиолом, тригалогенометилом, сульфаниламидом, С1-6 алкилом, С1-6 вторичным алкилом, С1-6 третичным алкилом, С2-6 алкенилом, С2-6 алкинилом, С1-4 алкилкарбонилом, С1-4 алкоксикарбонилом, аминокарбонилом, С1-6 алкиламинокарбонилом, ди(С1-6 алкил)аминокарбонилом, галогеноС1-6 алкилом, гидроксиС1-6 алкилом, С1-6 алкокси, галогеноС1-6 алкокси, гидроксиС1-6 алкокси, С3-7 циклоалкилом, С3-7 циклоалкокси, С1-6 алкиламино, ди(С1-6 алкил)амино, аминоС1-6 алкилом, аминоС1-6 алкокси, С1-6 алкиламиноС1-6 алкилом, ди(С1-6 алкил)аминоС1-6 алкилом, С1-6 алкилсульфинилом, С1-6 алкилсульфонилом;
необязательно,
по меньшей мере, один из R7, R8, R9 и R10 может быть выбран из нижеследующей формулы;
в которой:
n представляет собой целое число, выбираемое из 0, 1-5; предпочтительно, 2;
* указывает место присоединения к бензольному кольцу;
Z выбирают из CH2, O, S, или NH;
R11 и R12
независимо друг от друга выбирают из водорода, С1-6 алкила, галогеноС1-6 алкила, галогеноС1-6 алкокси, С3-7 циклоалкила;
необязательно, R11 и R12
присоединены и взятые вместе с атомами, к которым они присоединены, формируют 5-7-членное гетероциклоалкильное кольцо.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиридина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиридино)пиримидин. Пиридиновое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4, либо 4,3 пиридина, и выбирают из нижеследующих;
R7, R8 и R9
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиразина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиразино)пиримидин. Пиразиновое кольцо выбирают из нижеследующих;
в которой:
* указывает место присоединения к кольцу B формулы I и выбирают из нижеследующих;
R7 и R8 независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо A выбирают из пиримидина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиримидино)пиримидин. Пиримидиновое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 4,5, либо 5,4 пиримидина, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из пиридазина и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопиридазино)пиримидин. Пиридазиновое кольцо выбирают из нижеследующих;
в которой:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 3,4, либо 4,5, либо 4,3 пиридазина, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из тиофена, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинотиено)пиримидин. Тиофеновое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 тиофена, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из фурана, и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинофурано)пиримидин. Фурановое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 фурана, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из пиррола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинопирроло)пиримидин. Пиррольное кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 пиррола, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из селенофен и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноселенофено)пиримидин. Селенофеновое кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 2,3, либо 3,2, либо 3,4 селенофена, и выбирают из нижеследующих;
R7 и R8
независимо друг от друга выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из оксазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламинооксазоло)пиримидин. Оксазольное кольцо выбирают из нижеследующих;
в которых:
* указывает место присоединения к кольцу B формулы I; связь, которая сопряжена с кольцом B, представляет собой либо 4,5, либо 5,4 оксазола, и выбирают из нижеследующих;
R7
независимо выбирают из групп, указанных выше.
В другом варианте осуществления, изобретение предоставляет замещенные 4-(селенофен-2(или 3)-иламино)пиримидиновые соединения, представленные формулой (I), в которой кольцо А выбирают из изоксазола и полученная в результате сопряженная система представляет собой замещенный или незамещенный 4-(селенофен-2(или 3)-иламиноизоксазоло)пиримидин. Изоксазольное кольцо выбирают из нижеследующих;