Способ определения полифенольных соединений методом ступенчатого элюирования в тонком слое сорбента
Иллюстрации
Показать всеИзобретение относится к аналитической химии, а именно к способам стандартизации лекарственных препаратов, лекарственного растительного сырья, фитопрепаратов и биологически активных добавок по содержанию танина, галловой кислоты и кверцетина, и может быть использовано в фармацевтическом анализе, в химико-фармацевтической промышленности. Способ определения полифенольных соединений методом ступенчатого элюирования в тонком слое сорбента характеризуется тем, что навеску исследуемого препарата обрабатывают водой при кипячении на водяной бане с последующим ступенчатым хроматографированием в двух системах растворителей, обработкой 1% спиртовым раствором железо-аммонийных квасцов и высушиванием при температуре 80°С в течение 3-5 минут до проявления хроматографических зон; после проявления хроматографических зон пластины сканируют с помощью планшетного сканера, а полученные изображения обрабатывают известной компьютерной программой «Sorbfil Videodensitometer», зоны полифенольных соединений идентифицируются по характерному значению величины Rf и рассчитывают количественное содержание полифенольных соединений в пробе. Техническим результатом является повышение точности, возможность проведения одновременного разделения, идентификации и количественного определения полифенольных соединений в лекарственных препаратах, растительном сырье, фитопрепаратах и биологически активных добавках к пище, а также возможность разделения сложных смесей и отделения полифенольных соединений от других биологически активных веществ. 5 ил., 3 табл.
Реферат
Изобретение относится к аналитической химии и может быть использовано в фармацевтическом анализе, в химико-фармацевтической промышленности.
В настоящее время тонкослойная хроматография (ТСХ) в фармацевтическом анализе применяется для идентификации полифенольных соединений в субстанциях, лекарственном растительном сырье и фитопрепаратах. ТСХ, обладая всеми преимуществами хроматографических методов, находит широкое применение ввиду своей экспрессности, доступности, достаточной чувствительности, селективности и простоте выполнения анализа. Тем более, что разработанные в последнее десятилетие новые неподвижные фазы, оборудование для нанесения проб, новые методы элюирования пластинок и количественного определения с использованием сканирующих денситометров способны обеспечить более высокое разрешение, лучшее детектирование и воспроизводимость результатов качественного и количественного хроматографического анализа различных групп биологически активных веществ, в т.ч. и полифенольных соединений (Гейсс Ф. Основы тонкослойной хроматографии. М.: Мир, 1999, 405 с.). Многие из описанных способов позволяют определять только суммарное содержание дубильных веществ, без достоверной информации о присутствии отдельных компонентов.
Известен способ идентификации и количественного определения танина методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в лекарственном растительном сырье и лекарственных препаратах кровохлебки лекарственной (И.В. Попов, И.Н. Андреева, М.В. Гаврилин. Определение танина в сырье и препаратах кровохлебки лекарственной методом ВЭЖХ. - Химико-фармацевтический журнал. - 2003. - №7. - Т. 37. - С. 24-26), заключающийся в том, что точную навеску измельченных корневищ и корней кровохлебки помешают в плоскодонную колбу со шлифом вместимостью 100 мл, прибавляют 50 мл 40% этилового спирта, взвешивают с погрешностью ±0,01 г; присоединяют к обратному холодильнику и кипятят в течение 1 ч. После охлаждения до комнатной температуры колбу вновь взвешивают, доводят до первоначальной массы 40% этиловым спиртом и фильтруют через бумажный фильтр, отбрасывая первые 10 мл фильтра (раствор А). 2 мкл раствора А вводят в хроматограф «Милихром-5» с УФ-детектором при длине волны 280 им на колонке из нержавеющей стали длиной 80 мм с внутренним диаметром 2,0 мм, заполненной адсорбентом «Диасорб-С16», или аналогичной с диаметром частиц 5 мкм. Анализ проводят методом изократического элюирования при комнатной температуре в системе растворителей ацетонитрил-вода-ледяная уксусная кислота (4:6:0,1). Недостатком данного способа является использование дорогостоящего оборудования, материалов и реактивов.
Описан способ идентификации и количественного денситометрического определения галловой кислоты методом ТСХ в траве лофанта анисового (В.В. Чумакова, Т.Д. Мезенова, О.И. Попова. Определение галловой кислоты в траве лофанта анисового методом планарной хроматографии. - Химия растительного сырья. - 2011. - №4. - С. 269-271), включающий получение извлечения с использованием 70% этилового спирта с последующим хроматографированием на пластинках марки «Sorbfil ПТСХ-АФ-А-УФ» в системе н-бутанол - ледяная уксусная кислота - вода (4:1:1) при подъеме фронта растворителя на 12 см; высушивание пластин на воздухе до исчезновения запаха растворителя, обработку 1% водным раствором железоаммониевых квасцов, сканирование пластинки с помощью планшетного сканера с разрешением 100 dpi; обработку хроматограмм компьютерной программой «Sorbfil Videodensitometer». Недостатком данного способа - аналога является невозможность одновременного определения танина, галловой кислоты и кверцетина в растительных объектах и многокомпонентных лекарственных формах без предварительного разделения на отдельные компоненты.
1. Известны способы разделения и идентификации дубильных веществ методом ТСХ в извлечениях из растительного сырья, основанные на получении извлечения с использованием воды (А.А. Мальцева, А.С. Чистякова, А.А. Сорокина и др. Количественное определение дубильных веществ в траве горца почечуйного. - Вестник ВГУ. Сер.: Химия. Биология. Фармация. - 2013. - №2. - С. 203-205) или 60% этилового спирта (Е.Н. Гринько. Требования Российской и Европейской фармакопей к методикам определения содержания дубильных веществ в лекарственном растительном сырье. - Фармация. - 2010. - №5. - С. 49-53) с последующим хроматографированием в системе н-бутанол - ледяная уксусная кислота - вода (4:1:2 или муравьиная кислота безводная - этилацетат - толуол (10:30:60) (Гринько Е.Н. Исследования по стандартизации лекарственного растительного сырья, содержащего дубильные вещества / Автореф. дисс. канд. фарм. н. - Москва, 2011. - 25 с); высушивание пластин на воздухе до исчезновения запаха растворителя, обработку 1% спиртовым раствором железоаммониевых квасцов и идентификацию зон дубильных веществ (галловая кислота и танин) и кверцетина по величинам Rf в сравнении с достоверными стандартными образцами. Данные способы - прототипы не лишены недостатков, так как не позволяют проводить количественное определение полифенольных соединений в исследуемых объектах.
В научной фармацевтической, медицинской и патентной литературе способов, позволяющих идентифицировать и количественно определить одновременно не только высокомолекулярные (танин) и низкомолекулярные (галловая кислота) дубильных веществ, но и представителя флавоноидной группы полифенольных соединений - кверцетина методом ТСХ с применением ступенчатого элюирования, не обнаружено.
Задача изобретения: заключается в разработке способа разделения и количественного определения полифенольных соединений (на примере танина, галловой кислоты и кверцетина) методом ступенчатого элюирования в тонком слое сорбента, разделения сложных смесей и отделения полифенольных соединений от других биологически активных веществ (в том числе дубильной и флавоноидной групп) и стандартизации лекарственных препаратов, лекарственного растительного сырья и фитопрепаратов, биологически активных добавок по содержанию полифенольных соединений методом ТСХ. В задачи изобретения также входило обоснование необходимости ступенчатого хроматографирования при определении данных полифенольных соединений методом ТСХ.
Технический результат - повышение точности, а также возможность одновременного определения подлинности и количественного определения полифенольных соединений (танина, галловой кислоты и кверцетина), разделения сложных смесей и отделения полифенольных соединений от других биологически активных веществ достигается тем, что навеску исследуемого препарата растворяют в воде с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» с алюминиевой подложкой ПТСХ-П-А. Элюент 1 (высота пробега 9 см) - диэтиловый эфир-уксусная кислота-гексан-этилацетат (20:20:20:40). Элюент 2 (высота пробега 7 см) - этилацетат-муравьиная кислота-уксусная кислота-вода (67:7,5:7,5:18). Хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон. Оптимальный объем пробы - 0,5 мкл спиртового раствора с содержанием галловой кислоты 5 мг/мл; 0,5 мкл спиртового раствора с содержанием танина 10 мг/мл и 1-2 мкл спиртового раствора с содержанием кверцетина 1 мг/мл, причем время насыщения камер парами элюентов - 40 мин, время элюирования - 35-40 мин в системе 1 и 20-30 мин в системе 2; время выдерживания пластинки в термостате после проявления при t=80±2°C - 3-5 минут. Сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера (разрешение не менее 300 dpi), а полученные изображения (фиг. 1) обрабатывают компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг. 2), а содержание галловой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, в диапазонах концентраций 0,3-1,5 и 1,5-4,0 мкг/мкл рассчитывают по формулам соответственно:
Содержание танина (с, мкг) в пробе, нанесенной на хроматограмму, в диапазонах концентраций 0,5-4,5 и 5,0-7,0 мкг/мкл рассчитывают по формулам соответственно:
Содержание кверцетина (с, мкг) в пробе, нанесенной на хроматограмму, в диапазоне концентраций 1,0-6,0 мкг/мкл рассчитывают по формуле:
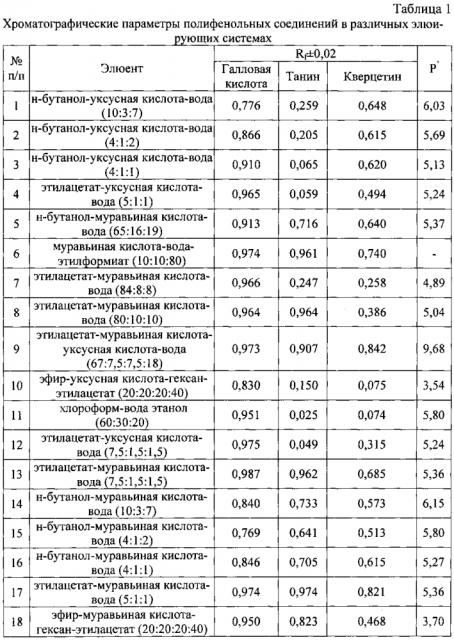
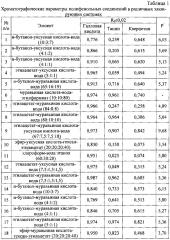
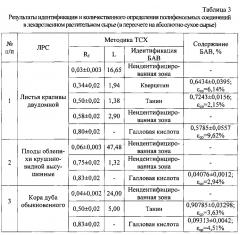
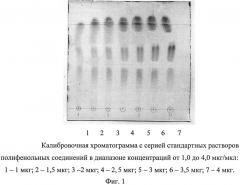
где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer». Изобретение проиллюстрировано графиками, чертежами, схемами, таблицами, где в таблице 1 представлены хроматографические параметры полифенольных соединений в различных элюирующих системах. Пределы обнаружения пятен исследуемых биологически активных веществ с помощью выбранного реагента приведены в таблице 2. Калибровочная хроматограмма с серией стандартных растворов полифенольных соединений в диапазоне концентраций от 1,0 до 4,0 мкг/мкл (1-1 мкг; 2-1,5 мкг; 3-2 мкг; 4-2,5 мкг; 5-3 мкг; 6-3,5 мкг; 7-4 мкг) дана на фиг. 1. Фиг. 2 демонстрирует вид денситограммы смеси стандартных растворов исследуемых полифенольных соединений. Влияние полярности элюентов на хроматографическую подвижность полифенольных соединений в тонком слое изображено на фиг. 3. Градуировочные графики для определения содержания танина в области концентраций (0,5-4,5 и 5,0-7,0 мкг/мкл) представлены на фиг. 4а. Градуировочный график для определения содержания кверцетина в области концентраций (1,0-6,0 мкг/мкл) изображен на фиг. 4б. Градуировочные графики для определения содержания галловой кислоты в области концентраций (0,3-1,5 и 1,5-4,0 мкг/мкл) приведены на фиг. 4в. Фиг. 5 демонстрирует вид хроматограммы водных извлечений из сырья (а - 20 мкл отвара плодов облепихи крушиновидной высушенных; б - 10 мкл настоя листьев крапивы двудомной; в - 10 мкл отвара коры дуба обыкновенного). В таблице 3 приведены результаты идентификации и количественного определения полифенольных соединений в лекарственном растительном сырье (в пересчете на абсолютно сухое сырье).
Способ определения полифенольных соединений методом ступенчатого элюирования в тонком слое сорбента реализуется следующим образом.
Навеску исследуемого препарата растворяют в воде или навеску измельченного лекарственного растительного сырья экстрагируют водой при кипячении на водяной бане с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» с алюминиевой подложкой ПТСХ-П-А в системе растворителей 1 (высота пробега 9 см) - диэтиловый эфир-уксусная кислота-гексан-этилацетат (20:20:20:40) с последующим высушиванием на воздухе в течение 5-7 мин, а затем повторно хроматографируют в системе растворителей 2 (высота пробега 7 см) - этилацетат-муравьиная кислота-уксусная кислота-вода (67:7,5:7,5:18); хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон. Оптимальный объем пробы - 0,5 мкл спиртового раствора с содержанием галловой кислоты 5 мг/мл; 0,5 мкл спиртового раствора с содержанием танина 10 мг/мл и 1-2 мкл спиртового раствора с содержанием кверцетина 1 мг/мл, причем время насыщения камер парами элюентов - 40 мин, время элюирования - 35-40 мин в системе 1 и 20-30 мин в системе 2.
В способе проведено обоснование применения ступенчатого элюирования для разделения и определения полифенольных соединений в тонком слое сорбента. Для выбора оптимальных условий хроматографического определения полифенольных веществ было изучено влияние полярности элюентов на хроматографическую подвижность в тонком слое (фиг. 3). В эксперименте изучено более двадцати типов элюирующих систем с различными значениями полярности, предлагаемые в литературе, а также вновь апробированные элюенты (табл. 1). Для каждой элюирующей системы рассчитаны полярность (Р′) и величина (). Для достижения оптимальных величин Rf, а также четкого разделения исследуемых веществ на хроматограммах необходимо использовать элюенты со значениями полярности в интервале 4,0-6,0 ед. Однако данные фиг. 3 также показывают, что за одно хроматографирование возможно отделить галловую кислоту, тогда как танин и кверцетин в данном диапазоне полярностей имеют сходные значения величин относительной подвижности в тонком слое. В то же время при достижении величины полярности элюента 8,0-9,5 ед. наблюдается удовлетворительное разделение зон танина и кверцетина на хроматограммах. Следовательно, для количественной обработки хроматограмм методом компьютерного сканирования необходимо использовать ступенчатое элюирование, где первый элюент - система №10 (Р=3,54 ед.) с высотой пробега 8-9 см, а второй элюент - система №9 (Р=9,68 ед.) с высотой пробега 7 см (табл. 1).
Сразу же после проявления хроматографических зон пластины сканируют с помощью планшетного сканера (разрешение не менее 300 dpi), а полученные изображения (фиг. 1) обрабатывают компьютерной программой «Sorbfil Videodensitometer». В результате получают треки в координатах Rf - интенсивность (фиг. 2).
Установлены линейные зависимости между содержанием изучаемых полифенольных соединений и площадью хроматографической зоны (фиг. 4а, б и в) в диапазоне изучаемых концентраций. Полученные результаты свидетельствуют о том, что для танина и галловой кислоты наблюдаются нелинейные зависимости площади хроматографической зоны от концентрации стандартного раствора с точками перегиба при 4,5 и 1,5 мкг/мкл соответственно (фиг. 4а и в). Наличие точки перегиба объясняется снижением коэффициента инструментальной чувствительности определения («а» в уравнении у=ах+b) с увеличением концентрации раствора. Анализ полученных данных позволил установить линейные зависимости между содержанием танина и галловой кислоты и интенсивностью окраски хроматографической зоны в диапазонах изучаемых концентраций (0,5-4,5 и 5,0-7,0 мкг/мкл) и (0,3-1,5 и 1,5-4,0 мкг/мкл) соответственно.
Ошибка в определении содержания танина будет уменьшаться с увеличением «а» в уравнении у=ах+в, следовательно, применение градуировочного графика для определения содержания танина, где а=6,0083 (фиг. 4а) приводит к более точным результатам по сравнению с результатами, полученными по графику в диапазоне концентраций 0,5-4,5 мкг/мкл, где а=4,4805.
Ошибка в определении содержания галловой кислоты будет меньше с применением градуировочного графика в области концентраций 0,3-1,5 мкг/мкл, где а=16,601 (фиг. 4в) по сравнению с результатами, полученными по графику в диапазоне концентраций 1,5-4,0 мкг/мкл, где а=4,8778. Наличие в регрессионных уравнениях коэффициентов b, отличных от нуля, говорит о постоянной систематической ошибке, обусловленной влиянием яркости фона пластины на оценку яркости окрашенной хроматографической зоны при обработке хроматограммы компьютерной программой «Sorbfil Videodensitometer».
Способ отличается возможностью проведения идентификации, разделения и количественной интерпретации данных ТСХ галловой кислоты, танина и кверцетина на персональном компьютере методом ступенчатого хроматографирования в тонком слое сорбента и стандартизировать лекарственные препараты, лекарственное растительное сырье, фитопрепараты и биологически активные добавки по содержанию полифенольных соединений; отличается также достаточной чувствительностью (3-10·10-7 г), экономичностью, доступностью и экспрессностью.
Способ иллюстрируется следующими конкретными примерами.
Пример 1. Разработанный способ идентификации и количественного определения полифенольных соединений был апробирован на лекарственном растительном сырье листьев крапивы двудомной.
Получение извлечения: Около 2,5 г (точная навеска) измельченного сырья с размером частиц, проходящих сквозь сито с диаметром отверстий 0,5 мм, помещают в коническую колбу вместимостью 100 мл, прибавляют 30 мл воды очищенной (с учетом коэффициента водопоглощения сырья). Колбу присоединяют к обратному холодильнику, нагревают на кипящей водяной бане в течение 15 мин, периодически встряхивая для смывания частиц сырья со стенок. Затем колбу с содержимым настаивали при комнатной температуре в течение 45 мин. Извлечение фильтруют через несколько слоев марли, отжимая частицы сырья в мерную колбу вместимостью 25 мл. При необходимости доводят объем до метки водой очищенной. Полученную суммарную вытяжку в количестве 10 мкл наносили на стартовую линию хроматографической пластинки и хроматографировали восходящим способом в условиях предлагаемого способа на пластинах размером 5×10 см. Элюент 1 (высота пробега 9 см) - диэтиловый эфир-уксусная кислота-гексан-этилацетат (20:20:20:40). Отмечали линию фронта, пластинку высушивали на воздухе 5-7 мин и помещали в элюент 2 (высота пробега 7 см) - этилацетат-муравьиная кислота-уксусная кислота-вода (67:7,5:7,5:18). Хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон. На хроматограммах извлечений из исследуемого сырья обнаружены зоны полифенольных соединений характерной окраски, среди которых идентифицирована кислота галловая, кверцетин и танин по характерному значению величин Rf в сравнении с достоверными стандартными образцами. Сразу же после проявления хроматограмм пластины сканируют с помощью планшетного сканера (разрешение не менее 300 dpi), а полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometer». Результаты количественного определения полифенольных соединений в извлечении из листьев крапивы двудомной, а также метрологическая характеристика представлены в табл. 3.
Пример 2. Разработанный способ идентификации и количественного определения полифенольных соединений был апробирован на лекарственном растительном сырье плодов облепихи крушиновидной.
Получение извлечения: Около 5,0 г (точная навеска) высушенного измельченного сырья помешают в коническую колбу вместимостью 100 мл, прибавляют 50 мл воды очищенной. Колбу присоединяют к обратному холодильнику, нагревают на кипящей водяной бане в течение 30 мин, периодически встряхивая для смывания частиц сырья со стенок. Затем колбу с содержимым настаивали при комнатной температуре в течение 10 мин. Извлечение фильтруют через несколько слоев марли, отжимая частицы сырья, в мерную колбу вместимостью 50 мл. При необходимости доводят объем до метки водой очищенной. Полученную суммарную вытяжку в количестве 20 мкл наносили на стартовую линию хроматографической пластинки и хроматографировали восходящим способом в условиях предлагаемого способа на пластинах размером 5×10 см. Элюент 1 (высота пробега 9 см) - диэтиловый эфир-уксусная кислота-гексан-этилацетат (20:20:20:40). Отмечали линию фронта, пластинку высушивали на воздухе 5-7 мин и помещали в элюент 2 (высота пробега 7 см) - этилацетат-муравьиная кислота-уксусная кислота-вода (67:7,5:7,5:18). Хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон. На хроматограммах извлечений из исследуемого сырья обнаружены зоны полифенольных соединений характерной окраски, среди которых идентифицирована кислота галловая по характерному значению величины Rf в сравнении с достоверным стандартным образцом. Сразу же после проявления хроматограмм пластины сканируют с помощью планшетного сканера (разрешение не менее 300 dpi), а полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometer». Результаты количественного определения полифенольных соединений в извлечении из плодов облепихи крушиновидной, а также метрологическая характеристика представлены в табл. 3.
Пример 3. Разработанный способ идентификации и количественного определения полифенольных соединений был апробирован на лекарственном растительном сырье коры дуба обыкновенного.
Получение извлечения: Около 5,0 г (точная навеска) высушенного измельченного сырья помешают в коническую колбу вместимостью 100 мл, прибавляют 70 мл воды очищенной (с учетом коэффициента водопоглощения сырья). Колбу присоединяют к обратному холодильнику, нагревают на кипящей водяной бане в течение 30 мин, периодически встряхивая для смывания частиц сырья со стенок. Затем колбу с содержимым настаивали при комнатной температуре в течение 10 мин. Извлечение фильтруют через несколько слоев марли, отжимая частицы сырья, в мерную колбу вместимостью 50 мл. При необходимости доводят объем до метки водой очищенной. Полученную суммарную вытяжку в количестве 10 мкл наносили на стартовую линию хроматографической пластинки и хроматографировали восходящим способом в условиях предлагаемого способа на пластинах размером 5×10 см. Элюент 1 (высота пробега 9 см) - диэтиловый эфир-уксусная кислота-гексан-этилацетат (20:20:20:40). Отмечали линию фронта, пластинку высушивали на воздухе 5-7 мин и помещали в элюент 2 (высота пробега 7 см) - этилацетат-муравьиная кислота-уксусная кислота-вода (67:7,5:7,5:18). Хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон. На хроматограммах извлечений из исследуемого сырья обнаружены зоны полифенольных соединений характерной окраски, среди которых идентифицированы кислота галловая и танин по характерному значению величин Rf в сравнении с достоверными стандартными образцами. Сразу же после проявления хроматограмм пластины сканируют с помощью планшетного сканера (разрешение не менее 300 dpi), а полученные изображения обрабатывают компьютерной программой «Sorbfil Videodensitometer». Результаты количественного определения полифенольных соединений в извлечении из коры дуба обыкновенного, а также метрологическая характеристика представлены в табл. 3.
Источники информации
1. Чумакова В.В. Фармакогностическое изучение лофанта анисового (Agastache Foeniculum (Pursh.) О. Kuntze) сем. яснотковые (Lamiaceae) / Автореф. дисс. канд. фарм. н. - Пятигорск, 2013. - 24 с.
2. О.Б. Рудаков, И.А. Востров, С.В. Федоров и др. Спутник хроматографиста. Методы жидкостной хроматографии. Воронеж: «Водолей», 2004, 528 с.
Способ определения полифенольных соединений методом ступенчатого элюирования в тонком слое сорбента характеризуется тем, что навеску исследуемого препарата растворяют в воде или навеску измельченного лекарственного растительного сырья экстрагируют водой при кипячении на водяной бане с последующим хроматографированием с использованием силикагелевых пластинок марки «Sorbfil» с алюминиевой подложкой ПТСХ-П-А в системе растворителей 1 (высота пробега 9 см) - диэтиловый эфир - уксусная кислота - гексан - этилацетат (20:20:20:40) с последующим высушиванием на воздухе в течение 5-7 мин, а затем повторно хроматографируют в системе растворителей 2 (высота пробега 7 см) - этилацетат - муравьиная кислота - уксусная кислота - вода (67:7,5:7,5:18); хроматограмму равномерно обрабатывают 1% спиртовым раствором железо-аммонийных квасцов из пульверизатора и высушивают в сушильном шкафу при температуре 80°C в течение 3-5 минут до проявления хроматографических зон; оптимальный объем пробы - 0,5 мкл спиртового раствора с содержанием галловой кислоты 5 мг/мл; 0,5 мкл спиртового раствора с содержанием танина 10 мг/мл и 1-2 мкл спиртового раствора с содержанием кверцетина 1 мг/мл, причем время насыщения камер парами элюентов - 40 мин, время элюирования - 35-40 мин в системе 1 и 20-30 мин в системе 2; после проявления хроматографических зон пластины сканируют с помощью планшетного сканера, а полученные изображения обрабатывают известной компьютерной программой «Sorbfil Videodensitometer», зоны полифенольных соединений идентифицируются по характерному значению величины Rf в сравнении с достоверными стандартными образцами, а количественное содержание галловой кислоты (с, мкг) в пробе, нанесенной на хроматограмму, в диапазонах концентраций 0,3-1,5 и 1,5-4,0 мкг/мкл рассчитывают по формулам соответственно: содержание танина (с, мкг) в пробе, нанесенной на хроматограмму, в диапазонах концентраций 0,5-4,5 и 5,0-7,0 мкг/мкл рассчитывают по формулам соответственно: содержание кверцетина (с, мкг) в пробе, нанесенной на хроматограмму, в диапазоне концентраций 1,0-6,0 мкг/мкл рассчитывают по формуле: где S - значение площади хроматографической зоны на хроматограмме, вычисленное с помощью компьютерной программы «Sorbfil Videodensitometer».