Применение соединений класса 1,3,4-тиадиазина в качестве средства коррекции экспериментального аллоксанового сахарного диабета
Иллюстрации
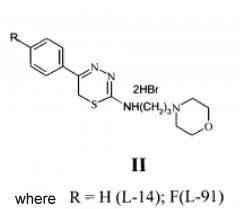
Показать всеИзобретение относится к области медицины, в частности к экспериментальной фармакологии, новым биологически активным соединениям общей формулы I, представляющим собой 2-морфолино-5-фенил-6Н-1,3,4-тиадиазин, гидробромид (L-17); 2-морфолино-5-(4′-фторфенил)-6Н-1,3,4-тиадиазин, гидробромид (L-31), или общей формулы II: 2-аминопропилморфолино-5-фенил-6Н-1,3,4-тиадиазин, дигидробромид (L-14); 2-аминопропилморфолино-5-(4′-фторфенил)-6Н-1,3,4-тиадиазин, дигидробромид (L-91) в качестве средства коррекции экспериментального аллоксанового сахарного диабета. Технический результат: вышеперечисленные соединения при внутримышечном введении в дозе 40 мг/кг обладают противодиабетическим действием при развитии аллоксанового сахарного диабета у крыс. 2 ил., 1 табл.
Реферат
Изобретение относится к области медицины, в частности к экспериментальной фармакологии (новым биологически активным соединениям).
Широкая распространенность сахарного диабета (СД) диктует необходимость поиска новых средств патогенетической терапии данного заболевания. Существующие подходы к терапии СД сводятся к заместительной инсулинотерапии в случае абсолютного дефицита инсулина при СД 1 типа, либо к назначению средств, стимулирующих секрецию инсулина и повышающих чувствительность к нему клеток-мишеней, при СД 2 типа [1, 2, 3]. Известны синтетические противодиабетические препараты в основном в классах азот- и серосодержащих органических соединений, таких как производные сульфонилмочевины, бигуаниды, тиазолидиндионы и др. [1, 2, 3]. Тем не менее, существующие подходы к лечению СД не могут обеспечить полной нормализации показателей нарушенного обмена веществ и предотвращения хронических осложнений заболевания - диабетических ангиопатий и нейропатии. В прогрессировании этих осложнений отводят ведущую роль двум взаимосвязанным биохимическим нарушениям - активации неферментативного гликозилирования белков и оксидативному стрессу [1, 4].
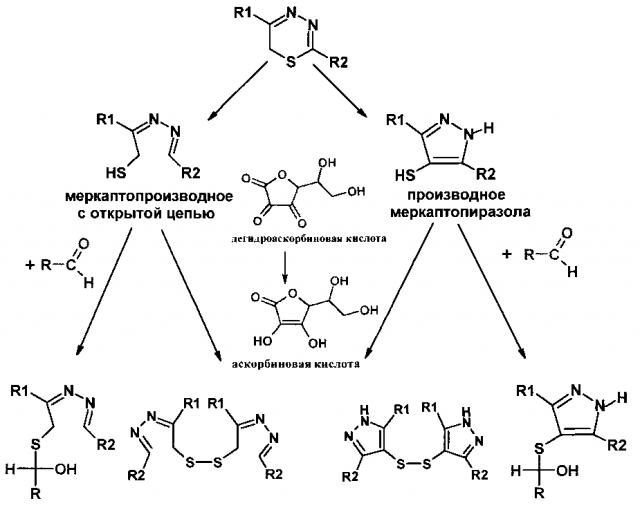
Неферментативное гликозилирование белков активируется при СД вследствие длительной и выраженной гипергликемии. Реакция гликозилирования протекает в три этапа: образование начальных продуктов процесса - шиффовых оснований и фруктозамина; деструктивное окисление начальных продуктов до карбонильных интермедиатов (глиоксаля, метилглиоксаля и др.); образование разнообразных конечных продуктов гликозилирования, необратимо повреждающих структуру белка (см. рис. 1).
Оксидативный стресс при СД связан с повышением образования свободных радикалов при гипергликемии, инактивацией антиоксидантных ферментов при их гликозилировании, истощением запасов низкомолекулярных антиоксидантов, в том числе тиолов, а также витаминов Е и С. Однако практическая медицина не располагает средствами лечения СД, сочетающими свойства антиоксидантов и блокаторов неферментативного глкозилирования белков.
В терапии сахарного диабета (в эксперименте и клинике) известно применение препаратов липоевой кислоты [3-5]. В механизме действия липоевой кислоты при СД прослеживается ее способность к трансформации в тиольную форму - дигидролипоевую кислоту в результате ферментативного восстановления in vivo дисульфидной связи в дитиолановом цикле. Дигидролипоевая кислота при пероральном и внутривенном введении проявляет свойства антиоксиданта и блокатора неферментивного гликозилрования белков.
В научном поиске новых эффективных противодиабетических средств мы обратили внимание на оригинальные синтетические соединения класса 1,3,4-тиадиазина, которые, в зависимости от природы его заместителей, обладают отличительным свойством - способностью к раскрытию и сужению гетерокольца с образованием их различных тиольных производных [6]. За последние 15 лет в этом классе были получены новые соединения с уникальным комплексом антиоксидантного, гипотермического, гипометаболического действия [7]. Были также найдены соединения, которые влияют на гемостаз [8] и обладают противовоспалительным эффектом [8]. Однако применения соединений класса 1,3,4-тиадиазина для коррекции экспериментального СД не было зарегистрировано.
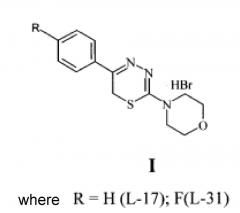
В результате широкого скрининга различных групп 1,3,4-тиадиазинов были выявлены в эксперименте in vitro 4 соединения общей формулы I и II, содержащие в качестве заместителей в положении-2 тиадиазинового кольца остатки морфолина(I) и 1-аминопропилморфолина(II), проявившие ярко выраженные противодиабетические свойства:
Общей формулы I: 2-морфолино-5-фенил-6Н-1,3,4-тиадиазин, гидробромид (L-17); 2-морфолино-5-(4′-фторфенил)-6Н-1,3,4-тиадиазин, гидробромид (L-31)
Общей формулы II: 2-Аминопропилморфолино-5-фенил-6Н-1,3,4-тиадиазин, дигидробромид (L-14); 2-Аминопропилморфолино-5-(4′-фторфенил)-6Н-1,3,4-тиадиазин, дигидробромид (L-91)
Для заявляемых соединений класса 1,3,4-тиадиазина I и II, в экспериментах in vitro, а затем и in vivo, была показана их высокая способность ингибировать неферментативное гликозилирование белков, а также их дозозависимая способность к снижению скорости окисления аскорбиновой кислоты кислородом воздуха (см. рис. 2).
Механизм ингибирования соединениями класса 1,3,4-тиадиазинов реакции неферментативного гликозилирования белков и окисления аскорбиновой кислоты до дегидроаскорбиновой кислоты кислородом воздуха мы связываем с вероятным образованием SH-замещенных производных 1,3,4-тиадиазинов (схема), подобно тому, как это наблюдается на примере их химической трансформации в кислых и щелочных средах [6].
Тиольные производные 1,3,4-тиадиазинов могут связывать глюкозу и карбонильные интермедиаты неферментативного гликозилирования белков и восстанавливать дегидроаскорбиновую кислоту до аскорбиновой кислоты (схема)
В результате поиска в научной литературе соединений, корригирующих метаболические нарушения при экспериментальном аллоксановом сахарном диабете, в статье [9] были найдены данные по комплексному соединению - производному 1,3,4-тиадиазола - бис{3-фенил-1-[2-(5-этил-1,3,4-тиадиазолил)]карбоксамидо-1,3-пропандионато} кадмию,
для которого была выявлена при тестировании гипогликемическая активность. Однако в этой публикации отсутствуют сведения об антиоксидантной активности этого соединения и его способности блокировать неферментативное гликозилирование белков.
Метод и результаты исследования
Эксперименты проведены на белых крысах-самцах линии Wistar массой 200-300 г.Для исследования способности соединений 1,3,4-тиадиазина корригировать течение экспериментального СД, моделировали аллоксановый СД путем трехкратного внутрибрюшинного введения аллоксана в суммарной дозе 300 мг/кг массы животного.
Эксперимент:
Одновременно с индукцией СД вводили внутримышечно раствор одного из соединений в дистиллированной воде (L-14, L-17, L-31 и L-92) в фармакологической дозе - 40 мг/кг массы животного с периодичностью 3 раза в неделю в течение 4 недель.
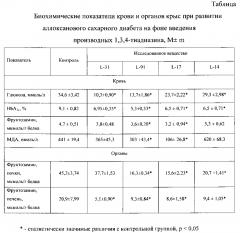
По окончании эксперимента в крови животных определяли концентрацию глюкозы и общего белка. Для характеристики активности процесса неферментативного гликозилирования белков (НГБ) у животных определяли концентрацию фруктозамина (ФА) плазмы и гликозилированного гемоглобина (HbA1c) крови, концентрацию ФА в гомогенатах органов. Активность свободно-радикального окисления липидов оценивали по концентрации малонового диальдегида (МДА) плазмы крови.
Согласно данным таблицы, введение аллоксана приводило к стойкой и выраженной гипергликемии, накоплению гликозилированных белков в крови и органах животных. Гипергликемия и активация неферментативного гликозилирования белков могли служить триггером оксидативного стресса, приводя к накоплению МДА в крови. Исследованные соединения 1,3,4-тиадиазина также обладали способностью частично корректировать метаболические нарушения при развитии аллоксанового СД. Так производные 1,3,4-тиадиазина вызывали снижение гипергликемии и концентрации HbA1c в крови, а также ФА в почках и печени животных.
Способность производных 1,3,4-тиадиазина ослаблять метаболические нарушения при развивающемся аллоксановом СД связываются, прежде всего, с защитой β-клеток островков Лангерганса от индуцированного аллоксаном оксидативного стресса, приводящего к гибели панкреатических эндокриноцитов. В качестве биохимического механизма такого влияния может рассматриваться способность производных 1,3,4-тиадиазина трансформироваться в тиольные производные (см. схему), увеличивающие эффективность антиоксидантной защиты β-клеток.
Техническим результатом данного изобретения является ранее неизвестное применение для коррекции экспериментального аллоксанового сахарного диабета соединений класса 1,3,4-тиадиазина.
Этот факт позволяет расширить и методологию поиска такого рода препаратов среди синтетических химических соединений, способных к трансформации в различные тиольные соединения и, таким образом, связывать глюкозу и карбонильные интермедиаты неферментативного гликозилирования белков.
Заявляемые соединения класса 1,3,4-тиадиазина перспективны для их углубленного изучения с целью создания эффективного лекарственного препарата для коррекции экспериментального аллоксанового сахарного диабета.
Список литературы
1. Сахарный диабет: диагностика, лечение, профилактика. Под ред. И.И. Дедова и М.В. Шестаковой. М., 2011. - 808 с.
2. Спасов А.А., Петров В.И., Чепляева Н.И., Ленская К.В. Фундаментальные основы поиска лекарственных средств для терапии сахарного диабета 2-го типа // Вестник РАМН. - 2013 - №2. - С. 43-49.
3. Аметов А.С. Сахарный диабет 2 типа. Проблемы и решения. М.: ГЭОТАР-Медиа, 2011. - 704 с.
4. Балаболкин М.И. Роль окислительного стресса в патогенезе диабетической нейропатии и возможность его коррекции препаратами α-липоевой кислоты / М.И. Балаболкин, В.М. Креминская, Е.М. Клебанова // Пробл. эндокринол. - 2005. - Т. 51, №3. - С. 22-33.
5. Нейрозащита α-липоевой кислотой при стрептозотоцин-индуцированном диабете / Г. Байдас, Е. Дондер, М. Килибоз, Е. Сонкая, М. Тузку, А. Язар, B.C. Недзветский // Биохимия. - 2004. - Т. 69, вып. 9. - С. 1233-1238.
6. Сидорова Л.П., Перова Н.М., Егорова Л.Г., Новикова А.П. Изучение реакционной способности 1,3,4-тиадиазинов в кислой и щелочной средах при трансформации в пиразолы // Тезисы I Всесоюзной конференции по теоретической органической химии. Волгоград, 29.09-05.10 1991 г. С. 232.
7. О.Н. Чупахин, Л.П. Сидорова, Э.А. Тарахтий, А.П. Новикова, Н.М. Перова и др., Патент РФ №2152943 (2000).
8. О.Н. Чупахин, Л.П. Сидорова, Н.М. Перова и др. Патент РФ №2456284 (2012).
9. Н.А. Пулина, В.В. Юшков, Т.А. Юшкова, П.А. Мокин, Е.А. Голышева, В.В. Залесов. Патент РФ №2364591 (2008).
Применение соединения формулы (I) или формулы (II) в качестве средства коррекции экспериментального аллоксанового сахарного диабета.