Способ определения содержания продуктов протеолиза в плазме крови и диагностическая тест-система для его осуществления
Иллюстрации
Показать всеГруппа изобретений относится к области медицины и иммунологии. В частности, группа изобретений относится к способам иммунологической диагностики, включающим применение как нативной молекулы, так и пептидных последовательностей фрагментов плазминогена, которые могут быть использованы в качестве универсальной системы детекции продуктов протеолиза с образованием на COOH-концах пептидной цепи лизина при проведении анализа для выявления у человека заболеваний, ассоциированных с повышенной активностью протеолитических ферментов. Группа изобретений касается также тест-системы, содержащей в качестве детектора как нативную молекулу, так и указанные пептидные последовательности. Технический результат заключается в достижении необходимой степени диссоциации комплекса антиген-антитело, присутствующего в образце, взятом у субъекта, а также в изменении конформации белков, что, в свою очередь, позволяет существенно повысить чувствительность метода определения уровня протеолитических фрагментов с C-концевым лизином, способных связываться с плазминогеном или его фрагментами. 3 н. и 8 з.п. ф-лы, 2 ил., 2 табл., 2 пр.
Реферат
Группа изобретений относится к области медицины и иммунологии. В частности, группа изобретений относится к способам иммунологической диагностики, включающим применение как нативной молекулы, так и пептидных последовательностей фрагментов плазминогена, которые могут быть использованы в качестве универсальной системы детекции продуктов протеолиза с образованием на COOH-концах пептидной цепи лизина (C-концевой лизин) при проведении анализа для выявления у человека заболеваний, ассоциированных с повышенной активностью протеолитических ферментов. Группа изобретений касается также диагностической тест-системы, содержащей в качестве детектора как нативную молекулу, так и указанные пептидные последовательности.
Терминология
Технические и научные термины, использованные в описании изобретения, имеют тот же смысл и значение, которые обычно применяются в соответствующих областях науки и техники.
Термин "антиген", используемый в изобретении, относится к белкам или их фрагментам, способным связываться с антителами.
Термин "детектор", относится к пептидной последовательности способной связываться с C-концевым лизином образовавшимся в белках после их протеолиза.
Термин "крингл" относится к белковому домену, имеющему структуру, стабилизированную тремя дисульфидными связями.
Термин "домен" относится к участку белка, характеризующемуся определенными структурными или функциональными свойствами.
Термин "анализ" относится к методам выявления высокомолекулярных соединений, включающий в себя стадии: (а) стадию контактирования антигена с биологическим образцом при условиях, подходящих для образования комплексов антиген-антитело или антиген-лиганд и (б) стадию детекции указанных комплексов.
Термин «маркер» относится к высокомолекулярным соединениям определенной структуры, выявление которых в образцах тканей человека ассоциировано с определенным спектром заболеваний.
Термин «эпитоп» в настоящем изобретении относится к участку белковой молекулы, который способен образовать связь с антителом.
Термин «лиганд» в настоящем изобретении относится к белковой молекуле, который способен образовать нековалентную связь с другой белковой молекулой.
Термин «диагностический тест» представляет собой определение диагностического показателя с помощью конкретного лабораторного метода, аналитические параметры которого остаются на постоянном уровне.
Уровень техники
Необходимость поиска новых маркеров для проведения диагностики заболеваний, ассоциированных с повышенным уровнем протеолитической активности в организме, в частности при возникновкнии онкологических процессов на наиболее ранних сроках не вызывает сомнений. Развитие опухоли сопровождается высоким уровнем протеолиза (Al-Majid S., Waters H. The biological mechanisms of cancer-related skeletal muscle wasting: the role of progressive resistance exercise // Biol. Res. Nurs. 2008. Vol. 10, №1. P. 7-20). Сегодня протеазы рассматривают, как один из факторов канцерогенеза (Bashir Т., Pagano M. Aberrant ubiquitin-mediated proteolysis of cell cycle regulatory proteins and oncogenesis // Adv. Cancer. Res. 2003. Vol. 88. P. 101- 144). В протекании канцерогенеза установлено участие всех типов протеаз, под действием которых усиливается пролиферация, инвазия, метастазирование клеток опухоли (Чилингиров Р.Х. Влияние ингибиторов протеолиза на некоторые бактериальные возбудители и течение гнойно-воспалительного процесса // Пат. физиол. и эксперим. терапия. 1997. №3. С. 37-39; K. Proteinase-activated receptor 2 (PAR-2) in gastrointestinal and pancreatic pathophysiology, inflammation and neoplasia // Scand. J. Gastroenterol. 2008. Vol. 43, №8. P. 902-909), но наибольший вклад в этот процесс вносят сериновые протеазы (Zorio Ε., J., F., L.A., R., A. Fibrinolysis: the key to new pathogenetic mechanisms // Curr. Med. Chem. 2008. Vol. 15, №9. P. 923-929). Мишенями сериновых протеаз в основном являются пептидные связи, образованные остатками положительно заряженных аминокислот, лизина и аргинина, а также эфиры и амиды этих аминокислот (Фершт Э. Структура и механизм действия ферментов. Под ред. Курганова Б.И. Москва: «Мир», 1980. 432 с). В настоящее время опубликован ряд работ, показывающих, что продукты протеолитической активности могут служить универсальными маркерами, обнаружение которых у человека может быть ассоциировано с различными аутоиммунными и онкологическими процессами. Так, например, согласно работам Robert Jordan et. all (патент US08501907), повышенное содержание продуктов протеолиза иммуноглобулинов может служить маркером наличия аутоиммунного или онкологического заболевания. Авторы предложили метод определения продуктов протеолиза иммуноглобулинов на основе использования поликлональных и моноклональных антител к этим продуктам. В работе Peter C. Harpel et al (The J. of biological chemistry Vol. 264, No. 1, Iseue of January 5, pp. 616-624,1989), представлены данные о специфическом протеолизе иммуноглобулинов плазмином. При этом часть молекулы иммуноглобулина после расщепления специфически может взаимодействовать с молекулой плазминогена благодаря наличию c-концевого лизина. Плазмин обычно получают из плазминогена путем его активации стрептокиназой, урокиназой. Плазмин относится к эндопептидазам - сериновым протеазам трипсиноподобного действия. Известно, что плазмин обладает фибринолитической активностью посредством связывания с C-концевыми лизиновыми остатками фибрина и дальнейшим протеолизом нитей фибрина, предотвращая образование сгустка. Участие С-концевых лизинов в связывании белков с плазминогеном продемонстрировано в работе Marco Candela et al. (Binding of Human Plasminogen to Bifidobacterium, Journal of bacteriology, Aug. 2007, p. 5929-5936). В этой работе белки, которые связывались с плазминогеном подвергались обработке карбоксипептидазой-B, которая специфически отщепляет только C-концевые лизин и аргинин. После такой обработки, белки теряли способность связываться с плазминогеном, что указывает на исключительное участие C-концевых лизинов в связывании с плазминогеном и его крингловыми фрагментами. Система плазминоген/плазмин принимает активное участие не только в процессах фибринолиза, но и тесно связанна с ангиогенезом и канцерогенезом. Функционально значима не только нативная молекула плазминогена (плазмина), но и целый спектр продуктов ее деградации. Ферментативно деградированные формы плазмина по своему действию на низкомолекулярные субстраты могут превосходить цельную молекулу (Ю.Г. Клысь, Н.В. Зайцева, А.И. Кизим, C.B. Веревка, Протеолитические производные плазминогена при развитии злокачественных новообразований, Онкология, Τ 12, №1, 2010). Описаны варианты существования кринглов плазминогена в плазме: K1-3; K2-3; K1-4; K1-4,85; K1-5 и отдельные кринглы (Perri S, Martineau D, Francois M, et al. Plasminogen kringle 5 blocks tumor progression by antiangiogenic and proinflammatory pathways. Mol Cancer Ther 2007; 6: 441-449). Известно, что все кринглы, а также их комбинации, принимают активное участие в ангиогенезе и онкогенезе. Кроме того они имеют лизин-связывающие сайты (за исключением 3 крингла). Наиболее изучена функциональная активность первых четырех кринглов (K1-4). Последовательность из этих кринглов представляет ангиостатин (Francis J. Castellino, Victoria A. Ploplis, Structure and function of the plasminogen/plasmin system, Thromb Haemost 2005; 93: 647-54; C. Boccaccio and Paolo M. Comoglio Cancer Res 2005; 65(19): 8579-82; Rijken DC, Lijnen HR. New insights into the molecular mechanisms of the fibrinolytic system. J Thromb Haemost 2009; 7: 4-13). Активация сериновых протеаз, которые являются основными участниками процессов протеолиза во время канцерогенеза, приводит к увеличению количества продуктов распада белков, имеющих как было описано выше, C-концевой лизин. Поскольку сама молекула плазминогена/плазмина, а также ее фрагменты имеют лизин связывающие сайты, они могут связываться с продуктами деградации сериновых протеаз и служить детектором как самого процесса канцерогенеза, так и его активности, а также активности самих сериновых протеаз в крови при других патологических процессах. Такой детектор обладает универсальностью по сравнению с предлагаемыми способами детекции продуктов деградации, которые требуют для этого использования моноклональных антител получаемых на каждый продукт протеолиза. Определение уровня продуктов протеолиза в образцах плазмы человека и животных можно проводить с помощью иммуноанализа, например иммуноферментного анализа (ИФА), где в качестве детектора используется молекула плазминогена или ее фрагменты.
В настоящее время используется огромное количество всевозможных разновидностей и модификаций ИФА. Широкое распространение получили разные варианты твердофазного иммуноферментного анализа (ELISA).
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец и контроли сравнения. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент(метка) или антиген-фермент(метка) он связывается с комплементарным участком комплекса антиген-антитело на твердой фазе. Инкубация субстрата в лунках со связавшимся конъюгатом приводит к развитию цветной реакции или проявлению флюоресценции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания или флуоресценции можно оценить визуально или по оптической плотности.
Уровень содержания фрагментов иммуноглобулинов и других белков после протеолиза определяют при помощи непрямого ИФА. В лунках панелей адсорбируют антитела против искомых белков (антигенов) и инкубируют с образцами сыворотки или другого биологического материала, полученного от больного (спинномозговая жидкость, слюна и др.). Специфические антигены, связавшиеся с антителами на твердой фазе, выявляют с помощью вторых антител к другому эпитопу антигена, конъюгированных с ферментом или флуоресцентной меткой. Также может использоваться конюгат моноклональных антител ко вторым антителам. В зависимости от цели анализа используют разные антиглобулиновые реагенты, выявляющие антитела всех изотипов, либо специфичные к отдельным классам и подклассам иммуноглобулинов. Основное достоинство метода состоит в универсальности конъюгата. Реакция методически проста.
Основные этапы непрямого ИФА для определения наличия специфического антигена (или антитела) в исследуемом образце:
1. Антиген, лиганд (антитело) адсорбируют на твердой фазе, затем отмывают от несвязавшихся компонентов.
2. Блокируют свободные места связывания. Отмывают.
3. В лунки вносят исследуемый материал, инкубируют и затем проводят процедуру отмывки. Параллельно ставят пробы с положительным и отрицательным контролями.
4. Добавляют вторые антитела с конюгатом (или антиглобулиновый конъюгат) в рабочем разведении, инкубируют, отмывают от несвязавшихся компонентов.
5. Вносят субстрат, инкубируют. По достижении оптимального уровня окрашивания в лунках с положительным контролем реакцию останавливают, добавляя стоп-раствор.
6. Измеряют количество продукта реакции на ИФА-ридере.
При оптимальных условиях проведения анализа метод является высокоспецифичным и чувствительным. Он позволяет выявлять нанограммовые количества антигена (антител) в сыворотках (плазме) исследуемых больных.
Однако в существующих методах иммунного анализа, предназначенных для определения титра антигена, существует ограничение, связанное с присутствием не только свободного антигена, но и комплекса антигена с другими белками в пробе. Этот комплекс не связывается с твердой фазой и тем самым маскирует истинную концентрацию антигена в пробе. При достаточно высокой концентрации комплекса результаты становятся ложноотрицательными. Для определения истинной концентрации антигена требуется диссоциация этого комплекса. Исследование свойств связывания комплекса антиген-антитело показало, что использование различных органических растворителей позволяет повысить чувствительность реакции (Mohd. Rehan, Hina Younus, Int. J. of Biol. Macromolecules, Effect of organic solvents on the conformation ant interaction of catalase and anticatalase antibodies).
Нами был разработан метод и тест-система на его основе позволяющая повысить чувствительность определения продуктов протеолиза. В отличие от методов, применяемых на сегодняшний день для детекции фрагментов иммуноглобулинов и других белков после протеолиза с C-концевым лизином в заявленном изобретении для проведения иммуноанализа в качестве антигенов и детекторов наряду с полноразмерным белком(плазминогеном) были использованы фрагменты плазминогена определенной структуры. Также для детекции фрагментов иммуноглобулинов и других белков после протеолиза с C-концевым лизином применялись органические компоненты в составе буферных систем, позволяющие существенно повысить чувствительность диагностической тест-системы.
Раскрытие изобретения.
Повышенный уровень фрагментов иммуноглобулинов и других белков после протеолиза с образованием C-концевого лизина, способных связываться с плазминогеном или его фрагментами, являются диагностическим признаком заболеваний, ассоциированных с повышенным уровнем фрагментов иммуноглобулинов и других белков после протеолиза.
Авторы изобретения предположили, что в области хронического воспаления, которое наблюдается при опухолевом процессе, происходит активация сериновых протеаз, что приводит к увеличению продуктов распада белков с C-концевым лизином. Эти продукты протеолиза выходят в кровь и их количество можно определить при помощи анализа крови. Эксперименты, проведенные авторами изобретения, показали, что продукты протеолиза с C-концевым лизином можно обнаружить с помощью плазминогена или его фрагментов.
Таким образом, повышение титра продуктов протеолиза с C-концевым лизином в плазме является маркером заболеваний, ассоциированных с повышенным уровнем продуктов протеолиза с C-концевым лизином, и измерение содержания уровня данных белков в плазме крови может использоваться в качестве диагностического признака развивающегося патологического процесса.
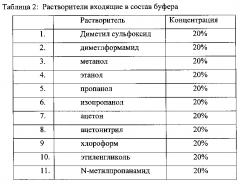
Для повышения чувствительности метода определения титра протеолитических фрагментов белков с C-концевым лизином, впервые были использованы оригинальные составы буферных растворов, которые включают различные органические растворители уменьшающие гидрофобные связи между молекулами. (диметилсульфоксид, диметлформамид, метанол, этанол, пропанол, изопропанол, ацетон, ацетонитрил, хлороформ, этиленгликоль, N-метилпропанамид)
В настоящее время в опубликованных источниках отсутствуют какие-либо данные об использовании предложенных компонентов в составе буфера для инкубации образцов плазмы в известных методах определения уровня протеолитических фрагментов белков с C-концевым лизином.
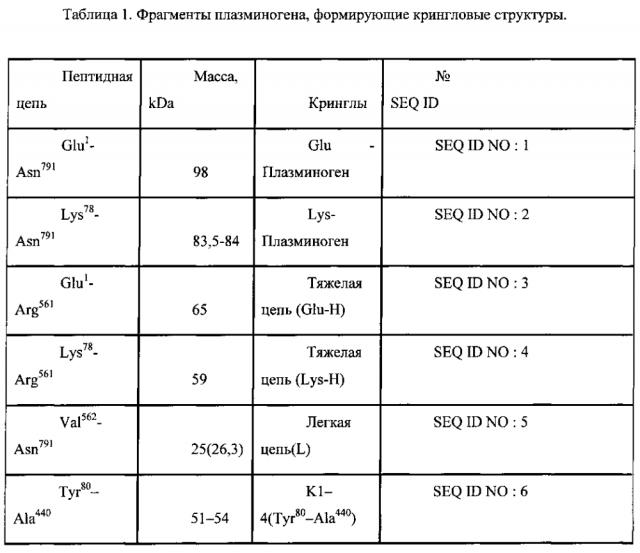
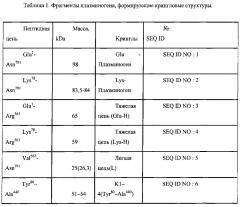
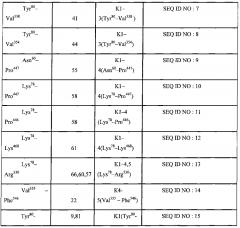
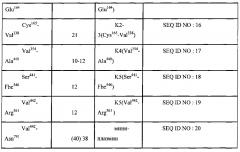
Авторы изобретения раскрывают новый способ определения уровня протеолитических фрагментов с C-концевым лизином в крови, представляюший собой диагностическую тест-систему для выявления субъекта с повышенным содержанием протеолитических фрагментов с C-концевым лизином способных связываться с плазминогеном или его фрагментами включающую буфер для инкубации, содержащий органические компоненты, антиген или детектор представляющие собой полноразмерный плазминоген или его фрагмент, являющийся по меньшей мере одной из последовательностей представленных в таблице 1 (SEQ ID NO: 1-20) и контрольную пробу К, при этом состав буфера включает по меньшей мере 1 компонент, выбранных из группы: диметилсульфоксид, диметлформамид, метанол, этанол, пропанол, изопропанол, ацетон, ацетонитрил, хлороформ, этиленгликоль, N-метилпропанамид.
При этом фрагмент плазминогена в заявленной тест-системе выбран из списка представленном в таблице 1. При этом контрольной пробой К в заявленной тест-системе является проба, взятая у здорового субъекта.
Плазминоген и/или его фрагмент могут быть иммобилизованы на твердом носителе, который в свою очередь также может входить в состав тест-системы. На твердом носителе могут быть иммобилизованы такжк антитела к продуктам протеолиза с C-концевым лизином, с которыми в свою очередь взаимодействуют плазминоген или его фрагмент, являющийся по меньшей мере одной из последовательностей представленных в таблице 1 (SEQ ID NO: 1-20).
При осуществлении способа определения уровня протеолитических фрагментов с C-концевым лизином в крови с использованием заявленной тест-системы, фрагменты плазминогена выбраны из списка представленного в таблице 1: При этом выявление протеолитических фрагментов с C-концевым лизином проводят при помощи иммунной реакции с последующей детекцией колориметрическим, флуоресцентным или кондуктометрическим методами.
При этом превышение значения уровня протеолитических фрагментов с C-концевым лизином в исследуемой пробе по сравнению с контрольной пробой К более чем на 30% является показателем наличия у субъекта патологического процесса.
Заявленную тест-систему применяют для выявления риска развития у субъекта онкологического или аутоиммунного процесса.
Количество связавшихся протеолитических фрагментов с C-концевым лизином может быть определено с помощью любых методов детекции известных в настоящее время: колориметрическим, флуоресцентным или кондуктометрическим (использование электрической проводимости).
Способ позволяет использовать заявленную диагностическую тест-систему для выявления субъекта, имеющего повышенный уровень протеолитических фрагментов с C-концевым лизином способных связываться с плазминогеном или его фрагментами. Для того, чтобы диагностировать повышенный уровень по сравнению с нормальным уровнем протеолитических фрагментов с C-концевым лизином у исследуемого субъекта, проводят сравнение полученного для него уровня исследуемых белков с C-концевым лизином с уровнем, обнаруживаемом в контрольном образце, полученном от здорового донора (доноров).
Таким образом, авторы усматривают технический результат в достижении необходимой степени диссоциации комплекса антиген-антитело, присутствующего в образце, взятом у субъекта, а также в изменении конформации белков за счет использования буфера для инкубации, содержащего органические растворители в раскрытых соотношениях, что в свою очередь позволяет существенно повысить чувствительность метода определения уровня протеолитических фрагментов с C-концевым лизином способных связываться с плазминогеном или его фрагментами.
Лиганды и детекторы для проведения иммуноанализа
По своей химической природе плазминоген является гликопротеином, молекула которого содержит 791 аминокислотных остатков и 24 дисульфидных мостика. Белок состоит из одной полипептидной цепи, где N-концевой аминокислотой является глютамин, С-концевой аспарагин. В состав молекулы входит 2%-3% углеводов, локализованных в тяжелой цепи. Олигосахариды присоединяются к Асп288 и Тре345. При активации плазминогена, происходит расщепление пептидной связи Арг560-Вал561 и образуются две цепи, легкая и тяжелая, соединенные дисульфидными связями. В легкой цепи (Вал561 - Асн790) находится активный протеазный центр, включающий аминокислотную последовательность: серии, гистидин, аспарагин. В тяжелой цепи плазмина (Лиз78 - Арг560) имеется 5 близких по аминокислотной последовательности петлеобразных участка - доменов или кринглов, которые представляют собой компактные структуры глобулярного типа с хорошо выраженным гидрофобным ядром. Подобные структуры принимают участие в осуществлении белковых взаимодействий в процессе свертывания крови. Кринглы тяжелой цепи обозначаются К1, К2, К3, К4, К5. В доменах К1-5 локализованы специфические участки, обладающие сильным сродством к лизину, ε-аминокапроновой кислоте, парааминобензойной кислоте и другим ω-карбоновым аминокислотам, обладающими антифибринолитическими свойствами.
Лизинсвязывающие участки (ЛСУ) играют важную роль во взаимодействиях между плазмином (плазминогеном) и фибрином, а также плазмином и его ингибитором - а2-АП (антиплазмин). Любой из фрагментов плазминогена, содержащий крингл, независимо от того, является ли он продуктом естественного расщепления в организме человека или получен в результате расщепления плазминогена in vitro (например, в результате ферментативного воздействия), может быть использован для выявления протеолитических фрагментов с C-концевым лизином.
Для определения титра протеолитических фрагментов с C-концевым лизином при различных заболеваниях, связанных с накоплением белков после протеолиза с C-концевым лизином способных связываться с фрагментами плазминогена в качестве детектора, помимо фрагментов плазминогена, может использоваться также полноразмерная молекула плазминогена.
Полноразмерный плазминоген и различные продукты его расщепления: тяжелая цепь и любой из фрагментов, содержащий крингл, могут быть использованы в качестве лиганда иммобилизованного на твердой фазе для связывания белков после протеолиза с C-концевым лизином в образцах плазмы крови человека.
Данные лиганды и детекторы являются протеолитическими производными нативного Glu-плазминогена, либо могут быть получены с помощью генно-инженерных методов, путем синтеза рекомбинантного пептида в эукариотических или бактериальных системах экспрессии. Рекомбинантные лиганды и детекторы соответствуют аминокислотной последовательности плазминогена человека. В частности, лигандом и детектором для осуществления раскрытого в изобретении способа диагностики, кроме полноразмерного плазминогена, могут являться также фрагменты представленные в таблице 1.
Авторы изобретения впервые обнаружили и экспериментально подтвердили, что плазминоген или его фрагменты могут быть использованы в качестве лигандов и детекторов для определения титра протеолитических фрагментов с C-концевым лизином при постановке иммуноферментной реакции, где исследуемым образцом является образец плазмы крови человека, и результат данной реакции может быть использован в качестве значимого диагностического признака для выявления наличия патологического процесса у исследуемого субъекта.
Авторы впервые применили способ обработки образцов плазмы с использованием диметилсульфоксида, диметлформамида, метанола, этанола, пропанола, изопропанола, ацетона, ацетонитрила, хлороформа, этиленгликоля, N-метилпропанамида в составе буфера инкубации, который позволяет улучшить чувствительность метода, т.е. увеличить количество обнаруженных позитивных образцов, по сравнению с методами, используемыми ранее, где буферный раствор для инкубации не имел в своем составе предложенных компонентов.
Несмотря на то, что раскрытый в настоящем изобретении способ определения основан на использовании строго определенных полипептидов и использовании специфических компонентов в составе буфера инкубации, квалифицированному специалисту в данной области техники очевидно, что аналогичным образом могут быть использованы и другие белки и пептиды, имеющие в своем составе данные аминокислотные последовательности, а также любые сочетания предложенных компонентов в составе буфера инкубации, идентичные раскрытым в изобретении.
Специалисту очевидно также, что в качестве антигенов и детекторов по настоящему изобретению могут быть использованы любые полипептиды, обладающие значительным уровнем гомологии (80% и выше) с заявленными полипептидами, так как замена отдельных аминокислот, не изменяющая пространственной структуры крингла, не является препятствием для детекции протеолитических фрагментов с C-концевым лизином.
В таблице 1 приведено описание различных полипептидов - производных плазминогена, формирующих кринглы, которые могут быть использованы для постановки иммуноферментной реакции с образцами плазмы крови человека для выявления протеолитических фрагментов с C-концевым лизином.
В Таблице 2 приведены различные органические компоненты в составе основного буфера, использованного для первичной обработки образцов плазмы.
Состав основного буфера инкубации: может быть следующим 5-25% органического компонента представленного в таблице 2 в 0,15 M Трис-HCl pH 8,8.
Краткое описание чертежей
Фиг. 1. Первичная структура плазминогена человека.
Черными стрелками показано место расщепления пептидных связей: (а) отщепление сигнального пептида - требуется для образования нативной формы Glu-плазминогена; (b) отщепление активационного пептида (Glu′-Lys77) и превращение Glu-плазминогена в Lys78-плазминоген или Glu-плазмина в Lys78-плазмин; (с) расщепление пептидной связи Arg561-Val562 и превращение плазминогена в плазмин.
Белыми стрелками показаны границы интронов в нуклеотидной последовательности гена плазминогена человека. Треугольники обозначают места прикрепления N-связанных олигосахаридов в положении 289 и O-связанных гликанов в позиции 346. Каталитические триады His603, Asp646, и Ser741, обозначены звездочкой (*). Дисульфидные связи обозначены сплошной линией.
alanine-ala-A; arginine-arg-R; asparagine-asn-N; aspartic acid-asp-D; cysteine-cys-С; glutamine-gln-Q; glutamic acid-glu-Ε; glycine-gly-G; histidine-his-H; isoleucine-ile-I; leucine-leu-L; lysine-lys-K; methionine-met-M; phenylalanine-phe-F; proline-pro-P; serine-ser-S; threonine-thr-T; tryptophan-trp-W; tyrosine-tyr-Y; valine-val-V.
Фиг 2. Схема получения тяжелой (К1-5+30r) и легкой цепей (микро-плазмина) Glu-плазминогена.
Осуществление изобретения
Плазминоген и его фрагменты, раскрытые в настоящем изобретении (табл. 1), были получены либо генноинженерным способом, либо очищены из плазмы крови и использованы в качестве антигенов и детекторов для создания наборов для иммунного анализа при определении титра протеолитических фрагментов с C-концевым лизином в крови пациентов с различными патологиями в том числе онкологическими заболеваниями.
Выделение лигандов для проведения иммуноанализа
Получение Тяжелой цепи (Glu-H) Glu1-Arg561 и Легкой цепи (L) Val562-Asn791 цепи плазминогена.
Принцип метода состоит в активации плазминогена в плазмин с последующим восстановлении S-S-связей между тяжелой и легкой цепями в условиях, исключающих автолиз, и выделении фрагментов аффинной хроматографией на Lys-Сефарозе 4В. Урокиназа разрывает активационную связь Arg561-Val562 в плазминогене. Образующийся плазмин разрывает связь 77-78 и отщепляется N-терминальный пептид (1-77). Меркаптоэтанол восстанавливает связи Cys558-Cys566 и Cys548-Cys666, соединяющие тяжелую и легкую цепи.
Первый этап: выделение достаточного количества Glu-Pg из плазмы крови. Glu-Плазминоген выделяли из замороженной донорской плазмы крови человека с помощью аффинной хроматографии на Lys-сефарозе 4В при 4°С и pH 8,0. Плазму крови размораживали в присутствии апротинина, центрифугировали 30 min при 4°С и разбавляли в 2 раза 0,02 M К-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин. Подготовленную плазму наносили на колонку с Lys-сефарозой 4В, уравновешенную 0,1 M К-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин. Колонку промывали от несвязавшихся белков 0,3 M К-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин, в течение ночи под свободным протоком до А280=0,05-0,01. Сорбированный Glu-Pg элюировали раствором 0,2 M 6-аминокапроновой кислоты 0,1 M К-фосфатном буфере, pH 8,0, содержавшем 20 KIU/ml апротинин. Фракции, содержавшие белок, объединяли и подвергали дополнительной очистке осаждением (NH4)2SO4 (0,31 g/ml раствора белка). Осадок оставляли при 4°С на 18-24 часа, после чего отделяли центрифугированием и растворяли в 0,05 M Трис-HCl буфере, pH 8,0 до концентрации порядка 1,5-2,0 mg/ml. Очищенный Glu-Pg диализовали при 4°С против воды (pH 8,0) и лиофилизировали.
Второй этап: получение двухцепочечного плазмина путем активации одноцепочечного Glu-Pg урокиназой (фирмы "Wakamoto Pharmaceutical Co. Ltd." (Корея). К раствору Glu-Pg (5 mg/ml) в 0,05 M Трис-HCl буфере, pH 8,8, содержавшем 0,02 M L-лизин, 0,15 M NaCl, 20% глицерин и 6000 KIU/ml апротинина, добавляли урокиназу до конечной концентрации 600 IU/ml и инкубировали 4 часа при 37°С. Полноту превращения Glu-Pg в плазмин контролировали по росту до максимального значения скорости гидролиза специфического субстрата плазмина S-2251 (HD-Val-Leu-Lys p-nitroanilide, "Sigma", США) в пробах, отобранных из реакционной смеси.
Третий этап: восстановление S-S-связей между тяжелой и легкой цепями плазмина. К полученному раствору плазмина добавляли меркаптоэтанол до конечной концентрации 0,25 тМ и инкубировали в токе азота в темноте в течение 20 мин. Образовавшиеся свободные SH-группы блокировали, инкубируя реакционную смесь со свежеприготовленным раствором йодоуксусной кислоты в 0,1 M Na-фосфатном буфере, pH 8,0 (конечная концентрация 0,315 М) и инкубировали 20 мин.
Четвертый этап: разделение тяжелой и легкой цепей плазмина хроматографией на колонке с Lys-Сефарозе 4В. Реакционную смесь разбавляли до концентрации 1 мг/мл 0,1 M Na-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин и наносили на колонку с Lys-Сефарозой 4В, уравновешенную тем же буфером. Хроматографию проводили при 25°С. Тяжелая цепь плазмина, содержащая кринглы 1-5 и 30 аминокислотных остатков соединительного пептида, сорбируется на аффинном носителе, а легкая цепь не сорбируется и элюируется уравновешивающим буфером Тяжелую цепь (Mr ~ 56-57 kDa) элюировали раствором 0,2 M раствором 6-аминокапроновой кислоты в 0,1 M Na-фосфатном буфере, pH 8,0. Объединенные фракции диализовали против воды (~ pH 8,0) и высушивали лиофильно. При необходимости препарат растворяли в 0,05М Трис-HCl буфере, pH7,4 и дополнительно очищали с помощью гель-фильтрации на колонке с Сефадексом G-75 (1,65×80 cm). Объединенные фракции белкового пика диализовали против воды pH 8,0 и лиофилизировали.
Чистоту и молекулярную массу препаратов оценивали методом электрофореза в 12% ПААГ в присутствии 0,1% SDS. Кроме того, отсутствие амидазной активности (по S-2251) до и после инкубации ее раствора со стрептокиназой свидетельствовало, что тяжелая цепь не содержит следовых концентраций мини-плазминогена, которые могли не обнаружиться при электрофорезе.
Получение Lys-плазминогена (Lys78-Asn791) и Тяжелой цепи (Lys-Η Lys78-Arg561) проводили тем же самым методом, только без добавления ингибитора - апротинина.
Получение миниплазмина (Val442-Asn791) Миниплазмин включает в себя К5 и легкую цепь плазмина. Его последовательность начинается от Val442 и до Asn791 включительно. Получается он при эластолизе Lys-плазминогена (Lys78-Asn791) дальнейшей доочисткой гель-фильтрацией на сефодексе G-75.
Получение крингла К1-4,5 (Lys78-Arg530) проводили по методике, описанной в работе Cao R., Wu H.L., Veitonmaki Ν., Linden P., Farnedo J., Shi C.Y., and Cao Y. (1999) Proc. Natl. Acad. Sci. USA,. 96, 5728-5733., с некоторыми модификациями. Glu-плазминоген (10 мг/мл) активировали урокиназой (600 МЕ/мл) в 0,05 M фосфатном буфере pH 9,0, содержащем 0,02 M L-лизин и 0,1 M NaCL, при 37°. Полноту превращения плазминогена в плазмин контролировали по увеличению амидазной активности раствора до максимального значения. К раствору плазмина добавляли равный объем 0.2 M глицеринового буфера, pH 12,0 и инкубировали в течение 18 ч при 25° и конечном значении pH 10,5. Реакционную смесь разбавляли в 5 раз буфером, содержащим 0,1 M фосфатный буфер, pH 8,0 и 40 KIU/мл апротинина, и наносили на колонку с Lys-сефарозой 4В, уравновешенную тем же буфером. После выхода микро-плазмина, сорбированный ангиостатин К1-4,5 элюировали с колонки 0,2 M раствором 6-аминокапроновой кислоты в 0,1 M фосфатный буфер, pH 8,0 и 40 KIU/мл апротинина, диализовали против воды и лиофилизировали. Чистоту препарата проверяли с помощью SDS-ПААГ-электрофореза в 12%-ном геле. Кроме того К 1-4,5 может быть естественным продуктом, включающим кринглы 1-4 плюс 85% К5, (Lys78-Arg530). Плазмин превращается в К1-4,5 в две стадии. Сначала плазминоген переходит в плазмин, затем плазмин подвергается аутопротеолизу внутренней петли 5 крингла. Аутопротеолиз может быть вызван свободными сульфгидрильными донорами или щелочной средой. Кроме того такая деградация плазмина происходит при добавлении к субстрату концентрированной ростовой среды клеток HT 1080, а также ряда других культивированных опухолевых клеток. В этот процесс вовлечена плазмин-редуктаза, которая содержится в ростовой среде опухолевых клеток (Paul Stathakis, Angelina J. Lay, Melinda Fitzgerald, Christian Schlieker, Lisa J. Matthias and Philip J. Hogg, Angiostatin Formation Involves Disulfide Bond Reduction and Proteolysis in Kringle 5 of Plasmin, J. Biol. Chem. Vol. 274, No. 13, Issue of March 26, pp. 8910-8916, 1999; Soff G. A. Angiostatin and angiostatin-related proteins, Cancer Metastasis Rev., 19: 97-107, 2000; Hao Wang, Ryan Schultz, Jerome Hong, Deborah L. Cundiff, Keyi Jiang, and Gerald A. Soff, Cell Surface-Dependent Generation of Angiostatin 4.5, Cancer Res January 1, 2004 64; 162).
Получение кринглов К1-4(Tyr80-Ala440) и К1-3(Tyr80-Val338) К4-5(Val355-Phe546) проводили при помощи гидролиза Glu-плазминогена эластазой по методу, описанному в работах Cao Y., Ji R.W., Davidson D., Schaller J., Marti D., Sohndel S., McCanse S.G., O`Reilly M.S., Llinas M., and Folkman J. (1996) J. Biol. Chem., 271, 29461-29467. Glu-плазминоген инкубировали с эластазой при соотношении 50:1 (М/М) в буфере содержащем 0,05 M Трис-HCl, pH 8,5, 0,5 M NaCl и 200 KIU апротинина, в течение 5 часов при комнатной температуре. Реакцию эластолиза останавливали трехкратным добавлением PMFS для поддержания его концентрации 1 мМ в течение 40-50 мин. Затем проводили гель-фильтрацию смеси на колонке с сефадексом G-75 для отделения низко- и высокомолекулярных примесей. Белковые фракции второго пика содержащего К1-3, К1-4, К4-5 и Миниплазмин, наносили на аффинную колонку с Lys-сефарозой 4В, уравновешенную буфером с 0,05 M Трис-HCl, pH 8,5 и 0,15 M NaCl. После выхода миниплазмина, который не сорбируется на носителе, сорбированные фрагменты К1-3, К1-4 и К4-5 элюировали раствором 0,2 M 6-аминокапроновой кислоты в том же буфере, диализовали против буфера содержащего 0,02 M Трис-HCl, pH 8,0 и наносили на колонку с гепарин-агарозой, уравновешенной тем же буфером. После элюции несвязавшегося с носителем фрагмента К1-4 и К4-5 уравновешивающим буфером, фрагмент К1-3 элюировали раствором 0,25 M KCl в том же буфере. Полученные фрагмент К1-3 диализовали против воды и лиофилизовали. К1-4 и К4-5 разделяли с помощью гель-фильтрации на колонке с Сефадексом G-75.
Получение кринглов K5(Ser449(Pro452)-Fhe546), K1-3(Tyr80-Val338), К-4 (Val335-Ala440) согласно работе Cao, Y., Chen, Α., An, S.S.Α., Ji, R. W., Davidson, D., and Llinas, M. (1997) J. Biol. Chem. 272, 22924-22928). Использовался метод ограниченного эластолиза Lys-Плазминогена (Lys78-Asn791). После обработки эластазой смесь наносили на колонку Mono-S (Bio-Rad) уравновешенную буфером, содержащим 20 мМ NaOAc, pH 5.0. Связавшиеся фрагменты градиентно элюировали буфером, содержащем 20 мМ NaOAc, 1 М KCl, pH 5.0. Были использованы градиент 0-20%, 20-50%, 50-70%, и 70-100%. К-5 сходил при 50% градиенте. По этой же схеме, но в другом градиенте получили К-4 (Val335-Ala440) крингл и крингл K1-3(Tyr80-Val354)
Кринглы К1-4 (Lys78-Pro446) и K1-4(Lys78-Lys468) получались согласно методу Patterson, В.С. and Sang, Q.Α. (1997) J. Biol. Chem. 272, 28823-28825 с использованием металлопротеиназ.
Крингл Kl-4(Asn60-Pro447) получен по методу Lijnen, H.R., Ugwu, F., Bini, Α., and Collen, D. (1998) Biochemistry 37, 4699-4702 с использованием металл опротеиназ.
Изготовление диагностической тест-системы для иммуноферментного определения титра протеолитических фрагментов с C-концевым лизином.
Были изготовлены два типа диагностической системы-прямой и обратный.
При изготовлении прямой диагностической системы в качестве лигандов для посадки на твердую фазу использовались полноразмерный плазминоген или его фрагменты, содержащие хотя бы один крингл. Различные виды антигенов, использованные в иммуноферментном анализе для проведения диагностики, перечислены в табл. 1. Их первичная аминокислотная последовательность приведена в перечне последовательностей.
Лиганд разводили в 0,1 M карбонатно-бикарбонатном буфере pH 9,6 в максимальной концентрации 5 мкг/мл для молекул с молекулярным весом более 25 кД и 10 мкг/мл для молекул с молекулярным весом менее 25 кД. Данные разведения лиганда использовались для определения всех видов иммуноглобулинов.
PBS (phosphate buffered saline, фосфатный солевой раствор):
0,14M NaCl; 0,003М KCl; 0,005М Na2HPO4; 0,002М KH2PO4
Приготовление 1 л 10x PBS:
80 г - NaCl 2 г - KCl 18 г - Na2HPO4 2 г - KH2PO4
Субстратный буферный раствор (pH 4,3): 31 мМ лимонная кислота, 0,05н NaOH, 3 мМ H2O2
Раствор ТМБ: 5 мМ 3,3′,5,5′-тетраметилбензидин в 70% ДМСО
Субстрат-хромогенный раствор (готовится перед употреблением): смешать 4 части субстратного буферного раствора и одну часть раствора ТМБ.
При созд