Способ определения повышенного уровня аутоантител к плазминогену человека и продуктам его деградации и диагностическая тест-система для его осуществления
Иллюстрации
Показать всеГруппа изобретений раскрывает способ выявления субъекта с повышенным содержанием аутоантител к плазминогену или его фрагментам, тест-систему, позволяющую выявить такого субъекта, и применение данной тест-системы для проведения диагностики у субъекта онкологического процесса. Способ устанавливает критерии, указывающие на необходимость проведения контрольного диагностического обследования. Высокая чувствительность предложенной тест-системы позволяет использовать ее в качестве скринингового теста для ранней диагностики онкологического процесса, оценки риска его развития или исключения диагноза. 3 н. и 7 з.п. ф-лы, 2 табл., 2 ил., 4 пр.
Реферат
Область техники
Группа изобретений относится к области медицины и иммунологии. В частности, группа изобретений относится к способам иммунологической диагностики, включающим применение пептидных последовательностей фрагментов плазминогена, которые могут быть использованы в качестве универсального антигенного маркера при проведении иммуноализа для выявления у человека заболеваний, ассоциированных с повышенным уровнем аутоантител к плазминогену. Группа изобретений касается также диагностической тест-системы, содержащей в качестве антигена указанные пептидные последовательности.
Терминология
Технические и научные термины, использованные в описании изобретения, имеют тот же смысл и значение, которые обычно применяются в соответствующих областях науки и техники.
Термин "антиген", используемый в изобретении, относится к белкам или их фрагментам, способным связываться с антителами.
Термин "крингл" относится к белковому домену, имеющему структуру, стабилизированную тремя дисульфидными связями.
Термин "домен" относится к участку белка, характеризующемуся определенными структурными или функциональными свойствами.
Термин "иммуноанализ" относится к методам выявления высокомолекулярных соединений, включающий в себя стадии: (а) стадию контактирования антигена с биологическим образцом при условиях, подходящих для образования комплексов антиген-антитело; и (б) стадию детекции указанных комплексов.
Термин «маркер» относится к высокомолекулярным соединениям определенной структуры, выявление которых в образцах тканей человека ассоциировано с определенным спектром заболеваний.
Термин «эпитоп» в настоящем изобретении относится к участку белковой молекулы, который способен образовать связь с антителом.
Термин «антитело человека» относится к антителу, обладающему аминокислотной последовательностью, которая соответствует аминокислотной последовательности антитела, продуцируемого человеком.
Термин «аутоантитела» (аутоагрессивные антитела, аутологичные антитела) - антитела, способные взаимодействовать с аутоантигенами, то есть с антигенами собственного организма.
Термин «диагностический тест» представляет собой определение диагностического показателя с помощью конкретного лабораторного метода, аналитические параметры которого остаются на постоянном уровне.
Уровень техники
Необходимость поиска новых маркеров для проведения диагностики заболеваний, ассоциированных с повышенным уровнем аутоантител к плазминогену, в частности онкологических, на наиболее ранних сроках не вызывает сомнений. В настоящее время опубликован ряд работ, показывающих, что существуют так называемые универсальные маркеры, обнаружение которых у человека может быть ассоциировано с данными видами нарушений или риском их развития (см., например, Anna Ε Prizment at al., Cancer Epidemiol Biomarkers Prev. Feb 2011; 20(2): 297-307). Так, например, согласно работам Фолкмана, нормальное развитие организма происходит при балансе ангиогенной и антиангиогенной систем. Известно, что опухолевая ткань содержит значительно больше сосудов и капилляров, чем окружающая здоровая ткань. По этим сосудам к быстро растущим опухолевым клеткам поступают питательные вещества и кислород, необходимые им для деления. (Folkman J. ngiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med 1995; 1: 27-31. Folkman J. Tumor angiogenesis. Adv Cancer Res 1985; 43: 175-203). Также известно, что раковые клетки в минимальном транзиторном количестве всегда присутствуют в организме и если возникают условия подходящие для их развития (достаточное количество сосудов, соответствующее микроокружение, и их объем превышает 2 mm2), то опухоль начинает быстро развиваться, при этом образуется очаг воспаления. Обзор механизмов ангиогенеза и его участия в опухолеобразовании дан в публикации РСТ WO 95/29242.
Плазминоген - неактивный предшественник основного фермента фибринолиза, плазмина, обнаружен во многих биологических жидкостях организма, некоторых тканях и компонентах крови. Плазмин относится к эндопептидазам - сериновым протеазам трипсиноподобного действия. Физиологическое действие плазмина направлено на поддержание баланса системы свертываемости крови. Плазмин обычно получают из плазминогена путем его активации стрептокиназой, урокиназой. Система плазминоген/плазмин принимает активное участие не только в процессах фибринолиза, но и тесно связанна с ангиогенезом.
Функционально значима не только нативная молекула плазминогена (плазмина), но и целый спектр продуктов ее деградации. Ферментативно деградированные формы плазмина по своему действию на низкомолекулярные субстраты даже превосходят цельную молекулу (Ю.Г. Клысь, Н.В. Зайцева, А.И. Кизим, СВ. Веревка, Протеолитические производные плазминогена при развитии злокачественных новообразований, Онкология, Τ. 12, №1, 2010).
Описаны варианты существования этих кринглов в плазме: K1-3; К2-3; К1-4; К1-4,85; К1-5 и отдельные кринглы (Perri S, Martineau D, Francois Μ, et al. Plasminogen kringle 5 blocks tumor progression by antiangiogenic and proinflammatory pathways. Mol Cancer Ther 2007; 6: 441-9). Известно, что все кринглы, а также их комбинации, принимают активное участие в ангиогенезе и онкогенезе. Наиболее изучена функциональная активность первых четырех кринглов (К1-4). Последовательность из этих кринглов представляет ангиостатин (Francis J. Castellino, Victoria Α. Ploplis, Structure and function of the plasminogen/plasmin system, Thromb Haemost 2005; 93: 647-54; C. Boccaccio and Paolo M. Comoglio Cancer Res 2005; 65(19): 8579-82; Rijken DC, Lijnen HR. New insights into the molecular mechanisms of the fibrinolytic system. J Thromb Haemost 2009; 7: 4-13).
Определение уровня антител, в т.ч. аутоантител в образцах ткани, полученных от человека, обычно проводятся помощью иммуноанализа, наприер иммуноферментного анализа (ИФА).
В настоящее время используется огромное количество всевозможных разновидностей и модификаций ИФА. Широкое распространение получили разные варианты твердофазного иммуноферментного анализа (ELISA).
Твердофазный ИФА был предложен в 1971 году. Основные принципы твердофазного ИФА, независимо от модификации, заключаются в следующем:
1. На 1 этапе реакции адсорбируют антигены или антитела на твердой фазе. При этом не связавшиеся с твердой фазой реагенты легко удаляются отмыванием.
2. В сенсибилизированных лунках инкубируют исследуемый образец. В лунках с положительным контролем - стандартные реагенты. При этом на поверхности твердой фазы формируются иммунные комплексы. Несвязавшиеся компоненты удаляют отмыванием.
3. При добавлении конъюгата антитело-фермент или антиген-фермент и связывании его с иммобилизованным иммунным комплексом активный центр фермента остается доступным для последующего взаимодействия с субстратом. Инкубация субстрата в лунках с иммобилизованным конъюгатом приводит к развитию цветной реакции. Эту реакцию можно остановить на нужной стадии, выраженность окрашивания можно оценить визуально или по оптической плотности.
Обычно уровень аутоантител определяют при помощи непрямого ИФА. Этот вариант ИФА используют обычно для выявления специфических антител. В лунках панелей адсорбируют стандартный антиген и инкубируют с образцами сыворотки или другого биологического материала, полученного от больного (спинномозговая жидкость, слюна и др.). Специфические антитела, связавшиеся с антигеном на твердой фазе, выявляют с помощью антиглобулинового конъюгата. В зависимости от цели анализа используют разные антиглобулиновые реагенты, выявляющие антитела всех изотипов, либо специфичные к отдельным классам и подклассам иммуноглобулинов. Основное достоинство метода состоит в универсальности конъюгата. Один и тот же коньюгат может служить для выявления антител человека к самым разным антигенам в любых образцах. Реакция методически проста.
Основные этапы непрямого ИФА для определения наличия антител в исследуемом образце:
1. Антиген адсорбируют на твердой фазе, затем отмывают от несвязавшихся компонентов.
2. Блокируют свободные места связывания. Отмывают.
3. В лунки вносят исследуемый материал, инкубируют и затем проводят процедуру отмывки. Параллельно ставят пробы с положительным и отрицательным контролями.
4. Добавляют антиглобулиновый конъюгат в рабочем разведении, инкубируют, отмывают от несвязавшихся компонентов.
5. Вносят субстрат, инкубируют.По достижении оптимального уровня окрашивания в лунках с положительным контролем реакцию останавливают, добавляя стоп-раствор.
6. Измеряют количество продукта реакции на ИФА-ридере.
При оптимальных условиях проведения анализа метод является высокоспецифичным и чувствительным. Он позволяет выявлять нанограммовые количества антител в сыворотках исследуемых больных.
Однако в существующих методах иммуноферметного анализа, предназначенных для определения титра аутоантител, существует ограничение, связанное с присутствием самого антигена в пробе. При достаточно высокой концентрации антигена в циркуляции, количество определяемых аутоантител может быть минимальным, и результаты становятся ложноотрицательными. Исследование свойств связывания комплекса антиген-антитело показало, что использование различных органических растворителей позволяет повысить чувствительность реакции (Mohd. Rehan, Hina Younus, Int. J. of Biol. Macromolecules, Effect of organic solvents on the conformation ant interaction of catalase and anticatalase antibodies).
Однако в современных работах по исследованию уровня аутоантител к плазминогену с помощью ИФА, первичную обработку плазмы и сыворотки крови проводят без использования органических растворителей. Так, при оценке уровня аутоантител к плазминогену с использованием иммуноферментного анализа образцы плазмы разводили от 1/10 до 1/100 раз в фосфатном буфере с 0,05% Tween 20 и добавлением от 0,3% до 1% желатина или БСА. (Stefanescu Μ., et all, Arch. Roum. Pathol. Exp. Microbiol., 1989, 48, 47-53; C. Bu et all, Clin. Exp. Immunology, 2007, 149, 31-39).
В отличие от методов, применяемых на сегодняшний день для детекции аутоантител к плазминогену, в заявленном изобретении для проведения иммуноанализа в качестве антигенов наряду с полноразмерным белком были использованы фрагменты плазминогена определенной структуры. Также для детекции аутоантител к плазминогену применялись органические компоненты в составе буферных систем, позволяющие существенно повысить чувствительность диагностической тест-системы.
Раскрытие изобретения.
Аутоантитела к плазминогену или его фрагментам являются диагностическим признаком заболеваний, ассоциированных с повышенным уровнем аутоантител к плазминогену.
Авторы изобретения предположили, что в результате хронического воспаления в ткани могут образовываться определенные производные плазминогена.
Авторы изобретения предположили, что в зоне хронического воспаления клетки образовываются определенные пептиды, на появление которых организм человека отвечает выработкой аутоантител. Эти аутоантитела, в свою очередь, могут оказывать ингибирующие действие на ангиостатин и другие производные плазминогена, и таким образом смещают баланс в пользу ангиогенной системы, а избыточная сосудистая сеть и является одним из условий, приводящих к возникновению патологического процесса, в том числе и быстрому развитию опухоли. Эти же аутоантитела могут оказывать ингибирующее действие на активность плазмина, тем самым усиливать свертываемость крови.
Эксперименты, проведенные авторами изобретения, показали, что обнаруженные ими иммуноглобулины являются антителами человека против собственного плазминогена и различных продуктов его деградации, в частности ангиостатина.
Таким образом, повышение титра аутоантител к плазминогену или продуктам его деградации в плазме является маркером заболеваний, ассоциированных с повышенным уровнем аутоантител к плазминогену, и измерение содержания уровня данных аутоантител в плазме крови может использоваться в качестве диагностического признака развивающегося патологического процесса.
Поскольку аутоантитела к плазминогену являются поликлональными, и молекула плазминогена содержит множество эпитопов, к которым могут быть выработаны аутоантитела, авторы изобретения предлагают использовать различные части молекулы плазминогена для определения титра аутоантител. Для повышения чувствительности метода определения титра аутоантител к плазминогену и его производных впервые были впервые использованы оригинальные составы буферных растворов, которые включают мочевину, изопропанол, диметилсульфоксид.
В настоящее время в опубликованных источниках отсутствуют какие-либо данные об использовании предложенных компонентов в составе буфера для инкубации образцов плазмы в известных методах определения уровня аутоантител.
Авторы изобретения раскрывают новый способ определения уровня аутоантител к плазминогену или его фрагментам в крови, представляюший собой диагностическую тест-систему для выявления субъекта с повышенным содержанием аутоантител к плазминогену или его фрагментам, включающую буфер для разведения образца, буфер для инкубации, включающий органические компоненты, твердый носитель, антиген, представляющий собой полноразмерный плазминоген или его фрагмент, содержащий по меньшей мере один крингл, и контрольную пробу К, при этом состав буфера включает по меньшей мере 2 компонента, выбранных из группы: Трис-HCl, Мочевина, изопропанол, диметилсульфоксид.
Состав буфера для инкубации в заявленной тест-системе выбирается из групп a-е:
a. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% изопропанол;
b. 0,15 Μ Трис-HCl pH 8,8, 10% диметилсульфоксид, 10% изопропанол;
c. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид;
d. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид, 10% изопропанол;
e. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид, 5% изопропанол.
При этом фрагмент плазминогена в заявленной тест-системе выбран из списка: полноразмерный плазминоген, Lys-плазминоген, тяжелая цепь (Glu-Н), тяжелая цепь (Lys-H), К1-4(Tyr80-Ala440), K1K1-4(Asn60-Pro447), K1-4(Lys78-Pro447), K1-4(Lys78-Pro446), K1-4(Lys78-Lys468), K1-4,5(Lys78-Arg530).
При этом контрольной пробой К в заявленной тест-системе является проба, взятая у здорового субъекта.
При осуществлении способа определения уровня аутоантител к плазминогену или его фрагментам в крови с использованием заявленной тест-системы фрагменты плазминогена для выявления аутоантител выбраны из списка: Lys-плазминоген, тяжелая цепь (Glu-H), тяжелая цепь (Lys-H), легкая цепь (L), K1-4(Tyr80-Ala440), K1-3(Tyr80-Val338), K1-3(Tyr80-Val354), K1-4(Asn60-Pro447), K1-4(Lys78-Pro447), K1-4(Lys78-Pro446), K1-4(Lys78-Lys468), K1-4,5(Lys78-Arg530).
При этом выявление аутоантител проводят при помощи иммуноферментной реакции.
При этом превышение уровня аутоантител над контрольной пробой К более чем на 30% является показателем наличия у субъекта патологического процесса.
При этом превышение уровня аутоантител над контрольной пробой К более чем на 30% является показателем риска развития у субъекта онкологического процесса.
Заявленную тест-систему применяют для выявления риска развития у субъекта онкологического процесса.
Количество связавшихся аутоантител может быть определено любыми методами детекции, известными в настоящее время: колориметрическим (ферментным), флуоресцентным, или кондуктометрическим (использование электрической проводимости).
Способ позволяет использовать заявленную диагностическую тест-систему для выявления субъекта, имеющего повышенный уровень аутоантител к плазминогену или его фрагментам. Для того, чтобы диагностировать повышенный по сравнению с нормальным уровень аутоантел у исследуемого субъекта, проводят сравнение определенного для него уровня аутоантител с уровнем аутоантител, обнаруживаемом в контрольном образце, полученном от здорового донора (доноров).
Таким образом, авторы усматривают технический результат в достижении необходимой степени диссоциации комплекса антиген-аутоантитело, пристутствующего в образце, взятом у субъекта, а также в изменении конформации антител за счет использования буфера для инкубации, содержащего органические компоненты в раскрытых соотношениях, что в свою очередь позволяет существенно повысить чувствительность метода определения уровня аутоантител к плазминогену.
Антиген для проведения иммуноанализа
По своей химической природе плазминоген является гликопротеином, молекула которого содержит 791 аминокислотных остатков и 24 дисульфидных мостика. Белок состоит из одной полипептидной цепи, где Ν-концевой аминокислотой является глютамин, С - концевой аспарагин. В состав молекулы входит 2%-3% углеводов, локализованных в тяжелой цепи. Олигосахариды присоединяются к Асп288 и Тре345. При активации плазминогена, происходит расщепление пептидной связи Арг560-Вал561 и образуются две цепи, легкая и тяжелая, соединенные дисульфидными связями. В легкой цепи (Вал561-Асн790) находится активный протеазный центр, включающий аминокислотную последовательность: серии, гистидин, аспарагин. В тяжелой цепи плазмина (Лиз78-Арг560) имеется 5 близких по аминокислотной последовательности петлеобразных участка - доменов или кринглов, которые представляют собой компактные структуры глобулярного типа с хорошо выраженным гидрофобным ядром. Подобные структуры принимают участие в осуществлении белковых взаимодействий в процессе свертывания крови. Кринглы тяжелой цепи обозначаются Κ1, К2, К3, К4, К5. В доменах К1-4 локализованы специфические участки, обладающие сильным сродством к лизину, ε-аминокапроновой кислоты, парааминобензойной кислоте и другим ω-карбоновым аминокислотам, обладающими антифибринолитическими свойствами. Лизиневязывающие участки (ЛСУ) играют важную роль во взаимодействиях между плазмином (плазминогеном) и фибрином, а также плазмином и его ингибитором - а2-АП (антиплазмин). Любой из фрагментов плазминогена, содержащий крингл, независимо от того, является ли он продуктом естественного расщепления в организме человека или получен в результате расщепления плазминогена in vitro (например, в результате ферментативного воздействия), может быть использован для выявления аутоантител.
Для определения титра аутоантител при различных заболеваниях, связанных с накоплением аутоанител к плазминогену или его фрагментам в качестве лиганда, помимо содержащих крингл фрагментов расщепления плазминогена, может использоваться также полноразмерная молекула плазминогена.
Полноразмерный плазминоген и различные продукты его расщепления: легкая или тяжелая цепь, и любой из фрагментов, содержащий крингл, могут быть использованы в качестве антигена для создания набора иммуноферментного анализа, определяющего титр аутоантител классов IgG, IgA и IgM к плазминогену человека и его частей в образцах плазмы крови человека.
Данные антигены являются производными нативного Glu-плазминогена, либо могут быть получены с помощью генно-инженерных методов, путем синтеза рекомбинантного пептида в эукариотических или бактериальных системах экспрессии.
Рекомбинантные антигены соответствуют аминокислотной последовательности плазминогена человека. В частности, антигеном для осуществления раскрытого в изобретении способа диагностики, кроме полноразмерного плазминогена, могут являться также его следующие фрагменты: Lys-плазминоген, тяжелая цепь (Glu-H), тяжелая цепь (Lys-H), легкая цепь (L), К1-4(Tyr80-Ala440), K1-3(Tyr80-Val338), K1-3(Tyr80-Val354), K1-4(Asn60-Pro447), K1-4(Lys78-Pro447), K1-4(Lys78-Pro446), K1-4(Lys78-Lys468), K1-4,5(Lys78-Arg530), мини-плазмин, а также любые их сочетания.
Авторы изобретения впервые обнаружили и экспериментально подтвердили, что плазминоген или его фрагменты могут быть использованы в качестве антигенов для определения титра аутоантител человека при постановке иммуноферментной реакции, где исследуемым образцом является образец плазмы крови человека, и результат данной реакции может быть использован в качестве значимого диагностического признака для выявления наличия патологического процесса у исследуемого субъекта.
Авторы впервые применили способ обработки образцов плазмы с использованием мочевины, изопропанола, диметилсульфоксида и каприловой кислоты в составе буфера инкубации, который позволяет улучшить чувствительность метода, т.е. увеличить количество обнаруженных позитивных образцов, по сравнению с методами, используемыми ранее, где буферный раствор для инкубации не имел в своем составе предложенных компонентов.
Так как раскрытый в настоящем изобретении способ диагностики основан на использовании строго определенных полипептидов и использовании специфических компонентов в составе буфера инкубации, квалифицированному специалисту в данной области техники очевидно, что аналогичным образом могут быть использованы и другие белки и пептиды, имеющие в своем составе данные аминокислотные последовательности, а также любые сочетания предложенных компонентов в составе буфера инкубации, идентичные раскрытым в изобретении.
Специалисту очевидно также, что в качестве антигенов по настоящему изобретению могут быть использованы любые полипептиды, обладающие значительным уровнем гомологии (90% и выше) с заявленными полипептидами, так как замена отдельных аминокислот, не изменяющая пространственной структуры крингла, не является препятствием для образования комплекса антиген-антитело.
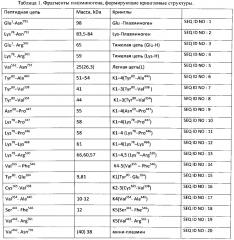
В таблице 1 приведено описание различных полипептидов - производных плазминогена, формирующих кринглы, которые могут быть использованы для постановки иммуноферментной реакции с образцами плазмы крови человека для выявления аутоантител.
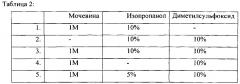
В Таблице 2 приведены различные органические компоненты в составе основного буфера, использованного для первичной обработки образцов плазмы.
Состав основного буфера инкубации: 0,15 Μ Трис-HCl pH 8,8.
Итоговый состав буферов:
1. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% изопропанол;
2. 0,15 Μ Трис-HCl pH 8,8, 10% диметилсульфоксид, 10% изопропанол;
3. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид, 10% изопропанол;
4. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид;
5. 0,15 Μ Трис-HCl pH 8,8, 1М Мочевина, 10% диметилсульфоксид, 5% изопропанол.
Краткое описание чертежей
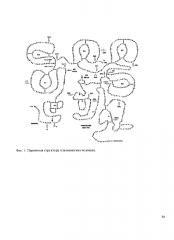
Фиг. 1. Первичная структура плазминогена человека.
Черными стрелками показано место расщепления пептидных связей: (а) отщепление сигнального пептида - требуется для образования нативной формы Glu-плазминогена; (b) отщепление активационного пептида (Glu′-Lys77) и превращение Glu-плазминогена в Lys78-плазминоген или Glu-плазмина в Lys78-плазмин; (с) расщепление пептидной связи Arg561-Val562 и превращение плазминогена в плазмин.
Белыми стрелками показаны границы интронов в нуклеотидной последовательности гена плазминогена человека. Треугольники обозначают места прикрепления Ν-связанных олигосахаридов в положении 289 и О-связанных гликанов в позиции 346. Каталитические триады His603, Asp646, и Ser741, обозначены звездочкой (∗). Дисульфидные связи обозначены сплошной линией.
alanine-ala-A; arginine-arg-R; asparagine-asn-N; aspartic acid-asp-D; cysteine-cys-C; glutamine-gin-Q; glutamic acid-glu-E; glycine-gly-G; histidine-his-H; isoleucine-ile-I; leucine-leu-L; lysine-lys-K; methionine-met-M; phenylalanine-phe-F; proline-pro-P; serine-ser-S; threonine-thr-T; tryptophan-trp-W; tyrosine-tyr-Y; valine-val-V.
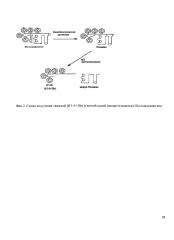
Фиг 2. Схема получения тяжелой (К1-5+30r) и легкой цепей (микро-плазмина) Glu-плазминогена.
Осуществление изобретения
Плазминоген и его фрагменты, раскрытые в настоящем изобретении (табл. 1), были получены либо генноинженерным способом, либо очищены из плазмы крови и использованы в качестве антигенов для создания наборов для иммуноферментного анализа для определения уровня аутоантител класса IgG, IgA, IgM к плазминогену или его фрагментам в крови пациентов с различными формами злокачественных опухолей или аутоиммунными заболеваниями, подтвержденных альтернативными методами диагностики.
Выделение антигенов для проведения иммуноанализа
Получение Тяжелой цепи (Glu-H) Glu1-Arg561 и Легкой цепи (L) Val562-Asn791 цепи плазминогена.
Принцип метода состоит в активации плазминогена в плазмин с последующим восстановлении S-S-связей между тяжелой и легкой цепями в условиях, исключающих автолиз, и выделении фрагментов аффинной хроматографией на Lys-Сефарозе 4В. Урокиназа разрывает активационную связь Arg561-Val562 в плазминогене. Образующийся плазмин разрывает связь 77-78 и отщепляется Ν-терминальный пептид (1-77). Меркаптоэтанол восстанавливает связи Cys558-Cys566 и Cys548-Cys666, соединяющие тяжелую и легкую цепи.
Первый этап: выделение достаточного количества Glu-Pg из плазмы крови. Glu-Плазминоген выделяли из замороженной донорской плазмы крови человека с помощью аффинной хроматографии на Lys-сефарозе 4В при 4°С и pH 8,0. Плазму крови размораживали в присутствии апротинина, центрифугировали 30 min при 4°С и разбавляли в 2 раза 0,02 Μ К-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин. Подготовленную плазму наносили на колонку с Lys-сефарозой 4В, уравновешенную 0,1 Μ К-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин. Колонку промывали от несвязавшихся белков 0,3 Μ K-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин, в течение ночи под свободным протоком до А280=0,05-0,01. Сорбированный Glu-Pg элюировали раствором 0,2 Μ 6-аминокапроновой кислоты 0,1 Μ К-фосфатном буфере, pH 8,0, содержавшем 20 KIU/ml апротинин. Фракции, содержавшие белок, объединяли и подвергали дополнительной очистке осаждением (NH4)2SO4 (0,31 g/ml раствора белка). Осадок оставляли при 4°С на 18-24 часа, после чего отделяли центрифугированием и растворяли в 0,05 Μ Трис-HCl буфере, pH 8,0 до концентрации порядка 1,5-2,0 mg/ml. Очищенный Glu-Pg диализовали при 4°С против воды (pH 8,0) и лиофилизировали.
Второй этап: получение двухцепочечного плазмина путем активации одноцепочечного Glu-Pg урокиназой (фирмы "Wakamoto Pharmaceutical Co. Ltd." (Корея). К раствору Glu-Pg (5 mg/ml) в 0,05 Μ Трис-HCl буфере, pH 8,8, содержавшем 0,02 Μ L-лизин, 0,15 Μ NaCl, 20% глицерин и 6000 KIU/ml апротинина, добавляли урокиназу до конечной концентрации 600 IU/ml и инкубировали 4 часа при 37°C. Полноту превращения Glu-Pg в плазмин контролировали по росту до максимального значения скорости гидролиза специфического субстрата плазмина S-2251 (HD-Val-Leu-Lys p-nitroanilide, "Sigma", США) в пробах, отобранных из реакционной смеси.
Третий этап: восстановление S-S-связей между тяжелой и легкой цепями плазмина. К полученному раствору плазмина добавляли меркаптоэтанол до конечной концентрации 0,25 mM и инкубировали в токе азота в темноте в течение 20 мин. Образовавшиеся свободные SH-группы блокировали, инкубируя реакционную смесь со свежеприготовленным раствором йодоуксусной кислоты в 0,1 Μ Na-фосфатном буфере, pH 8,0 (конечная концентрация 0,315 М) и инкубировали 20 мин.
Четвертый этап: разделение тяжелой и легкой цепей плазмина хроматографией на колонке с Lys-Сефарозе 4В. Реакционную смесь разбавляли до концентрации 1 мг/мл 0,1 Μ Na-фосфатным буфером, pH 8,0, содержавшим 20 KIU/ml апротинин и наносили на колонку с Lys-Сефарозой 4В, уравновешенную тем же буфером. Хроматографию проводили при 25°C. Тяжелая цепь плазмина, содержащая кринглы 1-5 и 30 аминокислотных остатков соединительного пептида, сорбируется на аффинном носителе, а легкая цепь не сорбируется и элюируется уравновешивающим буфером Тяжелую цепь (Mr ~56-57 kDa) элюировали раствором 0,2 Μ раствором 6-аминокапроновой кислоты в 0,1 Μ Na-фосфатном буфере, pH 8,0. Объединенные фракции диализовали против воды (~pH 8,0) и высушивали лиофильно. При необходимости препарат растворяли в 0,05 М Трис-HCl буфере, pH 7,4 и дополнительно очищали с помощью гель-фильтрации на колонке с Сефадексом G-75 (1,65×80 cm). Объединенные фракции белкового пика диализовали против воды pH 8,0 и лиофилизировали.
Чистоту и молекулярную массу препаратов оценивали методом электрофореза в 12% ПААГ в присутствии 0,1% SDS. Кроме того, отсутствие амидазной активности (по S-2251) до и после инкубации ее раствора со стрептокиназой свидетельствовало, что тяжелая цепь не содержит следовых концентраций мини-плазминогена, которые могли не обнаружиться при электрофорезе.
Получение Lys-плазминогена (Lys78-Asn791) и Тяжелой цепи (Lys-H Lys78-Arg561) проводили тем же самым методом, только без добавления ингибитора - апротинина.
Получение миниплазмина (Val442-Asn791) Миниплазмин включает в себя К5 и легкую цепь плазмина. Его последовательность начинается от Val442 и до Asn791 включительно. Получается он при эластолизе Lys-плазминогена (Lys78-Asn791) дальнейшей доочисткой гель-фильтрацией на сефодексе G-75.
Получение крингла К1-4,5(Lys78-Arg530) проводили по методике, описанной в работе Сао R., Wu H.L., Veitonmaki Ν., Linden P., Famedo J., Shi C.Y., and Cao Y. (1999) Proc. Natl. Acad. Sci. USA,. 96, 5728-5733., с некоторыми модификациями. Glu-плазминоген (10 мг/мл) активировали урокиназой (600 МЕ/мл) в 0,05 Μ фосфатном буфере pH 9,0, содержащем 0,02 Μ L-лизин и 0,1 Μ NaCL, при 37°. Полноту превращения плазминогена в плазмин контролировали по увеличению амидазной активности раствора до максимального значения. К раствору плазмина добавляли равный объем 0.2 Μ глицеринового буфера, pH 12,0 и инкубировали в течение 18 ч при 25° и конечном значении pH 10,5. Реакционную смесь разбавляли в 5 раз буфером, содержащим 0,1 Μ фосфатный буфер, pH 8,0 и 40 KIU/мл апротинина, и наносили на колонку с Lys-сефарозой 4В, уравновешенную тем же буфером. После выхода микро-плазмина, сорбированный ангиостатин К1-4,5 элюировали с колонки 0,2 Μ раствором 6-аминокапроновой кислоты в 0,1 Μ фосфатный буфер, pH 8,0 и 40 KIU/мл апротинина, диализовали против воды и лиофилизировали. Чистоту препарата проверяли с помощью SDS-ПААГ-электрофореза в 12%-ном геле. Кроме того К1-4,5 может быть естественным продуктом, включающим кринглы 1-4 плюс 85% К5, (Lys78-Arg530). Плазмин превращается в К1-4,5 в две стадии. Сначала плазминоген переходит в плазмин, затем плазмин подвергается аутопротеолизу внутренней петли 5 крингла. Аутопротеолиз может быть вызван свободными сульфгидрильными донорами или щелочной средой. Кроме того такая деградация плазмина происходит при добавлении к субстрату концентрированной ростовой среды клеток НТ 1080, а также ряда других культивированных опухолевых клеток. В этот процесс вовлечена плазмин-редуктаза, которая содержится в ростовой среде опухолевых клеток (Paul Stathakis, Angelina J. Lay, Melinda Fitzgerald, Christian Schlieker, Lisa J. Matthias and Philip J. Hogg, Angiostatin Formation Involves Disulfide Bond Reduction and Proteolysis in Kringle 5 of Plasmin, J. Biol. Chem. Vol. 274, No. 13, Issue of March 26, pp. 8910-8916, 1999; Soff G. A. Angiostatin and angiostatin-related proteins, Cancer Metastasis Rev., 19: 97-107, 2000; Hao Wang, Ryan Schultz, Jerome Hong, Deborah L. Cundiff, Keyi Jiang, and Gerald A. Soff, Cell Surface-Dependent Generation of Angiostatin 4.5, Cancer Res January 1, 2004 64; 162).
Получение кринглов K1-1(Tyr80-Ala440) и K1-3(Tyr80-Val338) K4-5(Val355-Phe546) проводили при помощи гидролиза Glu-плазминогена эластазой по методу, описанному в работах Cao Y., Ji R.W., Davidson D., Schaller J., Marti D., Sohndel S., McCanse S.G., O`Reilly M.S., Llinas M., and Folkman J. (1996) J. Biol. Chem., 271, 29461-29467. Glu-плазминоген инкубировали с эластазой при соотношении 50:1 (М/М) в буфере содержащем 0,05 Μ Трис-HCl, pH 8,5, 0,5 Μ NaCl и 200 KIU апротинина, в течение 5 часов при комнатной температуре. Реакцию эластолиза останавливали трехкратным добавлением PMFS для поддержания его концентрации 1 мМ в течение 40-50 мин. Затем проводили гель-фильтрацию смеси на колонке с сефадексом G-75 для отделения низко- и высокомолекулярных примесей. Белковые фракции второго пика содержащего К1-3, К1-4, К4-5 и Миниплазмин, наносили на аффинную колонку с Lys-сефарозой 4В, уравновешенную буфером с 0,05 Μ Трис-HCl, pH 8,5 и 0,15 Μ NaCl. После выхода миниплазмина, который не сорбируется на носителе, сорбированные фрагменты K1-3, К1-4 и К4-5 элюировали раствором 0,2 Μ 6-аминокапроновой кислоты в том же буфере, диализовали против буфера содержащего 0,02 Μ Трис-HCl, pH 8,0 и наносили на колонку с гепарин-агарозой, уравновешенной тем же буфером. После элюции нес вязавшегося с носителем фрагмента К1-4 и К4-5 уравновешивающим буфером, фрагмент К1-3 элюировали раствором 0,25 Μ KCl в том же буфере. Полученные фрагмент К1-3 диализовали против воды и лиофилизовали. К1-4 и К4-5 разделяли с помощью гель-фильтрации на колонке с Сефадексом G-75.
Получение кринглов K5(Ser449(Pro452)-Fhe546), K1-3(Tyr80-Val338), К-4(Val335-А1а440)согласно работе Cao, Y., Chen, Α., An, S.S. Α., Ji, R.W., Davidson, D., and Llinas, M. (1997) J. Biol. Chem. 272, 22924-22928). Использовался метод ограниченного эластолиза Lys-Плазминогена (Lys78-Asn791). После обработки эластазой смесь наносили на колонку Mono-S (Bio-Rad) уравновешенную буфером, содержащим 20 мМ NaOAc, pH 5.0. Связавшиеся фрагменты градиентно элюировали буфером, содержащем 20 мМ NaOAc, 1 Μ KCl, pH 5.0. Были использованы градиент 0-20%, 20-50%, 50-70%, и 70-100%. К-5 сходил при 50% градиенте. По этой же схеме, но в другом градиенте получили К-4 (Val335-Ala440) крингл и крингл К1-3(Tyr80-Val354)
Кринглы K1-4(Lys78-Pro446) и K1-4(Lys78-Lys468) получались согласно методу Patterson, В.С. and Sang, Q.Α. (1997) J. Biol. Chem. 272, 28823-28825 с использованием металлопротеиназ.
Крингл K1-4(Asn60-Pro447) получен по методу Lijnen, Η.R., Ugwu, F., Bini, Α., and Collen, D. (1998) Biochemistry 37, 4699-4702 с использованием металлопротеиназ.
Изготовление диагностической тест-системы для иммуноферментного определения аутоантител.
В качестве антигенов для иммуноферментного определения аутоантител использовались полноразмерный плазминоген или его фрагменты, содержащие хотя бы один крингл. Различные виды антигенов, использованные в иммуноферментном анализе для проведения диагностики, перечислены в табл. 1. Их первичная аминокислотная последовательность приведена в перечне последовательностей.
Антиген разводили в 0,1 Μ карбонатно-бикарбонатном буфере pH 9,6 в максимальной концентрации 5 мкг/мл для молекул с молекулярным весом более 25 кД и 10 мкг/мл для молекул с молекулярным весом менее 25 кД. Данные разведения антигена использовались для определения всех видов иммуноглобулинов.
PBS (phosphate buffered saline, фосфатный солевой раствор):
0,14 М NaCl; 0,003 М КСl; 0,005 М Na2HPO4; 0,002 М KH2PO4
Приготовление 1 л 10× PBS:
80 г - NaCl 2 г - КСl 18 г - Na2HPO4 2г - KH2PO4
Субстратный буферный раствор (pH 4,3): 31 мМ лимонная кислота, 0,05 н NaOH, 3 мМ H2O2
Раствор ТМБ: 5 мМ 3,3′,5,5′-тетраметилбензидин в 70% ДМСО
Субстрат-хромогенный раствор (готовится перед употреблением): смешать 4 части субстратного буферного раствора и одну часть раствора ТМБ.
При создании набора для иммуноферментного анализа проводили предварительную иммобилизацию антигена. Для иммобилизации антигена могут быть использованы различные виды носителей, например нитроцеллюлоза, стеклянные бусы или другие частицы, способные сорбировать белки, иммунологические стрипы или планшеты. На иммунологический планшет в каждую лунку вносили по 100 мкл раствора антигена. Инкубация проводилась в течение 14-16 часов при 4°С во влажной камере. Содержимое лунок удаляли путем вытряхивания, затем планшет дважды промывали раствором, содержащим однократный PBS с 0,05% Tweeen-20, по 200 мкл/на лунку для удаления несвязавшегося антигена. В качестве блокирующего раствора использовали 1% раствор бычьего сывороточног альбумина(БСА) в PBS, по 200 мкл/лунка с инкубацией в течение 1,5-2 часов при комнатной температуре. После окончания инкубации блокирующую жидкость удаляли, планшет сушили в течение ночи при комнатной температуре и затем использовали в дальнейшей работе.
Для увеличения чувствительности и специфичности метода использовали целый ряд компонентов в составе буфера инкубации, которые представлены в таблице 2.
Используемый буфер инкубации, в состав которого входили предложенные компоненты (мочевина, изопропанол, диметилсульфоксид, каприловая кислота) в заявленных сочетаниях (№1-5), позволял использовать конечное разведение образца плазмы до 1000 раз.
Исследуемые и контрольные образцы плазмы крови разводили в 100 раз буфером для инкубации, инкубировали 1 час при 37°С и затем разводили разводящим буфером (0,1 Μ Трис-HCl с 0,05% Tween-20 pH 8,0) в 10 раз, после этого вносили по 100 мкл в соответствующие лунки планшета и инкубировали 1 час при 37°C. После окончания инкубации содержимое лунок удаляли, планшет промывали 4 раза промывочным раствором (PBS с 0,05% Tween-20), каждый раз тщательно удаляя содержимое лунок. Рабочее разведение коньюгата в PBS с 0,5% БСА (для определения IgG, IgA, IgM в качестве коньюгата использовали соответственно Mab Fc IgG-peroxidase, Mab Fc IgA-peroxidase, Mab IgM-peroxidase) вносили в соответствующие лунки планшета по 100 мкл/лунка и снова инкубировали 1 час при 37°С. Несвязавшиеся компоненты удаляли 4-кратной промывкой планшета промывочным раствором. Затем во все используемые лунки вносили по 100 мкл субстрат-хромогенного раствора и инкубировали 15 минут при 37°C. Реакцию останавливали, внося во все используемые лунки по 100 мкл стоп-раствора (2 М H2