Способы получения сахарной цепи, содержащей сиаловую кислоту
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии. Предложены способы получения сиалированной сахарной цепи. Осуществляют взаимодействие сахарной цепи с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы при температуре от 20°C до 37°C в течение 8-48 часов с получением триантеннарной или тетраантеннарной N-связанной сиалированной сахарной цепи, содержащей сиаловую кислоту на каждом из своих невосстанавливающих концов. В другом варианте перед указанной стадией осуществляют взаимодействие сахарной цепи с UDP-сахаром в присутствии гликозилтрансферазы. В третьем варианте осуществляют взаимодействие агалакто-биантеннарной комплексной сахарной цепи с UDP-GlcNAc в присутствии MGAT4 и MGAT5. Полученный продукт взаимодействует с UDP-Gal в присутствии β4GalT1, затем с СМР-сиаловой кислотой в присутствии ST6Gal-I и фосфатазы. Изобретения позволяют получать триантеннарные и тетраантеннарные α2,6-сиалированные на каждом из своих невосстанавливающих концов сахарные цепи с высокими выходами в однореакторном синтезе. 3 н. и 12 з.п. ф-лы, 9 ил.
Реферат
Область техники, к которой относится изобретения
Настоящее изобретение относится к способу синтеза сахарной цепи, что может найти применение при получении лекарственных средств, таких как, гликопротеины, эталонов для аналитических приборов, научных реагентов, наборов сахарных цепей и т.д.
Предшествующий уровень техники
Большое количество предыдущих исследований показали, что структуры из сахарных цепей, связанные с белками, играют важную функциональную роль в биологической активности белков. Сахарную цепь также называют "лицом клетки". Известно, что сахарная цепь, экспрессированная на поверхности клетки, участвует во взаимодействии клетка-клетка или сигналировании, развитии или дифференциации, оплодотворении, раковом метастазировании и т.д. Что касается модификации сахарными цепями у млекопитающих, то хорошо известно, что в основном, это Asn-связанное гликозилирование, гликозилирование муцинового типа, гликозилирование протеогликанового типа и другие. Эти виды модификации дают соответствующие уникальные структуры сахарных цепей посредством различающихся путей биосинтеза. Известно, что сахара, такие как, фукоза или сиаловая кислота, присоединяются к невосстанавливающим концам таких структур сахарных цепей.
Сиаловая кислота это обобщенное название для аминозамещенных или гидроксизамещенных производных нейраминовой кислоты, которая является особой нонозой, имеющей амино- и карбоксигруппы. N-ацетилнейраминовая кислота (Neu5Ac), имеющая ацетилированную аминогруппу в положении 5, вероятно, является наиболее преобладающей формой в природе. Также известны различные структуры, такие как, N-гликолилнейраминовая кислота, имеющая гликолил-модифицированную аминогруппу в положении 5, или дезаминонейраминовая кислота KDN.
По имеющимся сведениям, сахарная цепь, содержащая сиаловую кислоту, встречается не только у млекопитающих, включая людей и мышей, но и у иных позвоночных, иглокожих и даже одноклеточных организмов, а также у некоторых грамотрицательных бактерий. Эта сахарная цепь, содержащая сиаловую кислоту, образуется с помощью сиалилтрансферазы. Сиалилтрансфераза использует сиаловую кислоту, присоединенную к цитидинмонофосфату (СМР), в качестве субстрата-донора для переноса сиаловой кислоты в, например, положение 3 или 6 галактозы, положение 6 N-ацетилгалактозамина или положение 8 других сиаловых кислот при посредстве альдегидной группы, имеющейся в положении 2 донора сиаловой кислоты. Например, фермент, переносящий сиаловую кислоту в положение 3 галактозы, называется α-2,3-сиалилтрансфераза; фермент, переносящий сиаловую кислоту в положение 6 галактозы или N-ацетилгалактозамина, называется α-2,6-сиалилтрансфераза; и фермент, переносящий сиаловую кислоту в положение 8 другой сиаловой кислоты, называется α-2,8-полисиалилтрансфераза. Из этих ферментов, α-2,6-сиалилтрансфераза известна как ферменты ST6Gal-I и ST6Gal-II, переносящие сиаловую кислоту в положение 6 галактозы, и ферменты ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III, и ST6GalNAc-IV, переносящие сиаловую кислоту в положение 6 N-ацетилгалактозамина в организме человека.
ST6Gal-I распознает структуру N-ацетиллактозамина (Galβ1-4GlcNAc), которая представляет собой N-ацетилглюкозамин, имеющий галактозу, присоединенную в положении 4, в качестве субстрата-акцептора и поэтому модифицирует структуры невосстанавливающих концов некоторых гликолипидов или N-связанных сахарных цепей. Его специфичность по отношению к субстрату-акцептору в основном анализировали с применением биантеннарых или триантеннарых N-связанных сахарных цепей. Согласно сообщению, сиаловая кислота обычно переносится на лактозамин, на антенну α1,3-связанной маннозы (см. Непатентная Литература, 1). Что касается получения биантеннарых или триантеннарых N-связанных сахарных цепей, эти сахарные цепи сложно успешно получить в значительном количестве, потому что, например: субстраты гликозилтрансферазы редко выделяют из природных продуктов; и крупномасштабный способ получения с применением этого фермента пока не был разработан.
Между тем, реакция переноса α2,6-сиаловой кислоты для тетраантеннарых N-связанных сахарных цепей была изучена с применением ST6Gal-I быка. Из четырех структур N-ацетиллактозамина в сахарной цепи, N-ацетиллактозаминная структура, β1,2-связанная с α1,3-связанной маннозой, является наиболее восприимчивой к переносу сиаловой кислоты, сопровождающемуся β1,4-связыванием N-ацетиллактозаминной структуры с α1,3-связанной маннозой, а затем присоединением любой из двух N-ацетиллактозаминных структур к α1,6-связанной маннозе, хотя никакого продукта, содержащего четыре молекулы сиаловой кислоты, не было обнаружено (см. Непатентная Литература, 2). Было сообщение о том, что ST6Gal-I человека, а также ST6Gal-II, обладают субстратной специфичностью (см. Непатентная Литература, 3 и 4). Однако не было сделано никакого исследования сиалирования с тетраантеннарыми N-связанными сахарными цепями в качестве акцепторных субстратов.
Согласно сообщениям, ингибирование ST6Gal-I продуктом СМР является 49% ингибированием (см. Непатентная Литература, 5) или 71% ингибированием (см. Непатентная Литература, 6) с помощью 0,25 мм СМР.
Между тем, имеются сообщения о Photobacterium damsela JT0160 (см. Непатентная Литература, 7), Photobacterium leiognathi JTPET-SHIZ-145 (см. Непатентная Литература, 8), и т.п., как о α2,6-сиалилтрансферазах бактериального происхождения. Однако ни для одной из них не было изучено сиалирование с тетраантеннарыми N-связанными сахарными цепями в качестве акцепторных субстратов.
Что касается реакции переноса α2,3-сиаловой кислоты на тетраантеннарые N-связанные сахарные цепи, тетраантеннарые N-связанные сахарные цепи, содержащие четыре α2,3-связанные молекулы сиаловой кислоты, присоединяются к гликопротеинам, таким как, эритропоэтин (ЕРО) (см. Непатентная Литература, 9). Согласно сообщению, такое сиалирование вносит вклад в устойчивость гликопротеинов крови (см. Непатентная Литература, 10). Хотя эти структуры также встречаются в природе, не было случая, чтобы сообщали о реальном получении в больших количествах тетраантеннарых N-связанных сахарных цепей, содержащих четыре α2,3-связанные молекулы сиаловой кислоты. Это имеет место потому, что применяемое в качестве исходного материала ЕРО или подобное, сложно недорого получить в больших количествах; и асиало-тетраантеннарые N-связанные сахарные цепи, применяемые в качестве акцепторов в ферментативном синтезе, также сложно недорого получить из других природных продуктов. Также известно, что гликопротеин ЕРО имеет, например, тетраантеннарые N-связанные сахарные цепи, содержащие α2,3 и α2,6-связи вместе (см. Непатентная Литература, 11).
Было сообщение относительно паттерна связывания сиаловой кислоты, связанной с сахарными цепями N-типа в лекарственных препаратах антител или гликопротеиновых лекарственным препаратах, таких как, цитокины, о том, что белки, имеющие α2,6-связанную сиаловую кислоту, исчезают из крови быстрее, чем белки, имеющие α2,3-связанную сиаловую кислоту. Для высвобождения из крови, гликопротеины включаются в клетки путем in vivo связывания с молекулами лектина и окончательно метаболизируются. Таким образом, можно ожидать, что гликопротеины, имеющие α2,6-связанную сиаловую кислоту, соединяются по органоспецифическому типу через связывание с конкретной молекулой лектина, и также используются в доставке лекарственных средств. Также, известно, что гликопротеины выделяются в мочу в почке, в зависимости от молекулярных размеров. По имеющимся сведениям, видимый молекулярный размер эритропоэтина возрастает с увеличением количества антенн в его сахарной цепи, что приводит к медленному высвобождению из крови. Таким образом, можно ожидать, что синтез сахарных цепей, имеющих α2,3-связанную и/или α2,6-связанную сиаловую кислоту, в частности, тетраантеннарых сахарных цепей N-типа, имеющих четыре молекулы α2,3-связанной и/или α2,6-связанной сиаловой кислоты, применим для производства гликопротеиновых лекарственных средств, различающихся по эффективности усвоения в органе.
Вирус гриппа человека распознает, для ее заражения, α2,6-связанную сиаловую кислоту в сахарных цепях, экспрессированных на поверхности клетки, в то время как вирус гриппа птицы распознает α2,3-связанную сиаловую кислоту для ее заражения. Многие вирусы, также включая вирус гриппа, начинают заражать клетки путем распознавания сахарных цепей структур клеток, подлежащих заражению. В этой связи, специфичность связывания этих вирусов необходимо изучать с использованием различных сахарных цепей. Таким образом, сахарные цепи, имеющие α2,3-или α2,6-связанную сиаловую кислоту, могут служить в качестве материала для исследования на специфичность связывания таких вирусов и применяться, например, для детектирования вирусов.
Список цитируемой литературы
Непатентная Литература
Непатентная Литература 1: van den Eijnden DH et al., Biochem Biophys Res Commun., 92 (3), 839-45 (1980)
Непатентная Литература 2: Joziasse et al., JBC, 262, 2025-2033 (1987)
Непатентная Литература 3: Takashima et al., JBC, 277, 45719-45728 (2002)
Непатентная Литература 4: Krzewinski-Recchi et al., EJB, 270, 950-961 (2003)
Непатентная Литература 5: Miyazaki Т et al., Glycobiology, 18, 187-194 (2008)
Непатентная Литература 6: Kleineidam et al., Glycoconj. J., 14, 57-66 (1997)
Непатентная Литература 7: Yamamoto Т et al., BBB, 62, 210-214 (1998)
Непатентная Литература 8: Yamamoto T et al., Glycobiology, 17, 1167-1174 (2007)
Непатентная Литература 9: Takeuchi et al., J. Biol. Chem., 263 (8), 3657-63 (1988)
Непатентная Литература 10: Tsuda et al., Eur J Biochem., 188 (2), 405-11 (1990)
Непатентная Литература 11: Takeuchi et al., J. Biol. Chem., 263 (8), 3657-63 (1988)
Краткое изложение сущности изобретения
Техническая задача
Известно важное значение сахарных цепей, имеющих α2,3-или α2,6-связанную сиаловую кислоту на их невосстанавливающихся концах. Хотя эти компоненты сахарных цепей могут встречаться в природе, требуется их промышленное производство из-за проблем их выделения из природных продуктов, такими как, редкость, труднодоступность и безопасность природных продуктов. В частности, производство лекарственных препаратов антител или гликопротеиновых лекарственных препаратов, таких как, цитокины, или исследование специфичности связывания вирусов или т.п., неизбежно требует производства в значительном количестве сахарных цепей, имеющих гомогенные структуры путем контролирования паттерна присоединения (α2,6-связь или α2,3-связь) сиаловой кислоты. В частности, считается сложным синтезировать химическим путем триантеннарную или тетраантеннарную комплексную сахарную цепь N-типа, имеющую сиаловую кислоту на каждом их своих невосстанавливающих концов. Не имеется сообщения, раскрывающего что, например, тетраантеннарная комплексная сахарная цепь N-типа, имеющая α2,6-связанную сиаловую кислоту на каждом из своих невосстанавливающих концов, была синтезирован химическим путем. Более того, эти сиалированные триантеннарые или тетраантеннарые цепочки сахара сложно успешно получить ферментативным путем.
Решение задачи
Настоящие изобретатели недавно обнаружили активность сиалилтрансферазы в расщеплении сиаловой кислоты в продукте реакции в присутствии СМР, и также обнаружили, что образующийся СМР можно разлагать ферментативным путем с успешным получением, посредством этого, сахарной цепи, содержащей сиаловую кислоту. Настоящие изобретатели, кроме того, обнаружили, что даже тетраантеннарную сахарную цепь N-типа, имеющую четыре α2,6-связанные молекулы сиаловой кислоты, которую раньше было сложно синтезировать, можно получать с высокими выходами в однореакторном синтезе, содержащем реакцию удлинения биантеннарной сахарной цепи, используемой в качестве исходного материала без осуществления очистки после каждой ферментативной реакции.
Конкретно, настоящее изобретение относится к способу получения сиалированной второй сахарной цепи или ее производного, содержащему взаимодействие первой сахарной цепи или ее производного с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы для переноса сиаловой кислоты на невосстанавливающийся конец первой сахарной цепи или ее производного.
В контексте данного изобретения, согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, первая сахарная цепь или ее производное представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь или ее производное.
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, первая сахарная цепь или ее производное представляет собой соединение, представленное следующей формулой:
Формула 1
где Gn представляет собой N-ацетилглюкозамин, Man представляет собой маннозу, и Gal представляет собой галактозу (то же самое распространяется на все описание изобретения; в настоящем описании изобретения N-ацетилглюкозамин именуется также GlcNAc) или его производное.
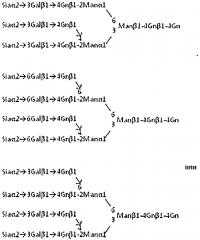
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, сиалированная вторая сахарная цепь или ее производное представляет собой триантеннарную или тетраантеннарную N-связанную комплексную сахарную цепь, где сахарная цепь представляет собой соединение, имеющее сиаловую кислоту на каждом из своих невосстанавливающих концов или его производное.
Согласно одному воплощению способа получения сиалированной второй сахарной цепи или ее производного по настоящему изобретению, сиалированная вторая сахарная цепь или ее производное представляет собой соединение, представленное следующей формулой
Формула 2
Формула 3
где Gn представляет собой N-ацетилглюкозамин, Man представляет собой маннозу, Gal представляет собой галактозу, и Sia представляет собой сиаловую кислоту (то же самое распространяется все описание изобретения; в настоящем описании изобретения, N-ацетилглюкозамин именуется также GlcNAc) или его производное.
Альтернативный объект настоящего изобретения относится к способу получения сиалированной сахарной цепи или ее производного, содержащий следующие стадии:
(а) однократное или многократное проведение стадии взаимодействия сахарной цепи, представленной следующей формулой:
Формула 4
или ее производного с UDP-сахаром, служащим в качестве субстрата гликозилтрансферазы в присутствии гликозилтрансферазы; и
(b) взаимодействие продукта стадии (а) с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы.
Дополнительный альтернативный объект настоящего изобретения относится к способу получения сахарной цепи, сиалированной на ее невосстанавливающем конце или ее производного, содержащему следующие стадии:
(a) взаимодействие агалакто-биантеннарной комплексной сахарной цепи или ее производного с UDP-GlcNAc в присутствии MGAT4 и MGAT5;
(b) взаимодействие продукта стадии (а) с UDP-Gal в присутствии β4GalT1; и
(c) взаимодействие продукта стадии (b) с СМР-сиаловой кислотой в присутствии сиалилтрансферазы и фосфатазы.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой α2,6-сиалилтрансферазу.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой сиалилтрансферазу человека.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, сиалилтрансфераза представляет собой ST6Gal-I.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, СМР-сиаловая кислота представляет собой CMP-Neu5Ac.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, фосфатаза представляет собой щелочную фосфатазу.
Согласно одному воплощению способа получения сиалированной сахарной цепи или ее производного по настоящему изобретению, фосфатаза представляет собой щелочную фосфатазу из Е.coli.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, имеющему сиаловую кислоту на каждом из своих невосстанавливающих концов тетраантеннарной N-связанной комплексной сахарной цепи или ее производного.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, имеющему α2,6-связанную сиаловую кислоту на каждом из своих невосстанавливающих концов тетраантеннарной N-связанной комплексной сахарной цепи или ее производного.
Дополнительный альтернативный объект настоящего изобретения относится к соединению, представленному следующей формулой:
Формула 5
Полезные эффекты изобретения
По способу настоящего изобретения можно более успешно получать сахарные цепи, содержащие сиаловую кислоту, с применением сиалилтрансферазы, чем когда-либо прежде. В частности, по способу настоящего изобретения можно успешно получать даже триантеннарную или тетраантеннарную комплексную сахарную цепь, содержащую сиаловую кислоту (включая гликоаминовые кислоты и гликопептиды), в которой сиаловая кислота связана с каждым из невосстанавливающих концов антенн, которую ранее было сложно получить. В дополнение, по способу настоящего изобретения можно добиться удобного получения с высокими выходами путем однореакторной реакции синтеза, и можно достичь также получение этих сахарных цепей в большом количестве, что ранее было сложно осуществить.
Краткое описание чертежей
На фигуре 1 показаны ВЭЖХ-хроматограммы каждого продукта реакции, полученные через 0 часов, 1 час, 6 часов или 24 часа (снизу вверх) реакции при 37°С после прибавления ST6Gal-1 к раствору, содержащему NA4-Fmoc в качестве тетраантеннарной комплексной сахарной цепи и CMP-NeuAc, или после дополнительного прибавления CMP-NeuAc и ST6Gal-1 к раствору спустя 24 часа и последующей 24-часовой реакции (самая верхняя хроматограмма). Термины "тетрасиало-", "трисиало-", "дисиало-" и "моносиало", указанные в верхней части хроматограмм, показывают времена удерживания (мин) (α2,6)тетрасиало-NA4-Fmoc, (α2,6)трисиало-NA4-Fmoc, (α2,6)дисиало-NA4-Fmoc, и (α2,6)моносиало-NA4-Fmoc, соответственно, в ВЭЖХ-хроматограммах.
На фигуре 2 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции (α2,6)тетрасиало-NA4-Fmoc при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac и в присутствии или в отсутствие сиалилтрансферазы. На диаграмме, "+Донор" показывает результаты реакции в присутствии 2 мМ CMP-Neu5Ac; "-Донор" показывает результаты реакции в отсутствие CMP-Neu5Ac; "+Донор, подвергшийся кипячению" показывает результаты реакции в присутствии 2 мМ CMP-Neu5Ac после нагревания при 100°С в течение 5 минут; и "-Фермент" показывает результаты реакции в отсутствие сиалилтрансферазы.
На левой диаграмме фигуры 3 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции тетрасиало-NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac или СМР. На правой диаграмме фигуры 3 показано относительное содержание (α2,3)тетрасиало-NA4-Fmoc и (α2,3)трисиало-NA4-Fmoc после реакции (α2,3)тетрасиало-NA4-Fmoc с сиалилтрансферазой (ST6Gal-I или ST3Gal-III) при 37°С в течение 15 часов в присутствии или в отсутствие CMP-Neu5Ac.
На фигуре 4 показано относительное содержание СМР после инкубирования CMP-Neu5Ac при 37°С, 33°С, 30°С или 25°С в течение 2 часов, 8 часов, или 24 часов.
На фигуре 5 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc, (α2,6)трисиало-NA4-Fmoc, (α2,6)дисиало-NA4-Fmoc и (α2,6)моносиало-NA4-Fmoc после реакции NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С, 30°С, 25°С, 20°С или 10°С в течение 2 часов, 8 часов, или 24 часов в присутствии CMP-Neu5Ac.
На фигуре 6 показано относительное содержание (α2,6)тетрасиало-NA4-Fmoc и (α2,6)трисиало-NA4-Fmoc после реакции (α2,6)тетрасиало-NA4-Fmoc с сиалилтрансферазой ST6Gal1 при 37°С в течение 3 часов, 6 часов, или 24 часов в отсутствие СМР и ВАР, в качестве контроля, в присутствии СМР или в присутствии СМР и ВАР.
На фигуре 7 приведена схема технологического процесса однореакторной реакции синтеза (α2,6)тетрасиало-NA4-Fmoc, описанную в разделе (7) примеров.
На фигуре 8 схематично показана реакция гликозилирования с использованием структурной формулы в однореакторной реакции синтеза (α2,6)тетрасиало-NA4-Fmoc, описанную в разделе (7) примеров.
Изображение на фигуре 9 относится к способу однореакторного синтеза (α2,6)тетрасиало-NA4-Fmoc, описанному в разделе (7) примеров. На диаграмме верхняя ВЭЖХ-хроматограмма, обозначенная как "+ST6Gall", представляет собой ВЭЖХ-хроматограмму продукта реакции; а нижняя ВЭЖХ-хроматограмму, обозначенная как "NGA2-Fmoc", представляет собой ВЭЖХ-хроматограмму исходного материала реакции.
Описание воплощений
В настоящем описании изобретения, «сиаловая кислота" представляет собой обобщенное обозначение для семейства производных нейраминовой кислоты, замещенных аминогруппой или гидроксигруппой. В этом контексте "нейраминовая кислота" представляет собой специальную нонозу, имеющую внутримолекулярные амино- и карбоксильную группы, и представлена следующей формулой:
Формула 6
В структуре сиаловой кислоты как известно аминогруппы в описанной выше нейраминовой кислоте замещают ацетилированием, гликолилированием или т.п. аминогруппы. В дополнение, как известно возможно, например, дезаминирование (элиминирование аминогруппы). Ацетилирование, метилирование, фосфорилирование, лактилирование или т.п. как известно, замещают гидроксигруппы, хотя замещение по настоящему изобретению не ограничено этим.
В настоящем описании изобретения, сиаловая кислота, предназначенная для переноса, представляет собой, предпочтительно, N-ацетилнейраминовую кислоту (Neu5Ac), которая наиболее часто встречается в природе, или N-гликолилнейраминовую кислоту (Neu5Gc), которая является второй по распространенности в природе, с точки зрения получения природных гликопротеинов или их сахарных цепей. N-ацетилнейраминовая кислота является более предпочтительной, в частности, с точки зрения получения природных гликопротеинов, таких как гликопротеины человека или их сахарные цепи.
В настоящем описании изобретения, "СМР-сиаловая кислота" означает цитидин-5′-монофосфо-сиаловую кислоту и относится к соединению, имеющему структуру, в которой гидроксигрупа в положении 2 сиаловой кислоты дегидратирована-конденсирована с фосфатной группой цитидинмонофосфата (СМР). Примеры СМР-сиаловой кислоты с более конкретно определенной сиаловой кислотой включают CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac) и CMP-N-гликолилнейраминовую кислоту (CMP-Neu5Gc). В настоящем описании изобретения СМР-сиаловая кислота, применяемая в настоящем изобретении, представляет собой, предпочтительно, CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac) или CMP-N-гликолилнейраминовую кислоту (CMP-Neu5Gc), с точки зрения получения природных гликопротеинов или их сахарных цепей, более предпочтительно, CMP-N-ацетилнейраминовую кислоту (CMP-Neu5Ac), в частности, с точки зрения получения природных гликопротеинов, таких как, гликопротеины человека или их сахарные цепи.
В настоящем описании изобретения, «сиалилтрансфераза" представляет собой один тип гликозилтрансфераз и относится к ферменту, который катализирует реакцию, посредством которой остаток сиаловой кислоты переносится из СМР-сиаловой кислоты, служащей в качестве сахара-донора (также называемого донорный субстрат) к структуре сахарной цепи, служащей в качестве сахара-акцептора (также называемого акцепторный субстрат) (в дальнейшем в этом документе эта реакция называется "реакция переноса сиаловой кислоты"). Известно, что сиалилтрансфераза переносит сиаловую кислоту на невосстанавливающий конец сахарной цепи. Реакцию переноса сиаловой кислоты можно представить реакционной схемой, показанной ниже. В случае применения производного сахарной цепи вместо сахарной цепи, сахарную цепь в схеме можно заменить производным сахарной цепи.
запись 1
где сиаловая кислота-сахарная цепь представляет собой соединение, имеющее сиаловую кислоту, связанную посредством гликозидной связи с невосстанавливающим концом сахарной цепи.]
Известно, что сиалилтрансфераза переносит сиаловую кислоту в, например, положение 3 или 6 галактозы, положение 6 N-ацетилгалактозамина или положение 8 другой сиаловой кислоты на невосстанавливающем конце сахарной цепи. Например, фермент, переносящий сиаловую кислоту в положение 3 галактозы, называется α-2,3-сиалилтрансфераза; фермент, переносящий сиаловую кислоту в положение 6 галактозы или N-ацетилгалактозамина, называется α-2,6-сиалилтрансфераза; и фермент, переносящий сиаловую кислоту в положение 8 другой сиаловой кислоты, называется α-2,8-полисиалилтрансфераза.
Например, известна сиалилтрансфераза бактериального происхождения, а также сиалилтрансфераза радужной форели или сиалилтрансфераза млекопитающих. Также, в растениях был обнаружен белок, имеющей сиалилтрансфераза-подобную активность. Сиалилтрансфераза млекопитающих является предпочтительной, в частности, с точки зрения получения природных гликопротеинов, таких как гликопротеины млекопитающих или их сахарные цепи. Сиалилтрансфераза человека является более предпочтительной, с точки зрения получения природных гликопротеинов таких как, гликопротеины человека или их сахарные цепи.
α-2,6-сиалилтрансфераза человека известна как, например, ферменты ST6Gal-I (также называемых ST6Gal1; то же самое распространяется на описание ниже) и ST6Gal-II, переносящие сиаловую кислоту в положение 6 галактозы и ферменты ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III и ST6GalNAc-IV, переносящие сиаловую кислоту в положение 6 N-ацетилгалактозамина.
α-2,3-сиалилтрансфераза человека известна как, например, ферменты ST3Gal-I - ST3Gal-VI, переносящие сиаловую кислоту в положение 3 галактозы.
Сиалилтрансфераза представляет собой, предпочтительно, ST6Gal-I, ST6Gal-II, ST3Gal-I, ST3Gal-II, ST3Gal-III, ST3Gal-IV, ST3Gal-VI, ST6GalNAc-I, ST6GalNAc-II, ST6GalNAc-III, ST6GalNAc-IV, ST8Sia-II, ST8Sia-III или ST8Sia-IV, в частности, с точки зрения получения природных гликопротеинов или их сахарных цепей. Альтернативно, ST6Gal-I, ST6Gal-II, ST3Gal-III, ST3Gal-IV, ST3Gal-VI, ST8Sia-II, ST8Sia-III или ST8Sia-IV являются предпочтительными, с точки зрения получения N-связанных сахарных цепей.
В настоящем описании изобретения, «сахарная цепь" относится к соединению, имеющему связь двух или более структурных единиц сахара(ов) (моносахаридов и/или их производных). В случае сахарной цепи, имеющей связь двух или более структурных единиц сахара, структурные единицы сахара связаны путем дегидратации - конденсации через гликозидную связь между ними. Примеры такой сахарной цепи включают, но не ограничиваются ими, моносахариды и полисахариды (глюкозу, галактозу, маннозу, фукозу, ксилозу, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловую кислоту и их комплексы и производные) содержащиеся in vivo, и широкий круг других сахарных цепей, таких как, разложившиеся полисахариды и сахарные цепи, отщепленные от или порожденные комплексными биомолекулами, включая гликопротеины, протеогликаны, гликозаминогликаны и гликолипиды. Сахарная цепь может быть линейной или разветвленной.
В настоящем описании изобретения «сахарная цепь" также включает соединение, имеющее модифицированный заместитель сахарной цепи. Примеры этого включают, но не ограничиваются ими, сахарные цепи, такие как, сахарные цепи, состоящие из сахаров, имеющих карбоксильную группу (например, альдоновую кислоту (например, D-глюконовую кислоту, продукт окисления D-глюкозы), которые представляют собой карбоновую кислоту, образующуюся путем окисления в положении С-1, и уроновую кислоту (например, D-глюкуроновую кислоту, продукт окисления D-глюкозы), которая представляет собой карбоновую кислоту, образующуюся путем окисления терминального атома углерода), сахара, имеющие аминогруппу или производное аминогруппы (например, ацетилированную аминогруппу) (например, N-ацетил-D-глюкозамин и N-ацетил-В-галактозамин), сахара, имеющие как амино, так и карбоксильную группы (например, N-ацетилнейраминовую кислоту (сиаловую кислоту) и N-ацетилмурамовую кислоту), дезоксидированные сахара (например, 2-дезокси-D-рибозу), сульфированные сахара, содержащие сульфатную группу, и фосфорилированные сахара, содержащие фосфатную группу.
В настоящем описании изобретения сахарная цепь представляет собой предпочтительно, сахарную цепь, которая находится в форме гликоконъюгата (гликопептида (или гликопротеина), протеогликана, гликолипида и т.д.) in vivo, предпочтительно, сахарную цепь, связанную с пептидом (или белком) с образованием гликопептида (или гликопротеина) in vivo, например, N-связанную сахарную цепь или O-связанную сахарную цепь, с точки зрения получения гликопротеинов, служащих в качестве лекарственных средств. N-связанная сахарная цепь представляет собой обобщенное обозначение для сахарных цепей, паттерн связывания которых с белком представляет собой связь между аномерной гидроксигруппой в N-ацетилглюкозамине на восстанавливающем конце сахарной цепи и аминогруппой (-NH2) боковой цепи аспарагина путем дегидратации-конденсации. O-связанная сахарная цепь представляет собой обобщенное обозначение для сахарных цепей, паттерн связывания которых с белком представляет собой связь между аномерной гидроксигруппой на восстанавливающем конце сахарной цепи и гидроксигруппой (-ОН) боковой цепи серина или треонина путем дегидратирования-конденсации.
N-связанную сахарную цепь также называют аспарагин-связанная сахарная цепь, сахарная цепь N-типа или т.п. N-связанная сахарная цепь представляет собой группу сахарных цепей, имеющих Man3-GlcNAc-GlcNAc в качестве ядра. Известно, что в зависимости от структуры сахарных цепей, связанных с Man в ядре, N-связанная сахарная цепь имеет определенную структуру сахарной цепи, называемую высокоманнозная, комплексная или гибридного типа. Также известна мультиантеннарная структура, такая как, биантеннарого типа, триантеннарого типа или тетраантеннарого типа, как разветвленная структура N-связанной сахарной цепи. Эти структуры сахарных цепей также описаны, например, в Seikagaku Jiten (Encyclopedia Biochemistry in English), 3rd ed., issued Tokyo Kagaku Dojin Co., Ltd.
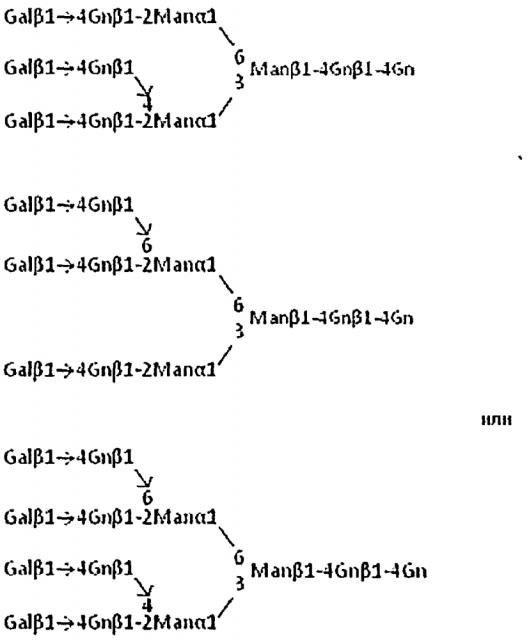
В настоящем описании изобретения первая сахарная цепь или производное, т.е., сахарная цепь или ее производное, служащая в качестве сахара-акцептора в присутствии сиалилтрансферазы и фосфатазы, никак конкретно не ограничивается при условии, что сахарная цепь или производное имеет на своем невосстанавливающем конце структуру сахарной цепи, служащую в качестве субстрата сиалилтрансферазы. Известно, что многие природные гликопротеины содержат разветвленную(ые) сахарную(ая) цепь(и), имеющую(ие) структуру(ы) в которой(ых) сиаловая кислота связана с невосстанавливающим концом N-связанной сахарной цепи комплексного или гибридного типа. Первая сахарная цепь или ее производное представляет собой, предпочтительно, N-связанную комплексную сахарную цепь или N-связанную гибридную сахарную цепь, более предпочтительно, N-связанную комплексную сахарную цепь, способную иметь сиаловую кислоту на каждом из своих невосстанавливающих концов, с точки зрения получения этих сахарных цепей. Разветвленная структура, представляет собой, предпочтительно, N-связанную триантеннарную или тетраантеннарную сахарную цепь, которую ранее было сложно получить. N-связанная триантеннарная или тетраантеннарная комплексная сахарная цепь является более предпочтительной.
В настоящем описании "первая сахарная цепь или ее производное" относится к сахарной цепи или ее производному, которое применяют в качестве исходного материала (также называемого исходным соединением) в реакции переноса сиаловой кислоты, и также относится к сахарной цепи, имеющей, по меньшей мере, на одном невосстанавливающем конце структуру сахарной цепи, служащую в качестве субстрата сиалилтрансферазы. "Первую сахарную цепь или ее производное", применяемые в реакции переноса сиаловой кислоты, именуют также "сахар-акцептор" или "акцепторный субстрат", в то время как "СМР-сиаловая кислота" именуют также "сахар-донор" или "донорный субстрат". Применяемая "первая сахарная цепь или ее производное" представляет собой, предпочтительно, например, соединение, имеющее структуру субстрата сиалилтрансферазы на каждом невосстанавливающем конце разветвленной сахарной цепи, или, иными словами, соединение, имеющее структуру, полностью дефицитную по сиаловой кислоте, относительно "сиалированной второй сахарной цепи или ее производного", как целевого соединения. В настоящем описании изобретения такую сахарную цепь именуют также "асиало-сахарная цепь", "асиало-форма" или "асиало".
В настоящем описании изобретения, асиало-сахарная цепь является предпочтительно, например, тетраантеннарной сахарной цепью, представленной формулой, показанной ниже, или ее производным.
В настоящем описании изобретения, асиало-тетраантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 7
или ее производным.
В настоящем описании изобретения, асиало-триантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 8
или ее производным.
В настоящем описании изобретения, асиало-биантеннарная N-связанная комплексная сахарная цепь или ее производное является, предпочтительно, например, сахарной цепью, представленной следующей формулой:
Формула 9
или ее производным.
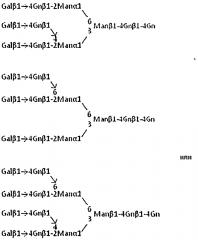
В дополнение к этим сахарным цепям, сахарная цепь, имеющая сиаловую кислоту, связанную посредством гликозидной связи с одним или более положением(ями) на невосстанавливающих концах каждой сахарной цепи, или ее производное, может быть использована в качестве сахара-акцептора в реакции переноса сиаловой кислоты по настоящему изобретению. Обычные способы редко приводят к получению мультиантеннарной сахарной цепи, имеющей сиаловую кислоту на каждом из своих невосстанавливающих концов сахарной цепи. Даже такую сахарную цепь, полученную обычным способом, можно превратить в сахарную цепь, имеющую сиаловую кислоту на каждом из своих невосстанавливающих концов, с помощью реакции переноса сиаловой кислоты по настоящему изобретению. Примеры сахарной цепи, полученной обычными способами, включают соединения, представленные следующими формулами:
Формула 10
Эти соединения можно получить обычными способами, или можно также получить путем изменения времени реакции в способе настоящего изобретения.
Сахарная цепь, имеющая сиаловую кислоту, связанную посредством гликозидной связи с одним или более положением(ями) на ее невосстанавливающих концах, или ее производное могут быть использованы в качестве первой сахарной цепи или ее производного, тогда как может быть использована сиалилтрансфераза, которая образует гликозидную связь, иную, чем связь сиаловой кислоты в соединении. В таком случае можно получить соединение, имеющее различные типы гликозидной связи остатков сиаловой кислоты.
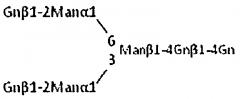
В настоящем описании "производное сахарной цепи" также включает соединение, имеющее дополнительное соединение, связанное с восстанавливающим концом сахарной цепи посредством дегидратации-конденсации или т.п. "Производным сахарной цепи" является, например, соединение, дополнительно имеющее R, связанный с N-ацетилглюкозамином на восстанавливающем конце сахарной цепи, представленное следующей формулой:
Формула 11
Это производное сахарной цепи приведено только в целях иллюстрации, и можно также привести производные других сахарных цепей: сахарны