Материал для культур клеток, полученный из растений
Иллюстрации
Показать всеПредложен материал для культивирования или доставки эукариотических клеток. Материал содержит происходящие из растений механически дезинтегрированные целлюлозные нановолокна и/или их производные в форме гидрогеля или мембраны во влажном состоянии. Диаметр целлюлозных нановолокон или пучков нановолокон в целлюлозных нановолокнах и/или их производных меньше 1 мкм, предпочтительно - меньше 200 нм, более предпочтительно - меньше 100 нм. Данный материал получают путем смешивания происходящих от растений механически дезинтегрированных целлюлозных нановолокон и/или их производных с водой. Предложен также матрикс для культивирования или доставки клеток, который содержит живые клетки и указанный материал, образующий гидрогель, при этом клетки находятся в этом матриксе в виде трехмерной или двухмерной структуры. Для культивирования клеток осуществляют контакт полученных клеток с материалом для образования матрикса, в котором культивирование клеток протекает в виде трехмерной или двухмерной структуры. Предложено также применение указанного материала для лабораторных и/или промышленных целей в качестве среды или компонента среды для сохранения клеток in vitro. Группа изобретений обеспечивает стабильность клеток в матриксе, а также гомогенное распределение их в указанном матриксе. 6 н. и 16 з.п. ф-лы, 15 ил., 11 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к композициям для культивирования и доставки клеток, содержащим целлюлозные нановолокна и/или их производные.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Здравоохранение является одной из наиболее активно разрабатываемых областей научных исследований. Необходимость открывать и разрабатывать дешевые и безопасные лекарственные средства постоянно растет. Огромное значение имеет возможность точного моделирования клеточной структуры определенной ткани или органа. Точное копирование системы in vivo в условиях in vitro может потребовать трехмерного роста клеток (3D). Перекрестная связь, возникающая между клетками в 3D культуре клеток, является имитацией роста клеток в физиологических условиях. Действительно, 3D культуры клеток приобрели значение в исследованиях, посвященных регенеративной медицине, лучшему пониманию хронических болезней и получению превосходной модельной системы in vitro для скрининга лекарственных средств и токсикологических анализов. Поэтому их появление было достаточно точно названо «новым измерением в биологии».
Проводятся интенсивные научные исследования с целью выявления и разработки «факторов и подложек», которые могут способствовать 3D росту клеток in vitro. В физиологических условиях клетки не только обмениваются информацией друг с другом, но и взаимодействуют с клеточной микросредой и экстраклеточным матриксом (ЭКМ), в котором они расположены. ЭКМ обеспечивает структурную поддержку клеток, а также участвует в передаче сигналов и определении судьбы клеток. ЭСМ преимущественно состоит из гликозаминогликанов и волокнистых белков, таких как коллаген, эластин, ламинин и фибронектин, которые самоорганизуются в нанофибриллярную сеть. Идеальная подложка для 3D роста клеток должна быть способной имитировать структурный компонент нативного ЭКМ, способствовать росту и сохранению клеток, содержать сеть взаимосвязанных пор достаточного размера для эффективной миграции клеток и переноса питательных веществ в клетки. По существу, механические и химические свойства подложки должны обеспечивать такую же функцию клеток, как в нативном состоянии.
Гидрогели, как синтетические, так и природные, оказались подходящими подложками для 3D культуры клеток. Сеть взаимосвязанных пор в гидрогелях обеспечивает удержание большого объема биологической жидкости, способствует транспортировке кислорода, питательных веществ и отходов. Кроме того, большинство гидрогелей могут формироваться при мягких цитосовместимых условиях, а их биологические свойства можно модулировать с использованием химии поверхностных явлений. Специально разработанные гидрогели с модифицированными механическими, химическими и биологическими свойствами потенциально могут имитировать ЭКМ, что определяет их пригодность для 3D клеточных культур. Коммерческими продуктами для 3D культивирования клеток являются, например, PuraMatrix™ (производства компании 3DM Inc.) и Matrigel (производства компании BD Biosciences). PuraMatrix™ - это гидрогель, состоящий из самоорганизующихся пептидных нановолокон, который напоминает структуру природного фибриллярного коллагена в ЭКМ с диаметром волокон, равным 5-10 нм. Он также имеет высокое содержание воды, в характерном случае - 99,5%. В публикациях US 7,449,180 и WO 2004/007683 описаны пептидные гидрогели. Matrigel - это гелеобразная смесь белков, секретируемых опухолевыми клетками мышей. Смесь напоминает сложную экстраклеточную среду, обнаруживаемую во многих тканях, и используется специалистами по биологии клетки в качестве подложки для культур клеток. MaxGel™ ЕСМ Matrix (производства компании Sigma-Aldrich), который содержит смесь компонентов ЭКМ человека, образует гель при температуре окружающей среды.
Бактериальную целлюлозу использовали для получения ранозаживляющих мембран и в качестве подложки для культур клеток. Ограничением использования бактериальной целлюлозы для культивирования клеток является внутренняя структура ферментированного материала; после культивирования бактериальная целлюлоза образует очень плотные мембраны на границе раздела «воздух-вода» в ферментере. Образующиеся мембраны являются слишком плотными для многих прикладных задач, связанных с 3D культивированием клеток, поэтому необходимы различные модификации для повышения их пористости, которая требуется для проникновения клеток и формирования клеточных кластеров.
Гидрогелевые материалы также широко использовали в других типах прикладных задач, связанных с культивированием клеток, где необходим гидрофильный опорный материал, например - гидроколлоиды агарового типа широко использовали для культивирования растительных клеток, бактерий и грибов для различных микробиологических целей.
В публикации US 5,254,471 описан носитель для культивирования клеток, изготовленный из ультратонких волокон. В публикации WO 2009/126980 описан гидрогель на основе целлюлозы, который содержит целлюлозу со средней степенью полимеризации в диапазоне от 150 до 6200.
Показано, что решения, соответствующие предшествующему уровню техники, были относительно неудовлетворительными для культивирования клеток. Все существующие методы и матриксы для 2D и 3D культур требуют использования химических веществ или соединений животного происхождения в средах из биологических материалов для сохранения и размножения клеток. Сохранение стволовых клеток является особенно трудной задачей, и не существует простых решений для получения матрикса, используемого с культуральной средой, который сохранял бы стволовые клетки в живом состоянии. Присутствие соединений животного происхождения в среде, окружающей культуру клеток, создает высокий риск иммунных реакций и различные проблемы с токсичностью, которая в конечном итоге убивает культивируемые клетки. Матриксы для клеточных культур, содержащие добавки животного происхождения, не пригодны для использования со стволовыми клетками, в частности, если стволовые клетки необходимо использовать для трансплантации тканей и тканевой технологии (инженерии). Кроме того, многие полимеры, предложенные для использования в среде для культивирования клеток, не выдерживают физиологическую температуру или являются токсичными для клеток.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Существует явная необходимость в усовершенствованном материале для культивирования клеток, который мог бы обеспечить соответствующую трех- или двухмерную основу для различных типов клеток. Такие функциональные 3D клеточные модели можно использовать в качестве средств для обнаружения лекарственных средств вместо экспериментов на животных, и они являются более совершенными, чем используемые в настоящее время 2D клеточные модели. Также очень желателен перенос культивированных клеток, например, если целью является пересадка ткани или клеточная терапия. Возможность переноса культивированных кластеров клеток в 3D матриксе желательна при разработке различных клеточных моделей in vitro. Существующие биоматериалы с 3D культурами клеток не позволяют перемещать гидрогелевый матрикс с помощью иглы без существенного повреждения культивируемых клеток.
Поэтому задачей настоящего изобретения является обеспечение нового подхода, позволяющего по меньшей мере частично решить или уменьшить вышеуказанные проблемы, существовавшие на предшествующем уровне техники. Задачи настоящего изобретения решены за счет композиции для культивирования или доставки клеток, содержащей целлюлозные нановолокна или их производные, которая имеет признаки, указанные в независимых пунктах формулы изобретения. Предпочтительные варианты осуществления настоящего изобретения описаны в зависимых пунктах формулы изобретения.
Настоящее изобретение основано на использовании целлюлозных нановолокон и/или их производных в 2D или 3D матриксе для культур клеток. Настоящее изобретение обеспечивает использование целлюлозных нановолокон и/или их производных в матриксе для культур клеток. Использование целлюлозных нановолокон и/или их производных в качестве 2D или 3D матрикса для культур клеток исключает необходимость использования добавок животного происхождения для ускорения и обеспечения размножения клеток на матриксе, содержащем целлюлозные нановолокна и/или их производные.
Авторы настоящего изобретения неожиданно обнаружили, что полученный из растений гидрогель на основе целлюлозных нановолокон (ЦНВ) можно использовать без каких-либо модификаций в качестве биомиметика ЭКМ человека для 3D культур клеток. Данные о пролиферации и жизнеспособности клеток подтверждают, что ЦНВ-гидрогель является оптимальным биоматериалом для 3D подложек для клеток, позволяющим проводить высокопроизводительные скрининговые анализы с использованием функциональных клеток при разработке лекарственных средств, при исследовании токсичности лекарственных средств, в регенеративной медицине, а также для доставки клеток in vivo.
Авторы настоящего изобретения впервые описали физические свойства и свойства биосовместимости ЦНВ-гидрогеля, полученного из растений. Растительную целлюлозу широко используют в целлюлозно-бумажной и текстильной промышленности, и она широко распространена в природе. Нативный целлюлозный нановолоконный гидрогель является непрозрачным. Химическая модификация целлюлозной массы перед ее механической дезинтеграцией позволяет получить оптически прозрачные гидрогели.
Настоящее изобретение основано на экспериментальных исследованиях гидрогелей, состоящих из целлюлозных нановолокон (ЦНВ), которые диспергированы в водной среде. Нановолокна являются высокогидрофильными из-за наличия гидроксильных функциональных групп в полимерах целлюлозы и частично покрыты гемицеллюлозными полисахаридами.
Соответственно, настоящее изобретение в качестве первого аспекта обеспечивает композицию для культивирования или доставки клеток, содержащую целлюлозные нановолокна и/или их производные, причем целлюлозные нановолокна имеют форму гидрогеля или мембраны.
Важным преимуществом настоящего изобретения является то, что клетки могут сохраняться (и пролиферировать) на или в среде из биоматериала, не содержащей во внеклеточной среде химических веществ, происходящих от животного или человека. Клетки равномерно диспергированы на или в среде (матриксе), содержащей целлюлозные нановолокна или их производные. Клетки распределяются на или в среде, начинают пролиферировать, и клеточные кластеры начинают спонтанно расти без аккумуляции клеток на дне планшета для культивирования клеток. Гомогенное распределение клеток в целлюлозных нановолокнах или их производных является предпосылкой функционирования биоматериала в качестве 3D среды для культивирования клеток.
Другими преимуществами настоящего изобретения являются следующие: целлюлозные нановолокна и/или их производные являются инертными и не создают флуоресцирующего фона. Среды, содержащие целлюлозные нановолокна или их производные, можно вводить посредством инъекции. Инъецируемость объясняется их реологическими свойствами. Инъекцию можно осуществить таким образом, что клетки остаются стабильными внутри матрикса и гомогенно распределенными в матриксе после инъекции.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
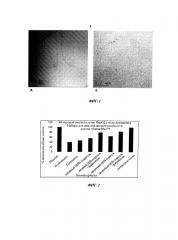
Фиг.1 изображает крио-ТЭМ снимки гидрогелей на основе целлюлозных нановолокон. Нативный ЦНВ-гидрогель изображен слева (А), а прозрачный ЦНВ-гидрогель - справа (В).
Фиг.2 демонстрирует жизнеспособность клеток HepG2 в коммерческих материалах для культивирования клеток [MaxGel™ (Sigma-Aldrich), HydroMatrix™ (Sigma-Aldrich) и PuraMatrix™ (3DM Inc.), в двух других материалах на основе целлюлозных нановолокон (нативный ЦНВ-гидрогель и прозрачный ЦНВ-гидрогель) и в ЦНВ-гидрогеле, в который добавлен фибронектин (ФН). В ходе анализа пролиферации с использованием Набора для анализа жизнеспособности клеток AlamarBlue™ клетки культивировали в течение 48 часов, а контрольные клетки культивировали в одинаковых условиях на полимерной поверхности.
Фиг.3 демонстрирует жизнеспособность клеток ARPE-19 в нативном ЦНВ-гидрогеле после переноса клеток иглами для шприца различного размера. Жизнеспособность представлена как относительная интенсивность флуоресценции.
Фиг.4 демонстрирует диффузию декстранов с различной молекулярной массой (20 кДа, 70 кДа и 250 кДа) через 1%-ный нативный гидрогель на основе целлюлозных нановолокон.
Фиг.5 представляет светомикроскопическое изображение клеток ARPE-19 на нативной ЦНВ-мембране. ЦНВ-мембрана поддерживает рост клеток в верхней части снимка, в нижней части снимка клетки растут на полимерной подложке для культивирования клеток. Увеличение 20×.
Фиг.6 представляет конфокально-микроскопические изображения срезов клеток HepG2 на полимерной подложке (A) для культивирования клеток и в нативном гидрогеле (B) на основе целлюлозных нановолокон.
Фиг.7 демонстрирует вязкоупругие свойства 0,5%-ного ЦНВ-гидрогеля, определенные посредством динамических осцилляторных реологических измерений. Показаны частотная зависимость G' (модуля накопления) и G'' (модуля потерь) 0,5%-ного нативного ЦНВ-гидрогеля.
Фиг.8 демонстрирует вязкость 0,5%-ных ЦНВ-гидрогелей как функцию приложенного сдвигающего напряжения по сравнению с 0,5%-ным раствором водорастворимого полимера полиакриламида (5000 кДа) и КМЦ (250 кДа).
Фиг.9 демонстрирует вязкость 0,5%-ных ЦНВ-гидрогелей как функцию измеренной скорости сдвига по сравнению с 0,5%-ным раствором полиакриламида и КМЦ. Характерные зоны скорости сдвига при различных физических процессах отмечены на рисунке стрелками.
Фиг.10 является схематическим изображением ЦНВ-гидрогеля, содержащего клетки, который течет в игле. Область высокой скорости сдвига (низкой вязкости) расположена на поверхности раздела «гель-игла», а область низкой скорости сдвига (очень высокой вязкости) - в центре иглы.
Фиг.11 демонстрирует изменение скорости сдвига и вязкости, когда 0,7%-ный ЦНВ-гель сдвигают в реометре с системой концентрических цилиндров при постоянном напряжении, равном 40 Па.
Фиг.12 демонстрирует восстановление структуры дисперсии в 0,7%-ном нативном ЦНВ-гидрогеле после сдвига с высокой скоростью сдвига по сравнению с осторожным перемешиванием стеклянной палочкой.
Фиг.13 демонстрирует стабильность двух суспензий песка в 0,5%-ном нативном ЦНВ-гидрогеле (верхний ряд) и в 0,5%-ном прозрачном ЦНВ-гидрогеле (нижний ряд) в течение периода, равного 17 дням. Был использован песок, соответствующий стандарту CEN (EN 196-1), со средним размером частиц, равным 1-2 мм и 2-3 мм. Образцы хранили при комнатной температуре.
Фиг.14 демонстрирует влияние ферментативного гидролиза на способность гелей на основе целлюлозных нановолокон к образованию суспензий. Был использован песок, соответствующий стандарту CEN (EN 196-1), со средним размером частиц, равным 1-2 мм.
Фиг.15 представляет конфокально-микроскопическое изображение прогениторных клеток печени, полученных из эмбриональных стволовых клеток человека, которые погружены в нативный ЦНВ-гидрогель. Длина измерительной линии: 70 мкм.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции для культивирования или доставки клеток, содержащей целлюлозные нановолокна и/или их производные, причем целлюлозные нановолокна или их производные имеют форму гидрогеля или мембраны. Целлюлозные нановолокна или их производные можно получить из материала, не происходящего от животных, например - из сырьевого материала, содержащего растительный материал.
Если в явном виде не указано иное, то термины, которые использованы в описании и формуле изобретения, имеют значения, обычно используемые в области культивирования клеток. Более конкретно, следующие термины имеют значения, приведенные ниже.
Термин «композиция для культивирования или доставки клеток» относится к материалу, содержащему целлюлозные нановолокна или производные целлюлозных нановолокон, который используют в качестве среды для культивирования клеток или для доставки клеток. Эту композицию можно также использовать для переноса клеток или кластеров клеток. Целлюлозные нановолокна могут находиться в форме гидрогеля или мембраны. Композиция может дополнительно содержать различные добавки, такие как особые компоненты экстраклеточного матрикса, сыворотку, факторы роста и белки.
Термин «целлюлозный сырьевой материал» относится к любому источнику целлюлозного сырьевого материала, который может быть использован для получения целлюлозной массы, рафинированной целлюлозной массы или целлюлозных нановолокон. Сырьевой материал может иметь в основе любой растительный материал, содержащий целлюлозу. Растительным материалом может быть древесина. Древесина может быть получена от деревьев с мягкой древесиной, таких как ель, сосна, пихта, лиственница, дугласова пихта или хемлок, или от деревьев с твердой древесиной, таких как береза, осина, тополь, ольха, эвкалипт или акация, или быть смесью мягкой древесины и твердой древесины. Недревесный материал может происходить из сельскохозяйственных отходов, трав или других растительных веществ, таких как солома, листья, кора, семена, шелуха, цветки, растения или плоды хлопчатника, кукурузы, овса, ржи, ячменя, риса, льна, конопли, манильской конопли, сизалевой агавы, джута, китайской крапивы, кенафа, сахарного тростника, бамбука или камыша.
Термин «целлюлозная масса» относится к целлюлозным волокнам, которые выделены из любого целлюлозного сырьевого материала с использованием химических, механических, термомеханических или химикотермомеханических процессов варки целлюлозы. Обычно диаметр волокон лежит в диапазоне от 15 до 25 мкм, а их длина превышает 500 мкм, но настоящее изобретение не ограничено этими параметрами.
Целлюлоза в настоящем изобретении структурно является целлюлозой I типа.
Термин «целлюлозное нановолокно» относится к совокупности выделенных целлюлозных нановолокон (ЦНВ) или пучков нановолокон, полученных из целлюлозного сырьевого материала или целлюлозной массы. Нановолокна в характерном случае имеют большое характеристическое отношение: их длина может превышать один микрометр, тогда как среднечисловой диаметр обычно меньше 200 нм. Диаметр пучков нановолокон может быть и большим, но обычно он меньше 1 мкм. Самые мелкие нановолокна сходны с так называемыми элементарными фибриллами, которые обычно имеют диаметр в диапазоне от 2 до 12 нм. Размеры фибрилл или пучков фибрилл зависят от сырьевого материала и способа дезинтеграции. Целлюлозные нановолокна могут также содержать некоторое количество гемицеллюлоз; их содержание зависит от растительного источника.
Механическую дезинтеграцию целлюлозных нановолокон из целлюлозного сырьевого материала, целлюлозной массы или рафинированной целлюлозной массы осуществляют с использованием подходящего оборудования, например - рафинатора, дефибратора, гомогенизатора, аппарата для получения коллоидной целлюлозы, фрикционного дефибратора, ультразвукового аппарата, флюидизатора, например - микрофлюидизатора, макрофлюидизатора или гомогенизатора флюидизирующего типа. «Целлюлозные нановолокна» предпочтительно являются механически дезинтегрированным материалом.
«Целлюлозные нановолокна» или «целлюлозные нановолокна и/или их производные» могут также быть любыми химически или физически модифицированными производными целлюлозных нановолокон или пучков нановолокон. Химическая модификация может быть основана, например, на реакциях карбоксиметилирования, окисления, например - окисления с использованием TEMPO (2,2,6,6-тетраметилпиперидин-1-оксила), эстерификации (образования сложного эфира) и этерификации (образования простого эфира) молекул целлюлозы. Модификация может быть также осуществлена посредством физической адсорбции анионных, катионных или неионногенных веществ или любой их комбинации на поверхности целлюлозы. Описанную модификацию можно осуществить до, после или во время получения целлюлозных нановолокон. Некоторые модификации могут привести к получению ЦНВ-материалов, способных разлагаться в организме человека.
Целлюлозный сырьевой материал, например - целлюлозную массу, перед механической дезинтеграцией предпочтительно предварительно обрабатывают кислотой или щелочью. Предварительную обработку проводят, подвергая целлюлозную массу обработке кислотой, предпочтительно - соляной кислотой, для удаления положительно заряженных ионов, имеющих заряд больше +1, с последующей обработкой неорганическим основанием, содержащим положительно заряженные ионы с зарядом +1, предпочтительно - NaOH, так что ионы Na+ замещают ранее присутствовавшие ионы. Такая предварительная обработка придает «целлюлозным нановолокнам» превосходные гелеобразующие свойства и прозрачность. Такой предварительно обработанный продукт называют прошедшими кислотно-щелочную обработку или ионозамещенными «целлюлозными нановолокнами».
Микробиологическая чистота «целлюлозных нановолокон» важна для качества клеточных культур. Поэтому «целлюлозные нановолокна» перед экспериментами с клеточными культурами стерилизуют в форме гидрогеля или в форме мембраны. Кроме того, важно минимизировать микробное загрязнение продукта до и во время получения волокон. Перед получением волокон предпочтительно асептически получить целлюлозную массу с целлюлозно-бумажного завода непосредственно после стадии отбеливания, пока масса еще остается стерильной.
Существует несколько широко используемых синонимов для целлюлозных нановолокон. Например: наноцеллюлоза, нанофибриллированная целлюлоза (ЦНФ), нанофибриллярная целлюлоза, целлюлозное нановолокно, целлюлоза, фибриллированная на наноуровне, микрофибриллярная целлюлоза, микрофибриллированная целлюлоза (ЦНФ) или целлюлозные микрофибриллы. Целлюлозные нановолокна, полученные с использованием некоторых микроорганизмов, также имеют различные синонимы, такие как бактериальная целлюлоза, микробная целлюлоза (МЦ), биоцеллюлоза, "nata de coco" (NDC) или "coco de nata".
Целлюлозные нановолокна, описанные в настоящем изобретении, не являются тем материалом, который называют целлюлозными вискерами, которые также известны под названиями: целлюлозные нановискеры, целлюлозные нанокристаллы, целлюлозные наноиглы, игольчатые микрокристаллы целлюлозы или целлюлозные нанонити. В некоторых случаях для обоих материалов используют одинаковую терминологию, например - в работе Kuthcarlapati et al. (Metals Materials and Processes 20(3):307-314, 2008), в которой исследованный материал был назван «целлюлозными нановолокнами», хотя они явно имели в виду целлюлозные нановискеры. Обычно эти материалы не имеют аморфных сегментов по длине волокнистой структуры, как целлюлозные нановолокна, что приводит к более жесткой структуре. Целлюлозные вискеры также короче, чем целлюлозные нановолокна; обычно их длина меньше одного микрометра.
Размеры отдельных целлюлозных нановолокон близки к указанным выше размерам коллагеновых волокон в ЭКМ, то есть 4-10 нм. Поэтому гидрогели на основе ЦНВ можно использовать в качестве 3D матрикса для культур клеток.
В экспериментах с клеточными культурами согласно настоящему изобретению было использовано два вида целлюлозных нановолокон: непрозрачные нативные ЦНВ и оптически прозрачные ЦНВ, которые представляли собой целлюлозу, окисленную с использованием TEMPO. Подробное описание материалов приведено в разделе «Описание примеров осуществления изобретения».
Термин «гидрогель на основе целлюлозных нановолокон» относится к водной дисперсии целлюлозных нановолокон.
Термин «мембрана из целлюлозных нановолокон» относится к влажной или сухой листовой структуре из целлюлозных нановолокон. Мембраны обычно получают посредством фильтрации разбавленной дисперсии целлюлозных нановолокон с использованием аппарата для вакуумной фильтрации с подходящим фильтром. Также для получения мембранных структур можно использовать формование из растворителя. Полученную мембрану можно использовать сразу же во влажном состоянии или высушить перед использованием.
Целлюлозные нановолокна или их производные согласно настоящему изобретению могут содержать химически или физически модифицированные производные целлюлозных нановолокон или пучков нановолокон.
Композиция для культивирования клеток или доставки клеток согласно настоящему изобретению может дополнительно содержать подходящие добавки, выбранные из группы, состоящей из специальных компонентов экстраклеточного матрикса, сыворотки, факторов роста и белков.
Настоящее изобретение также относится к матриксу для культивирования клеток или доставки клеток, который содержит живые клетки и композицию для культивирования клеток или доставки клеток, образующую гидрогель, причем клетки находятся в матриксе в виде трехмерной или двумерной структуры.
Клетками могут быть любые клетки. Любая эукариотическая клетка, например - животные клетки, растительные клетки или клетки грибов, входит в объем настоящего изобретения, также как и прокариотические клетки, такие как бактериальные клетки.
В зависимости от клеточной линии эксперименты проводят с использованием 2D или 3D матриксов, то есть либо клетки культивируют на ЦНВ-мембранах или ЦНВ-гелях, либо клетки равномерно диспергируют в ЦНВ гидрогелях или ЦНВ-мембранах. Конкретные примеры осуществления настоящего изобретения показывают, что спонтанно растущие клетки пигментного эпителия сетчатки (ARPE-19) образуют монослой, тогда как клетки гепатоклеточной карциномы человека (HepG2) образуют либо монослой, либо колонии клеток.
Клетки можно обнаружить с использованием любого средства обнаружения или красителя, известного в данной области техники.
Настоящее изобретение также относится к способу получения композиции согласно настоящему изобретению, включающему стадии получения целлюлозных нановолокон и/или их производных; необязательно - смешивания целлюлозных нановолокон и/или их производных с водой; и переноса или помещения целлюлозных нановолокон и/или их производных или полученной смеси в подходящую среду для культивирования или доставки клеток.
Гидрогели или мембраны на основе целлюлозных нановолокон или их производных или композицию согласно настоящему изобретению можно использовать в качестве материала для доставки клеток.
Гидрогели или мембраны на основе целлюлозных нановолокон или их производных или композицию для культивирования клеток или доставки клеток согласно настоящему изобретению можно использовать для доставки материала для клинического использования.
Настоящее изобретение относится к микробиологическому использованию целлюлозных нановолокон или их производных или композиции согласно настоящему изобретению для лабораторных и/или промышленных задач в качестве среды или компонента среды для сохранения клеток in vitro.
Композицию, содержащую целлюлозные нановолокна или их производные, можно использовать для иммобилизации клеток или ферментов.
Настоящее изобретение также относится к способу культивирования клеток, который включает стадии получения клеток; приведения в контакт клеток с композицией для культивирования клеток, содержащей целлюлозные нановолокна или их производные, с получением матрикса; и культивирования клеток в матриксе с получением трехмерной или двумерной структуры.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются эукариотическими клетками.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются прокариотическими клетками. Прокариотическими клетками являются микроорганизмы, такие как аэробные или анаэробные бактерии, вирусы или грибы, такие как дрожжевые и плесневые грибы.
Настоящее изобретение также относится к композиции, способу или применению в случае, когда клетки являются стволовыми клетками.
Удаление целлюлозных нановолокон можно произвести, например, с помощью ферментов, осуществив ферментативную деградацию молекул целлюлозы. Подходящими ферментами являются, например, коммерчески доступные целлюлазы. Культивируемые клеточные линии могут также быть модифицированы посредством генетической инженерии так, чтобы они выделяли необходимый белок-фермент в культуральную среду.
Настоящее изобретение также относится к способу удаления целлюлозных нановолокон или их производных из материала для роста клеток или культивирования клеток, который включает стадии получения материала, содержащего среду для роста клеток и клетки и, необязательно, медикамент; разбавления этого материала водной или неводной жидкостью; и удаления целлюлозных нановолокон посредством декантации. Умеренное центрифугирование можно использовать для осаждения клеток и агрегатов клеток перед декантацией.
Авторы настоящего изобретения неожиданно обнаружили, что ЦНВ-гидрогель, полученный из растений, можно использовать без каких-либо модификаций в качестве биомиметика ЭКМ человека для 3D культивирования клеток. Данные о пролиферации и жизнеспособности клеток свидетельствуют о том, что ЦНВ-гидрогель является оптимальным материалом для 3D-подложек для клеток, используемых для проведения на функциональных клетках высокопроизводительных скрининговых анализов при разработке лекарственных средств, при исследовании токсичности лекарственных средств и в регенеративной медицине, а также для доставки клеток in vivo.
Настоящее изобретение впервые описывает физические свойства ЦНВ-гидрогелей, полученных из растений, и их биосовместимость. Растительную целлюлозу широко используют в целлюлозно-бумажной и текстильной промышленности, и она широко распространена в природе. Нативный целлюлозный нановолоконный гидрогель является непрозрачным. Химическая модификация целлюлозной массы перед ее механической дезинтеграцией позволяет получить оптически прозрачные гидрогели.
Целлюлозные нановолокна согласно настоящему изобретению можно использовать в форме гидрогеля или влажной или сухой мембраны. Прочность ЦНВ-гидрогеля легко можно изменить посредством разбавления. Целлюлозные нановолокна или их производные, обладающие сходными свойствами, не токсичны для клеток.
Если сравнивать гидрогели на основе целлюлозных нановолокон с УФ-сшиваемыми гидрогелями дл культур клеток, такими как гидрогели на основе гиалуроновой кислоты или ПЭГ, то ЦНВ-материалы считаются гораздо менее токсичными. В УФ-сшиваемых гелях для инициации гелеобразования необходимо использовать вредные фотоинициаторы, тогда как ЦНВ-гидрогели образуются спонтанно. Нековалентный характер ЦНВ-гидрогелей обеспечивает также возможность регулирования их пористости посредством разбавления.
Клетки равномерно распределяются в гидрогелях на основе целлюлозных нановолокон и могут автоматически начать делиться и разрастаться с образованием 3D-кластеров без оседания на дно планшета для культивирования клеток. Все используемые в настоящее время коммерческие среды для 3D-культур клеток требуют добавления пептида адгезии для того, чтобы клетки могли сформировать 3D-структуру на планшете для культивирования клеток.
Целлюлозные нановолокна согласно настоящему изобретению или их производные можно использовать без пептида адгезии. Клетки прикрепляются к планшету и спонтанно равномерно распределяются в гидрогеле на основе целлюлозных нановолокон. Клетки образуют гомогенную суспензию в непрерывной фазе благодаря механической поддержке, обеспечиваемой целлюлозными нановолокнами. Достаточно высокий предел текучести стабилизирует клетки и растущие кластеры клеток, препятствуя их седиментации.
Гидрогели на основе целлюлозных нановолокон растительного происхождения функционируют без белка адгезии и/или искусственной пористости, тогда как бактериальные целлюлозные нановолокна требуют белка адгезии. Бактериальную целлюлозу используют непосредственно после ферментации, и в этом случае образующаяся мембранная структура является гораздо более плотной, чем гидрогель согласно настоящему изобретению, то есть гидрогель из целлюлозных нановолокон. Поэтому способы согласно предшествующему уровню техники требуют дополнительных процессов для придания гидрогелевому матриксу большей пористости.
Плотность среды для культивирования клеток, содержащей целлюлозные нановолокна, можно отрегулировать, не влияя на свойства культуры клеток. Целлюлозные нановолокна, происходящие от бактерий, также являются более толстыми, чем целлюлозные нановолокна из других источников, и поэтому они не являются свободно модифицируемыми для культивирования клеток.
Клетки растут в 3D-матриксе или на матриксе. Этот материал может быть инъецируемым или представлять собой плоскую мембрану с соответствующей топологией поверхности.
Свойства ЦНВ близки к оптимальным для 3D-культивирования клеток: прозрачные, не токсичные, высоковязкие, с высокой способностью к образованию суспензии, с высоким удержанием воды, с хорошей механической адгезией, не животного происхождения, по размерам напоминают ЭКМ, не чувствительны к солям, температуре или pH, не разлагаются, не автофлуоресцируют. ЦНВ обеспечивают пренебрежимо низкий флуоресцентный фон благодаря химической структуре материала. Кроме того, ЦНВ-гель не токсичен для клеток.
Клетки можно культивировать или выращивать на ЦНВ-гелях в течение длительного времени, например - в течение 2-7 дней или даже дольше. Клетки можно также культивировать или только суспендировать в гидрогеле в течение короткого времени, например - от нескольких минут до нескольких часов. Клетки используют наноцеллюлозные волокна как подложку/опору для роста, являющуюся платформой. Клетки образуют кластеры, что свидетельствует о пригодности целлюлозных нановолокон для использования в качестве подложки для 3D-культур клеток. Клетки растут в виде слоев или клеточных агрегатов на ЦНВ-геле или внутри него, в зависимости от метода нанесения и типа клеток.
Нетоксичный ЦНВ-гидрогель является таким же хорошим ЭКМ для исследованных клеток, как MaxGel™ на основе ЭКМ человека. Жизнеспособность клеток даже выше, чем в PuraMatrix™ или HydroMatrix™. В ЦНВ-гидрогели не добавляют компоненты ЭКМ человека или животных. Однако добавление фибронектина или коллагена IV в системы на основе ЦНВ в некоторых случаях может быть полезным. Судя по результатам исследования диффузии, ЦНВ-гидрогель является высоко проницаемым и способствует обмену кислорода, питательных веществ и водорастворимых метаболитов в клетках.
Криотрансмиссионная электронная микроскопия демонстрирует, что ЦНВ-гидрогель состоит из смеси отдельных целлюлозных нанофибрилл и пучков волокон. Размеры ЦНВ близки к размерам нативного коллагена человека, который является природным компонентом ЭКМ и обычно используется в качестве опоры для клеток. Прочность (упругость) ЦНВ-гидрогеля остается примерно постоянной в диапазоне частот от 0,01 до 1 Гц. Реологические данные показывают сдвиговую вязкость порядка нескольких сотен килопаскаль в покое (при низком сдвиговом напряжении), которая снижается до нескольких паскаль при сдвиговом напряжении, равном одному паскалю. Такое поведение уникально для гидрогелей из биоматериалов. Оно обеспечивает исключительно высокую суспендирующую способность и опору для клеток, а благодаря разжижению при сдвиге обеспечивает легкое дозирование и инъецирование клеток в ЦНВ-гидрогеле независимо от размера используемых игл; такого поведения ранее не было у других гидрогелей из биоматериалов для культивирования клеток. Механические свойства упругости и жесткости ЦНВ-гидрогелей являются оптимальными для роста 3D-культур клеток и инъектирования клеток.
Преимуществом настоящего изобретения является то, что размеры фибриллярной сети из целлюлозных нановолокон или их производных очень близки к размерам природной ЭКМ-сети из коллагеновых нановолокон. Кроме того, целлюлозные нановолокна или их производные являются материалом не животного происхождения, то есть отсутствует риск передачи болезней. В настоящее время большинство коммерческих продуктов получают от ж