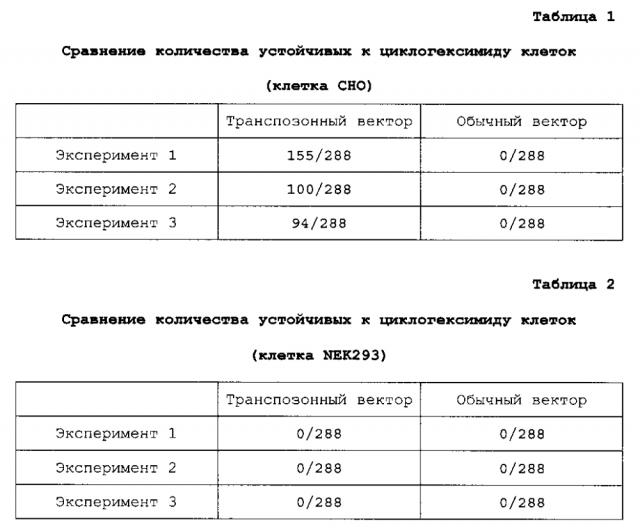
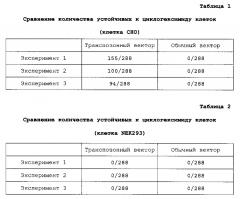
Способ получения белка
Иллюстрации
Показать всеИзобретение относится к биохимии. Описан способ получения интересующего белка, включающий введение по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также пару транспозонных последовательностей Tol1 или Tol2 на обоих концах генного фрагмента, в суспензионную клетку млекопитающего СНО и суспензионное культивирование клетки млекопитающего, где суспензионная клетка млекопитающего представляет собой суспензионную клетку СНО, которая способна выживать и пролиферировать в бессывороточной среде. Также представлены соответствующая суспензионная клетка и вектор. Изобретение позволяет за короткий период времени эффективно и на высоком уровне продуцировать интересующий белок. 5 н. и 26 з.п. ф-лы, 13 ил., 11 табл., 13 пр.
Реферат
Область техники
Данное изобретение относится к способу интеграции генного фрагмента, вставленного между парой транспозонных последовательностей, в хромосому клетки млекопитающего, включающему введение по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в суспензионную клетку млекопитающего; и к способу получения белка, включающему суспензионное культивирование суспензионной клетки млекопитающего, которая продуцирует белок, суспензионной клетки млекопитающего, которая экспрессирует белок; а также к экспрессионному вектору, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
Уровень техники
Получение экзогенных белков методами рекомбинантных ДНК используется в различных отраслях промышленности, таких как фармацевтическая промышленность и пищевая промышленность. В большинстве случаев рекомбинантные белки получают путем введения экспрессионного вектора, содержащего нуклеотидную последовательность, кодирующую интересующий белок, в хозяина, например, Escherichia coli, дрожжи, клетку насекомого, растительную клетку и животную клетку, отбора трансформанта, в котором экспрессионный вектор интегрирован в хромосому, и последующего культивирования трансформированной линии клеток в соответствующих условиях культивирования.
Однако, чтобы создать хозяина, способного эффективно продуцировать экзогенный белок, необходимо отбирать клетку-хозяина, обладающую хорошей продуктивностью для каждого представляющего интерес белка, так что существует потребность в дальнейших технических инновациях в области методов производства экзогенного белка для каждого хозяина.
В бактериальных системах, таких как Escherichia coli, и дрожжевых системах, отличающихся от животных клеток, во многих случаях трудно добиться посттрансляционных модификаций, таких как модификации сахарной цепи, и, таким образом, возникает проблема с получением белка, обладающего присущей ему активностью.
Поскольку в системе клеток насекомых продуцируемый белок подвергается посттрансляционным модификациям, таким как фосфорилирование и добавление сахарных цепей, эта система имеет то преимущество, что может экспрессироваться белок, обладающий присущей ему физиологической активностью. Однако, поскольку структура сахарной цепи секретируемого белка отличается от таковой в клетках млекопитающих, антигенность и тому подобное становится проблемой, когда белок применяют в фармацевтических целях.
Кроме того, поскольку в системе клеток насекомых используют рекомбинантный вирус при введении экзогенного гена, с точки зрения безопасности существует проблема, связанная с необходимостью инактивации и локализации вируса.
В системе животных клеток посттрансляционные модификации, такие как фосфорилирование, добавление сахарной цепи и фолдинг, можно проводить с белками высших животных, включая человека, в большей степени аналогично тому, как это происходит с белками, продуцируемыми в живом организме. Такие точные посттрансляционные модификации необходимы для воссоздания в рекомбинантном белке физиологической активности, изначально присущей белку, и систему производства белка, в которой в качестве хозяина используется клетка млекопитающего, как правило, применяют для получения фармацевтических продуктов и тому подобного, когда необходима такая физиологическая активность.
Однако система экспрессии белка, в которой в качестве хозяина используется клетка млекопитающего, как правило, обладает низкой продуктивностью и, кроме того, во многих случаях создает проблему стабильности введенных генов. Повышение продуктивности для белка при использовании культуры клеток млекопитающих в качестве хозяина не только очень важно при производстве медикаментов для лечения, диагностических средств и тому подобного, но и вносит значительный вклад в их исследование и разработку. Таким образом, необходимо в срочном порядке разработать систему экспрессии генов, которая легко позволяет получать линию клеток с высокой продуктивностью при использовании культуры клеток млекопитающих, в частности, клеток яичника китайского хомячка (клетки CHO), в качестве хозяина.
Транспозон представляет собой мобильный генетический элемент, который может перемещаться из одного локуса в другой локус на хромосоме. Транспозон является сильным инструментом для исследований в области молекулярной биологии и генетики и используется для таких целей, как мутагенез, улавливание гена и получение трансгенных особей, у насекомых или нематод (например, Drosophila melanogaster или Caenorhabditis elegans) и растений. Однако разработка такого метода отставала в случае позвоночных животных, включая клетки млекопитающих.
Тем не менее, в последние годы появились сообщения о транспозонах, которые обладают активностью также и в организме позвоночных животных, и некоторые из них, как было показано, обладают активностью в клетках млекопитающих, например, клетках мыши и человека. Типичные примеры включают транспозоны Tol1 (патентная ссылка 1) и Tol2 (непатентная ссылка 1), клонированные из оризии (рыбы семейства карпозубых), транспозон «спящая красавица», восстановленный из неавтономного транспозона, существующего в геноме лососевых рыб (непатентная ссылка 2), искусственный транспозон «лягушачий принц» (непатентная ссылка 3), полученный из лягушки, и транспозон piggyBac (непатентная ссылка 4), полученный из насекомого.
Эти ДНК транспозоны использовали для мутагенеза, улавливания генов, получения трансгенных особей, экспрессии устойчивых к лекарственным средствам белков и тому подобного, в качестве инструмента для введения генов с целью привнесения нового фенотипа в геном клетки млекопитающего (непатентные ссылки 5-12).
В случае насекомых был изучен способ, в котором экзогенный ген вводят в хромосому шелкопряда, используя транспозон piggyback, полученный из чешуекрылого насекомого, для экспрессии белка, кодируемого указанным экзогенным геном, и был описан способ получения белка с использованием вышеуказанного метода (патентная ссылка 2).
Однако, поскольку интересующий белок не экспрессируется на достаточном уровне и производится во всем теле шелкопряда, это вызывает экономические проблемы в связи с необходимостью усовершенствованных методов очистки для извлечения экспрессированного экзогенного белка в высокоочищенной форме из жидкостей организма, содержащих большое количество примесных белков.
Кроме того, известен пример того, как белок, связанный с устойчивостью к G418, экспрессируется в клетке млекопитающего с использованием полученного из оризии транспозона Tol2 (непатентные ссылки 12 и 13).
В случае получения белкового лекарственного средства для медицинского применения с использованием культивируемой клетки млекопитающего важно, чтобы в процессе его производства отсутствовал компонент животного происхождения, с целью предотвращения неожиданного загрязнения неизвестным вирусом или патогенным полипептидом. Клетку CHO наиболее часто используют в качестве животной клетки для получения белкового лекарственного средства, и в результате исследований последних лет также была создана суспензионная линия клеток CHO, которую можно культивировать в безопасной среде без применения сыворотки или компонента животного происхождения. Однако продуктивность клеточной линии, в которую ген был введен в бессывороточных или безбелковых условиях, ограничена наполовину по сравнению с клеточной линией, в которую ген был введен в условиях наличия сыворотки (непатентная литература 14). Показано, что трансдукция генов в бессывороточных или безбелковых условиях технически сложна.
Как правило, селектируемый маркер для скрининга клеток, экспрессирующих интересующий белок, находится в том же экспрессионном векторе. Это основано на предположении, что существует область, в которой ген, присутствующий в геноме, легко экспрессируется и область, в которой ген, присутствующий в геноме, экспрессируется плохо (это называют эффектами положения, непатентная литература 15), и что представляющий интерес белок также экспрессируется, когда экспрессируется селектируемый маркер.
С другой стороны, известно также, что, когда интересующий белок состоит из двух или более полипептидов, например, антитело и тому подобное, каждый полипептид экспрессируется при помощи различных векторов. В случае антитела показано, что продуктивность возрастает, когда экспрессия тяжелой цепи антитела выше, чем экспрессия легкой цепи (непатентная литература 16). Поскольку предсказано, что экспрессия тяжелой цепи и легкой цепи становится постоянной на одном и том же векторе. Стало возможным получение линии клеток, которые экспрессируют тяжелую цепь и легкую цепь в оптимальном соотношении, путем намеренной экспрессии тяжелой цепи и легкой цепи при помощи различных векторов для достижения высокой продуктивности. Однако, если белок экспрессируется с использованием двух или более различных векторов, также необходимы два или более селектируемых маркера.
В качестве способа преодоления этого, сообщалось о случае, когда ген dhfr, исходно соответствующий одной полипептидной цепи, был разделен на две полипептидных цепи, и одна из них была размещена на экспрессионном векторе тяжелой цепи, а другая была размещена на экспрессионном векторе легкой цепи (непатентная литература 17).
Однако клетка, описанная в непатентной литературе 17, является клеткой CHO, при этом клетка зависима от наличия белкового компонента, добавленного к среде, и, как описано выше, существует вероятность того, что эффективность введения гена является высокой в отличие от случая введения гена в бессывороточных или безбелковых условиях. По прогнозам, отбор высокопродуктивной клетки по-прежнему будет труден, если ген введен в бессывороточных или безбелковых условиях, имеющих высокую степень безопасности при отсутствии опасности вирусной инфекции и тому подобного.
Перечень ссылок
Патентная литература
Патентная литература 1: W02008/072540.
Патентная литература 2: Японская опубликованная нерассмотренная патентная заявка № 2001-532188.
Непатентная литература
Непатентная литература 1: Nature 383, 30 (1996).
Непатентная литература 2: Cell 91, 501-510 (1997).
Непатентная литература 3: Nucleic Acids Res, 31, 6873-6881 (2003).
Непатентная литература 4: Insect Mol. Biol. 5, 141-151 (1996).
Непатентная литература 5: Genetics. 166, 895-899 (2004).
Непатентная литература 6: PLoS Genet, 2, el69 (2006).
Непатентная литература 7: Proc. Natl. Acad. Sei. USA 95, 10769-10773 (1998).
Непатентная литература 8: Proc. Natl. Acad. Sei. USA 98:6759-6764 (2001).
Непатентная литература 9: Nature 436, 221-22 6 (2005).
Непатентная литература 10: Nucleic Acids Res., 31, 6873-6881 (2003).
Непатентная литература 11: Nucleic Acids Res., 35, e87 (2007).
Непатентная литература 12: Proc Natl. Acad. Sei. USA, 103, 15008-15013 (2006).
Непатентная литература 13: Plos Genetics, 2,1715-1724(2006).
Непатентная литература 14: Biotech. Bioeng. 96, 1118-1126.
Непатентная литература 15: Nature Biotech. 22, 1393-1398.
Непатентная литература 16: Biotech. Bioeng. 96, 337-348 (2007).
Непатентная литература 17: Biotech. Bioeng. 84, 439-444 (2003).
Раскрытие изобретения
Проблемы, решаемые при помощи изобретения
Для получения и анализа интересующего белка необходимо выбрать линию клеток, которые стабильно и на высоком уровне экспрессируют интересующий белок, используя культивируемые клетки животного происхождения. Однако подготовка и культивирование клеток, продуцирующих интересующий белок, требует значительных усилий и времени.
Кроме того, хотя известно, что интересующий белок экспрессируется в клетке млекопитающего с использованием транспозонной последовательности, способ получения клетки, которая способна экспрессировать интересующий белок на высоком уровне и, следовательно, может быть использована в качестве системы производства белка с использованием транспозонной последовательности; способ получения клетки млекопитающего, которая способна продуцировать интересующий белок на высоком уровне с использованием транспозонной последовательности; а также способ получения белка с использованием такой клетки остаются неизвестными.
Как описано выше, существует потребность в экспрессии интересующего белка в большом количестве путем создания системы производства белка, способной продуцировать интересующий белок на высоком уровне с использованием культивируемой клетки млекопитающего эффективно и за короткий период времени. Кроме того, было бы желательно создать продуцирующую клетку, для которой не требуются какие-либо компоненты животного происхождения в период от введения гена до создания продуцирующей клетки.
Таким образом, целями изобретения являются предложение клетки, способной экспрессировать интересующий белок на высоком уровне, которую можно эффективно создавать, и способ получения интересующего белка с помощью данной клетки.
Способы решения проблем
Для решения вышеупомянутых проблем авторы настоящего изобретения провели интенсивные исследования и в результате обнаружили, что интересующий белок можно эффективно получать путем введения по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в суспензионную клетку млекопитающего; и интеграции генного фрагмента, вставленного между парой (двумя) транспозонных последовательностей, в хромосому клетки млекопитающего. Кроме того, было установлено, что интересующий белок можно эффективно получать, используя такую клетку, и, таким образом, было совершено изобретение.
В частности, изобретение относится к следующему:
1. Способ получения интересующего белка, включающий введение по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в суспензионную клетку млекопитающего; интеграцию генного фрагмента, содержащего ДНК, кодирующую интересующий белок, вставленного между парой транспозонных последовательностей, в хромосому клетки млекопитающего для получения клетки млекопитающего, которая экспрессирует интересующий белок; и суспензионное культивирование клетки млекопитающего.
2. Способ получения интересующего белка, включающий следующие этапы (A)-(C):
(A) этап одновременного введения следующих экспрессионных векторов (a) и (b) в суспензионную клетку млекопитающего:
(a) по меньшей мере один экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(b) экспрессионный вектор, который содержит ДНК, кодирующую транспозазу, которая узнает транспозонные последовательности и обладает способностью перемещать генный фрагмент, вставленный между парой транспозонных последовательностей, в хромосому;
(B) этап получения суспензионной клетки млекопитающего, которая экспрессирует интересующий белок в результате временной экспрессии транспозазы с экспрессионного вектора, введенного в суспензионную клетку млекопитающего на этапе (A) с целью интеграции генного фрагмента, вставленного между парой транспозонных последовательностей, в хромосому клетки млекопитающего, и
(C) этап суспензионного культивирования суспензионной клетки млекопитающего, которая экспрессирует интересующий белок, полученной на этапе (B), для получения интересующего белка.
3. Способ получения суспензионной клетки млекопитающего, которая экспрессирует интересующий белок, включающий введение по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в суспензионную клетку млекопитающего и интеграцию генного фрагмента, вставленного между парой транспозонных последовательностей, в хромосому клетки млекопитающего.
4. Способ, описанный в любом из вышеприведенных пунктов 1-3, в котором по меньшей мере один из экспрессионных векторов, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, представляет собой экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
5. Способ, описанный в любом из вышеприведенных пунктов 1-4, включающий введение экспрессионного вектора, который содержит генный фрагмент, содержащий селектируемый маркер, и содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в клетку млекопитающего в дополнение к экспрессионному вектору, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
6. Способ, описанный в любом из вышеприведенных пунктов 1-5, в котором ДНК, кодирующая интересующий белок, представляет собой ДНК, кодирующую антитело.
7. Способ, описанный в вышеприведенном пункте 6, в котором ДНК, кодирующая антитело, представляет собой по меньшей мере одну из ДНК, кодирующей H-цепь антитела, и ДНК, кодирующей L-цепь антитела.
8. Способ, описанный в любом из вышеприведенных пунктов 4-7, в котором экспрессионный вектор, выбранный из следующих пунктов (a)-(d), вводят в суспензионную клетку млекопитающего:
(a) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(b) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(c) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и
(d) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь и L-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
9. Способ, описанный в любом из вышеприведенных пунктов 1-8, в котором суспензионная клетка млекопитающего представляет собой клетку, способную выживать и пролиферировать в бессывороточной среде.
10. Способ, описанный в любом из вышеприведенных пунктов 1-9, в котором суспензионная клетка млекопитающего представляет собой по меньшей мере клетку, выбранную из суспензионной клетки CHO, при этом клетка CHO адаптирована к суспензионному культивированию, клетки PER.C6, клетки крысиной миеломы YB2/3HL.P2.G11.16Ag.20 (или также называемой YB2/0) и суспензионной клетки мышиной миеломы NS0, адаптированной к суспензионному культивированию.
11. Способ, описанный в вышеприведенном пункте 10, в котором клетка CHO представляет собой по меньшей мере клетку, выбранную из CHO-K1, CHO-K1SV, DUKXB11, CHO/DG44, Pro-3 и CHO-S.
12. Способ, описанный в любом из вышеприведенных пунктов 4-11, в котором ген селектируемого маркера представляет собой ген устойчивости к циклогексимиду.
13. Способ, описанный в вышеприведенном пункте 12, в котором ген устойчивости к циклогексимиду соответствует рибосомному белку.
14. Способ, описанный в любом из вышеприведенных пунктов 1-13, в котором пара транспозонных последовательностей представляет собой нуклеотидные последовательности, полученные из пары транспозонов ДНК-типа, которые функционируют в клетке млекопитающего.
15. Способ, описанный в вышеприведенном пункте 14, в котором нуклеотидные последовательности, полученные из пары транспозонов ДНК-типа, представляют собой нуклеотидные последовательности, полученные из пары транспозонов Tol1, или нуклеотидные последовательности, полученные из пары транспозонов Tol2.
16. Способ, описанный в вышеприведенном пункте 15, в котором нуклеотидные последовательности, полученные из пары транспозонов Tol2, представляют собой нуклеотидную последовательность, содержащую нуклеотидную последовательность, приведенную в SEQ ID NO: 2, и нуклеотидную последовательность, приведенную в SEQ ID NO: 3.
17. Способ, описанный в вышеприведенном пункте 15, в котором нуклеотидные последовательности, полученные из пары транспозонов Tol1, представляют собой нуклеотидную последовательность, приведенную в SEQ ID NO: 14, и нуклеотидную последовательность, приведенную в SEQ ID NO: 15.
18. Суспензионная клетка млекопитающего, которая имеет хромосому, в которую интегрирован генный фрагмент, вставленный между парой транспозонов, и которая продуцирует интересующий белок, получаемый путем одновременного введения по меньшей мере одного экспрессионного вектора (a), который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионного вектора (b), который содержит ДНК, кодирующую транспозазу (трансферазу), способную узнавать транспозонные последовательности и обладающую способностью переносить генный фрагмент, вставленный между парой транспозонных последовательностей, в хромосому.
19. Клетка млекопитающего, описанная в вышеприведенном пункте 18, в которой по меньшей мере один из экспрессионного вектора (a), который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, представляет собой экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
20. Клетка млекопитающего, описанная в вышеприведенном пункте 18 или 19, которая представляет собой клетку, полученную в результате дополнительного введения экспрессионного вектора (c), который содержит генный фрагмент, содержащий ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, в дополнение к экспрессионным векторам (a) и (b).
21. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 18-20, в которой ДНК, кодирующая интересующий белок, представляет собой ДНК, кодирующую антитело.
22. Клетка млекопитающего, описанная в вышеприведенном пункте 21, в которой ДНК, кодирующая антитело, представляет собой по меньшей мере одну из ДНК, кодирующей H-цепь антитела, и ДНК, кодирующей L-цепь антитела.
23. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 18-22, в которую введен экспрессионный вектор, выбранный из следующих (a)-(d):
(a) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(b) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(c) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую L-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь антитела, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента, и
(d) экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую H-цепь и L-цепь антитела, и ген селектируемого маркера, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
24. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 18-23, представляющая собой клетку, способную выживать и пролиферировать в бессывороточной среде.
25. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 18-24, представляющая собой любую суспензионную клетку млекопитающего, выбранную из суспензионной клетки CHO, при этом клетка CHO адаптирована к суспензионному культивированию, клетки PER.C6, клетки крысиной миеломы YB2/3HL.P2.G11.16Ag.20 (или также называемой YB2/0) и суспензионной клетки мышиной миеломы NS0, адаптированной к суспензионному культивированию.
26. Клетка млекопитающего, описанная в вышеприведенном пункте 25, при этом клетка CHO представляет собой любую клетку, выбранную из CHO-K1, CHO-K1SV, DUKXB11, CHO/DG44, Pro-3 и CHO-S.
27. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 19-26, в которой ген селектируемого маркера представляет собой ген устойчивости к циклогексимиду.
28. Клетка млекопитающего, описанная в вышеприведенном пункте 27, в которой ген устойчивости к циклогексимиду представляет собой ген, кодирующий мутант человеческого рибосомного белка L36a.
29. Клетка млекопитающего, описанная в любом из вышеприведенных пунктов 19-28, в которой пара транспозонных последовательностей представляет собой нуклеотидные последовательности, полученные из пары транспозонов ДНК-типа, которые функционируют в клетке млекопитающего.
30. Клетка млекопитающего, описанная в вышеприведенном пункте 29, в которой нуклеотидные последовательности, полученные из пары транспозонов ДНК-типа, представляют собой нуклеотидные последовательности, полученные из пары транспозонов Tol1, или нуклеотидные последовательности, полученные из пары транспозонов Tol2.
31. Клетка млекопитающего, описанная в вышеприведенном пункте 30, в которой нуклеотидные последовательности, полученные из пары транспозонов Tol2, представляют собой нуклеотидную последовательность, приведенную в SEQ ID NO: 2, и нуклеотидную последовательность, приведенную в SEQ ID NO: 3.
32. Клетка млекопитающего, описанная в вышеприведенном пункте 30, в которой нуклеотидные последовательности, полученные из пары транспозонов Tol1, представляют собой нуклеотидную последовательность, приведенную в SEQ ID NO: 14, и нуклеотидную последовательность, приведенную в SEQ ID NO: 15.
33. Экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента.
34. Экспрессионный вектор, описанный в вышеприведенном пункте 33, в котором пара транспозонных последовательностей представляют собой нуклеотидные последовательности, полученные из пары транспозонов Tol1, или нуклеотидные последовательности, полученные из пары транспозонов Tol2.
35. Экспрессионный вектор для белка, описанный в вышеприведенном пункте 34, в котором нуклеотидные последовательности, полученные из пары транспозонов Tol2, представляют собой нуклеотидную последовательность, приведенную в SEQ ID NO: 2, и нуклеотидную последовательность, приведенную в SEQ ID NO: 3.
36. Экспрессионный вектор, описанный в вышеприведенном пункте 34, в котором нуклеотидные последовательности, полученные из пары транспозонов Tol1, представляют собой нуклеотидную последовательность, приведенную в SEQ ID NO: 14, и нуклеотидную последовательность, приведенную в SEQ ID NO: 15.
Эффект изобретения
Согласно способу получения белка по изобретению, интересующий белок можно эффективно производить с использованием суспензионной клетки млекопитающего. Кроме того, клетку по настоящему изобретению можно использовать в качестве продуцирующей клетки для получения рекомбинантного белка или рекомбинантного полипептида с высокой эффективностью.
Краткое описание чертежей
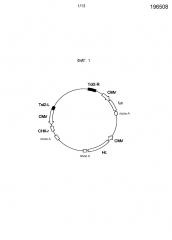
На фигуре 1 представлено схематическое изображение транспозонного вектора для экспрессии антитела против М2 человеческого вируса гриппа. Tol2-L представляет транспозон Tol2 с левого края (SEQ ID NO: 2), Tol2-R представляет транспозон Tol2 с правого края (SEQ ID NO: 3), CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования, Hc представляет кДНК H-цепи человеческого антитела, Lc представляет кДНК L-цепи человеческого антитела и CHX-r представляет ген устойчивости к циклогексимиду.
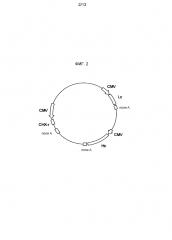
На фигуре 2 представлено схематическое изображение экспрессионного вектора для антитела против М2 человеческого вируса гриппа. CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования, Hc представляет кДНК H-цепи человеческого антитела, Lc представляет кДНК L-цепи человеческого антитела и CHX-r представляет ген устойчивости к циклогексимиду.
На фигуре 3 представлено схематическое изображение экспрессионного вектора для Tol2 транспозазы. CAGGS представляет промотор CAGGS, поли-A представляет сайт полиаденилирования и TPase кДНК представляет кДНК Tol2 транспозазы.
На фигуре 4 приведен результат исследования уровня экспрессии антитела против М2 человеческого вируса гриппа в суспензионной клетке CHO-K1 и прикрепляющейся клетке CHO-K1 при использовании Tol2 транспозонного вектора для экспрессии антитела против М2 человеческого вируса гриппа. На фигуре 4A приведен результат для суспензионной клетки CHO-K1, а на фигуре 4B приведен результат для прикрепляющейся клетки CHO-K1. На обеих фигурах на оси ординат указано количество продуцируемого антитела (мкг/мл), а на оси абсцисс указано количество трансгенных клонов каждой клетки.
На фигуре 5 представлено схематическое изображение Tol1 транспозонного вектора для экспрессии антитела против М2 человеческого вируса гриппа. Tol1-L представляет транспозон Tol1 с левого края (SEQ ID NO: 14), Tol1-R представляет транспозон Tol1 с правого края (SEQ ID NO: 15), CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования, Hc представляет кДНК H-цепи человеческого антитела, Lc представляет кДНК L-цепи человеческого антитела и CHX-r представляет ген устойчивости к циклогексимиду.
На фигуре 6 представлено схематическое изображение экспрессионного вектора для Tol1 транспозазы. CAGGS представляет промотор CAGGS, поли-A представляет сайт полиаденилирования и TPase кДНК представляет кДНК Tol1 транспозазы.
На фигуре 7 приведен результат исследования уровня экспрессии антитела против М2 человеческого вируса гриппа в суспензионной клетке CHO-K1 при использовании Tol1 транспозонного вектора для экспрессии антитела против М2 человеческого вируса гриппа. На оси ординат указано количество продуцируемого антитела (мкг/мл), а на оси абсцисс указано количество трансгенных клонов каждой клетки.
На фигуре 8 представлено схематическое изображение транспозонного вектора для экспрессии тяжелой цепи антитела против CD98 человека. Tol2-L представляет транспозон Tol2 с левого края (SEQ ID NO: 2), Tol2-R представляет транспозон Tol2 с правого края (SEQ ID NO: 3), Pmo представляет промотор вируса лейкемии мышей Молони, поли-A представляет сайт полиаденилирования и Hc представляет кДНК тяжелой цепи антитела против CD98 человека (SEQ ID NO: 18).
На фигуре 9 представлено схематическое изображение транспозонного вектора для экспрессии легкой цепи антитела против CD98 человека. Tol2-L представляет транспозон Tol2 с левого края (SEQ ID NO: 2), Tol2-R представляет транспозон Tol2 с правого края (SEQ ID NO: 3), CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования и Lc представляет кДНК легкой цепи антитела против CD98 человека (SEQ ID NO: 21).
На фигуре 10 представлено схематическое изображение транспозонного вектора для экспрессии гена устойчивости к циклогексимиду. Tol2-L представляет транспозон Tol2 с левого края (SEQ ID NO: 2), Tol2-R представляет транспозон Tol2 с правого края (SEQ ID NO: 3), CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования и CHX-r представляет ген устойчивости к циклогексимиду. (SEQ ID NO: 7).
На фигуре 11 представлено продуцируемое количество антитела против TNFα человека при введении в клетку CHO-K1 тандемного вектора TNFα-CHX или вектора TNFαH-CHX и вектора TNFαL. На оси ординат указана концентрация антитела (мкг/мл), продуцируемого в среду, контрольная схема обозначена как «Контроль», а экспериментальная схема обозначена как «Эксперимент».
На фигуре 12 представлено продуцируемое количество антитела против CD20 человека при введении в клетку CHO-K1 тандемного вектора CD20-CHX или вектора CD20H-CHX и вектора CD20L. На оси ординат указана концентрация антитела (мкг/мл), продуцируемого в среду, контрольная схема обозначена как «Контроль», а экспериментальная схема обозначена как «Эксперимент».
На фигуре 13 представлена структура экспрессионного вектора A для антитела. На фигуре 13 Tol2-L представляет фрагмент ДНК, содержащий последовательность Tol2-L (SEQ ID NO: 2), а Tol2-R представляет фрагмент ДНК, содержащий последовательность Tol2-R (SEQ ID NO: 3), CMV представляет промотор CMV, поли-A представляет сайт полиаденилирования, Hc представляет ген тяжелой цепи антитела к CD98, Lc представляет ген легкой цепи антитела против CD98 человека, SO представляет промотор SV40, SV представляет сайт полиаденилирования SV40 и Neo-r представляет ген устойчивости к неомицину.
Варианты осуществления изобретения
Данное изобретение относится к способу получения интересующего белка, включающему введение по меньшей мере одного экспрессионного вектора, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит транспозонные последовательности на обоих концах генного фрагмента, в суспензионную клетку млекопитающего; интеграцию генного фрагмента, вставленного между парой (двумя) транспозонных последовательностей, в хромосому клетки млекопитающего для получения суспензионной клетки млекопитающего, которая экспрессирует указанный интересующий белок; и суспензионное культивирование клетки млекопитающего.
Примеры способа получения интересующего белка в настоящем изобретении (далее в данном документе называемого способом по настоящему изобретению) включают способ получения интересующего белка, включающий следующие этапы (A)-(C):
(A) этап одновременного введения следующих экспрессионных векторов (a) и (b) в суспензионную клетку млекопитающего:
(a) по меньшей мере один экспрессионный вектор, который содержит генный фрагмент, содержащий ДНК, кодирующую интересующий белок, и также содержит пару транспозонных последовательностей на обоих концах генного фрагмента;
(b) вектор, который содержит ДНК, кодирующую транспозазу, которая узнает транспозонные последовательности и обладает способностью перемещать генный фрагмент, вставле