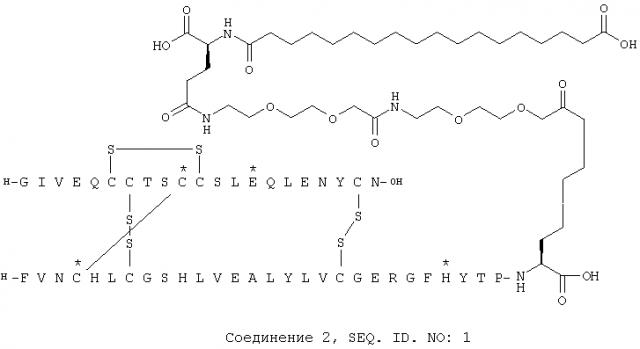
Производные инсулина, содержащие дополнительные дисульфидные связи
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к получению производных инсулина, содержащих дополнительные дисульфидные связи, и может быть использовано в медицине. В человеческий инсулин вводят две цистеиновые замены, выбранные из группы А10С, В2С; А10С, В3С; и А10С, В4С и боковую цепь, которую присоединяют к N-концу инсулина или эпсилон аминогруппе остатка лизина в инсулине. Изобретение позволяет получить производное человеческого инсулина, обладающее пролонгированным профилем по сравнению с нативным человеческим инсулином. 5 н. и 8 з.п. ф-лы, 4 ил., 114 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным инсулина, содержащим дополнительные дисульфидные связи, и к способам их получения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Сахарный диабет представляет собой метаболическое расстройство, при котором частично или полностью утрачивается способность использовать глюкозу. При лечении сахарного диабета предлагали и использовали многие разновидности препаратов инсулина, такие как обычный инсулин, инсулин-изофан (обозначенный NPH), суспензии инсулин цинк (такие как Semilente®, Lente® и Ultralente®) и двухфазный инсулин-изофан.
Человеческий инсулин состоит из двух полипептидных цепей, цепей А и В, которые содержат 21 и 30 аминокислотных остатков соответственно. Цепи А и В взаимосвязаны двумя дисульфидными мостиками. Инсулин из большинства других видов является аналогичным, но может содержать замены аминокислот в некоторых положениях. В последнее десятилетие был разработан целый ряд аналогов человеческого инсулина. Они предназначены для конкретных профилей действия, т.е. быстродействующие или пролонгированного действия. Имеющиеся в продаже продукты, содержащие такие аналоги инсулина, включают Levemir®, NovoRapid®, Humalog®, Apidra® и Lantus®.
Человеческий инсулин быстро деградирует в полости желудочно-кишечного тракта действием многочисленных протеаз, ограничивающих его поглощение в систему кровообращения. Аналоги инсулина, которые являются гидрофильными и стабилизированными в отношении протеолитической деградации, демонстрируют большую биодоступность в животных моделях по сравнению с нативным инсулином.
Включение дисульфидных связей в белки является одним из природных способов улучшения стабильности белка; среди термофильных организмов была обнаружена корреляция между числом дисульфидных связей и максимальной температурой для роста, подразумевающая важность дисульфидных связей в стабилизации белка в средах с высокими темпеатурами (Mallick Р, et al, 2002, Proc. Natl. Acad. Sci. USA, 99, 9679-9684.; Ladenstein R, et al, 2006, FEBS J., 273, 4170-4185). Также имеется много примеров успешного конструирования дисульфидных связей в белках с сопутствующими увеличениями стабильности. Одна из сильнейших стабилизации была достигнута для РНКазы барназы (Clarke J., Fersht А., 1993, Biochem., 32, 4322-4329). Такая стабилизация осуществляется увеличением энергии активации, требующейся для разворачивания, или ограничением несвернутых конформаций белка и, посредством этого, снижением их конформационной энтропии (Расе C.N., 1990, Trends Biol. Sci., 14-17). Однако в этой формирующейся области исследования требуется узнать значительно больше. В настоящее время отсутствуют сообщения о сконструированных дисульфидных связях в инсулине.
Все еще имеется потребность в новых производных инсулина, которые являются стабильными.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к производным инсулина, имеющим две или более чем две цистеиновые замены и боковую цепь, присоединенную к инсулину, где сохраняются три дисульфидные связи человеческого инсулина, и сайты цистеиновых замен выбраны таким образом, что введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине.
В одном аспекте получают производное инсулина по изобретению, где сайты цистеиновых замен выбраны таким образом, что (1) введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине, и (2) производное инсулина сохраняет желательные биологические активности, ассоциированные с человеческим инсулином.
В одном аспекте получают производное инсулина по изобретению, где сайты цистеиновых замен выбраны таким образом, что (1) введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине, и (2) производное инсулина сохраняет желательные биологические активности, ассоциированные с человеческим инсулином, и (3) производное инсулина имеет повышенную физическую стабильность относительно человеческого инсулина и/или производного инсулина без одной или более чем одной дополнительной дисульфидной связи.
В одном аспекте получают производное инсулина по изобретению, где сайты цистеиновых замен выбраны таким образом, что (1) введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине, (2) производное инсулина сохраняет желательные биологические активности, ассоциированные с человеческим инсулином, и (3) производное инсулина стабилизировано против протеолитической деградации.
Здесь также описан способ стабилизации производного инсулина, включающий замену двух или более чем двух аминокислот инсулина остатками цистеина и присоединение боковой цепи к инсулину, где
а. сохраняются три дисульфидные связи человеческого инсулина и
б. сайты цистеиновых замен выбраны таким образом, что введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине,
создавая, посредством этого, производное инсулина, содержащее одну или более чем одну дополнительную дисульфидную связь, не присутствующую в человеческом инсулине.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1: сравнение РК (фармакокинетических) профилей у крыс при внутривенном введении производного из примера 1 по сравнению с аналогичным производным без дополнительной дисульфидной связи.
Фиг.2: сравнение РК профилей у собак при внутривенном введении производного из примера 1 по сравнению с аналогичным производным без дополнительной дисульфидной связи.
Фиг.3: данные дифференциальной сканирующей калориметрии (ДСК) производных инсулина по изобретению.
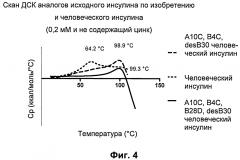
Фиг.4: данные дифференциальной сканирующей калориметрии (ДСК) исходных аналогов инсулина.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении представлены новые производные инсулина, где в производных инсулина сконструированы дисульфидные связи.
В одном аспекте производное инсулина согласно изобретению имеет две или более чем две цистеиновых замены, и сохраняются три дисульфидные связи человеческого инсулина.
В одном аспекте производное инсулина по изобретению имеет боковую цепь. В одном аспекте боковая цепь присоединена к эпсилон аминогруппе остатка лизина. В одном аспекте боковая цепь присоединена к эпсилон аминогруппе остатка лизина в В-цепи.
В одном аспекте производное инсулина согласно изобретению имеет две или более чем две цистеиновых замены, сохраняются три дисульфидные связи человеческого инсулина и боковая цепь, которая присоединена к эпсилон аминогруппе остатка лизина как, например, в В-цепи.
В одном аспекте изобретения сайты цистеиновых замен выбраны таким образом, что введенные остатки цистеина размещаются в трехмерной структуре свернутого производного инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине.
Авторы данного изобретения обнаружили, что производные инсулина согласно изобретению имеют улучшенную физическую стабильность. Таким образом, было обнаружено, что у производных инсулина согласно изобретению снижается тенденция формировать биологически неактивные и/или нерастворимые агрегаты аналогов инсулина, например, в результате воздействия на аналоги термо-механических стрессов и/или взаимодействия с поверхностями раздела и поверхностями, которые являются дестабилизирующими, такими как гидрофобные поверхности и поверхности раздела.
Человеческие производные инсулина согласно изобретению связываются с рецептором инсулина. Таким образом, авторы изобретения неожиданно обнаружили, что производные человеческого инсулина согласно изобретению имеют и улучшенную физическую стабильность, и сохраняют связывание с рецептором инсулина.
В одном аспекте производные инсулина согласно изобретению, т.е. содержащие одну или более чем одну дополнительную дисульфидную связь, являются более пролонгированными, чем аналогичные производные инсулина без одной или более чем одной дополнительной дисульфидной связи. Под термином «более пролонгированный» здесь подразумевается то, что они имеют более длительный период полувыведения или, другими словами, инсулиновый эффект в течение длительного периода, т.е. большую продолжительность действия. Таким образом, авторы изобретения неожиданно обнаружили, что производные инсулина, содержащие одну или более чем одну дисульфидную связь, могут иметь длительный период полувыведения или, другими словами, инсулиновый эффект в течение длительного периода, или пролонгированную продолжительность действия по сравнению с аналогичными производными инсулина с одной или более чем одной дополнительной дисульфидной связью.
В одном аспекте производные инсулина по изобретению стабилизированы против протеолитической деградации, т.е. против быстрой деградации в желудочно-кишечном (ЖК) тракте или где-либо еще в организме. В одном аспекте производные инсулина по изобретению стабилизированы против протеолитической деградации относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи.
Производное инсулина, которое стабилизировано против протеолитической деградации, следует здесь понимать как производное инсулина, которое подвергается более медленной деградации одной или более чем одной протеазой относительно человеческого инсулина. В одном воплощении производное инсулина согласно изобретению подвергается более медленной деградации одной или более чем одной протеазой относительно человеческого инсулина. В другом воплощении изобретения производное инсулина согласно изобретению стабилизировано против деградации одним или более чем одним ферментом, выбранным из группы, состоящей из следующих: пепсин (такой как, например, изоформы пепсин А, пепсин В, пепсин С и/или пепсин F), химотрипсин (такой как, например, изоформы химотрипсин А, химотрипсин В и/или химотрипсин С), трипсин, фермент, деградирующий инсулин (IDE), эластаза (такая как, например, изоформы эластаза I и/или II поджелудочной железы), карбоксипептидаза (например изоформы карбоксипептидаза А, карбоксипептидаза А2 и/или карбоксипептидаза В), аминопептидаза, катепсин D и другие ферменты, присутствующие в экстрактах кишечника, полученных от крысы, свиньи или человека.
В одном воплощении производное инсулина согласно изобретению стабилизировано против деградации одним или более чем одним ферментом, выбранным из группы, состоящей из следующих: химотрипсин, трипсин, фермент, деградирующий инсулин (IDE), эластаза, карбоксипептидазы, аминопептидазы и катепсин D. В другом воплощении производное инсулина согласно изобретению стабилизировано против деградации одним или более чем одним ферментом, выбранным из группы, состоящей из: химотрипсина, карбоксипептидаз и IDE. В еще одном другом воплощении производное инсулина согласно изобретению стабилизировано против деградации одним или более чем одним ферментом, выбранным из: химотрипсина и IDE. В еще одном другом воплощении производное инсулина согласно изобретению стабилизировано против деградации одним или более чем одним ферментом, выбранным из: химотрипсина и карбоксипептидаз.
«Протеаза» или «протеазный фермент» представляет собой расщепляющий фермент, который деградирует белки и пептиды и который находится в разных тканях человеческого организма, таких как, например, желудок (пепсин), просвет кишок (химотрипсин, трипсин, эластаза, карбоксипептидазы и т.д.) или поверхности слизистых ЖК тракта (аминопептидазы, карбоксипептидазы, энтеропептидазы, дипептидилпептидазы, эндопептидазы и т.д.), печень (фермент, деградирующий инсулин, катепсин D и т.д.) и в других тканях.
T½ (период полувыведения) можно определять, как описано в примере 102, как меру протеолитической стабильности производного инсулина согласно изобретению в отношении протеазных ферментов, таких как химотрипсин, пепсин и/или карбоксипептидаза А, или в отношении смеси ферментов, таких как тканевые экстракты (из печени, почки, двенадцатиперстной кишки, тощей кишки, подвздошной кишки, толстой кишки, желудка и т.д.). В одном воплощении изобретения Т½ увеличивается относительно человеческого инсулина. В другом воплощении Т½ увеличивается относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 2 раза относительно человеческого инсулина. В еще одном другом воплощении T½ увеличивается по меньшей мере в 2 раза относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 3 раза относительно человеческого инсулина. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 3 раза относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи. В еще одном другом воплощении T½ увеличивается по меньшей мере в 4 раза относительно человеческого инсулина. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 4 раза относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи. В еще одном другом воплощении T½ увеличивается по меньшей мере в 5 раз относительно человеческого инсулина. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 5 раз относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 10 раз относительно человеческого инсулина. В еще одном другом воплощении Т½ увеличивается по меньшей мере в 10 раз относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи.
В одном аспекте производное инсулина согласно изобретению имеет улучшенную химическую стабильность. В одном аспекте производное инсулина согласно изобретению имеет улучшенную физическую стабильность. В одном аспекте производное инсулина согласно изобретению имеет улучшенную химическую и физическую стабильность.
В одном аспекте производное инсулина согласно изобретению имеет улучшенную химическую и/или физическую стабильность относительно человеческого инсулина. В одном аспекте производное инсулина согласно изобретению имеет улучшенную химическую и/или физическую стабильность относительно производного инсулина без одной или более чем одной дополнительной дисульфидной связи.
Термин «физическая стабильность» в том виде, как он здесь используется, относится к тенденции производного инсулина образовать биологически неактивные и/или нерастворимые агрегаты белка в результате воздействия на белок термо-механических стрессов и/или взаимодействия с поверхностями раздела и поверхностями, которые являются дестабилизирующими, такими как гидрофобные поверхности и поверхности раздела. Физическая нестабильность, таким образом, включает конформационные изменения относительно человеческого инсулина, что включает потерю структуры более высокого порядка, агрегацию, фибрилляцию, осаждение и/или адсорбцию с поверхностями. Известно, что пептиды, такие как инсулин, склонны к нестабильности, например, из-за фибрилляции. Физическую стабильность раствора, содержащего производное инсулина, можно оценить традиционными способами, например, визуальной проверкой, нефелометрией и/или измерениями мутности после воздействия на раствор, которым заполнены подходящие контейнеры (например, картриджи или флаконы), механического/физического стресса (например встряхивания) при разных температурах в течение разных периодов времени. Визуальная проверка раствора проводится в точно сфокусированном свете с темным фоном. Мутность раствора характеризуется визуальным бальным ранжированием степени мутности, например, по шкале от 0 до 3 (раствор, не демонстрирующий мутность, соответствует визуальному бальному показателю 0, и раствор, демонстрирующий видимую мутность при дневном освещении, соответствует визуальному бальному показателю 3). Раствор классифицируется как физически нестабильный в отношении агрегации белка, когда он демонстрирует видимую мутность при дневном освещении. В качестве альтернативы, мутность раствора можно оценивать простыми измерениями мутности, хорошо известными специалисту. Физическую стабильность производного инсулина также можно оценивать посредством применения спектроскопического агента или зонда конформационного статуса производного инсулина. Зонд предпочтительно представляет собой маленькую молекулу, которая предпочтительно связывается с ненативным конформером белка. Одним примером низкомолекулярного спектроскопического зонда структуры белка является тиофлавин Т. Тиофлавин Т представляет собой флуоресцентный краситель, который широко использовался для детекции амилоидных фибрилл. В присутствии фибрилл, а возможно также и других конфигураций белка, тиофлавин Т дает новый максимум возбуждения при примерно 450 нм при и повышенное испускание при примерно 482 нм при связывании с фибриллярной формой белка. Несвязанный тиофлавин Т по существу не флуоресцирует при данных длинах волн. Физическую стабильность производных инсулина по изобретению, например, можно определить, как описано в примере 109.
В качестве зондов изменений структуры белка от нативных до ненативных состояний можно использовать другие маленькие молекулы. Например, зонды в виде «гидрофобной заплатки» (hydrophobic patch), которые предпочтительно связываются с экспонированными гидрофобными участками белка. Гидрофобные участки обычно скрыты в третичной структуре белка в его нативном состоянии, но становятся экспонированными по мере того, как белок начинает разворачиваться или денатурировать. Примерами данных низкомолекулярных спектроскопических зондов являются ароматические гидрофобные красители, такие как антрацен, акридин, фенантролин или тому подобное. Другие спектроскопические зонды представляют собой комплексы металл-аминокислота, такие как комплексы металла кобальт с гидрофобными аминокислотами, такими как фенилаланин, лейцин, изолейцин, метионин и валин или тому подобное.
Термин «химическая стабильность» производного инсулина в том виде, как он здесь используется, относится к химическим ковалентным изменениям в структуре белка, приводящим к образованию продуктов химической деградации с потенциально меньшей биологической активностью и/или потенциально повышенными иммуногенными свойствами по сравнению со структурой нативного белка, и включает избегание деградации ковалентных связей, такой как гидролиз, рацемизация, окисление или поперечное связывание. Могут образоваться разные продукты химической деградации, в зависимости от типа и природы нативного белка и среды, в которую экспонировано производное инсулина. Устранения химической деградации вероятнее всего нельзя полностью избежать, и часто на протяжении хранения и применения белкового препарата наблюдаются возрастающие количества продуктов химической деградации, как хорошо известно специалисту в данной области. Большинство белков склонно к дезаминированию, процессу, в котором гидролизуется амидная группа боковой цепи в глутамине или аспарагине с образованием свободной карбоновой кислоты. Остатки аспарагина и аспарагиновой кислоты могут дополнительно образовать продукты деградации на основе изоаспарагиновой кислоты. Другие пути деградации включают образование высокомолекулярных продуктов превращения, где две или более чем две молекулы белка ковалентно связаны друг с другом через трансамидирование и/или дисульфидные взаимодействия, приводящие к образованию ковалентно связанных димерных, олигомерных и полимерных продуктов деградации (Stability of Protein Pharmaceuticals, Ahern. T.J. & Manning M.C., Plenum Press, New York 1992). Окисление (например, остатков метионина) и рацемизация могут быть упомянуты как другой вариант химической деградации. Химическую стабильность производного инсулина можно оценить измерением количества продуктов химической деградации в разные моменты времени после воздействия разных условий окружающей среды (образование продуктов деградации часто может быть ускорено, например, увеличением температуры). Отдельные продукты деградации часто определяют разделением продуктов деградации, в зависимости от размера молекулы и/или заряда, например, с использованием комбинации хроматографических (например гель-фильтрация-ВЭЖХ (высокоэффективная жидкостная хроматография), ВЭЖХ-ОФ (высокоэффективная жидкостная хроматография с обращенной фазой) или ИО-ВЭЖХ (ионообменная ВЭЖХ)) и спектроскопических способов (разные способы масс-спектрометрии), иногда в комбинациях с химической/ферментативной фрагментацией.
В одном воплощении производное инсулина по изобретению имеет улучшенную химическую стабильность относительно химической стабильности производного инсулина с одной или боле чем одной дополнительной дисульфидной связью при тестировании, как описано в примерах.
В одном воплощении производное инсулина по изобретению имеет повышенную гидрофильность относительно гидрофильности человеческого инсулина и/или производного инсулина без одной или более чем одной дополнительной дисульфидной связи при тестировании на гидрофобность, как известно специалисту и, например, описано в примере 101.
В одном воплощении производное инсулина по изобретению имеет слабую тенденцию или не имеет тенденции к агрегации. Тенденция к агрегации предпочтительно значимо улучшается относительно тенденции к агрегации человеческого инсулина и/или производного инсулина без одной или более чем одной дополнительной дисульфидной связи при тестировании в анализе с тиофлавином.
В одном аспекте производное инсулина согласно изобретению имеет улучшенную термодинамическую стабильность, такую как, например, стабильность сворачивания, конформационная стабильность и/или более высокая температура плавления.
При использовании здесь говорят, что производное инсулина имеет улучшенную «термодинамическую стабильность», если для денатурации указанного производного требуется более высокий уровень стресса, как, например, более высокая температура и/или более высокая концентрация денатурирующего агента по сравнению с человеческим инсулином или производным инсулина без одной или более чем одной дополнительной дисульфидной связи.
Конформационную стабильность можно оценивать круговым дихроизмом и ЯМР (ядерный магнитный резонанс) как, например, описано Hudson and Andersen, Peptide Science, vol 76 (4), pp.298-308 (2004). Температуру плавления следует понимать как температуру, при которой структура инсулина обратимо или необратимо изменяется. Более высокая температура плавления соответствует более стабильным структурам. Температуру плавления можно определять, например, оценкой комформационной стабильности круговым дихроизмом и/или ЯМР как функцию температуры или дифференциальной сканирующей калориметрией. Термодинамическую стабильность также можно определять CD (круговой дихроизм) спектроскопией и/или ЯМР в присутствии возрастающей концентрации денатурирующего агента, такого как, например, гуанидиния гидрохлорид. Свободную энергию разворачивания, как описано ранее (Kaarsholm, N.C., et al, 1993, Biochemistry, 32, 10773-8), можно определять из таких экспериментов. При денатурации белка отрицательный CD в интервале дальнего УФ (ультрафиолетовый) излучения (240-218 нм) постепенно уменьшается, что согласуется с потерей упорядоченной вторичной структуры, которая сопровождает разворачивание белка (Holladay et al., 1977, Biochim. Biophys. Acta, 494, 245-254; Melberg and Johnson, 1990, Biochim. Biophys. Acta, 494, 245-254). CD спектр инсулина в интервале ближнего УФ излучения (330-250 нм) отражает окружение тирозинового хромофора с вкладом от дисульфидных связей (Morris et al., 1968, Biochim. Biophys. Acta., 160, 145-155; Wood et al., 1975, Biochim. Biophys. Acta, 160, 145-155; Strickland & Mercola, 1976, Biochemistry, 15, 3875-3884). Ранее из таких исследований было рассчитано, что свободная энергия разворачивания инсулина составляет 4,5 ккал/моль (примерно 18,84 кДж/моль) (Kaarsholm, N.C., et al, 1993, Biochemistry, 32, 10773-8).
CD спектр инсулина в интервале ближнего УФ излучения (330-250 нм) отражает окружение тирозинового хромофора с вкладом от дисульфидных связей. Поскольку остатки тирозина представляют собой часть поверхности димера инсулина, изменения молярной эллиптичности в данной области (особенно при 276 нм) отражают состояние ассоциации инсулина. Другим способом измерения состояния ассоциации инсулина является применение гель-фильтрации при недиссоциирующих условиях, как известно в данной области и описано в примерах.
Производное инсулина согласно изобретению может иметь по существу такую же или повышенную активность in vivo относительно исходного инсулина. В одном аспекте производное инсулина по изобретению имеет по существу такую же активность in vivo относительно исходного инсулина. В одном аспекте производное инсулина по изобретению имеет повышенную активность in vivo относительно исходного инсулина.
Стандартные анализы для измерения активности инсулина in vivo известны специалисту в данной области и включают анализы, описанные в примерах, такие как: активность производных инсулина по изобретению относительно человеческого инсулина, внутривенные анализы при стационарной фиксации, такие как фармакокинетика у крыс и РК (фармакокинетика) у крыс после внутрикишечной инъекции, эффект снижения содержания глюкозы в крови и внутривенные анализы РК у крыс.
Производное инсулина согласно изобретению может иметь по существу такую же или повышенную активность in vitro относительно исходного инсулина. В одном аспекте производное инсулина по изобретению имеет по существу такую же активность in vitro относительно исходного инсулина. В одном аспекте производное инсулина по изобретению имеет повышенную активность in vitro относительно исходного инсулина.
Стандартные анализы для измерения активности инсулина in vitro известны специалисту в данной области и включают, среди прочих, приведенные ниже анализы in vitro:
(1) радиорецепторные анализы инсулина, в которых относительная активность инсулина определяется как отношение инсулина к производному инсулина, требующееся для вытеснения 50% 125I-инсулина, специфично связанного с рецепторами инсулина, присутствующими на клеточных мембранах, например, во фракции плазматической мембраны печени крыс;
(2) анализы липогенеза, проведенные, например, с адипоцитами крыс, в которых относительная активность инсулина определяется как отношение инсулина к производному инсулина, требующееся для достижения 50% от максимального превращения [3-3H]глюкозы в вещество, экстрагируемое органическими растворителями (т.е. липиды); и
(3) анализы окисления глюкозы в выделенных жировых клетках, в которых относительная активность производного инсулина определяется как отношение инсулина к производному инсулина, требующееся для достижения 50% от максимального превращения глюкозы-1-[14C] до [14CO2].
Дисульфидные связи получаются путем связывания двух тиольных групп, и здесь их следует понимать как связь между двумя атомами серы, т.е. структуру, имеющую общую организацию связей R-S-S-R. Дисульфидные связи также могут называться соединительными дисульфидными связями, SS-связями или дисульфидными мостиками. Дисульфидная связь создается введением двух остатков аминокислоты цистеина в пептид с последующим окислением двух тиольных групп до дисульфидной связи. Такое окисление можно проводить химически (как известно специалистам в данной области), или оно может происходить во время экспрессии инсулина, например, в дрожжах.
При введении остатков цистеина в производное инсулина без одной или более чем одной дополнительной дисульфидной связи, остатки цистеина размещаются в трехмерной структуре свернутого аналога инсулина для обеспечения образования одной или более чем одной дополнительной дисульфидной связи, не присутствующей в человеческом инсулине. Например, при размещении двух новых остатков цистеина, окружение новых остатков цистеина в трехмерной структуре является таким, что дисульфидная связь может образоваться между двумя новыми остатками цистеина.
Число дисульфидных связей в белке (таком как инсулин) можно легко определить точными измерениями интактной массы, как описано, например, в Примерах. Организацию связей дисульфидными связями можно подтвердить (определить) стандартными методиками, известными в данной области, такими как пептидное картирование. Общая стратегия картирования дисульфидных связей в пептиде инсулина включает следующие стадии: 1) фрагментация невосстановленного инсулина на пептиды, связанные дисульфидными связями, содержащие, если возможно, только одну дисульфидную связь на пептид. Выбранные условия также являются такими, что избегается реаранжировка дисульфидных связей, 2) разделение пептидов, связанных дисульфидными связями, друг от друга. 3) Идентификация остатков цистеина, участвующих в отдельных дисульфидных связях.
Человеческий инсулин типично расщепляется протеазой Glu-C, дающей пептид I, содержащий две дисульфидные связи (А6-А11 и А7-В7), и пептид II, содержащий одну дисульфидную связь (А20-В19). Для недвусмысленного приписывания дисульфидных связей в пептиде I необходима дополнительная фрагментация. Для гидролиза CysCys связей в белках ранее использовали кислотный гидролиз (Ryle at al., 1955 Biochem J. 60, 541-56), расщепление по Эдману вручную (Kumazaki Т, Ishii, S. 1990 J. Biochem (Tokyo) 17, 414-9) или длительное расщепление термолизином (Ota M, Ariyoshi, Y., 1995, Biosci. Biotech. Biochem. 59, 1956-7). Альтернативным способом приписывания дисульфидных связей в пептиде I является частичное восстановление трискарбоксиэтилфосфином (восстановление дисульфидной связи А7-В7), алкилирование восстановленных остатков цистеина с последующим полным восстановлением и алкилирование цистеина с использованием другой алкильной группы (Yen, T.-Y., Yan, H., Macher, В., 2001 J Mass Spectrom. 37, 15-30). Стратегия картирования дисульфидов инсулинов, содержащих дополнительные дисульфидные связи, в принципе, является такой же, как описано выше для человеческого инсулина, с корректировкой для каждого аналога таким способом, который приспособлен для новой дисульфидной связи. Определение структуры инсулина ЯМР или рентгеновской кристаллографией является альтернативным подходом для подтверждения организации связывания дисульфидными связями. Условия для определения структур ЯМР и/или кристаллографией были описаны ранее и являются известными в данной области.
В одном аспекте изобретения предложено производное инсулина, которое имеет боковую цепь и по меньшей мере две цистеиновых замены, когда сохраняются три дисульфидные связи человеческого инсулина.
Под термином «цистеиновая замена» здесь подразумевается замена аминокислоты, которая присутствует в человеческом инсулине, цистеином. Например, каждый из изолейцина в положении 10 в цепи А (IleA10) и глутамина в положении 4 цепи В человеческого инсулина (GlnB4) может быть заменен на остаток цистеина. Под термином «замена другим остатком аминокислоты» здесь подразумевается замена аминокислоты, которая присутствует в человеческом инсулине, аминокислотой, которая не является цистеином.
Термин «человеческий инсулин» в том виде, как он здесь используется, означает человеческий гормон инсулин, двухмерные и трехмерные структуры и свойства которого хорошо известны. Трехмерная структура человеческого инсулина была определена, например, ЯМР и рентгеновской кристаллографией при многих разных условиях, и многие из этих структур внесены в банк данных белков (http://www.rcsb.org). Неограничивающим примером структуры человеческого инсулина является структура Т6 (http://www.rcsb.org/pdb/explore.do?structureld=1MSO) и структура R6 (http://www.rcsb.org/pdb/explore.do?structureld=1EV3). Человеческий инсулин имеет две полипептидные цепи, названные А-цепь и В-цепь. А-цепь представляет собой пептид из 21 аминокислоты, и В-цепь представляет собой пептид из 30 аминокислот, причем две цепи соединены дисульфидными связями: первым мостиком между цистеином в положении 7 А-цепи и цистеином в положении 7 В-цепи, и вторым мостиком между цистеином в положении 20 А-цепи и цистеином в положении 19 В-цепи. Третий мостик присутствует между цистеинами в положении 6 и 11 А-цепи. Таким образом, «производное инсулина, в котором сохраняются три дисульфидные связи человеческого инсулина» следует здесь понимать как производное инсулина, содержащее три дисульфидных связи человеческого инсулина, т.е. дисульфидную связь между цистеином в положении 7 А-цепи и цистеином в положении 7 В-цепи, дисульфидную связь между цистеином в положении 20 А-цепи и цистеином в положении 19 В-цепи и дисульфидную связь между цистеинами в положении 6 и 11 А-цепи.
В человеческом организме гормон инсулин синтезируется в виде одноцепочечного предшественника проинсулина (препроинсулина), состоящего из препептида из 24 аминокислот, с последующим проинсулином, содержащим 86 аминокислот в конфигурации: препептид-В-Arg Arg-C-Lys Arg-А, в которой С представляет собой соединительный пептид из 31 аминокислоты. Arg-Arg и Lys-Arg представляют собой сайты расщепления для отщепления соединительного пептида от цепей А и В.
В одном аспекте изобретения предложено производное инсулина, которое имеет две или более чем две цистеиновых замены, где сохраняются три дисульфидные связи человеческого инсулина, и где по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из А9, А10 и А12 А-цепи, заменен цистеином, по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из В1, В2, В3, В4, В5 и В6 В-цепи заменен цистеином, боковая цепь присоединена к эпсилон аминогруппе остатка лизина в В-цепи, и возможно удалена аминокислота в положении B30. В одном аспекте изобретения аминокислотный остаток в положении А10 А-цепи заменен цистеином, по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из В1, В2, В3 и В4 В-цепи заменен цистеином, боковая цепь присоединена к эпсилон аминогруппе остатка лизина в В-цепи, и возможно удалена аминокислота в положении В30. В одном аспекте изобретения по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из А9, А10 и А12 А-цепи, заменен цистеином, по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из В1, В2, В3, В4, В5 и В6 В-цепи, заменен цистеином, по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из А14, А21, В1, В3, В10, В16, В22, В25, В26, В27, В28, В29, В30, В31, В32, заменен аминокислотой, которая не является цистеином, боковая цепь присоединена к эпсилон аминогруппе остатка лизина в В-цепи, и возможно удалена аминокислота в положении В30. Понятно, что когда В1 или В3 представляет собой цистеин, та же самая аминокислота не может быть аминокислотой, которая не является цистеином, тогда как если, например, В1 представляет собой цистеин, В3, согласно данному аспекту изобретения, может быть заменен аминокислотой, которая не является цистеином, и наоборот. В одном аспекте изобретения аминокислотный остаток в положении А10 А-цепи заменен цистеином, по меньшей мере один аминокислотный остаток в положении, выбранном из группы, состоящей из В1, В2, В3 и В4 В-цепи, заменен цистеином, возможно по меньшей мере один аминокислотный остаток заменен аминокислотой, которая не является цистеином, боковая цепь присоединена к эпсилон аминогруппе остатка лизина в В-цепи, и возможно удалена аминокислота в положении В30. В одном аспекте изобретения аминокислотный остаток в положении А10 А-цепи заменен цистеином, п