Твердые дисперсии, содержащие средства, вызывающие апоптоз
Иллюстрации
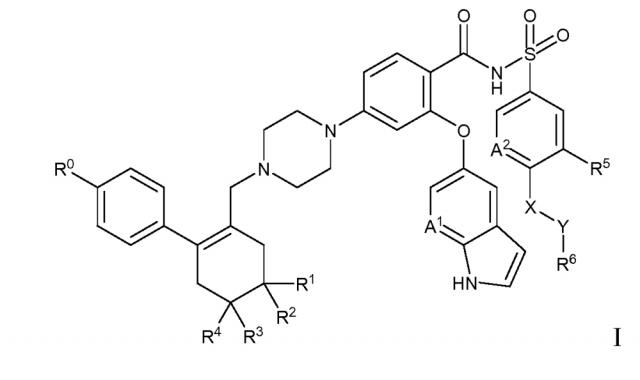
Показать всеИзобретение относится к твердой дисперсии для индукции апоптоза. Дисперсия включает соединение формулы I
где: R0 обозначает хлор; R1 и R2 обозначают Н; R3 и R4 обозначают метил; А1 обозначает N и А2 обозначает СН; R5 обозначает нитро; X обозначает -NH-; Y обозначает -(СН2)n-, где n=1; и R6 выбран из группы, состоящей из тетрагидропиранила и 4-гидрокси-4-метилциклогексила; или его фармацевтически приемлемую соль. При этом соединение формулы I или его фармацевтически приемлемая соль диспергированы в твердой матрице, которая содержит (а) по меньшей мере один фармацевтически приемлемый растворимый в воде полимерный носитель и (b) по меньшей мере одно фармацевтически приемлемое поверхностно-активное вещество. Растворимый в воде полимерный носитель выбран из группы, состоящей из гомополимеров и сополимеров N-виниллактамов, сложных эфиров целлюлозы, простых эфиров целлюлозы, полиалкиленоксидов с высокой молекулярной массой, полиакрилатов, полиметакрилатов, полиакриламидов, винилацетатных полимеров, привитых сополимеров этиленгликоля, поливинилкапролактама и поливинилацетата, олиго- и полисахаридов и их смесей. Поверхностно-активное вещество выбрано из группы, состоящей из полиоксиэтиленовых глицеридов, сложных моноэфиров жирных кислот сорбитана, полисорбатов, α-токоферил-полиэтиленгликоль сукцината (TPGS) и их смесей. Также не более 5% соединения формулы I или его фармацевтически приемлемой соли в твердой дисперсии находится в кристаллической форме по данным анализа дифракции рентгеновских лучей. Также описаны способ получения твердой дисперсии, перорально доставляемая фармацевтическая лекарственная форма. Твердая дисперсия является подходящей для перорального введения нуждающемуся в ней индивиду для лечения заболевания, характеризуемого сверхэкспрессией одного или более антиапоптозных белков из семейства Bcl-2, например, рака. 4 н. и 40 з. п. ф-лы, 2 табл., 17 пр.
Реферат
Перекрестная ссылка на родственные заявки
Настоящая испрашивает приоритет временной заявки № 61/408517, поданной 29 октября 2010 г., которая в полном объеме включена в настоящее описание в качестве ссылки.
Также без притязаний на приоритет или без признания того, что это характеризует уровень техники, дается перекрестная ссылка на рассматриваемую заявку на патент США под № 12/787682 (U.S. 2010/0305122), озаглавленную «Вызывающие апоптоз средства для лечения рака и иммунных и аутоиммунных заболеваний», полное описание которых включено в настоящую заявку в качестве ссылки.
Область, к которой относится изобретение
Настоящее изобретение относится к твердым дисперсиям, содержащим средство, вызывающее апоптоз, к фармацевтическим лекарственным формам, содержащим такие дисперсии, к способам получения таких дисперсий и к лекарственным формам и способам их применения для лечения заболеваний, характеризуемых сверхэкспрессией антиапоптозных белков семейства Bcl-2.
Уровень техники
Сверхэкспрессия белков Bcl-2 коррелируется с устойчивостью к химиотерапии, клиническим исходом, прогрессированием заболевания, общим прогнозом или их комбинацией при различных злокачественных заболеваниях и расстройствах иммунной системы.
Уклонение от апоптоза является отличительным признаком рака (Hanahan & Weinberg (2000) Cell 100:57-70). Раковые клетки должны преодолевать постоянную бомбардировку клеточными стрессами, такими как повреждение ДНК, активация онкогенов, прогрессирование аберрантного клеточного цикла и агрессивные микросреды, которые подвергли бы нормальные клетки апоптозу. Одно первичное средство, посредством которого раковые клетки уклоняются от апоптоза, является стимуляция антиапоптозных белков семейства Bcl-2.
Конкретным типом неопластического заболевания, по поводу которого требуются усовершенствованные способы лечения, является неходжкинская лимфома (NHL). NHL представляет собой шестой по распространенности тип нового злокачественного заболевания в США и возникает преимущественно у пациентов в возрасте 60-70 лет. NHL представляет собой не одно заболевание, а семейство родственных заболеваний, которые классифицируются на основании нескольких характеристик, включающих клинические показатели и гистологию.
По одному способу классификации различные гистологические подтипы распределяются на две основные категории на основании естественного течения заболевания, т.е. того, является ли заболевание вялотекущим или агрессивным. В целом, вялотекущие подтипы нарастают медленно и являются в целом неизлечимыми, тогда как агрессивные подтипы растут быстро и являются потенциально излечимыми. Фолликулярные лимфомы являются наиболее распространенным вялотекущим подтипом, а диффузные крупноклеточные лимфомы - наиболее распространенным агрессивным подтипом. Онкопротеин Bcl-2 был первоначально описан при неходжкинской B-клеточной лимфоме.
Лечение фолликулярной лимфомы обычно заключается в биологически основанной или комбинированной химиотерапии. Обычно применяется комбинированная терапия ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP), как и комбинированная терапия ритуксимабом, циклофосфамидом, винкристином и преднизоном (RCVP). Применяется также монотерапия ритуксимабом (нацеленным на CD20, фосфопротеин, равномерно экспрессированный на поверхности B-клеток) или флударабином. Добавление ритуксимаба к схемам химиотерапии может обеспечить повышенную частоту реакции и увеличенное выживание без прогрессирования заболевания.
Радиоиммунотерапевтические средства, высокодозовая химиотерапия и трансплантация стволовых клеток могут применяться для лечения рефракторной или рецидивирующей NHL. В настоящее время нет утвержденной схемы лечения, которая обеспечивает излечение, и современные руководства рекомендуют лечение пациентов в контексте клинического испытания, даже при лечении первой линии.
Лечение первой линии пациентов с агрессивной крупноклеточной B-клеточной лимфомой обычно состоит из ритуксимаба, циклофосфамида, доксорубицина, винкристина и преднизона (R-CHOP), или подобранных по дозе этопозида, преднизона, винкристина, циклофосфамида, доксорубицина и ритуксимаба (DA-EPOCH-R).
Большинство лимфом первоначально реагируют на любой из этих видов лечения, но опухоли обычно рецидивируют и в конечном счете становятся рефракторными. По мере увеличения числа схем лечения, которые получают пациенты, заболевание становится более устойчивым к химиотерапии. Средняя реакция на лечение первой линии составляет приблизительно 75%, 60% - на лечение второй линии, 50% - на лечении третьей линии и примерно 35-40% - на лечение четвертой линии. Частоты реакции, приближающиеся к 20% при применении одного средства при множественной рецидивирующей форме, считаются положительными и служат основанием для дальнейших исследований.
Другие неопластические заболевания, по поводу которых требуются усовершенствованные способы лечения, включают лейкозы, такие как хронический лимфоцитарный лейкоз (подобный NHL, B-клеточной лимфоме) и острый лимфоцитарный лейкоз.
Хронический лимфоидный лейкоз (CLL) является наиболее распространенным типом лейкоза. CLL является преимущественно заболеванием взрослых, причем возраст более чем 75% людей с вновь диагностированным CLL составляет более 50 лет, но в редких случаях его также обнаруживают у детей. Комбинированные схемы химиотерапии являются преобладающим способом лечения, например, флударабин с циклофосфамидом и/или ритуксимабом, или более сложные комбинации, такие как CHOP или R-CHOP.
Острый лимфоцитарный лейкоз, также известный как острый лимфобластический лейкоз (ALL), является преимущественно заболеванием детского возраста, ранее по существу с нулевым выживанием, но в настоящее время с выживанием до 75% благодаря схемам комбинированной химиотерапии, подобным тем, которые указаны выше. Для обеспечения дополнительного увеличения выживаемости все еще необходимы новые способы лечения.
Современные химиотерапевтические средства вызывают свою противоопухолевую реакцию индукцией апоптоза посредством разнообразных механизмов. Однако многие опухоли в конечном счете становятся устойчивыми к этим средствам. Было показано, что Bcl-2 и Bcl-XL придают устойчивость к химиотерапии при анализах краткосрочного выживания in vitro и, позднее, in vivo. Это свидетельствует о том, что если можно разработать усовершенствованные способы лечения, нацеленные на подавление функции Bcl-2 и Bcl-XL, то такую устойчивость к химиотерапии можно успешно преодолеть.
Вовлечение белков семейства Bcl-2 при раке мочевого пузыря, раке мозга, раке молочной железы, раке костного мозга, раке шейки матки, CLL, колоректальном раке, раке пищевода, печеночноклеточном раке, лимфобластическом лейкозе, фолликулярной лимфоме, лимфоидных злокачественных заболеваниях T-клеточного или B-клеточного происхождения, меланоме, миелогенном лейкозе, миеломе, раке ротовой полости, раке яичников, немелкоклеточном раке легких, раке предстательной железы, мелкоклеточном раке легких, раке селезенки и тому подобных описано в международных патентных публикациях №№ WO 2005/024636 и WO 2005/049593.
Вовлечение белков из семейства Bcl-2 при иммунных и аутоиммунных заболеваниях описано, например, Puck & Zhu (2003) Current Allergy и Asthma Reports 3:378-384; Shimazaki et al. (2000) British Journal of Haematology 110(3):584-590; Rengan et al. (2000) Blood 95(4):1283-1292; и Holzelova et al. (2004) New England Journal of Medicine 351(14):1409-1418. Вовлечение белков из семейства Bcl-2 при отторжении трансплантатов костного мозга раскрыто в опубликованной заявке на патент США № US 2008/0182845.
Известны соединения, которые занимают участок связывания на белках семейства Bcl-2. Для того чтобы быть терапевтически полезными при пероральном введении, такие соединения, желательно, должны иметь высокое сродство связывания, проявляя, например Ki<1 нМ, предпочтительно <0,1 нМ, предпочтительнее <0,01 нМ, с белками семейства Bcl-2, в частности, Bcl-2, Bcl-XL и Bcl-w. Кроме того, желательно, чтобы они были составлены таким образом, который обеспечивает высокое системное воздействие после перорального введения. Типичным показателем системного воздействия после перорального введения соединения является площадь под кривой (AUC) в результате нанесения на график концентрации в плазме соединения как функции времени после перорального введения.
Когда растворимость в воде соединения, связывающего Bcl-2, очень низкая, то составитель лекарственной формулы сталкивается с существенной проблемой при обеспечении приемлемой пероральной биодоступности, которая сильно зависит от растворимости в водной среде желудочно-кишечного тракта. Это справедливо, даже когда сродство связывания является очень высоким. Эта проблема становится еще большей при учете необходимости обеспечения адекватной лекарственной нагрузки в препаративной форме, с тем чтобы терапевтически эффективная доза могла быть введена в приемлемо небольшом объеме составленного продукта.
Жидкие лекарственные формы (включая инкапсулированные жидкости) могут применяться для некоторых лекарственных средств с низкой растворимостью в воде при условии, что может быть найдена фармацевтически приемлемая система растворителя (в целом, на липидной основе), которая обеспечивает адекватную лекарственную нагрузку, не создавая проблем, связанных с растворимостью и устойчивостью при хранении. Другие подходы, которые были предложены для таких лекарственных средств, включают твердые дисперсии, создающие свои собственные проблемы.
По разнообразным причинам, таким как соблюдение пациентами предписанной схемы приема и неприятный вкус, твердая лекарственная форма часто предпочтительнее жидкой лекарственной формы. Однако в большинстве случаев пероральные твердые лекарственные формы препарата обеспечивают более низкую биодоступность, чем пероральные растворы этого препарата.
В данной области были предложены разнообразные решения проблемы низкой пероральной биодоступности. Например, Sharma & Joshi (2007) Asian Journal of Pharmaceutics 1(1):9-19 обсуждают разнообразные стратегии повышения растворимости при получении твердых дисперсий. В этой публикации описан способ выпаривания растворителя для получения твердых дисперсий, с приведением в качестве примера твердой дисперсии эторикоксиба, полученной способом, который включает растворение полиэтиленгликоля (PEG), поливинилпирролидона (PVP или повидона) и активного ингредиента в 2-пропаноле.
Вызывающие апоптоз лекарственные средства, которые нацелены на белки семейства Bcl-2, такие как Bcl-2 и Bcl-XL, лучше всего вводятся в соответствии со схемой, которая обеспечивает непрерывное, например ежедневное, восполнение концентрации в плазме для поддержания концентрации в терапевтически эффективном диапазоне. Это может быть достигнуто ежедневным парентеральным, например, внутривенным (в/в) или внутрибрюшинным (в/б) введением. Однако ежедневное парентеральное введение часто непрактично в клинических условиях, в частности, для амбулаторных пациентов. Для повышения клинической применимости средства, вызывающего апоптоз, например, химиотерапевтического средства, у пациентов, страдающих раком, была бы очень желательна твердая лекарственная форма с приемлемой пероральной биодоступностью. Такая лекарственная форма и схема его перорального введения представили бы важный прогресс в лечении многих типов злокачественных заболеваний, включая NHL, CLL и ALL, и быстрее бы обеспечили возможность проведения комбинированных способов лечения с другими химиотерапевтического препаратами.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к твердой дисперсии, содержащей по существу в некристаллической, например, в аморфной форме, соединение формулы I:
,
где
R0 обозначает галоген;
R1 и R2 обозначают H или независимо обозначают метил или метокси;
R3 и R4 независимо обозначают метил или метокси, если R1 и R2 обозначают H, или обозначают H, если R1 и R2 независимо обозначают метил или метокси;
каждый из A1 и A2 обозначают независимо CH или N;
R5 обозначает C1-4 алкил или галогеналкил, C1-4 алкилсульфонил или галогеналкилсульфонил, галоген, нитро или циано;
X обозначает -O- или -NH-;
Y обозначает -(CH2)n-, где n=0, 1, 2 или 3; и
R6 обозначает незамещенное или замещенное 3-7-членное карбоциклическое или гетероциклическое кольцо, как определено в настоящем описании, или обозначает NR7R8;
где, если R6 обозначает NR7R8, то каждый из R7 и R8 независимо обозначают H или группы R9-(CH2)m-, причем не более чем один из R7 и R8 обозначает H, где каждый R9 обозначает независимо 3-7-членное карбоциклическое или гетероциклическое кольцо, необязательно замещенное не более чем двумя группами Z1, как определено ниже, и каждое m независимо равно 0 или 1; и
где, если R6 обозначает замещенное карбоциклическое или гетероциклическое кольцо, то заместителями на нем являются не более чем две группы Z1 и/или не более чем одна группа Z2, причем группы Z1 независимо выбраны из (a) C1-4 алкила, C2-4 алкенила, C1-4 алкокси, C1-4 алкилтио, C1-4 алкиламино, C1-4 алкилсульфонила, C1-4 алкилсульфониламино, C1-4 алкилкарбонила, C1-4 алкилкарбониламино и C1-4 алкилкарбокси, причем каждый необязательно замещен одним или более заместителей, независимо выбранных из галогена, гидрокси, C1-4 алкокси, амино, C1-4 алкиламино, ди-(C1-4 алкил)амино и циано, (b) галогена, (e) гидрокси, (f) амино и (g) оксо групп, и Z2 обозначает (i) дополнительное 3-6-членное карбоциклическое или гетероциклическое кольцо, необязательно замещенное не более чем двумя группами Z1, как определено выше, или (ii) NR7R8, где R7 и R8 обозначают, как определено выше;
или фармацевтически приемлемую соль такого соединения. Соединение или его соль диспергированы в твердой матрице, которая содержит (a) фармацевтически приемлемый растворимый в воде полимерный носитель и (b) фармацевтически приемлемое поверхностно-активное вещество.
Кроме того, изобретение относится к твердой перорально доставляемой лекарственной форме, содержащей такую твердую дисперсию, необязательно вместе с одним или более дополнительными эксципиентами.
Кроме того, изобретение относится к способу получения твердой дисперсии, как описано выше. Этот способ включает:
(a) растворение (i) активного фармацевтического ингредиента (API), содержащего соединение формулы I или его фармацевтически приемлемую соль, (ii) фармацевтически приемлемого растворимого в воде полимерного носителя и (iii) фармацевтически приемлемого поверхностно-активного вещества в подходящем растворителе; и
(b) удаление растворителя для получения твердой матрицы, содержащей полимерный носитель и поверхностно-активное вещество и имеющей соединение или его соль, диспергированные в ней по существу в некристаллической форме.
Соединение, присутствующее в готовой твердой дисперсии, может быть в такой же химической форме (например, материнского соединения или соли) как у API, используемого для ее получения. Способ может включать одну или более дополнительных стадий, где API превращается из материнского соединения в соль или наоборот. В соответствии с одним таким вариантом осуществления, способ дополнительно включает, перед удалением растворителя, добавление основания для превращения API в солевой форме в его соответствующее материнское соединение и, необязательно, экстракцию побочного продукта такого превращения (например, солевого побочного продукта) из полученной смеси. В соответствии с другим таким вариантом осуществления, способ дополнительно включает, перед удалением растворителя, добавление кислоты для превращения API в форме материнского соединения в соль, например, кислотно-аддитивную соль.
Кроме того, изобретение относится к твердой дисперсии, полученной описанным выше способом.
Кроме того, изобретение относится к способу лечения неопластических, иммунных или аутоиммунных заболеваний, включающему пероральное введение индивиду, имеющему заболевание, терапевтически эффективного количества описанной выше твердой дисперсии или одной или более твердых лекарственных форм, содержащих такую дисперсию. Примеры неопластических заболеваний включают различные формы рака. Определенным иллюстративным типом рака, который можно лечить в соответствии с настоящим изобретением, является неходжкинская лимфома (NHL). Другим иллюстративным типом рака, который можно лечить в соответствии с настоящим изобретением, является хронический лимфоцитарный лейкоз (CLL). Еще одним иллюстративным типом рака, который можно лечить в соответствии с настоящим изобретением, является острый лимфоцитарный лейкоз (ALL), например, у пациента детского возраста.
Дополнительные варианты осуществления изобретения, включая более конкретные аспекты вариантов осуществления, указанных выше, будут найдены в следующем подробном описании или станут очевидными из него.
ПОДРОБНОЕ ОПИСАНИЕ
Попытки составления соединения формулы I или его соли в виде перорально доставляемой лекарственной формы были тщетными вследствие очень ограниченного числа фармацевтически приемлемых жидких систем растворителей, обеспечивающих приемлемую растворимость соединения или соли, и тенденцией всех таких тестированных систем растворителей к осаждению нерастворимых твердых веществ во время хранения. В настоящее время было обнаружено, что более успешным подходом является составление соединения или соли в виде твердой дисперсии. В настоящем описании раскрыты подробности этого подхода, которым может быть достигнута комбинация всех факторов - удовлетворительной лекарственной нагрузки, приемлемой растворимости и адекватной биодоступности - с очень неперспективным классом активного ингредиента.
Твердая дисперсия в соответствии с настоящим описанием содержит активный ингредиент по существу в некристаллической или в аморфной форме, которая обычно более растворима, чем кристаллическая форма. Термин «твердая дисперсия» в настоящем описании охватывает системы, имеющие мелкие частицы в твердом состоянии (например, по существу некристаллические или аморфные частицы) одной фазы, диспергированные в другой фазе твердого состояния. Конкретнее, твердые дисперсии по настоящему изобретению содержат частицы одного или более активных ингредиентов, диспергированные в инертном носителе или матрице в твердом состоянии, и могут быть получены способами плавления или азеотропным способом или комбинацией способов плавления и азеотропного способа. В соответствии с настоящим изобретением особенно предпочтителен азеотропный способ, описанный в настоящей заявке.
«Аморфная форма» относится к частице без определенной структуры, т.е. не имеющей кристаллической структуры.
Термин «по существу некристаллическая» в настоящем описании значит, что при анализе дифракции рентгеновских лучей наблюдается кристалличность не более чем примерно 5%, например, не более чем примерно 2% или не более чем примерно 1%. В конкретном варианте осуществления выявляемая кристалличность не наблюдается ни при анализе дифракции рентгеновских лучей, ни при поляризационной микроскопии, или при них обоих. В этом отношении следует отметить, что когда выявляемая кристалличность не наблюдается, то твердая дисперсия, указанная в настоящем описании, может быть дополнительно или альтернативно описана как твердый раствор.
A. Активное соединение
Соединение формулы I, включая его соли, используемые в настоящем изобретении, обычно имеют очень низкую растворимость в воде, классифицируясь как по существу нерастворимые, т.е. имеющие растворимость менее чем примерно 10 мкг/мл. Примерами таких активных ингредиентов являются, например, лекарственные субстанции IV класса по системе классификации биофармацевтических соединений (BCS), которые характеризуются низкой растворимостью и низкой проницаемостью (см. «Waiver of in vivo bioavailability и bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system», U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), August 2000). Следует понимать, что растворимость в воде многих соединений зависит от pH; в случае таких соединений растворимость, представляющая интерес для настоящего изобретения, находится на уровне физиологически релевантного pH, например, pH от примерно 1 до примерно 8. Так, в различных вариантах осуществления лекарственное средство имеет растворимость в воде по меньшей мере в одной точке в диапазоне pH от примерно 1 до примерно 8 менее чем примерно 10 мкг/мл, в некоторых случаях менее чем примерно 1 мкг/мл или даже менее чем примерно 0,1 мкг/мл. Иллюстративно, определенное соединение, используемое в настоящем изобретении, имеет растворимость в воде при pH 4 <0,004 мкг/мл.
Твердые дисперсии по настоящему изобретению содержат в качестве активного ингредиента соединение формулы I, как определено выше, или фармацевтически приемлемую соль такого соединения. Необязательно, они могут дополнительно содержать второй активный ингредиент, например, терапевтическое средство, применяемое при комбинированном лечении с соединением формулы I, как указано ниже в настоящем описании.
В одном варианте осуществления соединение имеет формулу I, где R0 обозначает хлор.
В другом варианте осуществления соединение имеет формулу I, где R1 обозначает метил или метокси, R2 обозначает метил и каждый из R3 и R4 обозначает H.
В еще одном варианте осуществления соединение имеет формулу I, где R5 обозначает трифторметил, трифторметилсульфонил, хлор, бром или нитро. В более конкретном варианте осуществления, если A2 обозначает -CH-, то R5 обозначает нитро; и если A2 обозначает -N-, то R5 обозначает бром.
В более конкретном варианте осуществления соединение имеет формулу I, где (a) R0 обозначает хлор, (b) R1 обозначает метил или метокси, R2 обозначает метил, и каждый из R3 и R4 обозначают H, и (c) R5 обозначает трифторметил, трифторметилсульфонил, хлор, бром или нитро.
Соединения, применяемые в настоящем изобретении, значительно варьируются в заместителе -X-Y-R6, конкретнее, группе R6 формулы I. В большинстве вариантов осуществления R6 обозначает 3-7-членное карбоциклическое или гетероциклическое кольцо, необязательно замещенное, как определено выше.
Термин «карбоциклическое» в настоящем описании охватывает насыщенные и частично и полностью ненасыщенные кольцевые структуры, имеющие от 3 до 7 атомов углерода, включая бициклические структуры. В одном варианте осуществления R6 обозначает насыщенное карбоциклическое (т.е., циклоалкильное) кольцо, например, без ограничения ими, циклопропил, циклобутил, циклопентил или циклогексил, в каждом случае необязательно замещенные, как полнее описано ниже.
Термин «гетероциклические» в настоящем описании охватывает насыщенные и частично и полностью ненасыщенные кольцевые структуры, имеющие от 4 до 7 кольцевых атомов, один или более из которых являются гетероатомами, независимо выбранными из N, O и S. Обычно гетероциклическое кольцо имеет не более чем два таких гетероатома. В одном варианте осуществления R6 обозначает насыщенное гетероциклическое кольцо, например, без ограниченияими, азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил, в каждом случае необязательно замещенные, как полнее описано ниже.
Когда R6 обозначает карбоциклическое или гетероциклическое кольцо, например, насыщенное кольцо, как описано непосредственно выше, то оно может быть незамещенным или замещенным в трех положениях на кольце. Заместители, если они присутствуют, содержат не более чем две группы Z1 и/или не более чем одну группу Z2.
Группы Z1 независимо выбраны из (a) C1-4 алкила, C2-4 алкенила, C1-4 алкокси, C1-4 алкилтио, C1-4 алкиламино, C1-4 алкилсульфонила, C1-4 алкилсульфониламино, C1-4 алкилкарбонила, C1-4 алкилкарбониламино и C1-4 алкилкарбокси, каждого необязательно замещенного одним или более заместителями, независимо выбранными из галогена, гидрокси, C1-4 алкокси, амино, C1-4 алкиламино, ди-(C1-4 алкил)амино и циано, (b) галогена, (e) гидрокси, (f) амино и (g) оксо групп. Иллюстративные примеры таких групп Z1 включают без ограничения метил, цианометил, метокси, фтор, гидрокси, амино и метилсульфонил.
Группа Z2, если она присутствует, обозначает дополнительное 3-7-членное карбоциклическое или гетероциклическое кольцо, необязательно замещенное не более чем двумя группами Z1, как описано выше. Кольцо Z2, если оно присутствует, является обычно, но не обязательно, насыщенным, и в большинстве случаев дополнительно не насыщено. В одном варианте осуществления Z2 обозначает насыщенное карбоциклическое кольцо, например, без ограничения ими, циклопропил, циклобутил, циклопентил или циклогексил. В другом варианте осуществления Z2 обозначает насыщенное гетероциклическое кольцо, например, без ограничения ими, азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил.
В некоторых вариантах осуществления R6 обозначает группу NR7R8, где каждый из R7 и R8 обозначает независимо H или группы R9-(CH2)m-, причем не более чем один из R7 и R8 обозначает H, где каждый R9 обозначает независимо 3-7-членное карбоциклическое или гетероциклическое кольцо, необязательно замещенное не более чем двумя группами Z1, как определено выше, и каждый m независимо равен 0 или 1. Каждое из колец R9 обычно, но не обязательно, является насыщенным, и в большинстве случаев является ненасыщенным. Иллюстративные карбоциклические кольца на R7 и/или R8 включают без ограничения циклопропил, циклобутил, циклопентил или циклогексил. Иллюстративные карбоциклические кольца на R7 и/или R8 включают без ограничения азетидинил, оксетанил, тиетанил, пирролидинил, имазолидинил, пиразолидинил, тетрагидрофуранил, оксазолидинил, изоксазолидинил, тиофанил, тиазолидинил, изотиазолидинил, пиперидинил, пиперазинил, тетрагидропиранил, 1,4-диоксанил, морфолинил или тетрагидротиопиранил.
В конкретных вариантах осуществления R6 выбран из группы, состоящей из 4-метоксициклогексила, цис-4-гидрокси-4-метилциклогексила, транс-4-гидрокси-4-метилциклогексила, 4-морфолин-4-илциклогексила, (3R)-1-(метилсульфонил)пирролидин-3-ила, (3R)-1-тетрагидро-2H-пиран-4-илпирролидин-3-ила, тетрагидро-2H-пиран-4-ила, (3S)-тетрагидро-2H-пиран-3-ила, 4-метокситетрагидро-2H-пиран-4-ила, 4-фтортетрагидро-2H-пиран-4-ила, 4-аминотетрагидро-2H-пиран-4-ила, 1-(цианометил)пиперидин-4-ила, 4-фтор-1-оксетан-3-илпиперидин-4-ила, 1-тетрагидро-2H-пиран-4-илпиперидин-4-ила, 4-метилпиперазин-1-ила, 1,4-диоксан-2-ила, 4-метилморфолин-2-ила и циклопропил(оксетан-3-ил)амино.
Соединения формулы I могут содержать асимметрично замещенные атомы углерода в R- или S-конфигурации; такие соединения могут присутствовать в виде рацематов или в избытке одной конфигурации над другой, например, в энантиомерном отношении по меньшей мере примерно 85:15. Соединение может быть по существу энантиомерно чистым, например, имеющим энантиомерное отношение по меньшей мере примерно 95:5, или в некоторых случаях по меньшей мере примерно 98:2 или по меньшей мере примерно 99:1.
Соединения формулы I могут альтернативно или дополнительно содержать межуглеродные двойные связи или углерод-азотные двойные связи в Z- или E-конфигурации, причем термин «Z» обозначает конфигурацию, в которой более крупные заместители находятся на той же стороне такой двойной связи, а термин «E» обозначает конфигурацию, в которой более крупные заместители находятся на противоположной стороне двойной связи. Соединение может альтернативно присутствовать в виде смеси Z- и E-изомеров.
Соединения формулы I могут альтернативно или дополнительно существовать в виде таутомеров или их равновесных смесей, где протон сдвигается с одного атома на другой. Примеры таутомеров иллюстративно включают кето-енол, фенол-кето, оксим-нитрозо, аци-нитро, имин-енамин и тому подобные.
В одном варианте осуществления API, присутствующий в твердой дисперсии, выбран из соединений, конкретно идентифицированных в приведенной выше в качестве ссылки заявке на патент США под № 12/787682 (U.S. 2010/0305122), в ее примерах 1-378, и фармацевтически приемлемых солей таких соединений, независимо от того, охватываются ли эти соединения по отдельности настоящей формулой I. Соединения 1-378 этих примеров и иллюстративные процедуры их синтеза воспроизведены ниже в настоящем описании. В другом варианте осуществления API, присутствующий в твердой дисперсии, выбран из соединений 1-378 и их фармацевтически приемлемых солей, но только в той степени, в которой такие примеры по отдельности охватываются настоящей формулой I. Полное описание заявки на патент США под № 12/787682 (U.S. 2010/0305122) специально включено в настоящее описание путем ссылки.
Описание синтеза репрезентативных соединений представлено ниже. Другие соединения формулы I могут быть получены по существу аналогичными способами, как будет понятно специалисту в данной области. Приведенные в качестве примеров соединения были названы с использованием номенклатуры ACD/ChemSketch версии 5.06 (05 июня 2001 г., Advanced Chemistry Development Inc., Toronto, Ontario), ACD/ChemSketch версии 12.01 (13 мая 2009 г.), Advanced Chemistry Development Inc., Toronto, Ontario) или ChemDraw® версии 9.0.5 (CambridgeSoft, Cambridge, MA). Промежуточные соединения были названы с использованием номенклатуры ChemDraw® версии 9.0.5 (CambridgeSoft, Cambridge, MA).
Соединение 1
4-{4-[(4'-хлор-1,1'-бифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение 1A
трет-бутил-4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-карбоксилат
4'-Хлорбифенил-2-карбоксальдегид (4,1 г), трет-бутил-пиперазин-1-карбоксилат (4,23 г) и триацетоксиборгидрид натрия (5,61 г) в CH2Cl2 (60 мл) перемешивали в течение 24 часов. Реакцию гасили метанолом, и реакционную смесь выливали в простой эфир. Раствор промывали водой и рассолом, концентрировали и проводили хроматографию на силикагеле с 2-25% этилацетата/гексанов.
Соединение 1B
1-((4'-хлорбифенил-2-ил)метил)пиперазин
Соединение 1A (3,0 г) и триэтилсилан (1 мл) перемешивали в CH2Cl2 (30 мл) и трифторуксусной кислоте (30 мл) в течение 2 часов, и реакционную смесь концентрировали и затем и поглощали в простом эфире и снова концентрировали. Материал поглощали в дихлорметане (200 мл) и растворе NaHCO3 (100 мл) и делили на части. Органический слой сушили над Na2SO4 и конденсировали для получения указанного в заголовке соединения.
Соединение 1C
трет-бутил-4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)-2-фторбензоат
Трет-бутил-4-бром-2-фторбензоат (14,0 г), Соединение 1B (16,05 г), Pd2(dba)3 (трис(дибензилиденацетон)дипалладий(0))(1,40 г), 2-(ди-трет-бутилфосфино)бифенил (1,82 г) и K3PO4 (16,2 г) перемешивали в 1,2-диметоксиэтане (300 мл) при 80°C в течение 24 часов. Реакционную смесь охлаждали и концентрировали. Неочищенный продукт хроматографировали на силикагеле с 10-20% этилацетата/гексанов.
Соединение 1D
трет-бутил-2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)бензоат
1H-Пирроло[2,3-b]пиридин-5-ол (167 мг), Соединение 1C (500 мг) и Cs2CO3 (508 мг) перемешивали в диметилсульфоксиде (5 мл) при 130°C в течение 24 часов. Смесь охлаждали, разбавляли этилацетатом, промывали три раза водой и рассолом и сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на силикагеле с 25% этилацетата/гексанов.
Соединение 1E
2-(1H-пирроло[2,3-b]пиридин-5-илокси)-4-(4-((4'-хлорбифенил-2-ил)метил)пиперазин-1-ил)бензойная кислота
Соединение 1D (200 мг) и триэтилсилан (1 мл) перемешивали в дихлорметане (15 мл) и трифторуксусной кислоте (15 мл) в течение 1 часа. Смесь концентрировали, поглощали в этилацетат, дважды промывали NaH2PO4 и рассолом и сушили (Na2SO4), фильтровали и концентрировали.
Соединение 1F
3-нитро-4-((тетрагидро-2H-пиран-4-ил)метиламино)бензолсульфонамид
4-Фтор-3-нитробензолсульфонамид (2,18 г), 1-(тетрагидропиран-4-ил)метиламин (1,14 г) и триэтиламин (1 г) перемешивали в тетрагидрофуране (30 мл) в течение 24 часов. Раствор разбавляли этилацетатом, промывали раствором NaH2PO4 и рассолом и сушили (Na2SO4), фильтровали и концентрировали. Продукт порошковали из этилацетата.
Соединение 1G
4-{4-[(4'-хлор-1,1'-бифенил-2-ил)метил]пиперазин-1-ил}-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение 1E (115 мг), Соединение 1F (67 мг), 1-этил-3-[3-(диметиламино)пропил]карбодиимид гидрохлорид (82 мг) и 4-диметиламинопиридин (26 мг) перемешивали в CH2Cl2 (3 мл) в течение 24 часов. Реакционную смесь охлаждали и проводили хроматографию на силикагеле с 0-5% метанолом/этилацетатом.
1H ЯМР (300 МГц, дейтерированный диметилсульфоксид-d6) δ 11,48 (уш.с, 1H), 8,34 (уш.с, 1H), 8,31 (м, 1H), 7,90 (д, 1H), 7,68 (м, 1H), 7,58 (м, 2H), 7,46 (м, 4H), 7,35 (м, 2H), 7,21 (дд, 1H), 6,76 (м, 4H), 6,28 (м, 2H), 3,02 (м, 2H), 2,89 (м, 4H), 2,80 (м, 4H), 2,40 (м, 3H), 1,59 (м, 2H), 1,25 (м, 4H), 0,87 (м, 2H).
Соединение 2
4-{4-[(4'-хлор-1,1'-бифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение 2A
4-(3-морфолинопропиламино)-3-нитробензолсульфонамид
Это соединение получали замещением 3-(N-морфолинил)пропиламином 1-(тетрагидропиран-4-ил)метиламина в процедуре для соединения 1F.
Соединение 2B
4-{4-[(4'-хлор-1,1'-бифенил-2-ил)метил]пиперазин-1-ил}-N-({4-[(3-морфолин-4-илпропил)амино]-3-нитрофенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Это соединение получали замещением Соединением 2A соединения 1F в процедуре для соединения 1G.
1H ЯМР (300 МГц, дейтерированный диметилсульфоксид-d6) δ 11,60 (уш.с, 1H), 8,60 (м, 1H), 8,43 (д, 1H), 7,94 (д, 1H), 7,64 (м, 2H), 7,54 (д, 1H), 7,45 (м, 4H), 7,33 (м, 2H), 7,23 (дд, 1H), 6,96 (д, 1H), 6,85 (м, 2H), 6,32 (д, 1H), 6,26 (д, 1H), 3,60 (м, 4H), 3,10 (м, 4H), 3,05 (м, 10H), 2,40 (м, 2H), 2,33 (м, 2H), 1,77 (м, 2H).
Соединение 3
4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(1-тетрагидро-2H-пиран-4-илпиперидин-4-ил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид
Соединение 3A
метил-4,4-диметил-2-(трифторметилсульфонилокси)циклогекс-1-енкарбоксилат
К суспензии гексана, промытой NaH (17 г) в дихлорметане (700 мл), добавляли по каплям 5,5-диметил-2-метоксикарбонилциклогексанон (38,5 г) при 0°C. После перемешивания в течение 30 минут, смесь охлаждали до -78°C и добавляли трифторуксусный ангидрид (40 мл). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 24 часов. Органический слой промывали рассолом, сушили (Na2SO4), фильтровали и концентрировали для получения указанного продукта.
Соединение 3B
метил 2-(4-хлорфенил)-4,4-диметилциклогекс-1-енкарбоксилат
Соединение 3A (62,15 г), 4-хлорфенилбороновую кислоту (32,24 г), CsF (64 г) и тетракис(трифенилфосфин)палладий(0) (2 г) в 2:1 диметоксиэтане/метаноле (600 мл) нагревали до 70°C в течение 24 часов. Смесь концентрировали. Добавляли простой эфир (4×200 мл) и смесь фильтровали. Объединенный эфирный раствор концентрировали для получения указанного продукта.
Соединение 3C
(2-(4-хлорфенил)-4,4-диметилциклогекс-1-енил)метанол
К смеси LiBH4 (13 г), Соединения 3B (53,8 г) и простого эфира (400 мл) медленно шприцем добавляли метанол (25 мл). Смесь перемешивали при комнатной температуре в течение 24 часов. Реакцию гасили 1н HCl при охлаждении льдом. Смесь разбавляли водой и экстрагировали простым эфиром (3×100 мл). Экстракты сушили (Na2SO4), фильтровали и концентрировали. Неочищенный продукт хроматографировали на си