Производные ксантендиона для лечения пигментации и старения кожи
Иллюстрации
Показать всеИзобретение относится к новому соединению общей формулы (I), в котором: R1 и R2 представляют собой: OH, атом водорода, C1-C6 алкильный радикал, C1-C6 алкокси радикал или атом галогена; R4 представляет собой: COR5, пиранозный радикал, который может быть частично или полностью ацетилирован; R5 представляет собой: C10-C24 алкильный радикал или C12-C24 алкенильный радикал, содержащий по меньшей мере одну ненасыщенную связь, преимущественно от 1 до 6 и предпочтительно от 1 до 4; R6 и R7 представляют собой: -одновременно атом водорода или метильный радикал, либо, когда R6 представляет собой атом водорода, R7 представляет собой C1-C6 алкильный радикал или фенил, замещенный или не замещенный одним или более C1-C3 алкокси радикалами или одним или более атомами галогена, к его фармацевтически или косметически приемлемым солям и способам его получения. Изобретение также относится к применению соединения формулы I в качестве лекарственного или косметического активного ингредиента для депигментации кожи и/или волос, для лечения или предупреждения старения кожи или ее воспаления, а также к фармацевтическим или косметическим композициям на его основе. 6 н. и 8 з.п. ф-лы, 3 табл., 27 пр.
Реферат
Настоящее изобретение относится к производным ксантендиона и к содержащим их фармацевтическим или косметическим композициям, к способу их получения и к их применениям, в частности, в качестве лекарственного средства или в качестве косметически активного ингредиента.
Новые соединения согласно настоящему изобретению являются предшественниками ксантендиона. Применение этих предшественников обеспечивает медленное высвобождение функциональных групп ксантендиона в кожной среде.
Эти соединения могут представлять собой, с одной стороны, гликозиды, которые образуются в результате конденсации глюкозы и функциональных групп ксантендиона.
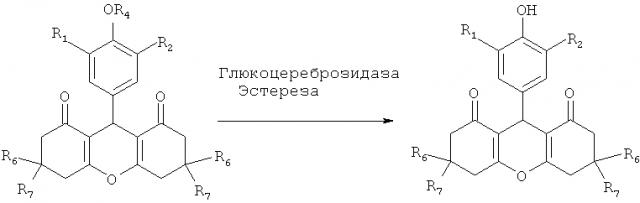
В данном случае принцип изобретения связан с использованием глюкоцереброзидазы, которая представляет собой лизосомальный фермент, присутствующий во всех клетках, и, следовательно, естественно присутствующий в коже (Yutaka Takagi, Ernst Kriehuber, Genji Imokawa, Peter M. Elias, and Walter M. Holleran, β-Giucocerebrosidase activity in mammalian stratum corneum, The Journal of Lipid Research, Vol.40, 861-869, (1999)). Глюкоцереброзидаза гидролизует активный предшественник, высвобождая посредством этого биологически активное вещество (см. схему 1), а именно функциональную группу ксантендиона.
Ферментативный гидролиз глюкоцереброзидазой медленно высвобождает функциональную группу ксантендиона. Это медленное высвобождение дает возможность избежать избыточной концентрации активного ингредиента. Таким образом, медленное высвобождение активного ингредиента обеспечивает его лучшую биодоступность в кожной среде и, следовательно, более эффективную защиту.
Эти соединения могут представлять собой, с другой стороны, алкиловый или алкениловый сложный эфир ксантендионов. Эти сложные эфиры также легко расщепляются эстеразами, присутствующими в коже (Redoules, D., Tarroux, R., Assalit, M.F. and Perie, J.J. Characterization and assay of five enzymatic activities in the stratum corneum using tape-stripping, Skin Pharmacol. Appl. Skin Physiol., 12, 182-192 (1999)). Расщепление этих сложных эфиров эстеразами, присутствующими в коже, таким образом, обеспечивает медленную диффузию активных ингредиентов (см. схему 1), которая соответствует концепции "доставки лекарства".
Схема 1: Расщепление соединений общей формулы (I) эстеразами или глюкоцереброзидазой кожи
Таким образом, объектом настоящего изобретения является соединение общей формулы (I):
в котором:
R1 и R2 представляют собой одновременно или независимо: OH, атом водорода, C1-C6 алкильный радикал, C1-C6 алкокси радикал, атом галогена или OCOR3;
R3 представляет собой: C1-C24 алкильный радикал, C12-C24 алкенильный радикал, содержащий по меньшей мере одну ненасыщенную связь, преимущественно от 1 до 6 и предпочтительно от 1 до 4;
R4 представляют собой: COR5, глюцидный радикал, замещенный или не замещенный одним или более ацетильными радикалами,
R5 представляет собой: C10-C24 алкильный радикал или C12-C24 алкенильный радикал, содержащий по меньшей мере одну ненасыщенную связь, преимущественно от 1 до 6 и предпочтительно от 1 до 4;
R6 и R7 представляют собой:
- одновременно атом водорода или метильный радикал,
либо
- когда R6 представляет собой атом водорода, R7 представляет собой C1-C6 алкильный радикал или фенил, замещенный или не замещенный одним или более C1-C3 алкокси или одним или более галогенами,
либо
- R6 и R7 связаны друг с другом и образуют C3-C6 циклоалкил,
и его косметически и фармацевтически приемлемые соли.
Определения:
"Алкильный радикал" означает в соответствии с настоящим изобретением насыщенную нормальную или разветвленную алифатическую углеводородную цепь, и содержащий указанное число атомов углерода. Для примера можно перечислить метил, этил и пропил. Алкильный радикал может, в частности, представлять собой углеводородную цепь C1-C24 и, в частности, C10-C24 насыщенную жирную кислоту.
Насыщенные жирные кислоты могут представлять собой каприновую кислоту (10:0), ундециловую кислоту (11:0), лауриновую кислоту (12:0), тридециловую кислоту (13:0), миристиновую кислоту (14:0), пентадециловую кислоту (15:0), пальмитиновую кислоту (16:0), маргариновую кислоту (17:0), стеариновую кислоту (18:0), нонадециловую кислоту (19:0), арахидиновую кислоту (20:0), генэйкозановую кислоту (21:0), бегеновую кислоту (22:0), трикозановую кислоту (23:0), лигноцериновую кислоту (24:0). В частности, насыщенные жирные кислоты могут представлять собой пальмитиновую кислоту и стеариновую кислоту.
"Алкокси радикал" означает в соответствии с настоящим изобретением нормальную или разветвленную углеводородную цепь, содержащую указанное число атомов углерода и атом кислорода, например, метокси радикал, этокси радикал, пропокси радикал или бутокси радикал.
"Алкенильный радикал" означает в соответствии с настоящим изобретением насыщенную нормальную или разветвленную алифатическую углеводородную цепь, содержащую указанное число атомов углерода и содержащую по меньшей мере одну ненасыщенную двойную связь, преимущественно от 1 до 6 и предпочтительно от 1 до 4. "Ненасыщенная двойная связь" означает в соответствии с настоящим изобретением C=C двойную связь.
Алкенильный радикал может, в частности, представлять собой углеводородную цепь, происходящую от C12-C24 ненасыщенной жирной кислоты, содержащей по меньшей мере одну ненасыщенную двойную связь, преимущественно от 1 до 6 и предпочтительно от 1 до 4.
Ненасыщенные жирные кислоты могут представлять собой лауролеиновую кислоту (C12:1), миристолеиновую кислоту (C14:1), пальмитолеиновую кислоту (C16:1), олеиновую кислоту (C18:1), рицинолеиновую кислоту (C18:1), гадолеиновую кислоту (C20:1), эруковую кислоту (C22:1), α-линоленовую кислоту (C18:3), стеаридоновую кислоту (C18:4), эйкозатриеновую кислоту (C20:3), эйкозатетраеновую кислоту (C20:4), эйкозапентаеновую кислоту (C20:5), докозапентаеновую кислоту (C22:5), докозагексаеновую кислоту (C22:6), тетракозапентаеновую кислоту (C24:5), тетракозагексаеновую кислоту (C24:6), линолевую кислоту (C18:2), гамма-линоленовую кислоту (C18:3), эйкозадиеновую кислоту (C20:2), дигомо-гамма-линоленовую кислоту (C20:3), арахидоновую кислоту (C20:4), докозатетраеновую кислоту (C22:2), докозапентаеновую кислоту (C22:5), адреновую кислоту (C22:4) и календовую кислоту (C18:3). В частности, ненасыщенные жирные кислоты могут представлять собой: α-линоленовую кислоту (C18:3), олеиновую кислоту (C18:1), линолевую кислоту (C18:2), гамма-линоленовую кислоту (C18:3) и дигомо-гамма-линоленовую кислоту (C20:3). "Ацетил" означает соль или сложный эфир уксусной кислоты. Атом галогена означает атом хлора, атом фтора, атом брома и атом йода. "Глюцид" означает в соответствии с настоящим изобретением класс органических молекул, содержащих карбонильную группу (альдегид или кетон) и несколько гидроксильных (-OH) групп.
Термины глюциды, моносахариды, сахариды, углеводы, сахара эквивалентны в настоящем изобретении.
Преимущественно глюцид общей формулы (I) выбран из моносахаридов. Более предпочтительно глюцид общей формулы (I) выбран из моносахаридов серии D.
Еще более предпочтительно глюцид общей формулы (I) выбран из C3-C6 моносахаридов серии D, таких как глицеральдегид, эритроза, треоза, рибоза, арабиноза, ксилоза, ликсоза, аллоза, альтроза, гулоза, идоза, талоза, глюкоза, галактоза, манноза, фруктоза и их производные, такие как их циклические формы, когда они существуют, например, пиранозного или фуранозного типа. Предпочтительным моносахаридом в настоящем изобретении является D-глюкопираноза. Глюцид может быть связан с производным ксантендиона связью α- или β-озидного типа, если эта связь находится на аномерном атоме углерода глюцида. Глюцид может быть также связан с производным ксантендиона простой эфирной связью, если эта связь образована на атоме кислорода не аномерного атома углерода глюцида.
Согласно форме осуществления изобретения соединения общей формулы (I) представляют собой соединения, для которых R1 и R2 представляют собой одновременно или независимо атом водорода или C1-C6 алкокси радикал.
Согласно изобретению соединения общей формулы (I) представляют собой соединения, для которых R4 представляет собой COR5.
Изобретение также относится к соединениям общей формулы (I), для которых R5 представляет собой C14-C18 алкильный радикал или C14-C18 алкенильный радикал, содержащий от 1 до 3 ненасыщенных двойных связей.
Согласно форме осуществления изобретения соединения общей формулы (I) представляют собой соединения, для которых R4 представляет собой глюцид, замещенный или не замещенный одним или более ацетильными радикалами, в частности, пиранозный радикал, если целесообразно, частично или полностью ацетилированный.
Согласно изобретению соединения общей формулы (I) представляют собой соединения, для которых R6 и R7 представляют собой одновременно метильный радикал.
Соединения общей формулы (I) могут быть выбраны из приведенного ниже перечня соединений:
-2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенилпальмитат
-(9Z,12Z)-2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенилоктадека-9,12-диеноат
-(3R,4S,5S)-2-(ацетоксиметил)-6-(2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенокси)тетрагидро-2H-пиран-3,4,5-триилтриацетат
-9-(3-метокси-4-((3S,4S,5S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-илокси)фенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
-(3S,4S,5S,6S)-2-(ацетоксиметил)-6-(2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенокси)тетрагидро-2H-пиран-3,4,5-триилтриацетат
-9-(3-метокси-4-((2S,3S,4S,5R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-илокси)фенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
-(3R,4S,5S,6S)-2-(ацетоксиметил)-6-(4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенокси)тетрагидро-2Н-пиран-3,4,5-триилтриацетат
-3,3,6,6-тетраметил-9-(4-((2S,3S,4S,5S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-илокси)фенил)-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион.
Настоящее изобретение также распространяется на соединение общей формулы (I'):
В котором радикалы R1, R2, R3, R4, R5, R6 и R7 имеют значения, идентичные приведенным выше, но в котором R4 может дополнительно представлять собой атом водорода или ацетильный радикал, и его фармацевтически или косметически приемлемые соли, для применения в качестве лекарственного средства или в качестве косметического активного ингредиента.
Изобретение также относится к соединениям общей формулы (I'), определенным выше, для их применения при депигментации кожи и/или волос на голове и/или волос на теле, при лечении и/или при предупреждении старения кожи или при лечении и/или предупреждении воспаления кожи.
Изобретение также относится к соединениям общей формулы (I'), определенным выше, в которых R4 представляет собой атом водорода при депигментации кожи и/или волос на голове и/или волос на теле, при лечении и/или при предупреждении старения кожи или при лечении и/или предупреждении воспаления кожи.
Настоящее изобретение относится к соединениям общей формулы (I') для их применения в качестве активного депигментирующего ингредиента, активного антиоксидантного ингредиента или активного противовоспалительного ингредиента.
Депигментирующая активность, которая в общем состоит в снижении и/или ингибировании продуцирования меланинов, ответственных за депигментацию, или в снижении транспорта меланинов в дендритах, может проявляться различными типами действий в соответствии с настоящим изобретением:
- снижение и/или устранение пигментных пятен, таких как пятна гиперпигментации вследствие провоспалительного стресса (например, коричневатых пигментных пятен, вызванных УФ излучением) и хлоазм, или вместо этого;
- отбеливание и/или осветление кожи и/или волос на теле и/или волос на голове, преимущественно с целью:
- унификации оттенка; которая характеризуется получением однородного, более светлого, более прозрачного, более блестящего оттенка кожи. Блеск оттенка, таким образом, улучшается. Полученные преимущества особенно представляют интерес для чувствительной кожи независимо от ее природы (сухой, нормальной, жирной) и более конкретно матовой и лишенной блеска чувствительной кожи, и/или;
- лечения определенных некрасивых пигментных пятен вследствие гиперпигментации эпителия, особенно таких как пятна старения кожи. Депигментирующая активность согласно настоящему изобретению, таким образом, влечет за собой видимое снижение интенсивности и размера этих пигментных пятен и/или предупреждение появления дополнительных пятен.
Настоящее изобретение относится к соединениям общей формулы (I'), в которых R4 представляет собой атом водорода, для их применения в качестве активного депигментирующего ингредиента, активного антиоксидантного ингредиента или активного противовоспалительного ингредиента.
Настоящее изобретение также относится к применению косметических композиций, содержащих соединение общей формулы (I'), для депигментации кожи и/или волос на голове и/или волос на теле, при лечении и/или предупреждении старения кожи или при лечении и/или предупреждении воспаления кожи.
Настоящее изобретение относится к способу отбеливания и/или осветления кожи и/или волос на теле и/или волос на голове человека, включающему нанесение на кожу и/или волосы на теле и/или волосы на голове косметической композиции, содержащей по меньшей мере одно соединение общей формулы (I').
Настоящее изобретение относится к косметическому способу лечения и/или предупреждения старения кожи, включающему нанесение на кожу косметической композиции, содержащей по меньшей мере одно соединение общей формулы (I').
Настоящее изобретение относится к косметическому способу лечения и/или предупреждения воспалительных реакций кожи, включающему нанесение на кожу косметической композиции, содержащей по меньшей мере одно соединение общей формулы (I').
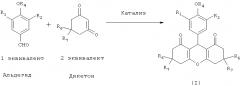
Настоящее изобретение также распространяется на способ синтеза соединений общей формулы (I), характеризующийся тем, что две молекулы 1,3-дикетона подвергают взаимодействию с альдегидом в присутствии кислотных или основных катализаторов:
где R1, R2, R3, R4, R5, R6 и R7 имеют такие же значения, как приведены в общей формуле (I).
Для синтеза продуктов общей формулы (I) с R4=COR5 фенол подвергают взаимодействию с активированной R5COCl карбоновой кислотой
где R1, R2, R3, R4, R5, R6 и R7 имеют такие же значения, как приведены в общей формуле (I).
Для синтеза продуктов общей формулы (I) с R4=глюцид, замещенный одним или более ацетильными радикалами, фенол подвергают взаимодействию с глюцидным радикалом, замещенным одним или более ацетильными радикалами
где R1, R2, R3, R4, R5, R6 и R7 имеют такие же значения, как приведены в общей формуле (I), после чего, если целесообразно, может следовать стадия омыления.
1) Общий протокол синтеза соединений согласно изобретению
Пример 1:
-9-(4-Гидрокси-3-метоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
Общий метод А
Синтез функциональной группы ксантендиона описан в литературе в одну или две стадии из 1,3-дикетона и альдегида в присутствии кислотных или основных катализаторов (S. Kantevari et al., Arkivoc 2006, 136-148) (В. Das et al., Catalysis Communications 8 (2007) 535-538).
К суспензии 1,40 г 5,5-диметил-1,3-циклогександиона (димедона, 10 ммоль) и 0,76 г ванилина (5 ммоль) в 10 мл ацетонитрила добавляют 0,63 мл хлорида триметилсилана (5 ммоль). Смесь доводят до образования флегмы до температуры 110°C, и наблюдают солюбилизацию частиц в суспензии до прозрачного, желтого раствора. После 6 ч взаимодействия раствор охлаждают до температуры окружающей среды в течение 10 минут, затем помещают на 10 минут в ледяную баню. Затем добавляют воду с целью осаждения полученного ксантендиона. Затем смесь фильтруют на агломерате с дистиллированной водой, затем с н-пентаном. Твердое вещество высушивают в вакуумной печи в течение по меньшей мере одной ночи при 50 м бар и при 40°C с получением белого твердого вещества при выходе 79%.
1H ЯМР (400 МГц, CDCl3): δ: 1.00 (s, 6H); 1.10 (s, 6H); 2.20 (dd, 4H); 2.45 (s, 4H); 3.87 (s, 3H); 4.66 (s, 1H); 5.60 (s, 1H); 6.58 (dd, 1H); 6.72 (d, 1H); 6.99 (d, 1H).
13C ЯМР 100 МГц, CDCl3): δ: 27.2; 29.2; 31.2; 32.1; 40.8; 50.7; 55.8; 112.2; 113.9; 115.7; 145.8; 162.0; 196.5.
MC (ИЭР+): 397,1 [M+H]+
Rf (гептан/EtOAc; 1/1): 0,57
Пример 2:
-9-(3,4-дигидроксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантене-1,8(2H)-дион
1H ЯМР (400 МГц, ДМСО d6): δ: 0.91 (s, 6H); 1.02 (s, 6H); 2.07 (d, сист. AB, 2H); 2.23 (d, сист. AB, 2H); 2.52 (m, 4H); 4.37 (s, 1H); 6.36 (d, 1H); 6.53 (d, 1H); 6.60 (s, 1H); 8,58 (s, OH, 1H); 8.7 (s, OH, 1H).
13C ЯМР (100 МГц, ДМСО d6): δ: 26.4; 28.6; 30.0; 31.7; 50.0; 114.8; 114.9; 115.8; 118.4; 135.3; 143.4; 144.4; 162.3; 195.9.
MC (APCI): 383,2 [M+H]+
Rf (1/1; Гептан/EtOAc): 0,75
Пример 3:
9-(4-Гидрокси-3,5-диметоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, ДМСО d6): δ: 0.93 (s, 6H); 1.03 (s, 6H); 2.10 (d, сист. AB, 2H); 2.27 (d, сист. AB, 2H); 2.52 (m, 4H); 3.66 (s, 6H); 4.44 (s, 1H); 6.36 (s, 2H); 8.1 (s, OH, 1H).
13C ЯМР (100 МГц, ДМСО d6): δ: 26.1; 28.7; 30.6; 31.7; 49.9; 55.8; 105.6; 114.4; 124.9; 134.1:134.4; 147.4; 162.6; 196.0.
MC (ИЭР+): 427,2 [M+H]+
Пример 4:
9-(3,4-Дигидроксифенил)-3,6-дифенил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 2.64 (m, 4H); 2.83 (m, 4H); 3.35 (m, 1H); 3.46 (m, 1H); 4.81 (s, 1H); 6.38-7.04 (m, 3H); 7.3 (m, 10Н).
MC (APCI+): 479,1 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,38
Пример 5:
9-(3,5-Ди-трет-бутил-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 0.99 (s, 6H); 1.10 (s, 6H); 1.37 (s, 18H); 2.20 (dd, 4H); 2.45 (dd, 4H); 4.67 (s, 1H); 4.98 (d, 1H); 7.02 (s, 2H).
13C ЯМР (100 МГц, CDCl3): δ: 26.9; 29.4; 30.3; 31.0; 32.2; 34.1; 40.9; 50.7; 116.2; 124.8; 134.8; 134.9; 152.0; 162.0; 196.3.
MC (ИЭР+): 479,3 [M+H]+
Rf (гептан/EtOAc; 7/3): 0,26
Пример 6:
9-(4-Гидрокси-3-метоксифенил)-3,6-дифенил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 2.66 (m, 4H); 2.87 (m, 4H); 3.30 (m, 1H); 3.48 (m, 1H); 3.84 (s, 3H); 4.81 (s, 1H); 5.57 (s, 1H); 6.43-6.83 (m, 3H); 7.09-7.36 (m, 10H).
MC (ИЭР+): 515,0 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,51
Пример 7:
(9Z,12Z)-2-Метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенилоктадека-9,12-диеноат
К раствору 0,99 г ксантендиона (пример 1) (2,5 ммоль) в 12,5 мл безводного ДХМ (дихлорметана) в атмосфере N2 добавляют 417 мкл триэтиламина (3 ммоль). Смесь охлаждают до 0°C с помощью ледяной бани, затем добавляют по каплям 0,88 мл хлорангидрида линолевой кислоты. После 5 минут перемешивания при 0°C ледяную баню удаляют, и реакцию продолжают при температуре окружающей среды в течение ночи. Смесь экстрагируют дистиллированной водой и промывают насыщенным раствором NaCl, после чего высушивают органическую фазу MgSO4, который затем фильтруют. Раствор выпаривают до сухости с получением желтого масла, и проводят хроматографию Combiflash. Используют градиент от 95:5 до 50:50 в гептане/этилацетате. Чистую фракцию выделяют и выпаривают.
Твердое вещество высушивают в печи в течение по меньшей мере 30 минут при 50 мбар с целью получения 1,26 г бежевого продукта при выходе 76,5%.
1H ЯМР (400 МГц, CDCl3): δ: 0.88 (t, 3H); 1.01 (s, 6H); 1.10 (s, 6H); 1.30 (m, 14H); 1.72 (m, 2H); 2.05 (m, 4H); 2.17 (m, 4H); 2.45 (s, 4H); 2.53 (m, 2H); 2.77 (t, 2H); 3.81 (s, 3H); 4.76 (s, 1H); 5.30 (m, 4H); 6.70 (dd, 1H); 6.74 (d, 1H); 7.04 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 14.03; 22.51; 24.94; 25.56; 27.14; 27.35; 28.94; 29.09; 29.13; 29.17; 29.28; 29.55; 31.35; 31.45; 31.97; 32.15; 32.30; 33.96; 40.81; 50.66; 55.78; 76.68; 77.00; 77.32.
MC (ИЭР+): 659,4 [M+H]+
Rf (циклогексан/EtOAc; 2/1): 0,52
Пример 8:
2-Метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенилпальмитат
Такой же протокол, как для примера 7, с пальмитоилхлоридом.
1H ЯМР (400 МГц, CDCl3): δ: 0.89 (t, 3H); 1.00 (s, 6H); 1.10 (s, 6H); 1.31 (m, 22H); 1.39 (m, 2H); 1.72 (m, 4H); 2.22 (m, 4H); 2.45 (m, 4H); 3.81 (s, 3H); 4.66 (s, 1H); 6.69 (dd, 1H); 6.84 (d, 1H); 7.04 (d, 1H).
MC (ИЭР+): 652,5 [M+NH4]+
Rf (гептан/EtOAc; 1/1): 0,54
Пример 9:
9-(4-Гидроксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 0.99 (s, 6H); 1.09 (s, 6H); 2.20 (m, 4H); 2.46 (s, 4H); 4.66 (s, 1H); 5.83 (s, 1H); 6.54 (d, 2H); 7.07 (d, 2H).
13C ЯМР (100 МГц, CDCl3): δ: 27.33; 29.09; 30.89; 32.21; 40.79; 50.70; 115.22; 115.82; 129.26; 135.41; 154.74; 162.43; 197.28.
MC (ИЭР+): 367,2 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,58
Пример 10:
9-(4-Гидрокси-3,5-диметилфенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 0.99 (s, 6H); 1.09 (s, 6H); 2.05 (s, 6H); 2.20 (s, 4H); 2.46 (s, 4H); 4.60 (s, 1H); 5.00 (s, 1H); 6.83 (s, 2H).
13C ЯМР (100 МГц, CDCl3): δ: 15.95; 27.31; 29.15; 30.85; 32.19; 40.82; 50.77; 115.90; 122.56; 128.43; 135.49; 150.79; 161.96; 196.72.
MC (ИЭР+): 395,2 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,64
Пример 11:
9-(4-Гидрокси-3-метоксифенил)-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 2.00 (m, 4H); 2.33 (m, 4H); 2.60 (m, 4H); 3.87 (s, 3H); 4.73 (s, 1H); 5.49 (s, 1H); 6.53 (dd, 1H); 6.73 (d, 1H); 7.07 (d, 1H).
MC (ИЭР+): 358.2 [M+NH4]+
Rf (циклогексан/EtOAc; 3/7): 0,39
Пример 12:
9-(4-Гидрокси-3-метоксифенил)-3,6-диизопропил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 0.92 (m, 12H); 1.60 (m, 2H); 1.70 (m, 2H); 2.10 (m, 2H); 2.30 (m, 2H); 2.45 (m, 2H); 2.65 (m, 2H); 3.88 (s, 3H); 4.70 (s, 1H); 5.62 (s, 1H); 6.51 (m, 1H); 6.72 (m, 1H); 7.07 (m, 1H).
MC (ИЭР+): 425,2 [M+H]+
Rf (циклогексан /EtOAc; 1/1): 0,65
Пример 13:
3,6-Бис(4-фторфенил)-9-(4-гидрокси-3-метоксифенил)-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 2.30 (m, 4H); 2.78 (m, 4H); 3.00 (m, 1H); 3.40 (m, 1H); 3.54 (s, 1H); 3.84 (m, 3H); 5.50 (s, 1H); 6.40 (m, 1H); 6.68 (m, 1H); 6.90 (m, 1H); 7.08 (m, 4H); 7.25 (m, 4H).
MC (ИЭР+): 547,2 [M+NH4]+
Rf (циклогексан/EtOAc; 1 /1): 0,50
Пример 14:
3,6-Бис(3,4-диметоксифенил)-9-(4-гидрокси-3-метоксифенил)-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 2.65 (m, 4H); 2.87 (m, 4H); 3.31 (m, 1H); 3.47 (m, 1H); 3.85 (m, 15H); 4.80 (m, 1H); 5.53 (s, 1H); 6.50 (m, 1H); 6.70 (m, 6H); 7.10 (m, 1H); 7.30 (m, 1H).
MC (ИЭР+): 630,3 [M+NH4]+
Rf (циклогексан/EtOAc; 3/7): 0,42
Пример 15:
9-(3-Этокси-4-гидроксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1Н ЯМР (400 МГц, CDCl3): δ: 0.99 (s, 6H); 1.09 (s, 6H); 1.40 (t, 3H); 2.20 (m, 4H); 2.46 (s, 4H); 4.13 (s, 2H); 4.64 (s, 1H); 5.56 (s, 1H); 6.56 (dd, 1H); 6.73 (d, 1H); 6.98 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 14.79; 27.21; 29.22; 31.21; 32.11; 40.76; 50.69; 64.22; 113.05; 113.78; 115.71; 119.82; 136.26; 144.02; 145.07; 162.00; 196.52.
MC (ИЭР+) 4,112 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,50
Пример 16:
9-(3-Хлор-4-гидрокси-5-метоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 1.00 (s, 6H); 1.10 (s, 6H); 2.20 (m, 4H); 2.47 (s, 4H); 3.90 (s, 3H); 4.64 (s, 1 H); 5.73 (s, 1 H); 6.61 (d, 1 H); 6.97 (d, 1 H).
13C ЯМР (100 МГц, CDCl3): δ: 27.34; 29.18; 31.33; 32.20; 40.80; 50.71; 56.29; 111.18; 115.21; 118.82; 120.41; 136.59; 140.44; 146.72; 162.37; 196.55.
МС (ИЭР+): 431,1 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,48
Пример 17:
9-(3-Бром-4-гидрокси-5-метоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 1.00 (s, 6H); 1.10 (s, 6H); 2.20 (m, 4H); 2.47 (s, 4H); 3.90 (s, 3H); 4.64 (s, 1H); 5.80 (s, 1H); 6.74 (d, 1H); 7.01 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 27.31; 29.17; 31.25; 32.19; 40.78; 50.69; 56.26; 107.57; 111.84; 115.19; 123.17; 137.19; 141.50; 146.50; 162.36; 196.55.
MC (ИЭР+): 475,0 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,37
Пример 18:
9-(4-Гидрокси-3-йод-5-метоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 1.00 (s, 6H); 1.10 (s, 6H); 2.20 (m, 4H); 2.47 (s, 4H); 3.89 (s, ЗН); 4.61 (s, 1 H); 6.00 (s, 1 H); 6.92 (d, 1 H); 7.04 (d, 1 H).
13C ЯМР 100 МГц, CDCl3): δ: 27.25; 29.19; 31.03; 32.18; 40.76; 50.67; 56.15; 80.60; 112.78; 115.20; 128.93; 138.05; 144.07; 145.35; 162.30; 196.54.
MC (ИЭР+): 523,1 [M+H]+
Rf (циклогексан/EtOAc; 1 /1): 0,47
Пример 19:
9-(3,4-Дигидрокси-5-метоксифенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
1H ЯМР (400 МГц, CDCl3): δ: 1.00 (s, 6H); 1.10 (s, 6H); 2.17 (m, 4H); 2.45 (s, 4H); 3.85 (s, 3H); 4.64 (s, 1H); 5.47 (s, 2H); 6.31 (d, 1H); 6.65 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 27.40; 29.06; 31.33; 32.10; 40.73; 50.66; 55.97; 104.89; 107.54; 115.55; 131.04; 135.94; 143.68; 146.35; 162.23; 196.84.
MC (ИЭР+): 413,2 [M+H]+
Rf (циклогексан/EtOAc; 3/7): 0,66
Пример 20:
(3R,4S,5S)-2-(ацетоксиметил)-6-(2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенокси)тетрагидро-2Н-пиран-3,4,5-триилтриацетат
Продукт получен согласно общему методу А из гликозилированного ванилина, синтез которого описан в литературе (Chemical and pharmaceutical bulletin, 51 (11), 1268-1272; 2003).
Продукт получают после очистки на силикагеле в форме белого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ: 0.97 (s, 3H); 1.02 (s, 3H); 1.10 (s, 3H); 1.11 (s, 3H); 2.02 (s, 3H); 2.03 (s, 3H); 2.05 (s, 3H); 2.06 (s, 3H); 2.21 (m, 4H); 2.45 (m, 4H); 3.71 (m, 1H); 3.81 (s, 3H); 4.11 (dd, 1H); 4.25 (dd, 1H); 4.69 (s, 1H); 4.88 (d, 1H); 5.13 (dd, 1H); 5.24 (m, 2H); 6.64 (dd, 1H); 6.92 (d, 1H); 6.99 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 20.56; 20.61; 20.68; 26.85; 27.13; 27.30; 29.25; 31.47; 32.12; 32.15; 40.79; 50.67; 50.70; 55.94; 61.86; 68.40; 71.14; 71.69; 72.60; 100.69; 113.85; 115.33; 115.54; 119.74; 120.05; 140.99; 144.29; 150.09; 162.13; 162.46; 169.38; 169.39; 170.23; 170.61; 196.42; 196.64.
MC (APCI+): 727,2 [M+H]+
Пример 21:
9-(3-Метокси-4-((3S,4S,5S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-илокси)фенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
Раствор примера 20 в безводном метаноле обрабатывают раствором метилата натрия согласно методу, описанному в приведенной ниже ссылке. Затем продукт получают в форме белого твердого вещества (European Journal of Medicinal Chemistry 43 (2008) 2549-2556).
1H ЯМР (300 МГц, CD3OD): δ: 1.00 (s, 6H); 1.12 (s, 6H); 2.17 (d, 2H); 2.33 (d, 2H); 2.58 (2d, 4H); 3.36 (m, 2H); 3.39 (m, 2H); 3.70 (m, 1H); 3.85 (m, 1H); 3.87 (s, 3H); 4.60 (s, 1H); 4.82(d, 1H); 6.73 (d, 1H); 6.97 (s, 1H); 7.03 (d, 1H).
MC (ИЭР+): 581,1 [M+Na]+
Пример 22:
(3S,4S,5S,6S)-2-(ацетоксиметил)-6-(2-метокси-4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1Н-ксантен-9-ил)фенокси)тетрагидро-2H-пиран-3,4,5-триилтриацетат
Продукт получен в соответствии с методом, описанным для примера 20, из галактозилированного ванилина, синтез которого описан в литературе (European Journal of Medicinal Chemistry, 43 (2008) 166-173).
Продукт получают после очистки на силикагеле в форме белого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ: 0.97 (s, 3H); 1.02 (s, 3H); 1.10(s,3H); 1.11 (s, 3H); 2.00 (s, 3H); 2.02 (s, ЗН); 2.07 (s, ЗН); 2.15 (s, 3H); 2.21 (m, 4H); 2.45 (m, 4H); 3.81 (m, 1H); 3.92 (t, 1H); 4.12 (m, 1H); 4.69 (s, 1H); 4.83 (d, 1H); 5.06 (dd, 1H); 5.43 (m, 2H); 6.63 (dd, 1H);6.92(d, 1H); 6.99(d, 1H).
MC (APCI+): 727,4 [M+H]+, 744,4 [M+NH4].
Пример 23:
9-(3-Метокси-4-((2S,3S,4S,5R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-илокси)фенил)-3,3,6,6-тетраметил-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
Раствор примера 22 в безводном метаноле обрабатывают раствором метилата натрия согласно методу, описанному в приведенной ниже ссылке. Затем продукт получают в форме белого твердого вещества (European Journal of Medicinal Chemistry, 43 (2008) 2549-2556).
1H ЯМР (400 МГц, CDCl3): δ: 0.92 (s, 6H); 1.15 (s, 6H); 2.09 (dd, 2H); 2.11 (dd, 2H); 2.54 (m, 4H); 3.57 (m, 3H); 3.68 (s, 3H); 4.47 (m, 2H); 4.62 (t, 1H); 4.80 (dd, 2H); 4.98 (d, 1H); 6.63 (dd, 1H); 6.72 (d, 1H); 6.91 (d, 1H).
Пример 24:
(3R,4S,5S,6S)-2-(ацетоксиметил)-6-(4-(3,3,6,6-тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)фенокси)тетрагидро-2H-пиран-3,4,5-триилтриацетат
Продукт получен согласно общему методу из глюкозилированного ванилина, синтез которого описан в литературе (Chemical and pharmaceutical bulletin, 51(11), 1268-1272:2003).
Продукт получают после очистки на силикагеле в форме белого твердого вещества.
1H ЯМР (400 МГц, CDCl3): δ: 0.98 (s, 6H); 1.10 (s, 6H); 2.02 (s, 3H); 2.03 (s, 3H); 2.05 (s, 3H); 2.06 (s, 3H); 2.20 (m, 4H); 2.45 (m, 4H); 3.81 (m, 1H); 4.13 (dd, 1H); 4.28 (dd, 1H); 4.70 (s, 1H); 5.01 (d, 1H); 5.14 (dd, 1H); 5.24 (m, 2H); 6.83 (d, 2H); 7.21 (d, 2H).
MC (ИЭР+): 697,3 [M+H]+; 714,3 [M+NH4]+.
Пример 25:
3,3,6,6-Тетраметил-9-(4-((2S,3S,4S,5S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-илокси)фенил)-3,4,5,6,7,9-гексагидро-1H-ксантен-1,8(2H)-дион
Раствор примера 24 в безводном метаноле обрабатывают раствором метилата натрия согласно методу, описанному в приведенной ниже ссылке. Затем продукт получают в форме белого твердого вещества (European Journal of Medicinal Chemistry, 43 (2008) 2549-2556).
1H ЯМР (300 МГц, CD3OD): δ: 0.88 (s, 6H); 1.0 (s, 6H); 2.20 (d, 2H); 2.42 (d, 2H); 2.52 (2d, 4H); 3.20 (m, 2H); 3.28 (m, 4H); 3.57 (dd, 1H); 3.76 (d, 1H); 4.49 (s, 1H); 4.73 (d, 1H); 6.84 (d, 2H); 7.06 (d, 1H).
13C ЯМР (75 МГц, CD3OD): δ: 27.7; 27.8; 29.8; 29.9; 32.7; 33.6; 41.8; 51.9; 62.9; 71.7; 75.3; 78.3; 78.4; 102.7; 117.0; 117.6; 130.9; 140.0; 158.0; 165.4; 199.7.
MC (ИЭР+): 529,3 [M+H]+; 546,3 [M+NH4]+; 551,2 [M+Na]+.
Пример 26:
4-(1,8-Диоксо-3.6-дифенил-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)-1,2-фенилендиацетат
Получен из 3,4-диацетоксибензальдегида.
1H ЯМР (400 МГц, CDCl3): δ: 2.27 (s, 6H); 2.30 (m, 4H); 2.83 (m, 4H); 3.4 (m, 1H);3.5(m, 1H); 4.93 (s, 1H); 7.04 (m, 3H); 7.3 (m, 1H).
MC (ИЭР+): 563,2 [M+H]+
Rf (циклогексан/EtOAc; 1/1): 0,40
Пример 27:
4-(3,3,6,6-Тетраметил-1,8-диоксо-2,3,4,5,6,7,8,9-октагидро-1H-ксантен-9-ил)-1,2-фенилендиацетат
Получен из 3,4-диацетоксибензальдегида.
1H ЯМР (400 МГц, CDCl3): δ: 0.99 (s, 6H); 1.09 (s, 6H); 1.88 (s, 3H); 2.22 (m, 4H); 2. 46 (s, 4H); 4.77 (s, 1H); 7.04 (dd, 1H); 7.20 (d, 1H); 7.22 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 20.62; 27.46; 29.04; 31.08; 32.17; 40.77; 50.59; 115.03; 122.62; 122.88; 126.55; 140.34; 141.61; 142.58; 162.50; 167.91; 168.16; 196.50.
МС(ИЭР+): 467,1 [M+H]+
Rf (циклогексан/EtOAc; 3/7): 0,38
2) Экспериментальный протокол теста
А) Тест количественного анализа меланина в клетках B16-F10:
Принцип:
Данный тест включает тест на измерение синтеза меланина с помощью колориметрического анализа на клеточной линии меланомы мыши: линии B16-F10. Данный тест дает возможность оценить депигментирующую эффективность активных ингредиентов.
Клетки B16-F10 культивируют в 96-луночных планшетах в среде DMEM (среде Игла, модифицированной Дульбекко) с добавлением ФСТ (фетальной сыворотки теленка) и инкубируют 24 часа при 37°C, 5% CO2. Затем клетки стимулируют 0,1 мкМ α-МСГ (меланоцит-стимулирующего гормона) (для стимуляции синтеза меланина, наблюдаемая стимуляция составляет примерно 150%) и обрабатывают в течение 72 часов тестируемыми активными ингредиентами. Каждую концентрацию активного ингредиента тестируют по меньшей мере в трех повторах. Затем анализируют суммарный меланин, а затем внутриклеточный меланин, растворенный в буфере для лизиса, путем считывания поглощения при 405 нм. Суммарные белки анализируют в лизате, и результаты выражают в мг меланина/мг белков. Процент активности вычисляют, как описано ниже:
Отрицательное значение указывает на ингибирование, тогда как положительное значение указывает на индукцию синтеза меланина.
- Общие условия эксперимента:
- Оборудование:
- CO2 инкубатор клеток (Heraeus), Oven, Centrifuge (Heraeus), вытяжной шкаф с ламинарным потоком воздуха, 96-луночные планшеты с прозрачным дном
- Falcon, стерильные наконечники - Treff Lab, Polylabo, Mithras LB940 (Berthold Technologies) - 154/MIPA/003
- Биологическое оборудование:
- Клеточная линия B16-F10 между P10 и P20 (меланоциты мыши) (ATCC, CRL-6475)
- Реагенты
- DMEM без фенолового красного (gibcobrl, 31053-028), 200 мМ добавки Glutamax-l (GIBCOBRL, 35050-038), D-ФСБ (фосфатно-солевой буфер) (GIBCOBRL, 14190-094), фетальная сыворотка теленка (Invitrogen, 10270-098), Трипсин-ЭДТА (GIBCOBRL, 25300-054), NaOH (Sigma, S8045-500G), ДМСО (Sigma, 471267-1 L), Nle, Phe - меланоцит-стимулирующий гормон (Sigma, M-8764), меланин (Sigma, M-0418), BCA-COPPER (SIGMA, B9643 и C2284), БСА (бычий сывороточный альбумин) (SIGMA, P0914);
В) Тест для исследования антиоксидантной способности с помощью хемилюминесценции (Photochem Analytik Jena)
- Принцип:
Данный тест используют для определения антиоксидантной способности молекул. Он представляет собой метод, с помощью которого образуют свободные радикалы посредством фотохимического сигнала. Интенсивность окисления в 1000 раз выше, чем полученная в нормальных условиях.
Определение осуществляют с помощью хемилюминесценции. Оно дает возможность оценки водорастворимых и жирорастворимых антиоксидантных молекул или экстрактов.
Результаты выражают соответственно в эквивалентном количестве витамина С или тролокса (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты). Чувствительность составляет порядка наномоля.
Антиоксидантная активность, исследуемая в данном тесте, представляет собой способность специфично улавливать анионы супероксида путем хемилюминесценции.
Количественные результаты выражают в эквиваленте тролокса (стандарта), то есть в "мкг продукта на 1 мкг тролокса". Это означает, что количество x образца требуется для получения активности, эквивалентной активности, определенной на 1 мкг стандарта. Это количество представляет собой антиоксидантную эффективность относительно стандарта, которую можно определить независимо от тестируемой концентрации.
- Образование окисленных свободных радикалов:
Супероксидный радикал: O 2 ∘ − образуется в результате фотохимической реакции:
L + h v ( U V ) + O 2 → L * O 2 → L ∘ + + O 2 ∘ −
L*: люминоп в возбужденном состоянии
L ∘ + : радикал люминола
- Обнаружение сигнала:
Часть супероксидных анионов гасится антиоксидантами. Оставшиеся свободные радикалы количественно определяют с помощью хемилюминесценции.
L ∘ + + O 2 ∘ − → N 1 + A P * 2 − → A P 2 − + h v (люминесценция)
AP*2-: аминофталат в возбужденном состоянии
| Название | Условия | Фотосенсибилизация | Антиоксидант |
| Чистый контроль | Образуется 100% O 2 ∘ − | + | - |
| Стандарты | Диапазон стандарта: от 1 до 3 нмоль | + | Витамин C или тролокс |
| Тест | Образуется + / − O 2 ∘ − | + | Тестируемая молекула x |
3) Экспериментальные результаты теста
A) Тест количественного определения меланина в клетках B16-F10:
Результаты приведены в кратком изложении в таблице 1 ниже.
- Интерпретация результатов:
IC50 представляет собой концентрацию, для которой наблюдают 50% ингибирование синтеза меланина.
Можно наблюдать, что большинство тестируемых соединений обладает хорошей способностью к ингибированию синтеза меланина. Соединения согласно изобретению обладают хорошей депигментирующей активностью.
B) Тест на исследование антиоксидантной способности с помощью хемилюминесценции (Photochem Analytik Jena)
Результаты также приведены в кратком изложении в таблице 1 ниже.
Большинство соединений обладает хорошей антиоксидантной активностью. Шкала интерпретации результатов приведена ниже:
| Продукты | мкг образца на 1 мкг тролокса | Активность |