Способ получения гидроксида бериллия из бериллийсодержащих концентратов
Иллюстрации
Показать всеИзобретение относится к области получения соединений бериллия, а именно гидроксида бериллия, широко используемого в производстве металлического бериллия, медно-бериллиевой лигатуры, керамики из оксида бериллия и солей бериллия. Описан способ получения гидроксида бериллия из бериллийсодержащих концентратов путем воздействия на них концентрированным раствором гидроксида натрия, отделением раствора от кека, где после отделения раствора от кека проводят двухступенчатую электрохимическую нейтрализацию избытка щелочи в анодных камерах электролизеров с выделением нерастворимого осадка гидроксидов железа и марганца после первой стадии при концентрации щелочи 170-180 г/дм3, отделяют осадок гидроксида бериллия, образующийся в результате гидролиза бериллата натрия после второй стадии нейтрализации щелочи до концентрации 30 г/дм3, а раствор гидроксида натрия укрепляют до концентрации 400-600 г/дм3, требуемой для вскрытия концентрата, при прохождении его через катодные камеры электролизеров, отделенные от анодных катионообменными мембранами, с компенсацией потерь щелочи добавлением твердого гидроксида натрия, где расход тока на электрохимическую нейтрализацию щелочи в анодных камерах электролизеров на первой стадии составляет не менее 188 А·ч/дм3, а на 2-й стадии - не менее 93,8 А·ч/дм3. Технический результат заключается в снижении энергозатрат, сокращении расхода воды, организации замкнутого водооборота, исключении сброса жидких отходов на хвостохранилище и снижении нагрузки на окружающую среду. 2 з.п. ф-лы, 2 ил., 1 табл., 2 пр.
Реферат
Изобретение относится к области получения соединений бериллия, а именно гидроксида бериллия, широко используемого в производстве металлического бериллия, медно-бериллиевой лигатуры, керамики из оксида бериллия и солей бериллия.
Известен ряд методов, описанных в источнике [Блешинский С.В., Абрамова В.Ф., Дружинин И.Г. Химия бериллия. Фрунзе: Академия наук Киргизской ССР, 1955. С. 193]:
- измельченный берилл обрабатывают концентрированным раствором едкого натра, взятым по отношению к бериллу в количестве 1,2-3 весовых частей. При перемешивании массы в течение нескольких часов при температуре 100-400°С берилл разлагается;
- разложение берилла проводят путем обработки раствором едкого натра с концентрацией 50-75% при температуре 175-185°С. Щелок разбавляют водой;
- сплавление измельченной берилловой руды со щелочами с последующим растворением плава в воде.
Известен способ [пат. 2264986 РФ, МПК C01F 3/02] получения гидроксида бериллия из бериллийсодержащих концентратов путем воздействия гидроксида натрия с последующим разделением продуктов реакции. Концентрат или смесь концентратов обрабатывают в автоклаве гидроксидом натрия с концентрацией 400-450 г/дм3 в присутствии оксида кальция при мольном отношении СаО:SiO2=1,1-1,3, температуре 250-260°С и отношении Na2O:ВеО=12-13 в течение 4-5 ч.
Практически эти же параметры вскрытия бертрандит-фенакитового концентрата приведены в отчете [Разработка щелочно-автоклавной очистки бериллиево-флюоритового продукта от фтора и технологии переработки бериллиевого концентрата Ермаковского месторождения с выделением и очисткой гидроксида бериллия: Отчет НИР/ФГУП «ВНИИХТ»; Руководитель М.Л. Коцарь; Инв № ТИ/3506, 2006].
Отчет принят за прототип, поскольку содержит наиболее полные данные, как по технологии щелочного автоклавного вскрытия бериллийсодержащих концентратов, так и дальнейшей переработки растворов бериллата натрия с получением гидроксида бериллия.
Как указано в отчете, оптимальными условиями щелочного автоклавного разложения бертрандит-фенакитового концентрата являются:
- концентрация NaOH - 450 г/дм3;
- каустический модуль Na2O/BeO ~12;
- мольное отношение CaO/SiO2=1,2;
- температура 260°С;
- продолжительность обработки - 4 ч;
- промывка нерастворимого остатка при соотношении Ж:Т=3,5-3,9 при температуре 60°С в течение 0,5 ч.
Технологический раствор после отделения нерастворимого остатка разбавляют конденсатом до остаточной щелочности 170-180 г/дм3 (~ в 2,6 раза), после чего обрабатывают пероксидом водорода для окисления железа и марганца с последующим отделением выделившегося осадка указанных примесей.
Очищенный раствор бериллата натрия разбавляют конденсатом до остаточной концентрации NaOH 29-30 г/дм3 (~ в 5,9 раза), нагревают острым паром до кипения и выдерживают при этой температуре в течение 1 ч. Выделившийся в результате гидролиза гидроксид бериллия отфильтровывают и промывают конденсатом от избытка щелочи. Маточный раствор с концентрацией NaOH ~30 г/дм3 вместе с промывным раствором выпаривают до концентрации NaOH=450 г/дм3 и после отделения содового осадка фильтрованием возвращают на операцию вскрытия концентрата. Извлечение бериллия в гидроксид по данному способу составляет 97-98%.
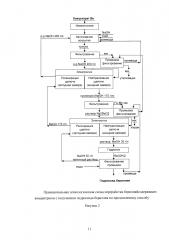
Принципиальная технологическая схема переработки концентратов по способу-прототипу приведена на рисунке 1.
Недостатками указанного способа, принятого за прототип, являются:
- большой расход воды - разбавление в 15 раз основного технологического раствора 450 до 30 г/дм3 NaOH и необходимость ее последующего выпаривания из маточных растворов после выделения гидроксида бериллия с целью концентрирования щелочи с 30 до ~450 г/дм3 NaOH и возврата ее на операцию вскрытия новой порции концентрата. Процесс выпаривания связан со значительными затратами энергии (0,626 кВт·ч/кг воды);
- большое обводнение технологического процесса получения гидроксида бериллия в целом за счет образования в процессе выпарки конденсатов сокового и греющего пара, что предполагает сброс избытка растворов, не замкнутых в технологическом цикле, на хвостохранилище. Это создает дополнительную нагрузку на окружающую среду;
- необходимость применения реагента (пероксида водорода) для очистки технологического раствора от примесей железа и марганца;
- необходимость организации участка фильтрования и промывки от избытка щелочи содового осадка, образующегося в процессе выпаривания щелочного раствора (карбонизация щелочи).
Техническим результатом предлагаемого способа являются снижение энергозатрат, сокращение расхода воды, организация замкнутого водооборота, исключение сброса жидких отходов на хвостохранилище и снижение нагрузки на окружающую среду.
Технический результат данного изобретения достигается за счет того, что в способе получения гидроксида бериллия из бериллийсодержащих концентратов путем воздействия на них концентрированных растворов гидроксида натрия с последующим отделением раствора от кека проводят двухступенчатую электрохимическую нейтрализацию избытка щелочи в анодных камерах электролизеров с выделением нерастворимого осадка гидроксидов железа и марганца между стадиями при концентрации щелочи 170-180 г/дм3, отделяют осадок гидроксида бериллия, образующийся в результате гидролиза бериллата натрия после второй стадии нейтрализации щелочи, а раствор укрепляют до концентрации, требуемой для вскрытия концентрата при прохождении его через катодные камеры электролизеров с компенсацией потерь щелочи добавлением твердого гидроксида натрия.
Расход тока на электрохимическую нейтрализацию щелочи в анодных камерах электролизеров на первой стадии составляет не менее 188 А·ч/дм3, а на 2-й стадии - не менее 93,8 А·ч/дм3. Катодные и анодные камеры электролизеров разделены катионообменными мембранами.
Снижение энергозатрат на получение гидроксида бериллия достигается за счет проведения электрохимической нейтрализации щелочи в анодных камерах электролизеров с параллельной ее регенерацией в катодных камерах и исключения разбавления технологического раствора водой до 30 г/дм3 и последующего выпаривания маточных растворов, образующихся после гидролиза бериллата натрия, до исходной концентрации с целью дальнейшего использования их на операции вскрытия концентрата.
В предлагаемом способе упрощается аппаратурное оформление технологического процесса за счет ликвидации участков выпаривания растворов, фильтрования и промывки соды.
Водород, выделяющийся в катодных камерах электролизеров, может быть аккумулирован геттерами-накопителями водорода на основе интерметаллических соединений (ИМС), например LaNi5, Zr3Al2, ZrNi, или использован для получения пара (при сжигании 1 м3 водорода выделяется 3,55 кВт·ч энергии) с последующим применением его для нагрева технологических растворов и пульп в производстве бериллия.
При проведении электрохимической нейтрализации щелочи в анодной камере электролизера происходит снижение концентрации ионов гидроксила за счет их разряда на положительно заряженном аноде с превращением в воду и образованием кислорода:
4 ОН--4 е-=O2↑+2 H2O.
Снижение содержания ионов ОН- согласно закону Фарадея пропорционально расходу тока. При пропускании 26,8 А·ч содержание NaOH снижается на 1 моль-экв. При этом в раствор не вносится никаких дополнительных реагентов. Более того, отпадает необходимость использования пероксида водорода для очистки технологического раствора от примесей железа и марганца, поскольку их окисление осуществляется кислородом, выделяющимся в анодной камере электролизера.
В катодной камере электролизера протекает обратный процесс образования гидроксильных ионов с одновременным выделением водорода на катоде:
2 H2O+2 е-=Н2↑+2 ОН-.
Таким образом происходит регенерация реагента (щелочи).
Для предотвращения миграции образующихся на катоде гидроксильных ионов к аноду электродные камеры разделены катионообменными мембранами, через которые проходят от анода к катоду ионы натрия.
Проведение электрохимической нейтрализации щелочи в две стадии определяется необходимостью очистки технологического раствора от железа и марганца перед выделением гидроксида бериллия. На 1-й стадии электрохимической нейтрализации в анодной камере содержание щелочи снижают до 170-180 г/дм3, после чего отфильтровывают выделившийся осадок гидроксидов железа и марганца, затем проводят 2-ю стадию электрохимической нейтрализации NaOH до ≈ 30 г/дм3. Данная концентрация щелочи необходима для достижения наиболее полного выделения гидроксида бериллия при гидролизе бериллата натрия, который проводится при температуре кипения раствора в течение 1 ч:
Na2BeO2+2 H2O→Ве(ОН)2↓+2 NaOH.
Предлагаемый способ электрохимической нейтрализации щелочного раствора и регенерации реагента может быть использован при переработке отходов металлического бериллия.
Исходный фенакит-бертрандитовый концентрат после измельчения до крупности 0,05 мм (95%) в количестве 110 г смешивали с оксидом кальция в соотношении СаО:SiO2=1,2 и подвергали обработке растворами щелочи (концентрация NaOH 400-600 г/дм3, объемом 1 дм3) в автоклаве при температуре 250-260°С в течение 4 ч.
После охлаждения полученную пульпу фильтровали: кек подвергали двукратной отмывке от водорастворимого бериллия, а щелочной раствор использовали для получения гидроксида бериллия по прототипу и предлагаемому способу.
Пример 1. Получение гидроксида бериллия по способу-прототипу
Технологический раствор после отделения нерастворимого остатка разбавляли водой в 2,3-3,4 раза (пропорционально исходной концентрации NaOH) до остаточной щелочности 170-180 г/дм3, после чего обрабатывали пероксидом водорода для окисления железа и марганца с последующим отделением выделившегося осадка указанных примесей.
Очищенный раствор бериллата натрия разбавляли дистиллированной водой в 5,8 раза до остаточной концентрации NaOH ~30 г/дм3, нагревали острым паром до кипения и выдерживали при этой температуре в течение 1 ч. Выделившийся в результате гидролиза гидроксид бериллия отфильтровывали и промывали от избытка щелочи. Маточный раствор с концентрацией NaOH ~30 г/дм3 вместе с промывным раствором выпаривали в 15-20 раз до концентрации NaOH=400-600 г/дм3 и фильтровали для отделения содового осадка.
Пример 2. Получение гидроксида бериллия по предлагаемому способу
Технологический раствор, полученный аналогично прототипу, после отделения нерастворимого остатка направляли в анодную камеру электролизера для проведения 1-й стадии электрохимической нейтрализации щелочи. В ходе эксперимента использовали источник постоянного тока (Б5-46). Материал электродов: анод выполнен из никеля, катод - из нержавеющей стали. Анодные и катодные камеры электролизеров разделены катионообменными мембранами МК-40 на основе сорбента КУ-2. При пропускании постоянного тока в количестве 188 А·ч/дм3 в анодной камере содержание NaOH снижали до ~175 г/дм3. При этом за счет выделения кислорода происходило окисление примесей железа и марганца. Полученную суспензию фильтровали: кек отмывали от водорастворимого бериллия, а раствор направляли в анодную камеру электролизера для проведения 2-й стадии электрохимической нейтрализации щелочи до концентрации NaOH ~30 г/дм3 при пропускании тока в количестве 93,8 А·ч/дм3, после чего раствор бериллата натрия подвергали гидролизу при кипячении в течение 1 ч. Суммарный расход тока за 2 стадии нейтрализации составил 281,4 А·ч/дм3.
Выделившийся осадок гидроксида бериллия отделяли фильтрованием и промывали от избытка щелочи. Маточный раствор после гидролиза направляли в катодную камеру электролизера 2-й стадии, где под действием тока происходил обратный процесс образования гидроксильных ионов. При этом содержание щелочи повышалось до 170-180 г/дм3 NaOH. Полученный раствор направляли в катодную камеру электролизера 1-й стадии нейтрализации, где происходила регенерация реагента до требуемой концентрации (400-600 г/дм3 NaOH).
Технологическая схема получения гидроксида бериллия по предлагаемой схеме приведена на рисунке 2.
Сравнительные результаты переработки бериллийсодержащего концентрата (в расчете на 1 кг бериллия в гидроксиде бериллия)
Как видно из таблицы, наибольшее извлечение бериллия в гидроксид достигается при концентрации щелочи, равной 400-600 г/дм3.
Использование щелочных растворов с концентрацией NaOH меньше 400 г/дм3 нецелесообразно из-за недостаточно высокого извлечения бериллия в гидроксид, а использование щелочных растворов с концентрацией NaOH больше 600 г/дм3 не приводит к значительному увеличению извлечения бериллия в гидроксид и сопряжено с получением технологической суспензии с большой вязкостью, что приводит к дополнительным потерям бериллия с кеком вследствие высокой влажности.
Предложенный способ электрохимической нейтрализации щелочи для проведения гидролиза бериллата натрия с последующей ее регенерацией в катодной камере электролизера обеспечивает значительное (в 17 раз) снижение энергозатрат и сокращение водопотребления в среднем на 3,4 м3/кг бериллия в гидроксиде.
1. Способ получения гидроксида бериллия из бериллийсодержащих концентратов путем воздействия на них концентрированным раствором гидроксида натрия, отделением раствора от кека, отличающийся тем, что после отделения раствора от кека проводят двухступенчатую электрохимическую нейтрализацию избытка щелочи в анодных камерах электролизеров с выделением нерастворимого осадка гидроксидов железа и марганца после первой стадии при концентрации щелочи 170-180 г/дм3, отделяют осадок гидроксида бериллия, образующийся в результате гидролиза бериллата натрия после второй стадии нейтрализации щелочи до концентрации 30 г/дм3, а раствор гидроксида натрия укрепляют до концентрации 400-600 г/дм3, требуемой для вскрытия концентрата, при прохождении его через катодные камеры электролизеров, отделенные от анодных катионообменными мембранами, с компенсацией потерь щелочи добавлением твердого гидроксида натрия, где расход тока на электрохимическую нейтрализацию щелочи в анодных камерах электролизеров на первой стадии составляет не менее 188 А·ч/дм3, а на 2-й стадии - не менее 93,8 А·ч/дм3.
2. Способ по п. 1, отличающийся тем, что водород, выделяющийся при электрохимической регенерации реагента в катодных камерах электролизеров, используют для получения пара и нагрева технологических растворов и пульп в процессе вскрытия исходных концентратов.
3. Способ по п. 1, отличающийся тем, что водород, выделяющийся при электрохимической регенерации щелочи в катодных камерах электролизеров аккумулируют на накопителях водорода и используют для технологических целей.