Устройства мембранного разделения, системы и способы, применяющие указанные устройства, и системы и способы управления данными
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике. Способ идентификации контейнеров для хранения включает загрузку контейнеров для хранения из набора для обработки в устройство обработки крови, извлечение данных идентификации донора и данных контейнеров для хранения из набора для обработки, ассоциирование данных идентификации донора с контейнерами для хранения из набора, обработку цельной крови таким образом, что отделенный продукт крови передается в контейнеры для хранения из набора с генерированием данных контейнера для хранения, проверку данных контейнера для хранения относительно данных идентификации донора и после проверки отсоединение контейнеров для хранения из набора для обработки. Для осуществления способа используется программируемый контроллер, выполненный с возможностью автоматического выполнения или с возможностью запроса выполнения пользователем различных этапов способа. Раскрыты вариант способа и система обработки крови, включающая программируемый контроллер. Изобретения обеспечивают автоматизацию и снижение ошибок при обработке донорской крови. 3 н. 19 з.п. ф-лы, 31 ил., 2 табл.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящая заявка относится, частично, к типу устройств разделения, использующих взаимно вращающиеся поверхности, по меньшей мере одна из которых содержит мембрану для фильтрации компонента от жидкости, проходящей между поверхностями; к контурам и системам потока жидкости, включающим в себя такой сепаратор; и к применению таких систем для отделения биологических клеток, таких как эритроциты, плазма или лейкоциты, от цельной крови, среды для хранения, среды взвеси, супернатанта и т.п.
УРОВЕНЬ ТЕХНИКИ
Традиционное взятие крови продолжает существенно опираться на ручное взятие цельной крови у здоровых доноров на мероприятиях по сдаче крови, при визитах доноров в центры крови или больницы и т.п. При типичном ручном взятии, цельная кровь берется путем ее простого протекания под воздействием силы тяжести и венозного давления из вены донора в контейнер для сбора. Объем забранной цельной крови обычно составляет “единицу”, которая составляет около 450 мл.
Конкретнее, при таком взятии обычно применяется предварительно собранная конструкция трубок и контейнеров или пакетов, включая первичный контейнер из эластичного пластика или пакет для приема единицы цельной крови от донора и один или более вспомогательных контейнеров или пакетов. Кровь сначала собирается в первичный контейнер, который также содержит противосвертывающее средство (обычно содержащее цитрат натрия, фосфат и декстрозу - часто называемое CPD). Консервант (часто называемый “раствор добавки” или AS, и обычно содержащий среду из физиологического раствора, аденина и глюкозы, которая называется SAG) может быть включен в качестве элемента большей по размеру конструкции пакетов и трубок, которые используются при обработке после сбора крови.
После сбора единицы цельной крови общепринятой практикой в банках крови является транспортировка единицы цельной крови, с помощью подсоединенных трубок и контейнеров, в лабораторию обработки компонентов крови, обычно называемую “вспомогательная лаборатория”, для дальнейшей обработки. Дальнейшая обработка обычно включает в себя ручную загрузку первичного контейнера и связанных с ним трубок и вспомогательных контейнеров в центрифугу для разделения цельной крови на компоненты, такие как концентрированные эритроциты и обогащенная тромбоцитами плазма или обедненная тромбоцитами плазма. Данные компоненты затем вручную отжимаются из первичного контейнера в другие предварительно подсоединенные вспомогательные контейнеры, и могут опять центрифугироваться для выделения тромбоцитов из плазмы. После этого компоненты крови могут подвергаться лейкоредукции посредством фильтрации для дальнейшей обработки или хранения. Коротко говоря, данный процесс требует больших временных затрат, является трудоемким и подвержен возможным ошибкам, связанным с человеческим фактором.
Другой типовой задачей, выполняемой банками крови и центром переливания крови, является “промывание клеток”. Оно может выполняться с целью удаления и/или замещения жидкой среды (или ее части), в которой суспендированы клетки, с целью концентрирования или дальнейшего концентрирования клеток в жидкой среде, и/или с целью очистки взвеси клеток путем удаления нежелательного клеточного или другого материала.
В предшествующих системах промывания клеток чаще всего применялось центрифугирование взвеси клеток, слив суперанатанта, ресуспендирование концентрированных клеток в новых средах, а также возможное повторение данных этапов до тех пор, пока клетки во взвеси не будут представлены в достаточно высокой или желательной по другим признакам концентрации. Центробежные сепараторы, используемые в обработке крови и компонентов крови, обычно использовались в таких способах промывания клеток.
Данные процессы также требуют достаточно больших временных затрат, поскольку требуют повторяющихся ручных манипуляций с кровью или компонентами крови и сборки или разборки различных устройств обработки жидкостей. Это, естественно, повышает не только стоимость, но и потенциал для связанной с человеческим фактором ошибки или погрешности. Соответственно, несмотря на десятилетия развития устройств и процессов разделения крови, продолжает существовать потребность в лучших и/или более эффективных устройствах, системах и способах разделения, применимых к базовым методикам взятия и обработки крови.
Хотя во многих предшествующих устройствах и процедурах разделения крови применялись принципы разделения центрифугированием, существует другой класс устройств, основанных на применении мембран, которые использовались для плазмафереза, то есть отделения плазмы от цельной крови. Конкретнее, устройства этого типа используют вращающиеся друг относительно друга поверхности, одна из которых содержит пористую мембрану. Обычно устройство имеет внешний неподвижный корпус и внутренний вращающийся ротор, покрытый пористой мембраной.
Одним из таких хорошо известных устройств для плазмафереза является сепаратор Autopheresis-C®, поставляемый Fenwal, Inc. из Lake Zurich, штат Иллинойс. Подробное описание сепаратора с вращающейся мембраной можно найти в патенте США No. 5194145, выданном Schoendorfer, который включен в настоящее описание посредством ссылки. В данном патенте описывается покрытый мембраной вращатель, имеющий внутреннюю систему сбора, размещенную в неподвижной оболочке. Кровь подается в кольцевое пространство или зазор между вращателем и оболочкой. Кровь перемещается вдоль продольной оси оболочки в направлении выходной области, при этом плазма проходит через мембрану за пределы оболочки в пакет для сбора. Оставшиеся компоненты крови, в основном, эритроциты, тромбоциты и лейкоциты, переходят в выходную область между вращателем и оболочкой, и затем обычно возвращаются донору.
Было обнаружено, что сепараторы с вращающейся мембраной обеспечивают отличную скорость фильтрации плазмы, в основном благодаря уникальным схемам потока (“вихри Тейлора”), возбуждаемым в зазоре между вращающейся мембраной и оболочкой. Вихри Тейлора помогают удерживать клетки крови от осаждения на мембрану и ее загрязнения или закупоривания.
Несмотря на то, что сепараторы с вращающейся мембраной широко использовались для сбора плазмы, они обычно не использовались для сбора других компонентов крови, в частности, эритроцитов. Сепараторы с вращающейся мембраной также обычно не использовались для промывания клеток. Один из примеров сепаратора с вращающейся мембраной, примененного для промывания клеток, таких как эритроциты, описан в патенте США No. 5053121, который также включен в настоящее описании посредством ссылки во всей своей полноте. Однако в системе, описанной в этом патенте, используется два отдельных вращателя, соединенных последовательно или параллельно, для промывания “выделенной” крови пациента. Другие описания применения сепараторов с вращающейся мембраной для разделения крови или компонентов крови, также можно найти в патентах США No. 5376263; 4776964; 4753729; 5135667 и 4755300.
Объект изобретения, изложенный в настоящей заявке, предоставляет дополнительные достижения в области мембранных сепараторов, потенциального снижения стоимости и различных других достижений и преимуществ по сравнению с предшествующим ручным сбором и обработкой крови.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящий объект изобретения имеет ряд аспектов, которые могут быть применены в различных комбинациях, и изложение одного или более конкретных вариантов осуществления приведено в целях изложения и описания, а не ограничения. В изложении сущности выделено только несколько аспектов данного объекта изобретения, и дополнительные аспекты изложены на чертежах и в приведенном ниже более подробном описании.
В соответствии с одним из аспектов настоящего изобретения, изложен способ для предоставления информации идентификации для одного или более контейнеров для хранения из набора для обработки для продукта крови во время обработки некоторого количества цельной крови, содержащегося в контейнере для сбора, на основании данных идентификации донора, которые могут быть ассоциированы с контейнером для сбора, если обработка собранной крови выполняется отдельно. При таких обстоятельствах способ включает в себя этапы загрузки контейнера для сбора и одного или более контейнеров для хранения из набора для обработки в устройство обработки крови; извлечения данных из контейнера для сбора и одного или более контейнеров для хранения из набора для обработки; ассоциирования данных для контейнера для сбора с одним или более контейнерами для хранения из набора для обработки; обработки цельной крови в контейнере для сбора таким образом, что отделенный продукт крови передается в один или более контейнеров для хранения из набора для обработки; проверка данных контейнеров для хранения относительно данных контейнера для сбора; и отсоединение одного или более контейнеров для хранения из набора для обработки от контейнера для сбора. Альтернативно, если обработка выполняется одновременно со сбором цельной крови у донора, то данные идентификации донора получают непосредственно у донора, поскольку контейнер для сбора не используется.
В соответствии с родственным аспектом, в способе применяется система обработки крови, имеющая пользовательский интерфейс, и способ включает в себя этапы запроса у пользователя загрузки контейнера для сбора и одного или более контейнеров для хранения из набора для обработки в устройство обработки крови; запроса у пользователя извлечения информации идентификации для одного или более контейнеров для сбора из набора для обработки; запроса у пользователя извлечения данных идентификации, ассоциированных с контейнером для сбора; ассоциирование данных идентификации донора с одним или более контейнерами для хранения из набора для обработки; обработки крови в контейнере для сбора с получением продукта крови в одном или более контейнерах для хранения из набора для обработки; запроса у пользователя извлечения информации идентификации, ассоциированной с контейнерами для хранения из набора для обработки, и сравнение ее с данными идентификации для контейнера для сбора с целью проверки данных контейнера для хранения; и после проверки правильности информации идентификации, запроса у пользователя отсоединения одного или более контейнеров для хранения из набора для обработки от контейнера для сбора. И в этом случае также, если обработка выполняется одновременно со сбором цельной крови у донора, то данные идентификации донора получают непосредственно у донора, поскольку контейнер для сбора не используется.
В соответствии с данными способами, контейнер для сбора может являться частью объединенной системы, включающей в себя один или более контейнеров для хранения из набора для обработки. Альтернативно, контейнер для сбора может вначале находиться отдельно от одного или более контейнеров для хранения из набора для обработки, и может подсоединяться к набору для обработки после сбора цельной крови в контейнер для сбора.
В соответствии с данными способами, данные идентификации могут быть ассоциированы со штрихкодом, ассоциированы с меткой RFID, или и со штрихкодом, и с меткой RFID. Кроме того, данные идентификации для контейнера для сбора могут содержать один или более элементов из идентификатора донора, типа контейнера, даты истечения срока годности, времени сбора, объема сбора, идентификатора медсестры и места сбора.
В другом аспекте, представлена система обработки крови для обработки цельной крови или компонента цельной крови, содержащегося в исходном контейнере, в которой система обработки сконфигурирована для приема контура обработки потока, который включает в себя один или более контейнеров для хранения и включает в себя контроллер с пользовательским интерфейсом, который запрограммирован для способствования предоставлению информации идентификации по одному или более контейнерам для хранения контура обработки на основании данных идентификации донора, ассоциированных с исходным контейнером. Контроллер сконфигурирован для запроса у пользователя загрузки контейнера для сбора и одного или более контейнеров для хранения из контура обработки в систему обработки крови; запроса у пользователя извлечения информации идентификации для одного или более контейнеров для хранения из набора для обработки; запроса у пользователя извлечения данных идентификации донора, ассоциированных с исходным контейнером; ассоциирования данных идентификации донора с одним или более контейнерами для хранения; переработки жидкости в исходном контейнере в продукт крови, который принимают один или более контейнеров для хранения контура обработки; и сравнения данных идентификации донора и данных контейнера для хранения или запроса у пользователя извлечения информации идентификации, ассоциированной с контейнерами для хранения контура обработки, и сравнение ее с данными идентификации донора с целью проверки данных контейнера для хранения.
В другом аспекте, контроллер может быть сконфигурирован для создания по меньшей мере одной этикетки для прикрепления к одному или более контейнерам для хранения. Дополнительно, контроллер может находиться в устройстве разделения крови, или может находиться в устройстве стерильного соединения для соединения исходного контейнера с контуром обработки жидкостного потока. Дополнительно, система обработки крови может содержать запоминающее устройство для хранения данных идентификации донора и/или пользовательский интерфейс для ввода данных пользователем.
Исходный контейнер для системы обработки крови также может содержать некоторое количество ранее собранной цельной крови, или он может содержать кровь или компоненты крови, при этом обработка жидкости включает в себя этап промывания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Указанные и другие характеристики объекта настоящего изобретения описаны в приведенном ниже подробном описании и показаны на прилагаемых чертежах, среди которых:
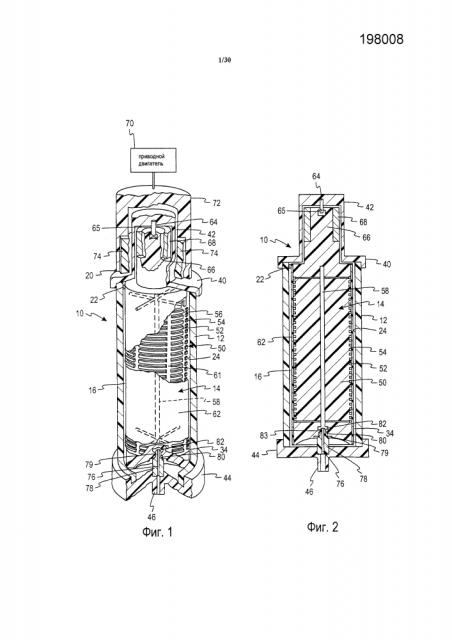
Фиг. 1 представляет собой вид в перспективе сепаратора с вращающейся мембраной, в парциальном сечении и с удалением частей для демонстрации деталей.
Фиг. 2 представляет собой продольный вид в поперечном сечении сепаратора с вращающейся мембраной с фиг. 1.
Фиг. 3 представляет собой контурное изображение выходных значений гематокрита и напряжения сдвига на стенке выходного клапана как функции относительной длины фильтрации и радиуса вращателя на основании теоретической проектной модели.
Фиг. 4 представляет собой контурное изображение выходных значений гематокрита и концентрации гемоглобина в плазме для выходного клапана как функции относительной длины фильтрации и радиуса вращателя на основании теоретической проектной модели, в которой тангенциальная скорость мембраны является постоянной.
Фиг. 5 представляет собой контурное изображение выходных значений гематокрита и числа Тейлора как функции относительной длины фильтрации и радиуса вращателя на основании теоретической проектной модели.
Фиг. 6 представляет собой трехмерный график концентрации гемоглобина в плазме как функции относительной длины фильтрации и радиуса вращателя на основании теоретической проектной модели.
Фиг. 7 представляет собой вид в перспективе устройства или сепаратора с вращающейся мембраной по настоящей заявке.
Фиг. 8 представляет собой схематический поперечный разрез сепаратора с вращающейся мембраной по настоящей заявке, при этом вращатель содержит радиально направленный выступ для задания отдельных областей жидкости.
Фиг. 9 представляет собой схематическое изображение автоматизированной системы разделения цельной крови для обработки ранее собранной цельной крови, содержащей одноразовый модуль контура циркуляции жидкости и долговременный контроллер или управляющий модуль, на который установлен модуль контура циркуляции жидкости.
Фиг. 10 представляет собой схему циркуляции, демонстрирующую один из вариантов осуществления потока жидкости через контур циркуляции жидкости, в соответствии с описанным в настоящем описании, для переработки единицы цельной крови в концентрированный продукт эритроцитов и продукт плазмы.
Фиг. 11 аналогична фигуре 9, но демонстрирует несколько более подробное изображение компонентов одноразового контура, или модуля циркуляции жидкости, и долговременного модуля контроллера.
Фиг. 12 представляет собой схематическое изображение альтернативного варианта осуществления системы в соответствии с настоящим изложением, в котором система применяется для разделения ранее собранной цельной крови.
Фиг. 12A представляет собой схематическое изображение еще одного альтернативного варианта осуществления, аналогичного фиг. 12.
Фиг. 13 представляет собой вид в перспективе системы разделения крови с двумя насосами, такой как показана на фиг. 9, 11, 12 и 12A.
Фиг. 14 представляет собой схематическое изображение еще одной альтернативы, аналогичной фиг. 12, за исключением того, что она включает в себя три насоса, иллюстрирующей систему в фазе заполнения.
Фиг. 15 представляет собой схематическое изображение системы с фиг. 14, иллюстрирующее систему в фазе разделения.
Фиг. 15A представляет собой схематическое изображение еще одной альтернативной системы с тремя насосами, аналогичной фиг. 14 и 15.
Фиг. 16 представляет собой схематическое изображение автоматизированной системы сбора цельной крови в соответствии с настоящим изложением, демонстрирующее конфигурацию системы для автоматизированного кабинетного сбора и обработки цельной крови донора в режиме заполнения.
Фиг. 17 представляет собой схематическое изображение системы с фиг. 16, демонстрирующее конфигурацию системы для сбора и разделения цельной крови на эритроциты и плазму.
Фиг. 18 представляет собой схематическое изображение системы с фиг. 16, демонстрирующее конфигурацию системы для прополаскивания системы противосвертывающим средством после завершения взятия крови у донора.
Фиг. 19 представляет собой схематическое изображение системы с фиг. 16, демонстрирующее конфигурацию системы в конце процедуры сбора крови.
Фиг. 20 представляет собой схематическое изображение системы с фиг. 16, демонстрирующее конфигурацию системы в необязательной конфигурации для фильтрации собранных эритроцитов через лейкоцитный фильтр.
Фиг. 21 представляет собой схематическое изображение альтернативного варианта осуществления автоматизированной системы сбора цельной крови относительно систем, показанных на фиг. 16-20, в которой компонент контура циркуляции жидкости одноразового использования содержит встроенный фильтр лейкоредукции как часть линии извлечения устройства доступа к донору.
Фиг. 22 представляет собой схематическое изображение альтернативного варианта осуществления контура циркуляции жидкости одноразового использования с фиг. 21, в котором фильтр лейкоредукции размещен в линии извлечения по ходу потока относительно входной точки, в которой противосвертывающее средство вводится в цельную кровь.
На фиг. 23 показан одноразовый набор, подходящий для промывания клеток в соответствии со способом, изложенным в настоящем описании.
На фиг. 24 показан другой вариант осуществления одноразового набора, подходящего для промывания клеток в соответствии с альтернативным способом, изложенным в настоящем описании.
На фиг. 25 показан вариант осуществления панели управления устройства, подходящего для промывания клеток в соответствии со способом, изложенным в настоящем описании.
Фиг. 26-28 представляют собой блок-схемы этапов способа промывания клеток, изложенного в настоящем описании.
Фиг. 29 представляет собой блок-схему, иллюстрирующую способ управления данными в соответствии с настоящим изложением.
Фиг. 30 представляет собой схематическое изображение системы управления данными в соответствии с настоящим изложением в комбинации с контейнером для сбора и набором для обработки.
Фиг. 31 представляет собой блок-схему, иллюстрирующую различные этапы, которые включает в себя способ для управления данными в соответствии с настоящим изложением.
ПОДРОБНОЕ ОПИСАНИЕ
Более подробное описание сепаратора с вращающейся мембраной в соответствии с настоящим изложением и его применения в различных автоматизированных системах приведено ниже. Следует понимать, что приведенное ниже описание конкретных устройств и способов предлагается в качестве примера, и не является исчерпывающим описанием всех возможных вариаций или применений. Таким образом, не предполагается, что объем изложения является ограничивающим, и должен пониматься как включающий вариации или варианты осуществления, которые будут понятны специалистам.
Обратимся к фиг. 1 и 2, на которых показана система разделения или фракционирования крови с вращающейся мембраной, обозначенная в общем как 10. Такая система 10 обычно применяется для извлечения плазмы из цельной крови, полученной у отдельного донора-человека. В целях облегчения понимания, показаны только устройство выделения плазмы и связанный с ним блок привода, хотя следует понимать, что такой сепаратор образует часть одноразовой системы, содержащей пакеты для сбора, пакеты с добавками, такими как физиологический раствор или ACD, возвратные пакеты, трубки, и т.д., и что также имеются ассоциированные системы управления и система контрольно-измерительных средств для функционирования устройства.
Система 10 содержит, по существу, цилиндрический корпус 12, установленный концентрически вокруг продольной вертикальной центральной оси. Внутренний элемент 14 установлен концентрически с центральной осью. Корпус и внутренний элемент имеют возможность вращения друг относительно друга. В предпочтительном варианте осуществления, в соответствии с проиллюстрированным, корпус является неподвижным, и внутренний элемент является вращающимся, при этом он вращается концентрически в пределах цилиндрического корпуса 12. Границы маршрута тока крови в общем случае определены зазором 16 между внутренней поверхностью корпуса 12 и внешней поверхностью ротационного вращателя 14. Пространство между корпусом и вращателем иногда называется зазором сдвига. Типовой зазор сдвига может составлять приблизительно 0,025-0,050 дюйма (0,067-0,127 см) и может иметь равномерный размер вдоль оси, например, когда ось вращателя и корпуса совпадают. Зазор сдвига также может изменяться, например, по окружности, когда оси корпуса и вращателя смещены друг относительно друга.
Зазор сдвига также может изменяться вдоль направления оси, например, предпочтительно, ширина зазора может увеличиваться в направлении потока с целью ограничения гемолиза. Такая ширина зазора может изменяться в диапазоне от 0,025 до около 0,075 дюйма (0,06-0,19 см). Например, оси корпуса и ротора могут совпадать, и диаметр ротора может уменьшаться в направлении оси (направлении потока), тогда как диаметр внутренней поверхности корпуса остается постоянным, или диаметр корпуса увеличивается, и диаметр ротора остается постоянным, или диаметр обеих поверхностей изменяется. Например, ширина зазора может составлять около 0,035 дюйма (0,088 см) в конце зазора со стороны начала потока, или у конца зазора около входного клапана, и около 0,059 дюйма (0,15 см) в конце зазора со стороны конца потока. Ширина зазора может изменяться путем изменения внешнего диаметра ротора и/или внутреннего диаметра передней поверхности корпуса. Ширина зазора может изменяться линейно или пошагово, или некоторым другим желаемым образом. В любом случае, размер ширины зазора предпочтительно выбирается таким образом, чтобы при желаемой относительной скорости вращения поток Тейлора-Куэтта, такой как вихри Тейлора, создавался в зазоре, и при этом ограничивался гемолиз.
Цельная кровь подается из впускной трубки 20 через впускное отверстие 22, которое направляет кровь во входную область тока крови по маршруту, касательному к окружности вокруг верхнего конца вращателя 14. В нижнем конце цилиндрического корпуса 12 внутренняя стенка корпуса имеет выпускное отверстие 34.
Цилиндрический корпус 12 заканчивается крышкой 40 верхнего конца, имеющей концевую втулку 42, стенки которой являются немагнитными, и нижний конец 44 корпуса заканчивается выпускным отверстием 46 плазмы, концентрическим с центральной осью.
Вращатель 14 установлен с возможностью вращения между крышкой 40 верхнего конца и нижним концом 44 корпуса. Вращатель 14 содержит формованный центральный сердечник или ротор 50, внешняя поверхность которого отформована для задания ряда разнесенных в пространстве кольцевых каналов или выступов 52, разделенных кольцевыми перемычками 54. Поверхностные каналы, задаваемые кольцевыми каналами 52, соединены друг с другом посредством продольных каналов 56. На каждом конце сердечника 50 эти каналы 56 связаны с центральным отверстием или трубой 58.
В проиллюстрированном варианте осуществления поверхность ротационного вращателя 14, по меньшей мере, частично, и, предпочтительно, по существу или полностью покрыта цилиндрической пористой мембраной 62. Мембрана 62 обычно имеет номинальный размер поры 0,6 мкм, но альтернативно могут использоваться другие размеры пор. Мембраны, подходящие для способов промывания, описанных в настоящем описании, могут представлять собой волокнистые сетчатые мембраны, литые мембраны, трековые мембраны или мембраны других типов, которые будут известны квалифицированным специалистам в данной области техники. Например, в одном из вариантов осуществления, мембрана может содержать полиэфирную сетку (подложку) с частицами нейлона, отвержденными на ней, посредством чего создается извилистый путь, через который пройдут только компоненты определенного размера. В другом варианте осуществления мембрана может быть сделана из тонкого (толщиной приблизительно 15 мкм) листа, например, поликарбоната. В данном варианте осуществления, поры (отверстия) могут быть больше, чем описанные выше. Например, поры могут составлять приблизительно 3-5 мкм. Размер пор может быть таким, чтобы допускать прохождение небольших сформированных компонентов (например, тромбоцитов, микрочастиц, и т.д.), и чтобы при этом собирались нужные клетки (например, лейкоциты).
Ротационный вращатель устанавливается в крышку верхнего конца для вращения вокруг стержня 64, который запрессован в крышку 40 конца с одной стороны и размещен внутри цилиндрической несущей поверхности 65 в концевом цилиндре 66, образующем часть ротационного вращателя 14. Внутренний вращатель или внешний корпус может вращаться посредством любого устройства или системы привода вращения. В соответствии с проиллюстрированным, концевой цилиндр 66 частично охвачен кольцом 68 из магнитного материала, используемым в косвенном управлении вращателем 14. Приводной двигатель 70, внешний по отношению к корпусу 12, подсоединен с целью поворота элемента 72 кольцевого магнитного привода, который содержит, по меньшей мере, пару внутренних постоянных магнитов 74. При вращении элемента 72 кольцевого магнитного привода магнитное притяжение между кольцом 68, расположенным внутри корпуса 12, и магнитами 74, расположенными вне корпуса, присоединяет вращатель 14 к внешнему приводу, вызывающему вращение вращателя 14.
На нижнем конце ротационного вращателя 14 центральное выпускное отверстие 58 связано с центральным каналом 76 в концевом подшипнике 78, который является концентрическим с центральной осью. Место установки концевого подшипника определяется внутренним фланцем 80, который формирует нижний край центрального отверстия 82. Центральное отверстие 82 соединено с выпускным отверстием 46 плазмы. Если поверхность внутренней стороны корпуса полностью или частично покрыта мембраной, пакет сбора жидкости или труба может размещаться под мембраной для сбора плазмы и направлять ее через выпускной клапан корпуса (не показано).
I. Конструкция мембранного сепаратора
В соответствии с одним из аспектов заявки, представлен сепаратор с вращающейся мембраной, который обеспечивает улучшенные скорости потока плазмы с приемлемо низким уровнем гемолиза в сохраняемой крови. Известны различные факторы, влияющие на скорость потока фильтрации через сепараторы с вращающейся мембраной, включающие в себя скорость вращения, размер зазора между вращающейся мембраной и оболочкой, эффективную площадь мембраны, концентрацию эритроцитов (или гематокрит) и вязкость крови. Предшествующие практики проектирования устройств с вращающейся мембраной были в значительной степени эмпирическими, и им до некоторой степени способствовали неясные феноменологические описания влияния различных параметров проектирования на производительность и гемолиз. Это оказалось неэффективным относительно времени разработки и затрат технических ресурсов.
Напротив, параметры сепаратора с вращающейся мембраной по настоящей заявке были определены на основании количественных дифференциальных моделей, которые принимают во внимание локальную скорость плазмы при прохождении через мембрану и локальную концентрацию гемоглобина. Данные дифференциальные модели интегрировались по длине устройства с целью получения суммарной скорости потока плазмы и концентрации гемоглобина в плазме на выходе устройства.
Способ включает операционные входные данные на основании геометрических параметров и условий функционирования существующего сепаратора Plasmacell-C, включая гематокрит донора, скорость входного потока крови, скорость вращения и эффективную площадь мембраны. Также учитывались геометрические входные данные для радиуса ротора, ширины кольцевого зазора и длины, по которой выполняется интегрирование. См. таблицу 1 ниже.
Для получения спрогнозированных значений для гипотетических сепараторов, радиус ротора и длина фильтрации изменялись от около 1,0 до около 2,0 раз по сравнению с текущими значениями Plasmacell-C с шагом 0,05, в результате чего была получена сетка пространства параметров проектирования размером 21×21 для каждой представляющей интерес выходной переменной. Для всех устройств срез корпуса и зазор в выпускном клапане сохранялись постоянными, и зазор во входном клапане и скорость вращения изменялись соответственно. Также разрабатывались модели, которые связывали вязкость и плотность крови с гематокритом, температурой и концентрацией противосвертывающего средства.
| Таблица 1Входные данные для расчета моделей | |
| Параметр, единицы измерения | Значение |
| Скорость входного потока крови, мл/мин | 106 |
| Входной гематокрит, % | 42 |
| Температура, °C | 35 |
| Концентрация цитрата, % | 5,66 |
| Длина фильтрации, см | 7,600 |
| Радиус ротора с мембраной, см | 1,3551 |
| Входной зазор, см | 0,0673 |
| Выходной зазор, см | 0,0584 |
| Эффективная доля мембраны | 0,50 |
| Ширина контактного участка мембраны, см | 0,46 |
| Скорость вращения, об/мин | 3600 |
| Гематокрит для стенок, % | 0,90 |
| Радиус эритроцитов, мкм | 2,75 |
| Концентрация гемоглобина в эритроцитах, мг/дл | 335,60 |
| Плотность плазмы, г/см3 | 1,024 |
| Плотность упакованных эритроцитов, г/см3 | 1,096 |
| Вязкость цитратной плазмы, сП | 1,39 |
В одной из реализаций способа, выходные данные для скорости потока плазмы и концентрации гемоглобина были получены для различных значений радиуса ротора, скорости вращения и длины интегрирования. Результаты моделирования показаны в наложенных контурных изображениях выходного гематокрита и выходного напряжения сдвига на стенке (фиг. 3), выходного гематокрита и выходной концентрации гемоглобина в плазме (фиг. 4), и выходного гематокрита и числа Тейлора (фиг. 5), во всех случаях - как функция относительной длины фильтрации и радиуса вращателя. При использовании в настоящем документе, “длина фильтрации” понимается как осевая длина центрального сердечника ротора 50 от начала до конца каналов или выступов 52. В общем смысле, она представляет собой длину мембраны, доступную для фильтрации. “Радиус вращателя” или “диаметр вращателя” понимается как радиус или диаметр ротора с прикрепленной мембраной. На фиг. 6 показаны результаты как функция длины фильтрации и радиуса вращателя на трехмерном графике, демонстрирующем увеличение гемоглобина с увеличением размеров устройств. Данные результаты затем оценивались с целью обеспечения наилучшего баланса высокой скорости потока плазмы с приемлемо низкими уровнями гемолиза.
Модели показали, что эффективная площадь мембраны имеет наиболее сильное положительное влияние на производительность. Кроме того, хотя увеличение площади мембраны путем увеличения диаметра ротора более положительно влияет на скорости потоков, чем увеличение площади мембраны путем увеличения длины ротора, оно также увеличивает возможность гемолиза вследствие повышенной скорости мембраны, и, вследствие этого, повышения сдвигающих сил в зазоре.
Соответственно, моделирование позволило спрогнозировать длины и диаметры ротора, которые приведут к повышению площади мембран, применение которых также позволит иметь приемлемо низкие уровни гемолиза. Сепараторы-прототипы (на основании результатов моделирования) были сделаны и протестированы с целью проверки результатов, спрогнозированных посредством моделирования. Ниже в таблице 2 приведено сравнение имеющегося устройства для плазмафереза Plasmacell-C с двумя потенциальными альтернативами, основанными на моделях.
| Таблица 2 | |||
| Параметр, единицы измерения | Устройство | ||
| Plasmacell-C | RL 140-162 | RL 140-185 | |
| Относительная длина фильтрации | 1,00 | 1,62 | 1,85 |
| Относительный радиус вращателя | 1,00 | 1,40 | 1,40 |
| Относительная скорость вращателя | 1,00 | 0,70 | 0,75 |
| Длина фильтрации, см | 7,600 | 12,311 | 14,059 |
| Радиус вращателя, см | 1,3551 | 1,8971 | 1,8971 |
| Скорость вращателя, об/мин | 3600 | 2520 | 2700 |
| Входной зазор, см | 0,0673 | 0,0729 | 0,0749 |
| Выходной зазор, см | 0,0584 | 0,0584 | 0,0584 |
| Скорость входного потока, мл/мин | 106 | 106 | 106 |
| Входной гематокрит, % | 42 | 42 | 42 |
| Концентрация цитрата, % | 5,66 | 5,66 | 5,66 |
| Скорость потока плазмы, мл/мин | 36,33 | 47,42 | 50,57 |
| Выходной гематокрит, % | 63,90 | 76,00 | 80,32 |
| Выходная концентрация гемоглобина в плазме, мг/дл | 5,04 | 14,36 | 27,84 |
| Время пребывания, с | 2,98 | 7,99 | 9,77 |
| Центростремительное давление, мм рт. ст. | 100,22 | 96,25 | 110,50 |
| Крутящий момент, Н-см | 1,045 | 3,319 | 4,442 |
| Выходное число Тейлора | 89,07 | 51,00 | 46,96 |
Со ссылкой на таблицу 2 и фиг. 7, сепаратор с вращающейся мембраной 10 содержит ротационный вращатель 14, который имеет диаметр вращателя D, длину фильтрации FL и суммарную длину LOA. В типичном устройстве плазмафереза, таком как сепаратор Plasmacell-C, ротор имеет диаметр D, составляющий приблизительно 2,8 см, длину фильтрации FL, составляющую приблизительно 7,6 см, и суммарную длину LOA, составляющую приблизительно 12,7 см.
В соответствии с настоящей заявкой, было обнаружено, что диаметр мембраны может быть увеличен вплоть до около 2,0 раз относительно диаметра мембраны, имеющегося в типичном устройстве плазмафереза, тогда как длина может быть увеличена вплоть до около 2,5 раз относительно длины вращающейся мембраны в типичном устройстве плазмафереза. Увеличение размера ротора в пределах данных периметров достаточно увеличивает площадь мембраны фильтра для обеспечения высокого скорости потока плазмы, при этом обеспечивая приемлемо низкий уровень гемолиза. В конкретном примере сепаратор с вращающейся мембраной по настоящей заявке может, предпочтительно, иметь диаметр D, составляющий 4,19 см, длину фильтрации FL, составляющую 14,02 см, и суммарную длину LOA, составляющую 19,