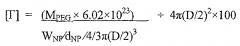Композиции на основе наночастиц с улучшенным проникновением через слизистые оболочки
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтической промышленности, а именно к гипотонической композиции для быстрого и равномерного распределения терапевтического, профилактического, диагностического или нутрицевтического агента по мукозальной поверхности, содержащей частицы, проникающие через слизь, которые содержат терапевтический, профилактический, диагностический или нутрицевтический агент и полиалкиленоксидное покрытие, улучшающее проникновение через слизь, которое улучшает диффузию частиц через слизь, где покрытие имеет коэффициент плотности [Г]/[Г*]>3, где Г - это плотность полиэтиленгликоля, характеризующая число молекул полиэтиленгликоля на 100 нм2 поверхности частицы, а Г* - это полное покрытие поверхности частицы, характеризующее теоретическое число свободных молекул полиэтиленгликоля, требуемое для полного покрытия 100 нм2 поверхности частицы, а также к способу введения одного или более терапевтических, профилактических и/или диагностических агентов человеку или животному с помощью указанных композиций. Группа изобретений обеспечивает получение частиц, проникающих через слизь, полностью защищенных от адсорбции слизи. 2 н. и 19 з.п. ф-лы, 23 ил., 8 табл., 10 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ НАСТОЯЩЕЕ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области композиций на основе наночастиц, в частности к гипотоническим композициям на основе наночастиц, которые быстро доставляют наночастицы, проникающие через слизь, к эпителиальным поверхностям, покрытым слизью, и способам их получения и применения.
ПРАВА ПРАВИТЕЛЬСТВА
Правительство США имеет определенные права на настоящее изобретение. Настоящая работа поддержана грантами национального института здоровья (R01HD062844, R33AI079740, R01CA140746) (J.H. and R.C.), национальной научной организацией (L.M.E.) и национальным институтом здоровья (бактерицидная инновационная программа 5R21AI079740).
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
U.S.S.N. 61/588350, поданная 19 января 2012 г.
PCT/US 2012/024344, поданная 8 февраля 2012 г.
PCT/US 2012/069882, поданная 14 декабря 2012 г.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Локализованная доставка терапевтических средств с помощью биоразлагаемых наночастиц часто обеспечивает преимущества по сравнению с системным введением лекарственного средства, включая ослабленные системные побочные эффекты и контролируемые концентрации лекарственного средства в сайтах-мишенях. Однако контролируемая доставка лекарственного средства к мукозальным поверхностям ограничена присутствием защитного слоя слизи.
Слизь представляет собой вязкоупругий гель, который покрывает все внешние эпителиальные поверхности, непокрытые кожей, такие как респираторный, желудочно-кишечный, носоглоточный и женский репродуктивный тракты, и поверхность глаз. Слизь эффективно задерживает общепринятые системы доставки лекарственных средств на основе частиц за счет пространственных и/или адгезионных взаимодействий. Как результат обновления слизи, большинство терапевтических средств, доставляемых местно на мукозальные поверхности, страдают от плохого проникновения и распределения, которые ограничивают их эффективность.
Наночастицы, содержащие лекарственные средства или гены, осуществляющие доставку в клетки, покрытые слизью, глаз, носа, легких, желудочно-кишечного тракта и женского репродуктивного тракта, должны достигать однородного распределения для того, чтобы максимально лечить или защищать данные поверхности. Однако чрезвычайно вязкоэластичный (т.е. вязкий и твердообразный по свойствам) и адгезионный слой слизи может замедлять или полностью связывать частицы, и, посредством этого, препятствовать их распределению по мукозальной поверхности. Кроме того, некоторые мукозальные поверхности, такие как мукозальные поверхности рта, желудка, кишечника, толстой кишки и влагалища, имеют сильноскладчатые эпителиальные поверхности, которые являются недоступными для общепринятых мукоадгезивных частиц и также для многих низкомолекулярных лекарственных и терапевтических средств. Без максимального распределения с проникновением в данные углубления, большая часть эпителия остается восприимчивой и/или необработанной. Кроме того, проникновение в складки, вероятно содержащие гораздо медленнее очищаемый слой слизи, допускает продленное время пребывания на эпителиальной поверхности.
Что касается применений по доставке лекарственных средств или генов, терапевтические частицы должны быть способны 1) достигать равномерного распределения по соответствующей мукозальной поверхности, а также 2) эффективно проходить слизистый барьер, избегая быстрого выведения со слизью, и обеспечивать эффективную доставку их терапевтического содержимого в лежащие глубже клетки (das Neves J & Bahia MF Int J Pharm 318, 1-14 (2006); Lai et al. Adv Drug Deliver Rev 61, 158-171 (2009); Ensign et al. Sci Transl Med 4, 138ral79 (2012); Eyles et al. J Pharm Pharmacol 47, 561-565 (1995)).
Биоразлагаемые наночастицы, которые проникают глубоко в слизистый барьер, могут давать улучшенное распределение, удерживание и эффективность лекарственного средства на мукозальных поверхностях. Плотные поверхностные слои из низкомолекулярного полиэтиленгликоля (ПЭГ) позволяют наночастицам быстро проникать через сильно вязкоэластичные слизистые секреции людей и животных. Гидрофильное и биоинертное покрытие ПЭГ эффективно снижает до минимума адгезионные взаимодействия между наночастицами и компонентами слизи. Биоразлагаемые частицы, проникающие через слизь (MPP), получают физической адсорбцией определенных плюроников, таких как F127, на готовых мукоадгезивных наночастицах.
Поверхность влагалища является сильноскладчатой, приспосабливаясь к расширению при половом сношении и родах; данные складки или "руги" обычно стянуты внутрибрюшным давлением, затрудняя доставку лекарственного средства к складчатым поверхностям. Для действительно эффективного предотвращения и лечения, постоянные концентрации лекарственного средства должны доставляться и сохраняться на всей доступной поверхности. Неспособность достигать подходящего распределения на всем эпителии влагалища представляет собой документально зафиксированный вид неудовлетворительных результатов для влагалищных микробицидов.
Другое значительное препятствие для эффективной доставки лекарственных средств во влагалище представляет собой вязкоэластичный слой слизи, секретируемый эндоцервиксом, который покрывает эпителий влагалища. Слизь эффективно захватывает чужеродные частицы и взвеси как пространственным, так и адгезионным механизмами, способствуя быстрому выведению. Хотя применение мукоадгезивных лекарственных форм предложено для увеличения времени пребывания во влагалище, мукоцилиарный клиренс протекает быстро (порядка от минут до часов), ограничивая время пребывания мукоадгезивных систем.
Мукозальный эпителий применяет осмотические градиенты для того, чтобы вызвать поглощение и выделение жидкости. Продукты для применения во влагалище традиционно получают с гипертоническими композициями, включая лечение молочницы влагалища, большинство смазок половых органов, таких как разогревающий гель KY®, и гели, разработанные для предотвращения передачи инфекции, передающейся половым путем, такой как ВИЧ. Гипертонические композиции вызывают быстрое, вызванное осмотически выделение жидкости во влагалище и, таким образом, вызывает немедленное повышение утечки жидкости из влагалища со скоростью, пропорциональной гипертоничности композиции. Более того, недавние исследования возможных влагалищных и ректальных микробицидов и в моделях животных, и на людях показали, что гипертонические композиции вызывают токсические эффекты, которые могут увеличивать восприимчивость к инфекциям. Первое успешное микробицидное испытание на предотвращение ВИЧ обнаружило, что антиретровирусное лекарственное средство, тенофовир, доставляемое в геле для влагалища, обеспечивает частичную защиту. К сожалению, гелевая композиция была сильно гипертонической, заставляя исследователей в новейшем клиническом исследовании тенофовира снижать концентрацию глицерина, снижая токсичность. Однако концентрацию не снижали, и композиция была все еще в значительной степени гипертонической. По-видимому, нет оснований признавать приемлемыми гипертонические композиции для доставки лекарственного средства во влагалище, поскольку в добавление к документально зафиксированным токсичным эффектам, гипертонические композиции вызывают быстрое вызываемое осмотически выделение влагалищного отделяемого, поток жидкости, который препятствует доставке лекарственных средств к эпителию. Данное отсутствие обоснованности игнорировалось и исследователями, и производителями продуктов для применения во влагалище, причем единственным очевидным исключением являются смазки половых органов, предназначенные для того, чтобы способствовать оплодотворению. Данные продукты формулируют так, чтобы они были изотоническими (осмоляльность является эквивалентной осмоляльности плазмы), способствуя поддержанию жизнеспособности сперматозоидов.
Следовательно, цель настоящего изобретения заключается в обеспечении композиций для быстрой и равномерной доставки дисперсий широкого диапазона лекарственных средств к эпителиальным поверхностям, покрытым слизью, с минимальной токсичностью для эпителия.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Осмос можно применять для того, чтобы вызвать быстрое проникновение частиц, проникающих через слизь, в глубокие полости в сильноскладчатых тканях слизистой оболочки. Поглощение и проникающая способность в глубокие полости тканей слизистой оболочки улучшают распределение по мукозальной поверхности, иначе плохо распределяемых молекул. Быстрое поглощение и проникающая способность в глубокие полости тканей слизистой оболочки приводят к продленному времени пребывания частиц, проникающих через слизь. Быстрое поглощение улучшает переносимость потребителем в добавление к увеличению эффективности лечения и снижению до минимума промежутка времени между применением и мукозальной защитой.
Гипотонические композиции оценивали на доставку растворимых в воде лекарственных средств и на доставку лекарственных средств с помощью мукоинертных (то есть, неадгезивных) наночастиц, проникающих через слизь (MPP). Гипотонические композиции заметно увеличивают скорость, с которой лекарственные средства и MPP достигают эпителиальной поверхности. Кроме того, гипотонические композиции значительно улучшают доставку лекарственных средств и MPP ко всей эпителиальной поверхности, включая проникновение глубоко в складки влагалища (руги), в которые не проникают изотонические композиции. Гипотонические композиции могут вызывать высвобождение лекарственных средств не только для поглощения эпителием, но также для проникновения через эпителий, снижая удерживания во влагалище. Напротив, гипотонические композиции вызывают быстрое и равномерное накопление MPP на поверхностях влагалища, но они не проникают через эпителий и, таким образом, сохраняют идеальную позицию для длительной мукозальной доставки лекарственных средств. Минимально гипотонические композиции, предпочтительно в диапазоне 20-220 мосмоль/кг, обеспечивают быструю и равномерную доставку MPP по всей поверхности влагалища, с минимальным риском токсичности для эпителия. Гипотонические композиции для доставки лекарственных средств во влагалище с помощью MPP должны заметно улучшать предотвращение и лечение заболеваний и расстройств репродуктивного тракта.
Данные также показывают, что имеется большая осмоляльность в толстой кишке, так что среды с осмоляльностью, большей чем осмоляльность плазмы крови (обычно считают изотонической при ~300 мосмоль/кг), все же приводят к улучшением распределения в толстой кишке, благодаря быстрому, вызванному осмотически поглощению жидкости. Диапазон для улучшенного распределения в толстой кишке с помощью гипотонической среды в толстой кишке составляет ~20 мосмоль/кг - 450 мосмоль/кг. В предпочтительном варианте осуществления композиция для применения в толстой или прямой кишке имеет осмоляльность приблизительно 20 мосмоль/кг - 450 мосмоль/кг, где ионы натрия (Na+) составляют по меньшей мере 30% осмоляльности свыше 220 мосмоль/кг. (т.е., если осмоляльность композиции составляет 450 мосмоль/кг, Na+ ионы должны составлять по меньшей мере 30% от 450-220=230 мосмоль/кг, или 69 мосмоль/кг). Улучшенное распределение гипотонически вводимых MPP (по сравнению с CP) в ткани прямой кишки с вызванным язвенным колитом, включая поглощение MPP язвенной тканью, также не демонстрировалось. Гипотоническое введение также приводит к улучшенному распределению свободного лекарственного средства (тенофовир, меченный FITC) в толстой кишке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигуры 1A и 1B представляют собой репрезентативные кривые наночастиц PLA-PEG и PCL-PEG, содержащих CHA и PVA, полученных способом эмульсификации. Фигуры 1C и 1D представляют собой графики, показывающие усредненные по множеству геометрические среднеквадратичные отклонения (<MSD>/мкм2) в виде функции времени (временная шкала/с). Фигуры 1E и 1F представляют собой графики, показывающие степень проникновения в виде функции распределений логарифмов эффективной диффузионной способности отдельных частиц (Deff) при промежутке времени 1 с. Фигуры 1G и 1H представляют собой графики, показывающие предполагаемую долю частиц, способных проникать через физиологический слой слизи 30 мкм в толщину с течением времени. Данные представляют собой три независимых эксперимента с ≥120 наночастиц, отслеживаемых для каждого эксперимента. «Усы» представлены как s.e.m.
Фигуры 2A и 2B показывают эффект молекулярного веса ПЭГ на скорость переноса MPP в шеечно-влагалищной слизи: фигура 2A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение <MSD/мкм2> в виде функции промежутка времени/с. Фигура 2B представляет собой график, показывающий распределения логарифмов эффективной диффузионной способности отдельных частиц (Deff) при промежутке времени 1 с. Частицы получали способом эмульсификации, применяя PLGA-PEG (6% по весу PEG). Данные представляют собой три независимых эксперимента с ≥120 наночастиц, отслеживаемых для каждого эксперимента. «Усы» представлены как s.e.m.
Фигура 3A представляет собой график, показывающий усредненное по множеству геометрическое среднеквадратичное отклонение <MSD/мкм2> в виде функции промежутка времени. Фигура 3B представляет собой график, показывающий распределения логарифмов эффективной диффузионной способности отдельных частиц (Deff) при промежутке времени 1 с. Фигура 3C представляет собой график, показывающий предполагаемую долю частиц, которые, как предполагается, будут проникать через слой слизи 30 мкм толщиной с течением времени. Данные представляют собой три независимых эксперимента с ≥120 наночастиц, отслеживаемых для каждого эксперимента. «Усы» представлены как s.e.m.
Фигуры 4A-C представляют собой схемы, иллюстрирующие влияния покрытия поверхности ПЭГ ([Γ/Γ*]) на проникновение через слизь наночастиц. Фигуры 4A-C показывают получение наночастиц PLGA-PEG с покрытием поверхности ПЭГ при повышении покрытия. По мере увеличения покрытия поверхности ПЭГ, режим ПЭГ сменяется с режима типа «гриб» (соседние цепи ПЭГ не перекрываются, [Γ/Γ*]<1, фигура 4A), на режим типа «щетка» (соседние цепи ПЭГ перекрываются, 1<[Γ/Γ*]<3, фигура 4B), на режим типа «плотная щетка» ([Γ/Γ*]>3, фигура 4C). При низком покрытии ПЭГ ([Γ/Γ*] <1, фигура 4A) муциновые волокна сильно сцепляются с ядрами наночастиц. При среднем покрытии ПЭГ (1<[Γ/Γ*]<3, фигура 4B), муциновые волокна все еще частично абсорбируются на ядрах наночастиц. При высоком ([Γ/Γ*]>3, фигура 4C) покрытии ПЭГ ядра наночастиц полностью экранированы биоинертным кольцом ПЭГ, приводя в результате к отсутствию адсорбции муцина на наночастицах. Фигура 4C показывает, что наночастицы с низким покрытием ПЭГ связываются в слизи, наночастицы со средним покрытием ПЭГ замедляются или даже связываются в слизи, и наночастицы с высоким и очень высоким покрытием ПЭГ способны быстро проникать через слизь.
Фигуры 5A и 5B показывают покрытие влагалища доксорубицином (Dox), введенным или в гипотоническом (hypo), или изотоническом (iso) растворе. Мышей (A) оставляли лежать на спине в течение 1 часа перед сбором ткани (неамбулаторные) или (B) они свободно перемещались в течение 10 минут перед сбором ткани (амбулаторные). Изображения показывают среднее покрытие поверхности влагалища для амбулаторных мышей, которым вводили Dox в (C) изотоническом (iso) и (D) гипотоническом (hypo) растворе. Данные представляют собой средние ± SEM (n=5). *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 6 показывает удерживание во влагалище доксорубицина, введенного или в изотоническом (iso), или гипотоническом (hypo) растворе. Мышей оставляли лежать на спине в течение 10 минут перед сбором ткани. Наложение интенсивности флуоресценции доксорубицина и светлопольных изображений для изотонического раствора и гипотонического раствора в цельной ткани шеечно-влагалищного тракта. Относительный сигнал доксорубицина, основанный на количественном измерении сигнала флуоресценции, скорректированный для флуоресценции в растворе, является репрезентативным для средних, рассчитанных для n=4 мышей, и его количественно определяли в виде относительного сигнала ± SEM. *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 7 показывает HSV-2 инфекцию во влагалище после обработки монофосфатом ацикловира (ACVp) или в гипотоническом (hypo), или в изотоническом (iso) растворе. ACVp (10 мг/мл) вводили за 1 минуту или 60 минут до вирусного инокулята. n≥45 мышей испытывали в каждой группе, и скорости заражения в контрольной группе составляли ~90%. *P<0,05 по сравнению с изотоническим, точный критерий Фишера.
Фигуры 8A и 8B показывает удерживание во влагалище MPP, введенных или в гипотоническом (hypo), или изотоническом (iso) растворе. Фигура 8A, мышей оставляли лежать на спине в течение 1 часа перед сбором ткани (неамбулаторные). Фигура 8B, мыши свободно передвигались в течение 10 минут перед сбором ткани (амбулаторные). Удерживание частиц рассчитывали как среднее ± SEM (n≥5). *P<0,05 по сравнению с изотоническим, критерий суммы рангов Уилкоксона.
Фигура 9 показывает распределение во влагалище флуоресцентных 100 нм MPP, введенных в растворах с изменяющейся осмолярностью в поперечных срезах, полученных из замороженной ткани влагалища, и в цельной разглаженной ткани влагалища. Все ткани собирали в пределах 10 минут введения частиц. Все величины представлены в единицах мосмоль/кг. Осмолярность для мукоадгезивных CP частиц составляла 20 мосмоль/кг. Изображения являются репрезентативными для n≥5 мышей. Данные рассчитывали как среднее ± SEM (n≥3). # - перепечатано из (4). * - P<0,05 по сравнению с гипотоническими растворами (20-220), критерий суммы рангов Уилкоксона
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Многие мукозальные поверхности, такие как поверхности рта, желудка, кишечника, толстой кишки и влагалища, содержат большое количество глубоких эпителиальных складок, обеспечивая расширение эпителия и поглощение жидкостей и питательных веществ. По этим причинам значительная доля эпителиальной поверхности содержится в данных труднодоступных складках. Способность создать частицы, которые равномерно распределяются на мукозальной поверхности ткани, имеет много важных следствий для терапевтической доставки, получения изображений и диагностических применений. Например, частицы, которые не достигают равномерного распределения и не проникают в глубокие полости, не способны полностью вылечивать или защищать мукозальную поверхность (Rajapaksa et al. J Biol Chem 285, 23739-23746 (2010).
В области доставки лекарственных средств во влагалище, достижение приемлемого распределения во всех целевых поверхностях представляет собой часто цитируемую проблему. Поверхность влагалища является сильноскладчатой, обеспечивая расширение при половом сношении и родовом акте, приводя в результате к сложенным складкам или "ругам". Плохое распределение в складках, даже после имитированного полового сношения, приводится в качестве решающего фактора в неспособности микробицидных продуктов защищать влагалище от инфекций. В других микробицидных исследованиях на мышах применяли большие объемы испытуемого продукта (вплоть до 40 мкл), способствуя более полному распределению во влагалище. Влагалище мышей может удерживать объем ~50 мкл; данный сравнительно большой объем испытуемого агента растягивает и развертывает эпителий влагалища. Напротив, человеческое влагалище может удерживать в диапазоне 50 мл, тогда как стандартные продукты для влагалища доставляют только 2-5 мл. Для исследования распределения во влагалище у мышей in vivo применяли небольшой объем (5 мкл), который будет более подходящим образом имитировать объемы, применяемые для людей. Способ, который доставляет лекарственные средства к поверхностям глубоких складок без растягивания влагалища, может приводить к более эффективной доставке лекарственных средств во влагалище.
Эпителий влагалища является проницаемым для небольших молекул и способен поглощать различные лекарственные средства. Поверхностный слой эпителия влагалища содержит плотно упакованные омертвевшие и умирающие клетки (роговой слой), которые защищают более глубокие слои живых клеток, обеспечивая выделение и поглощение жидкости через эпителий. Влагалище обладает естественной способностью вызванного осмотически поглощения жидкости, которую применяют для доставки лекарственных средств. Доксорубицин, вводимый в гипотоническом растворе, покрывает более 85% поверхности влагалища амбулаторных мышей, тогда как только 25% поверхности ткани влагалища покрывается доксорубицином, вводимом в изотоническом растворе. Изотоническая жидкость не проникает в руги, оставляя испещренный полосами рисунок при распрямлении ткани влагалища. Предположено, что гипотоническая доставка может увеличивать контрацептивную эффективность детергентного ноноксинола-9 (N9), увеличивая подвижность N9 через слизь (Dunmire EN & Katz DF Contraception 55, 209-217 (1997); Owen et al. J Control Release 60, 23-34 (1999)). Улучшенное проникновение гипотонического раствора N9 через слизь показано в выделенной слизи in vitro, причем цель заключалась в достижении более быстрого контакта между детергентом и сперматозоидами в слизи.
Доставка в шеечно-влагалищный тракт и толстую кишку в особенности может быть проблематичной, не только из-за проблемы распределения, но также из-за "утечки". Большинство влагалищных и ректальных композиций являются чрезвычайно гиперосмолярными, что вызывает осмотическое выделение жидкости из мукозального эпителия. Данное выделение жидкости приводит к разбавлению и утечке композиции, вместе с токсичностью, связанной с гиперосмолярностью (Rudolph et al. Mol Ther 12, 493-501 (2005); Bertschinger et al. Journal of Controlled Release 116, 96-104 (2006); Pihl et al Acta Physiol 193, 67-78 (2008); Noach J Pharmacol Exp Ther 270, 1373-1380 (1994)). Абсорбция лекарственного средства, применяя гипотонические растворы лекарственных средств, является известной, но не эффекты абсорбции на распределение и удерживание. См., например, Eyles et al. J Pharm Pharmacol 47, 561-565 (1995); Rajapaksa et al. J Biol Chem 285, 23739-23746 (2010); Rudolph et al. Mol Ther 12, 493-501 (2005); Bertschinger et al. Journal of Controlled Release 116, 96-104 (2006); Pihl et al. Acta Physiol 193, 67-78 (2008); Noach et al. J Pharmacol Exp Ther 270, 1373-1380 (1994); Lennernas H Pharmaceut Res 12, 1573-1582 (1995).
Тоничность композиции зависит от свойств проницаемости ткани (например, толстой кишки относительно влагалища) и существует критический слегка гипотонический диапазон для улучшенного поглощения и однородности распределения без токсичности. Слегка гипотонические композиции должны вызывать поглощение жидкости, которое будет снижать "утечку", часто приводимую пациентами в клинических исследованиях как вредное побочное действие. Данная утечка продукта ведет и к ухудшенной приемлемости для потребителя, а также быстрому удалению терапевтического агента. Например, снижение осмоляльности с 294 мосмоль/кг до 220 мосмоль/кг выполняло функцию слегка гипотонической жидкости, которая увеличивала покрытие поверхности влагалища с 60% до 76%, и по существу все гипотонически доставляемые MPP получали из катетера, достигая эпителиальной поверхности, глубоко в складчатых поверхностях в пределах 10 минут введения.
Композиции в виде частиц, которые быстро достигают равномерного распределения, а также проходят через слизь, можно применять для эффективной доставки в эпителий, покрытый слизью, в теле для широкого спектра применений, включая лечение лекарственными средствами (в диапазоне от низкомолекулярных терапевтических средств, подобных химиотерапевтическим лекарственным средствам, до пептидов, белков, олигонуклеотидов, ДНК и т.д.), получение изображений и диагностику. Для терапевтических целей, молекулы, захваченные в частицы, затем могут высвобождаться в течение длительного времени при заранее определенных скоростях. В общем, терапевтические применения для данной технологии включают доставку любого лекарственного средства, в случае, когда стандартная композиция не является пригодной, не является эффективной на 100%, или приводит к нежелательным побочным эффектам из-за неэффективного распределения, токсичности или "утечки". Данный способ должен также улучшать проникновение и равномерное распределение стандартных композиций лекарственных средств (т.е. без частиц для доставки лекарственных средств), в частности для доставки генов/олигонуклеотидов; направленной и в высшей степени локализованной химиотерапевтической доставки для лечения рака; направленной доставки противовоспалительных лекарственных средств; лечения или предотвращения ЗППП; проникновения в биопленки и другие биологические покрытия/барьеры; и направленной доставки антибиотиков для лечения бактериальной инфекции.
Большинство вагинальных гелей формулируют с эксципиентами, такими как глицерин или пропиленгликоль, которые придают гелю изотоничность. К сожалению, недавние исследования показывают, что данные гипертонические композиции обладают токсичностью в вагинальном тракте мышей, которая увеличивает восприимчивость к HSV-2 инфекции (Moench et al. BMC Infect Dis 10, 331 (2010)), которая, по всей вероятности, является гипертонической (Fuchs et al. J Infect Dis 195, 703-710 (2007); Clark MR & Friend DR. (2012) Pharmacokinetics and Topical Vaginal Effects of Two Tenofovir Gels in Rabbits. AIDS Res Hum Retroviruses.). Кроме того, было обнаружено, что гипертоническая гелевая композиция нарушает целостность эпителия в толстой кишке человека, и было обнаружено, что гипертоническая гелевая композиция тенофовира вызывает разрушение эпителия в эктоцервикальных и колоректальных эксплантатах по сравнению с тканями, подверженными воздействию только среды (Rohan PLoS One 5, e9310 (2010)). Было предположено, что основной влияющий фактор в экспериментальной модели мышей с заболеванием раздраженного кишечника, вызванным декстраном сульфата натрия (DSS), представляет собой гипертоничность раствора DSS. Высвобождение воспалительных цитокинов в промываемой жидкости влагалища мышей увеличивалось после 7 одноразовых доз среды для гипертонического геля, но увеличение отсутствовало после 7 одноразовых доз гипотонической композиции.
I. Определения
"Наночастица", как применяют в настоящем изобретении, обычно относится к частице любой формы, имеющей диаметр от приблизительно 1 нм вплоть до, но не ограничиваясь, приблизительно 1 микрона, более предпочтительно от приблизительно 5 нм до приблизительно 500 нм, самое предпочтительное от приблизительно 5 нм до приблизительно 100 нм. Наночастицы, имеющие сферическую форму, обычно называют "наносферами".
"Средний размер частиц", как применяют в настоящем изобретении, обычно относится к статистически среднему размеру частиц (диаметру) частиц в группе частиц. Диаметр по существу сферической частицы можно называть физическим или гидродинамическим диаметром. Диаметр несферической частицы может предпочтительно относиться к гидродинамическому диаметру. Как применяют в настоящем изобретении, диаметр несферической частицы может относиться к наибольшему линейному расстоянию между двумя точками на поверхности частицы. Средний размер частиц можно измерить, применяя способы, известные в данной области техники, такие как динамическое рассеяние света.
"Монодисперсное" и "однородное по размеру распределение" применяют взаимозаменяемо в настоящем изобретении, и они описывают множество наночастиц или микрочастиц, где частицы имеют одинаковый или практически одинаковый диаметр или аэродинамический диаметр. Как применяют в настоящем изобретении, монодисперсное распределение относится к распределениям частиц, в которых 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95% или более распределения лежит в пределах 5% масс-медианного диаметра или аэродинамического диаметра.
"Гидрофильное", как применяют в настоящем изобретении, относится к веществам, которые содержат сильно полярные группы, которые легко взаимодействуют с водой.
"Липофильное" относится к соединениям, обладающим сродством к липидам.
"Амфифильное" относится к молекуле, комбинирующей гидрофильные и липофильные (гидрофобные) свойства.
"Гидрофобное", как применяют в настоящем изобретении, относится к веществам, которые не обладают сродством к воде; стремящиеся отталкивать и не поглощать воду, а также не растворяться в или не смешиваться с водой.
"Фармацевтически приемлемое", как применяют в настоящем изобретении, относится к соединениям, веществам, композициям и/или лекарственным формам, которые, по результатам тщательной медицинской оценки, являются пригодными для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, с соразмерным соотношением риск/польза, согласно руководству государственных учреждений, таких как управление по продовольствию и лекарствам.
"Биосовместимый" и "биологически совместимый", как применяют в настоящем изобретении, обычно относятся к материалам, которые, вместе с любыми их метаболитами или продуктами разложения, обычно являются нетоксичными для реципиента и не вызывают любые заметные вредные эффекты у реципиента. В целом, биосовместимые материалы представляют собой материалы, которые не вызывают значительного воспаления или иммунной реакции при введении пациенту.
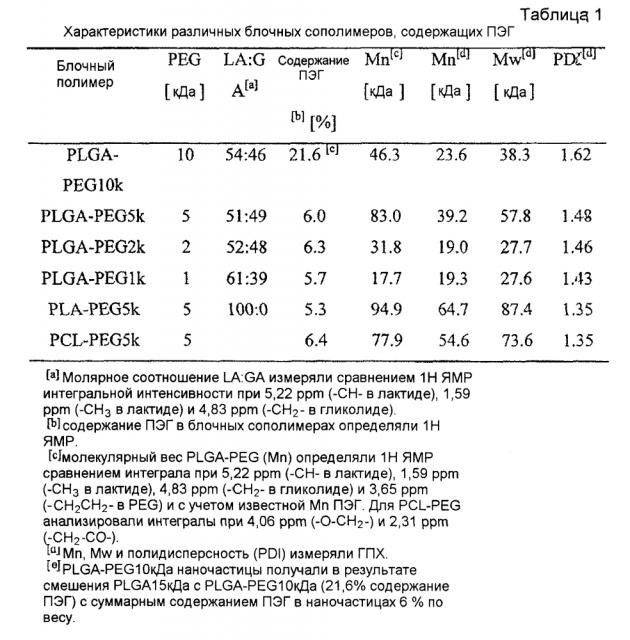
"Молекулярный вес", как применяют в настоящем изобретении, обычно относится к относительной средней длине цепи блочного полимера, если не указано иначе. На практике, молекулярный вес можно оценить или охарактеризовать, применяя различные способы, включая гельпроникающую хроматографию (ГПХ) или капиллярную вискозиметрию. ГПХ молекулярные веса приводят в виде средневесового молекулярного веса (Mw), в противоположность среднечисловому молекулярному весу (Mn). Капиллярная вискозиметрия дает оценку молекулярного веса в виде характеристической вязкости, определенной для разбавленного раствора полимера, применяя конкретный набор концентраций, температур и растворителей.
"Гидрофильный", как применяют в настоящем изобретении, относится к свойству обладать сродством к воде. Например, гидрофильные полимеры (или гидрофильные сегменты полимерной цепи) представляют собой полимеры (или сегменты полимерной цепи), которые в основном являются растворимыми в водных растворах и/или имеют тенденцию поглощать воду. В общем, чем более гидрофильным является полимер, тем большую склонность растворятся в, смешиваться с или смачиваться водой имеет данный полимер.
"Гидрофобный", как применяют в настоящем изобретении, относится к свойству отсутствия сродства к воде или даже способности отталкивать воду. Например, чем более гидрофобным является полимер (или сегмент полимерной цепи), тем меньшую склонность растворяться в, смешиваться с или смачиваться водой имеет данный полимер.
"Слизь", как применяют в настоящем изобретении, относится к вязкоэластичному природному веществу, содержащему в основном муциновые гликопротеины и другие вещества, которые защищают эпителиальную поверхность различных органов/тканей, включая респираторную, назальную, шеечно-влагалищную, желудочно-кишечную, ректальную, зрительную и слуховую системы. "Мокрота", как применяют в настоящем изобретении, относится к крайне вязкоэластичным секрециям слизи, состоящим из ряда макромолекул, таких как ДНК, актины и другого клеточного детрита, высвобождающихся из мертвых клеток в добавление к муциновым гликопротеинам. "Мокрота" обычно присутствует в болезненных дыхательных путях пациентов, пораженных обструктивными заболеваниями легких, включая, но не ограничиваясь, астму, ХОБЛ и КФ. "Слизь при КФ" и "мокрота при КФ", как применяют в настоящем изобретении, относятся к слизи и мокроте, соответственно, у пациента, страдающего от кистозного фиброза.
"Агент, уменьшающий количество слизи", как применяют в настоящем изобретении, относится к веществу, которое увеличивает скорость мукоцилиарного клиренса при введении пациенту. Агенты, уменьшающие количество слизи, являются известными в данной области техники. См., например, Hanes, J. et al. Gene Delivery to the Lung, в Pharmaceutical Inhalation Aerosol Technology. Marcel Dekker. Inc., New York; 489-539 (2003). Примеры агентов, уменьшающих количество слизи, включают N-ацетилцистеин (NAC), который расщепляет дисульфидные и сульфгидрильные связи, присутствующие в слизи. Другие агенты, уменьшающие количество слизи, включают полынь, бромелайн, папаин, клеродендрум, ацетилцистеин, бромгексин, карбоцистеин, эпразинон, мезну, амброксол, собрерол, домиодол, денуфозол, летостеин, стэпронин, тиопронин, гелзолин, тимозин β4, нелтенексин, эрдостеин и различные ДНКазы, включая РНКазы.
Термин "поверхностно-активное вещество", как применяют в настоящем изобретении, относится к агенту, который снижает поверхностное натяжение жидкости.
Термин "терапевтический агент" относится к агенту, который можно вводить для предотвращения или лечения заболевания или расстройства. Терапевтические агенты могут представлять собой нуклеиновую кислоту, аналог нуклеиновой кислоты, небольшую молекулу, пептидомиметик, белок, пептид, углевод или сахар, липид или поверхностно-активное вещество, или их комбинацию.
Термин "лечение" или предотвращение заболевания, расстройства или состояния от возникновения у животного, которое может быть предрасположено к заболеванию, расстройству и/или состоянию, но которому еще не поставлен диагноз его наличия; ингибирование заболевания, расстройства или состояния, например, задерживание его развития; и облечение заболевания, расстройства или состояния, например, вызов ремиссии заболевания, расстройства и/или состояния. Лечение заболевания или состояния включает облегчение по меньшей мере одного симптома конкретного заболевания или состояния, даже если не воздействуют на лежащую в основе патофизиологию, такое как лечение боли у субъекта введением анальгезирующего агента, даже если данный агент не излечивает причину боли.
Термин "молекула, осуществляющая направленную доставку", как применяют в настоящем изобретении, относится к молекуле, которая локализуется в или далеко от конкретной области. Молекула может представлять собой, например, белок, нуклеиновую кислоту, аналог нуклеиновой кислоты, углевод или небольшую молекулу. Молекула может представлять собой, например, терапевтическое соединение, такое как небольшая молекула, или молекулу для диагностики, такую как детектируемая метка. Область может представлять собой ткань, в частности тип клеток, или внутриклеточный компартмент. В одном варианте осуществления группа, осуществляющая направленную доставку, управляет локализацией активной молекулы. Активная молекула может представлять собой небольшую молекулу, белок, полимер или метал. Активная молекула может быть пригодной для терапевтических, профилактических или диагностических целей.
Термин "терапевтически эффективное количество" относится к количеству терапевтического агента, который, при введении в и/или на частицах, описанных в настоящем изобретении, дает некоторый требуемый эффект при приемлемом соотношении риск/польза, применимом в любом терапевтическом лечении. Эффективное количество может изменяться в зависимости от таких факторов, как заболевание или состояние, которые лечат, конкретные направленные конструкты, которые вводят, размер субъекта, или тяжесть заболевания или состояния. Специалист в данной области техники может эмпирически определить эффективное количество конкретного соединения без необходимости чрезмерного экспериментирования.
Термины "включенный" и "инкапсулированный" относится к включению, формулированию или другому включению активного агента в и/или на композиции, которое обеспечивает высвобождение, такое как замедленное высвобождение, данного агента при требуемом применении. Термины предполагают любой способ, которым терапевтический агент или другой материал включают в полимерный матрикс, включая, например: присоединение к мономеру данного полимера (ковалентным, ионным или другим связывающим взаимодействием), физическое смешение, включение агента в покрывающий слой полимера, включение в полимер, распределение по полимерному матриксу, прикрепление к поверхности полимерного матрикса (ковалентным или другими связывающими взаимодействиями), инкапсулирование внутри полимерного матрикса и т.д. Термин "совместное вклю