Способ прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к онкологии, и может быть использовано для прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода. На дооперационном этапе проводят компьютерно-томографическое исследование желудка в нативном режиме и с болюсным контрастным усилением изображения. Последовательно измеряют денситометрические показатели плотности в фиксированных точках кардиального отдела, средней трети тела по большой кривизне и антрального отдела желудка. Строят динамические кривые плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка. В случае увеличения плотности стенки желудка с пиком контрастирования в артериальную фазу не более 90 HU, смещением пика контрастирования в портальную или венозную фазу со значениями, не превышающими 70 HU и 80 HU соответственно, в сочетании с локусным характером контрастирования и стертостью границ между мышечным и слизистым слоями стенки желудка в артериальную фазу контрастирования прогнозируют высокую вероятность риска развития в послеоперационном периоде недостаточности пищеводно-желудочного анастомоза. Способ позволяет точно и информативно провести прогнозирование, а также снизить частоту послеоперационных осложнений за счет проведения компьютерно-томографического исследования желудка и построения динамических кривых плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка. 3 ил., 1 пр.
Реферат
Изобретение относится к области медицины, конкретно к онкологии, и предназначено для прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода.
Несмотря на прогресс, наблюдаемый при лучевой и химиотерапии, единственно радикальным способом лечения рака пищевода остается хирургический. В связи с совершенствованием технического обеспечения вмешательств, успехами анестезиологии и реаниматологии тактика лечения рака пищевода за последние 10-15 лет существенно изменилась - значительно расширились показания к радикальным и реконструктивным вмешательствам, а многоэтапные операции на пищеводе уступили место одномоментным [Давыдов М.И., 2006].
Как известно, одномоментная резекция и пластика пищевода предпочтительна с позиции функциональности и качества жизни больных. Однако, при выполнении операций типа Льюиса достаточно часто развиваются осложнения в виде недостаточности пищеводно-желудочных анастомозов [Черноусов А.Ф., 2005], частота которых колеблется от 4 до 16%, что, в конечном счете, приводит к летальному исходу в 50-70% случаев. Среди причин несостоятельности анастомозов выделяют: особенности хирургической техники (пересечение левой желудочной артерии и ваготомия); факторы, связанные с основным заболеванием (неблагоприятные метаболические изменения алиментарного и опухолевого генеза); ятрогенные причины (натяжение сшиваемых органов, грубое обращение с тканями, избыточная мобилизация пищевода или желудка, чрезмерное или недостаточное затягивание узлов, повторное наложение анастомоза при неудачной попытке его создания и др.). Таким образом, можно констатировать, что в подавляющем большинстве случаев недостаточность анастомозов развивается вследствие нарушения микроциркуляции и питания местных тканей.
В настоящее время в связи с развитием и внедрением в клиническую практику новых диагностических технологий (ультрасонография, контрастные вазографии, радиоизотопные исследования) значительно увеличились возможности дооперационной оценки функционального состояния внутренних органов и особенностей их кровоснабжения. Так, в абдоминальной хирургии на основании изучения параметров порто-печеночного кровообращения были разработаны критерии прогноза парциальных порто-кавальных анастомозов, позволяющие выделить группу абсолютного риска порто-кавального шунтирования, относительно низкого и наиболее благоприятного течения заболевания [Плеханов А.Н., 1996]. В результате, удалось уточнить критерии отбора больных для различных типов порто-кавального шунтирования и, тем самым, улучшить результаты хирургического лечения [Бохян Т.С., 1998].
Наиболее близким к предлагаемому способу прогнозирования риска развития недостаточности анастомозов (прототипом) является способ, включающий в себя прецизионную термометрию в сочетании с холодовой пробой, который позволяет диагностировать тип нарушений микроциркуляции и прогнозировать развитие несостоятельности анастомозов в раннем послеоперационном периоде [Шатрова Н.А., 2012]. Результат достигается путем регистрации колебаний кожной температуры, связанной с изменениями сосудистого тонуса до и после функциональной нагрузки, и обработки данных с помощью математического анализа. Недостатками данного способа являются: техническая сложность исследования, ограничивающая применение в повседневной практике хирургических и онкологических стационаров; а также зависимость результатов термометрии от индивидуальных параметров организма больного (различные типы вегето-сосудистой регуляции). Прогноз недостаточности анастомозов строится только на основании нарушений эндотелиального механизма регуляции сосудистого тонуса без учета таких факторов, как анатомические особенности и аномалии развития сосудистого русла конкретного органа, атеросклеротические поражения сосудов и т.д.
Новая техническая задача - повысить точность и информативность способа, что позволит персонифицировать и повысить эффективность хирургического лечения больных раком пищевода за счет снижения частоты послеоперационных осложнений.
Для решения поставленной задачи в способе прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода, включающем инструментальное определение на дооперационном этапе особенностей кровоснабжения - проводят компьютерно-томографическое исследование желудка в нативном режиме и с болюсным контрастным усилением изображения. Затем последовательно измеряют денситометрические показатели плотности в фиксированных точках кардиального отдела, средней трети тела по большой кривизне и антрального отдела желудка. На основании полученных данных строят динамические кривые плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка. В случае увеличения плотности стенки желудка с пиком контрастирования в артериальную фазу не более 90 HU, смещением пика контрастирования в портальную или венозную фазу со значениями не превышающими 70 HU и 80 HU, соответственно, в сочетании с локусным характером контрастирования и стертостью границ между мышечным и слизистым слоями стенки желудка в артериальную фазу контрастирования, прогнозируют высокую вероятность развития в послеоперационном периоде недостаточности пищеводно-желудочного анастомоза.
Изобретение соответствует критерию "новизна", так как для прогнозирования недостаточности анастомозов у больных раком пищевода не использовалось компьютерно-томографическое исследование желудка в указанной схеме и последовательности.
Изобретение соответствует критерию "изобретательский уровень", так как оно явным образом не следует для специалиста из уровня техники.
Изобретение соответствует критерию "промышленно применимо", так как оно может использоваться в клинической практике для прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода.
Способ осуществляют следующим образом: на предоперационном этапе у больных раком пищевода натощак проводят компьютерно-томографическое исследование желудка в нативном режиме и с болюсным контрастным усилением изображения с толщиной среза 1-2,5 мм, pitch - 1,5 (компьютерный томограф «Emotion-6»), при этом контрастное вещество («Омнипак-350») в количестве 100 мл вводят в локтевую вену со скоростью 3 мл в секунду. Сканирование выполняют в артериальную, портальную и венозную фазу контрастирования, затем последовательно, в каждой из фаз контрастного усиления изображения, измеряют денситометрические показатели плотности в фиксированных точках стенки кардиального, средней трети тела по большой кривизне и антрального отдела желудка, и на основании полученных данных строят динамические кривые плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка. При увеличении плотности стенки желудка с пиком контрастирования в артериальную фазу не более 90 HU, смещением пика контрастирования в портальную или венозную фазу со значениями, не превышающими 70 HU и 80 HU, соответственно, в сочетании с локусным характером контрастирования и стертостью границ между мышечным и слизистым слоями стенки желудка в артериальную фазу контрастирования, прогнозируют высокую вероятность развития в послеоперационном периоде недостаточности пищеводно-желудочного анастомоза.
Обоснование способа
Оперативное вмешательство по поводу рака пищевода - тяжелейшая травма с повреждением жизненно важных органов и структур в грудной и брюшной полости у больных с исходными метаболическими нарушениями. Необходимо отметить, что опухолевый процесс и сопутствующие хронические заболевания значительно снижают адаптационные и функциональные возможности организма больных [Свиридова С.П., 2003]. В связи с этим в послеоперационном периоде значительно повышается риск развития осложнений, частота и тяжесть которых напрямую зависят от точности дооперационной диагностики, правильного отбора больных и выбора метода лечения [Давыдов М.И., 2006; Рудык Ю.В., 2013].
Известно, что наиболее грозным осложнением при операциях на пищеводе является недостаточность анастомоза, которая приводит к развитию перитонитов, абсцессов брюшной полости, кишечных свищей, и, в конечном счете, к летальным исходам [Черноусое А.Ф., 2005].
В литературе обсуждается значение различных факторов риска развития несостоятельности анастомозов, знание которых позволит прогнозировать его развитие и проводить профилактику. Однако до настоящего времени нет единой точки зрения на причины, вызывающие данное осложнение.
Для прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода предложен способ, основанный на дооперационном определении адекватности кровоснабжения желудка посредством проведения компьютерно-томографического исследования в нативном режиме и с болюсным контрастным усилением изображения. На основании результатов собственного исследования сделаны выводы о вкладе особенностей кровоснабжения стенок желудка на развитие послеоперационных осложнений и сформулированы критерии прогноза развития недостаточности анастомоза. Так, ретроспективный анализ данных проведен у 18 больных раком пищевода, которым была выполнена операция по типу Льюиса. Средний возраст больных составил 58 лет, соотношение мужчин и женщин - 16:2. В зависимости от особенностей кровоснабжения стенки желудка на дооперационном этапе и течении послеоперационного периода больные были разделены на три группы.
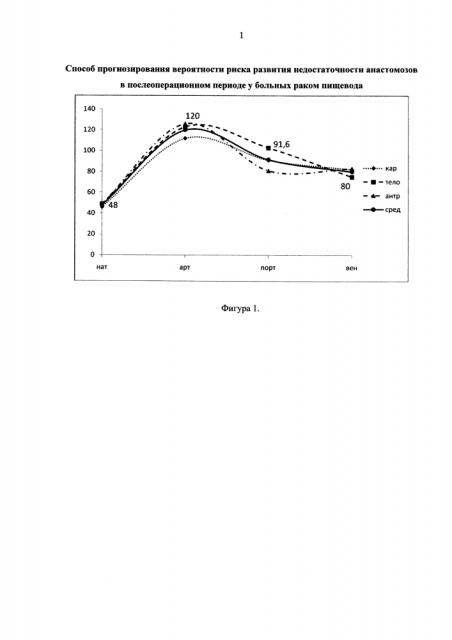
В I группе послеоперационный период был гладким, без осложнений (12 больных). Во всех случаях выявлено равномерное, довольно интенсивное увеличение плотности стенки желудка с пиком контрастирования в артериальную фазу (свыше 110 HU) и постепенным снижением в портальную и венозную фазы (фигура 1). Скиалогическая картина стенки желудка характеризовалась довольно четким разграничением мышечного и слизистого слоев в артериальную фазу и выравниванием их плотности в портальную и венозную.
Во II группе в раннем послеоперационном периоде зафиксирована несостоятельность пищеводно-желудочного анастомоза (4 больных). В 2-х случаях кривая контрастирования была идентичной кривой у больных I группы, но с более низкими значениями пика контрастирования в артериальную фазу, не превышающими 90 HU (фигура 2а), и в 2-х случаях кривая контрастирования характеризовалась медленным подъемом показателей плотности с пиком в портальную фазу на уровне 70 HU с последующим медленным снижением (фигура 2б). Скиалогическая картина стенки желудка при этом имела локусное контрастирование, стертость границ мышечного и слизистого слоев в артериальную фазу контрастирования. Следует отметить, что больные имели атеросклеротические изменения в устье чревного ствола с сужением просвета от 4,5 до 2,2 мм.
В III группе в послеоперационном периоде развился некроз желудочного трансплантата (2 больных). Кривая контрастирования характеризовалась медленным, но неуклонным повышением плотности последовательно от артериальной до венозной фазы, при этом пик контрастирования смещался к венозной фазе и не превышал значений плотности выше 80 HU (фигура 3). Скиалогическая картина стенки желудка соответствовала изменениям во II группе больных. Кроме того, было выявлено атеросклеротическое сужение просвета чревного ствола до 4,3 мм с дугообразным его изгибом.
Таким образом, было показано, что компьютерно-томографическое исследование с измерением денситометрических показателей плотности в фиксированных точках желудка, на основании которых строят динамические кривые плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка, может использоваться для прогнозирования недостаточности анастомозов у больных раком пищевода. Так, в последующих исследованиях при планировании хирургического лечения у 8 больных раком пищевода за счет применения указанного способа прогнозирования были выявлены высокие риски развития недостаточности пищеводно-желудочного анастомоза, что позволило отказаться от пластики желудочным стеблем в пользу трансплантата из толстой кишки и, тем самым, избежать грозного осложнения.
Клинический пример:
Больной К., 54 лет, поступил в торакоабдоминальное отделение ФГБУ «НИИ онкологии» СО РАМН 04.11.13 г. с диагнозом: Рак нижней трети пищевода. Гистология - Плоскоклеточный рак. Больному на предоперационном этапе проведено компьютерно-томографическое исследование желудка в нативном режиме и с болюсным контрастным усилением изображения, по результатом которого установлено, что кривая контрастирования имеет пик в портальную фазу (67 HU), а скиалогическая картина стенки желудка характеризуется локусным контрастированием и стертостью границ мышечного и слизистого слоев в артериальную фазу контрастирования. На основании полученных данных выставлен высокий риск развития недостаточности пищеводно-желудочного анастомоза. В связи с полученными данными тактика хирургического лечения была изменена и 20.11.14 г. выполнена резекция пищевода из раздельного торакоабдоминального доступа с пластикой толстой кишкой. Ближайший послеоперационный период протекал без особенностей, швы сняты на 12 сутки после операции. Осложнений не наблюдалось. Больной выписан на 18 сутки после операции из клиник в удовлетворительном состоянии.
Таким образом, предлагаемый способ прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода основан на результатах экспериментальных и клинических исследований, на основании которых можно сделать вывод о том, что использование данного способа позволяет повысить точность диагностики и эффективность хирургического лечения больных раком пищевода за счет снижения частоты послеоперационных осложнений.
ПРИЛОЖЕНИЕ
Комментарии к фигурам описания изобретения «Способ прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода»
Фигура 1. Динамическое изменение плотности стенки желудка в зависимости от фазы контрастирования у больных с неосложненным течением послеоперационного периода.
Фигура 2. Динамическое изменение плотности стенки желудка в зависимости от фазы контрастирования у больных с недостаточностью пищеводно-желудочного анастомоза в раннем послеоперационном периоде, а) с пиком контрастирования в артериальную фазу; б) с пиком контрастирования в портальную фазу.
Фигура 3. Динамическое изменение плотности стенки желудка в зависимости от фазы контрастирования у больных с некрозом желудочного трансплантата в послеоперационном периоде.
Сокращения:
нат - нативный режим, арт - артериальная фаза, порт - портальная фаза, вен - венозная фаза;
кар - кардиальный отдел желудка, тело - средняя треть тела желудка по большой кривизне, антр - антральный отдел желудка, сред - среднее значение.
Список литературы:
1. Давыдов М.И., Полоцкий Б.Е., Стилиди И.С. Рак пищевода: современные подходы к диагностике и лечению // Рус. мед. журн. - 2006. - №14. - С. 1006-1015.
2. Черноусов А.Ф., Хоробрых Т.В., Антонов О.Н. Профилактика недостаточности анастомозов желудочно-кишечного тракта // Хирургия. Журнал им. Н.И. Пирогова. - 2005. - №12. - С. 25-29.
3. Плеханов А.Н. Критерии прогноза результатов парциальных порто-кавальных анастомозов у больных циррозом печени: Автореф. дис. … канд. мед. наук. - Москва, 1996. - 22 с.
4. Бохян Т.С., Лебезев В.М., Ерамишанцев А.К. Неинвазивные методы прогнозирования результатов портокавального шунтирования у больных циррозом печени // Анналы хирургической гепатологии. - 1998. - Том. 3. - №3. - С. 20-22.
5. Шатрова Н.А. Прогнозирование, профилактика и лечение несостоятельности толстокишечных анастомозов: Автореф. дис. … канд. мед. наук. - Пермь, 2012. - 24 с.
6. Свиридова С.П., Мазурина О.Г., Нехаев И.В. и др. Основные принципы предоперационной подготовки и интенсивной терапии послеоперационного периода у больных раком пищевода // Практическая онкология. - 2003. - Т. 4. - №2. - С. 120-126.
7. Рудык Ю.В., Афанасьев С.Г., Тузиков С.А. и др. Эффективность комбинированного лечения больных раком пищевода с применением неоадъювантной химиотерапии // Сибирский онкологический журнал. - 2013. - №4 (58). - С. 17-22.
Способ прогнозирования вероятности риска развития недостаточности анастомозов в послеоперационном периоде у больных раком пищевода, включающий инструментальное определение на дооперационном этапе особенностей кровоснабжения, отличающийся тем, что проводят компьютерно-томографическое исследование желудка в нативном режиме и с болюсным контрастным усилением изображения, затем последовательно измеряют денситометрические показатели плотности в фиксированных точках кардиального отдела, средней трети тела по большой кривизне и антрального отдела желудка, на основании полученных данных строят динамические кривые плотности стенки желудка в зависимости от фазы контрастного усиления и анатомического отдела желудка, и в случае увеличения плотности стенки желудка с пиком контрастирования в артериальную фазу не более 90 HU, смещением пика контрастирования в портальную или венозную фазу со значениями, не превышающими 70 HU и 80 HU соответственно, в сочетании с локусным характером контрастирования и стертостью границ между мышечным и слизистым слоями стенки желудка в артериальную фазу контрастирования, прогнозируют высокую вероятность риска развития в послеоперационном периоде недостаточности пищеводно-желудочного анастомоза.