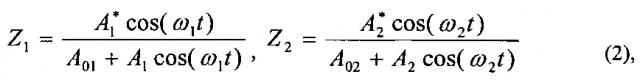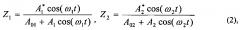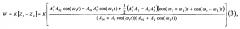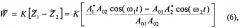Устройство для измерения кожного кровотока
Иллюстрации
Показать всеИзобретение относится к медицинской технике и предназначено для измерения кожного кровотока на основе метода лазерной доплеровской флоуметрии. Устройство содержит источник первичного лазерного излучения, систему транспортировки первичного излучения, систему приема вторичного излучения и два канала электронной обработки сигнала. Система транспортировки первичного излучения содержит два оптических волокна и модель, имитирующую оптические свойства живой биологической ткани без крови. Система приема вторичного излучения содержит два оптических волокна. Схема каждого канала содержит последовательно соединенные фотоприемное устройство, фильтр высоких частот, усилитель и аналоговый делитель. Схема обработки сигнала каждого канала дополнительно включает в себя фильтр низких частот с частотой среза 2 Гц, параллельно соединенный с фотоприемным устройством и со вторым входом аналогового делителя. Устройство также включает в себя дифференциальный усилитель, входы которого соединены с выходами аналоговых делителей двух каналов, а выход - со схемой вычисления показателя перфузии. Достигается повышение точности получаемых частотных ритмов микроциркуляции за счет очистки сигнала от ложных спектров в дифференциальном каскаде и исключения вычитания синфазных коррелированных полезных сигналов на дифференциальном усилителе. 7 ил.
Реферат
Изобретение относится к медицине и медицинской технике, а именно к устройствам для измерения кожного кровотока на основе метода лазерной доплеровской флоуметрии.
Лазерная доплеровская флоуметрия (ЛДФ) является методом неинвазивной (in vivo, in situ), неразрушающей, прижизненной диагностики, контроля и/или мониторинга функционального состояния тканей организма. Принцип метода ЛДФ в целом и действия изобретения, в частности, основан на зондировании лазерным излучением биологической ткани и регистрации обратно-рассеянного и/или отраженного излучения, содержащего компоненты доплеровского сигнала. ЛДФ предназначена для оценки уровня микроциркуляции кожного кровотока, определяемого по величине перфузии тканей кровью, которая пропорциональна концентрации и скорости эритроцитов в зоне обследования, и, в свою очередь, определяется по доплеровскому спектру частот (Лазерная доплеровская флоуметрия микроциркуляции крови // Под ред. А.И. Крупаткина и В.В. Сидорова. - М.: Медицина, 2005).
Известно несколько аналогичных способов и устройств для определения скорости капиллярного кровотока с использованием эффекта Доплера (Патент США 4596254, 1986 г.; Патент США 4109647, 1978 г. и др.). Однако перечисленные способы и устройства имеют недостатки. Основной и существенный недостаток всех этих устройств заключается в том, что в их схемах не предусмотрено средств по подавлению шумовых помех, источником которых может быть целый ряд причин: нестабильность лазерного источника, внешний световой фон, сетевые электромагнитные наводки, интерференция мод лазера, движения пациента во время обследования и т.д. Данные помехи сильно влияют на полезный сигнал, искажают его, что существенно снижает эффективность, достоверность и информативность проводимой диагностики с точки зрения практической медицины.
Наиболее близким к предлагаемому изобретению является устройство для измерения движения потока в жидкости, в том числе и для кожного кровотока (Патент США 4476875, 1984 г.), в котором, по мнению авторов описываемого устройства, устранены некоторые из этих недостатков за счет использования двухканальной схемы обработки сигнала (фиг. 1). Устройство содержит источник первичного лазерного излучения, систему транспортировки первичного излучения, включающую в себя оптическое волокно, систему приема вторичного излучения, включающую в себя два оптических волокна, два канала электронной обработки сигнала, вход каждого из которых выполнен с возможностью соединения с одним из оптических волокон системы приема вторичного излучения, при этом схема каждого канала содержит фотоприемное устройство, фильтр высоких частот, усилитель и аналоговый делитель, включающий в себя первый вход и второй вход, фотоприемное устройство выполнено с возможностью параллельного соединения с фильтром высоких частот и со вторым входом аналогового делителя, фильтр высоких частот выполнен с возможностью соединения с усилителем, а усилитель выполнен с возможностью соединения с первым входом аналогового делителя; а также дифференциальный усилитель, входы которого выполнены с возможностью соединения с выходами аналоговых делителей двух каналов, и схему вычисления показателя перфузии, вход которой выполнен с возможностью соединения с выходом дифференциального усилителя. Монохроматический свет от лазерного источника 1 передается через оптическое волокно системы транспортировки первичного излучения 2 на область исследования кровотока (поверхность кожи) 3. Часть светового потока с доплеровским смещением, рассеянная от отдельных, прилегающих друг к другу объемов освещаемой ткани 3.1 и 3.2, собирается и передается через оптические волокна системы приема вторичного излучения 4 и 4′ на два отдельных фотоприемных устройства (ФПУ) 5 и 5′ в каналах электронной обработки сигнала I и II соответственно.
В этих каналах широкополосные выходные сигналы с ФПУ 5 и 5′ поступают на фильтры высоких частот (ФВЧ) 6 и 6′, в которых удаляется постоянная составляющая сигналов. Оставшиеся переменные составляющие сигналов усиливаются в малошумящих линейных усилителях 7 и 7′, и впоследствии нормируются в делителях 8 и 8′. Нормировка сигналов осуществляется путем деления выходных сигналов X1 и X2 с усилителей 7 и Т на суммарные выходные сигналы Y1 и Y2 с ФПУ 5 и 5', в результате чего выходные сигналы Z1 и Z2 с делителей 8 и 8′ становятся независимыми (по крайней мере, в некоторой степени) от изменений мощности лазерного источника.
Связанные с кровотоком выходные нормированные сигналы Z1 и Z2 с делителей 8 и 8′ в каналах I и II, соответственно, поступают на дифференциальный усилитель 9 и далее, с выхода дифференциального усилителя 9 на схему вычисления показателя перфузии 10, где происходит окончательная обработка сигнала. Схема вычисления показателя перфузии 10 включает в себя полосовой фильтр, усилитель, выпрямитель, дифференциатор, делитель и два усреднителя, последовательно соединенные между собой.
Поскольку высокоамплитудные помехи, вызванные интерференцией мод в лазерном пучке, в выходных сигналах с делителей 8 и 8′ синфазны, то они эффективно подавляются в дифференциальном усилителе 9. По этой же причине, широкополосный шум и помехи, вызванные изменениями интенсивности лазерного излучения и внешнего светового фона, также должны отсутствовать в выходном сигнале с дифференциального усилителя 9. Но связанные с кровотоком переменные составляющие выходных сигналов с каналов I и II, наоборот, в основном, усиливаются в дифференциальном усилителе 9, поскольку считается, что они возникают от различных эритроцитов в кровотоке в объемах 3.1 и 3.2 и являются взаимно статистически независимыми реализациями одного и того же стохастического процесса.
Однако такая схема обработки сигнала обладает своим собственным существенным недостатком. Во-первых, предположение о статистической независимости переменных сигналов в каналах I и II верно лишь отчасти. Определенная доля сигнала, образующегося в перекрывающемся объеме 3.3, является коррелированной в обоих каналах, синфазна, поэтому она гасится в дифференциальном усилителе 9, что уменьшает чувствительность прибора. Во-вторых, в выходных сигналах Y1 и Y2 с ФПУ 5 и 5′, которые поступают сразу на делители 8 и 8′, помимо постоянной составляющей сигнала, пропорциональной мощности лазерного излучения, присутствует и переменная составляющая, обусловленная движением крови в ткани, а также ритмическими процессами в системе микроциркуляции крови. Наличие данной переменной составляющей сигнала приводит в рассматриваемой дифференциальной схеме к образованию ложных компонент в спектре полезного сигнала (Лапитан Д.Г., Рогаткин Д.А., Милищинский Э.М., Образование ложного спектра в схеме обработки сигнала приборов лазерной допплеровской флоуметрии серии «ЛАКК», VI Троицкая конференция «Медицинская физика и инновации в медицине» (ТКМФ-6). Сборник материалов. - 2014. - Секция "Биомедицинская фотоника" - С. 2-4). Наглядным подтверждением, иллюстрирующим этот недостаток, является простой расчет. Сигналы, поступающие на делители 8 и 8′, представляют собой гармонические колебания, частоты которых в каналах I и II немного различаются:
Где А1, А2 - амплитуды необработанных переменных сигналов в каналах
I и II; - амплитуды обработанных переменных сигналов в каналах I и
II; А01, А02 - амплитуды постоянных сигналов в каналах I и II, соответственно; ω1 и ω2 - круговые частоты сигналов в I и II каналах. На выходе делителей 8 и 8′ имеем:
где Z1, Z2 - выходные нормированные сигналы с делителей 8 и 8′ в каналах I и II.
Таким образом, нормировка в делителях 8 и 8′ осуществляется на сигнал, в котором присутствуют и постоянная составляющая, и связанная с кровотоком переменная составляющая сигнала.
В дифференциальном усилителе 9 происходит вычитание сигналов и умножение полученного результата на соответствующий коэффициент усиления К. Таким образом, на выходе 9, после всех преобразований, получается разностный сигнал:
где W - итоговый выходной сигнал после всех преобразований.
Как видно из формулы (3), итоговый выходной сигнал W содержит, помимо компонент полезного сигнала, биения с частотами, равными сумме и разности частот полезного сигнала в обоих каналах. Для того чтобы проверить этот теоретически полученный результат, были проведены экспериментальные измерения сигналов Z1, Z2 и W. На вход схемы был подан сигнал с частотой 39,4 Гц. На фиг. 2 представлены осциллограммы, снятые в точках схемы до (фиг. 2а) и после (фиг. 2б) дифференциального усилителя 9. Как видно, в сигнале после дифференциального усилителя (фиг. 2б), помимо основной частоты сигнала 39,4 Гц, присутствуют также биения с низкой 1 и высокой 2 частотой, что согласуется с формулой (3).
Также было проведено теоретическое моделирование данной схемы обработки сигнала в программе Simulink. На входы двух каналов схемы были поданы гармонические сигналы с частотами f1=60 Гц и f2=50 Гц, соответственно. Был получен спектр сигнала на выходе дифференциального усилителя 9, который представлен на фиг. 3. Как видно из фиг. 3, данный спектр, помимо компонент полезных сигналов 1, а также их вторых гармоник 2, содержит компоненты с частотами, равными сумме 3 и разности 4 частот полезного сигнала в обоих каналах: f1+f2=110 Гц и f1-f2=10 Гц, что также согласуется с формулой (3).
Данные биения образуют ложные компоненты в спектре полезного сигнала, передаются дальше по схеме обработки сигнала и приводят к ошибкам вычисляемых прибором частотных параметров показателя перфузии крови (частотных ритмов микроциркуляции). Таким образом, дифференциальная схема прототипа содержит еще один существенный недостаток в виде отсутствия каскадов подавления ложного спектра полезного сигнала, что приводит к возникновению дополнительных приборных ошибок диагностики, за счет чего снижается точность и эффективность диагностики в практическом здравоохранении.
Полученные результаты являются актуальными для всех приборов ЛДФ, реализующих двухканальную схему обработки сигнала. Как указано выше, такие приборы обладают двумя главными недостатками, заключающимися в снижении чувствительности за счет наличия определенной доли синфазного сигнала и в образовании ложных спектров в дифференциальном каскаде.
Для устранения указанных недостатков двухканальной схемы-прототипа авторами предлагается устройство для измерения кожного кровотока, содержащее источник первичного лазерного излучения, систему транспортировки первичного излучения, включающую в себя оптическое волокно, систему приема вторичного излучения, включающую в себя два оптических волокна, при этом волокна обеих систем представляют собой единый жгут оптических волокон, два канала электронной обработки сигнала, вход каждого из которых выполнен с возможностью соединения с одним из оптических волокон системы приема вторичного излучения, при этом схема каждого канала содержит фотоприемное устройство, фильтр высоких частот, усилитель и аналоговый делитель, включающий в себя первый вход и второй вход, фотоприемное устройство выполнено с возможностью параллельного соединения с фильтром высоких частот и со вторым входом аналогового делителя, фильтр высоких частот выполнен с возможностью соединения с усилителем, а усилитель выполнен с возможностью соединения с первым входом аналогового делителя; а также дифференциальный усилитель, входы которого выполнены с возможностью соединения с выходами аналоговых делителей двух каналов; и схему вычисления показателя перфузии, вход которой выполнен с возможностью соединения с выходом дифференциального усилителя. Отличие устройства от прототипа заключается в том, что схема обработки сигнала каждого канала дополнительно включает в себя фильтр низких частот с частотой среза 2 Гц, при этом выход фотоприемного устройства выполнен с возможностью параллельного соединения со входом фильтра низких частот, выход фильтра низких частот выполнен с возможностью соединения со вторым входом аналогового делителя, а система транспортировки первичного излучения дополнительно включает в себя второе оптическое волокно и модель, имитирующую оптические свойства живой биологической ткани без крови.
Техническое решение заключается в модификации схемы прототипа, в первую очередь, путем установки фильтров низких частот (ФНЧ) 11 и 11′ между ФПУ 5 и 5′ и делителями 8 и 8′ (фиг. 4). Это позволит убрать образование ложных спектров. Данные фильтры не пропускают переменные составляющие сигналов Y1 и Y2 в каналах I и II, в результате чего в спектре выходного сигнала с дифференциального усилителя 9 не образуется ложных компонент за счет биений переменных сигналов между двумя каналами. Это можно наглядно проиллюстрировать следующим. Перепишем формулы (1)-(3) в соответствии с предлагаемым изменением:
Где - модифицированные за счет добавления фильтров сигналы, на которые осуществляется нормировка в делителях 8 и 8′.
где - выходные нормированные сигналы с делителей 8 и 8′ в каналах I и II.
Теперь сигнал на выходе дифференциального усилителя 9 выглядит следующим образом:
где - итоговый выходной сигнал после всех преобразований.
Как видно из формулы (6), сигнал содержит только компоненты полезного сигнала. В результате проведенного теоретического моделирования модифицированной схемы предлагаемого устройства был получен "чистый" спектр сигнала на выходе дифференциального усилителя 9 при подаче на входные каналы схемы сигналов с частотами 60 Гц и 50 Гц, соответственно (фиг. 5). Как видно из фиг. 5, данный спектр содержит только компоненты полезных сигналов 1 и не содержит низко- и высокочастотных биений по сравнению со спектром на фиг. 3, что согласуется с формулой (6). Таким образом, использование фильтра, отсекающего переменный сигнал в цепях нормировки доплеровского сигнала Yi, позволяет избавиться от биений в выходном полезном сигнале.
В качестве такого фильтра, как пример реализации, предлагается использовать фильтр низких частот (ФНЧ) Баттерворта 4-го порядка с частотой среза 2 Гц. Принципиальная схема такого ФНЧ представлена на фиг. 6. Данный фильтр представляет собой каскад из двух последовательно соединенных фильтров второго порядка, построенных по топологии Саллена-Кея (Марше Ж., Операционные усилители и их применение, Пер. с франц., Л.: Энергия, 1974. - 216 с.). На фиг. 7 представлена логарифмическая амплитудно-частотная характеристика этого ФНЧ.
Дополнительно для повышения чувствительности устройства предлагается исключить вычитание синфазных коррелированных полезных сигналов на дифференциальном усилителе 9. Для этого предлагается добавить в систему транспортировки первичного излучения второе оптическое волокно 2′, освещающее входящую в эту систему дополнительную светорассеивающую модель 3′, имитирующую оптические свойства живой биологической ткани без крови (например, модель, представленную в патенте RU 2398232, 2010 г.), и сигнал в канал I направить с этой модели (фиг. 4). В этом случае нестабильность мощности источника излучения будет одинаково влиять на оба канала и будет компенсирована на дифференциальном усилителе 9. Внешнее помеховое освещение, если при измерениях модель 3′ располагать рядом с областью исследования кровотока 3 в тех же условиях освещения, также будет компенсировано дифференциальным усилителем 9, однако весь полезный сигнал с области исследования кровотока 3 будет поступать далее на схему вычисления показателя перфузии 10, без вычитания, что существенно увеличивает чувствительность устройства.
Таким образом, использование заявляемого устройства для измерения кожного кровотока позволяет повысить точность получаемых частотных ритмов микроциркуляции за счет очистки сигнала от ложных спектров в дифференциальном каскаде и исключения вычитания синфазных коррелированных полезных сигналов на дифференциальном усилителе, следовательно, устройство обладает более высокой точностью при диагностике и пригодно для решения практических задач медицины.
Устройство для измерения кожного кровотока, содержащее источник первичного лазерного излучения, систему транспортировки первичного излучения, включающую в себя оптическое волокно, систему приема вторичного излучения, включающую в себя два оптических волокна, два канала электронной обработки сигнала, вход каждого из которых выполнен с возможностью соединения с одним из оптических волокон системы приема вторичного излучения, при этом схема каждого канала содержит фотоприемное устройство, фильтр высоких частот, усилитель и аналоговый делитель, включающий в себя первый вход и второй вход, фотоприемное устройство выполнено с возможностью соединения с фильтром высоких частот, фильтр высоких частот выполнен с возможностью соединения с усилителем, а усилитель выполнен с возможностью соединения с первым входом аналогового делителя; а также дифференциальный усилитель, входы которого выполнены с возможностью соединения с выходами аналоговых делителей двух каналов, и схему вычисления показателя перфузии, вход которой выполнен с возможностью соединения с выходом дифференциального усилителя, отличающееся тем, что схема обработки сигнала каждого канала дополнительно включает в себя фильтр низких частот с частотой среза 2 Гц, при этом выход фотоприемного устройства выполнен с возможностью параллельного соединения со входом фильтра низких частот, выход фильтра низких частот выполнен с возможностью соединения со вторым входом аналогового делителя, а система транспортировки первичного излучения дополнительно включает в себя второе оптическое волокно и модель, имитирующую оптические свойства живой биологической ткани без крови.