Штамм бактерий bacillus amyloliquefaciens subsp. plantarum bs89 в качестве средства повышения продуктивности растений и их защиты от болезней
Иллюстрации
Показать всеИзобретение относится к биотехнологии и сельскому хозяйству. Штамм Bacillus amyloliquefaciens subsp. plantarum BS89, обладающий высокой фунгицидной активностью против фитопатогенных грибов и бактерицидной активностью против фитопатогенных бактерий, депонирован в Ведомственной коллекции ФГБНУ ВНИИСХМ под номером RCAM03458. Штамм Bacillus amyloliquefaciens subsp. plantarum RCAM03458 может быть использован в сельском хозяйстве в качестве эффективного средства для защиты растений от фитопатогенных грибов и бактерий, улучшения питания сельскохозяйственных культур и увеличения продуктивности растений. При этом для эффективного использования штамма Bacillus amyloliquefaciens subsp. plantarum BS89 в составе различных биопрепаратов титр бактерий должен составлять 104-109 кл/мл. Изобретение позволяет повысить урожайность сельскохозяйственных культур. 16 табл.
Реферат
Изобретение относится к биотехнологии и сельскому хозяйству и касается нового штамма ризосферных бактерий p. Bacillus в качестве средства для повышения продуктивности растений и их защиты от фитопатогенных микроорганизмов.
Современное высокоэффективное сельскохозяйственное производство невозможно без применения удобрений и средств защиты растений. Так, широкое использование минеральных удобрений, в первую очередь азотных, позволило за последние 50 лет более чем в 5 раз поднять урожайность основных сельскохозяйственных культур в развитых странах. Однако процесс получения и применения минеральных азотных удобрений является наиболее энергоемким - на него расходуется до от 30 до 50% всей энергии, потребляемой в сельскохозяйственном производстве.
В настоящее время известно множество микробиологических препаратов для сельского хозяйства различного назначения: ростостимулирующих, а также подавляющих развитие фитопатогенных бактерий и грибов.
Микроорганизмы могут стимулировать их рост (Azospirillum), связывать азот (Rhizobium), предотвращать заболевания растений (Pseudomonas или Bacillus), или же уничтожать вредных насекомых (Streptomyces).
Известен «Способ обработки семян», описанный в заявке №2170987 Великобритании с приоритетом от 14.02.85 г., МКИ 4 A01C 1/06, опубликованный в ИСМ №10 за 1987 г. Указанный способ предусматривает обработку семян составом, состоящим из микроорганизмов, носителя, например отрубей, и клея, такого как смола гатти. Наиболее благоприятные результаты получаются при обработке семян пшеницы.
Известен патент РФ №2140138 на группа изобретений «Способ предпосевной обработки семян овощных культур и способ получения препарата для предпосевной обработки семян овощных культур» по заявке №98120341 с приоритетом от 13.11.1998 г. на имя ЗАО ССПР «СОРТСЕМОВОЩ», МПК A01C 1/06, опубликовано 27.10.1999 г.
Указанные способы осуществляются с помощью биофунгицидного препарата, содержащего штамм бактерий Bacillus subtilis Ч-13 (депонирован под рег. номером ВНИИСХМ Д-606 в группе эпифитных микроорганизмов). Способ получения биофунгицидного препарата заключается в смешивании культуральной жидкости, содержащей штамм B.s. Ч-13, который предварительно культивируют в жидкой стерильной питательной среде, с эмульсией ПВА, водным разбавителем и стерильным мелом или доломитом в определенных пропорциях. Изобретения позволяют повысить эффективность защиты овощных культур от фитопатогенных грибов путем предпосевной обработки семян.
Известен патент РФ №2099947 на изобретение «Биопрепарат Фитоспорин для защиты растений от болезней» по заявке 96121980 с приоритетом от 15.11.1996 г. на имя Института Микробиологии и вирусологии НАН Украины (UA) и НПО «Башкирское» (RU), МПК A01N 63/00; C12N 1/20; C12R1:125, публикация 27.12.1997 г.
Основу биопрепарата «Фитоспорин» составляет штамм бактерий Bacillus subtilis ВНИИСХМ 128 с концентрацией клеток 109-1010 на 1 мл физраствора в количестве 92-98 об. % и наполнитель в количестве 2-8 об. %. При этом штамм Bacillus subtilis ВНИИСХМ 128 характеризуется высокой антагонистической активностью в отношении фитопатогенных бактерий и грибов, что позволяет использовать его для защиты различных видов сельскохозяйственных (зерновых и бобовых) и декоративных древесных растений путем предпосевной обработки семян.
Известен патент РФ №2478290 на изобретение «Биопрепарат для стимуляции роста и защиты растений от болезней, повышения урожайности и почвенного плодородия» патенту РФ №2478290 (заявка №2011145665) с приоритетом от 11.11.2011 г. на имя ООО «Бациз», МПК A01N 63/02, А01С 1/06, C12N 1/20, C12R 1/07, публикация заявки 20.05.2012 г., патента - 10.04.2013 г.
Биопрепарат содержит биомассу Bacillus amyloliquefaciens ВКПМ В-11008 и гуматы при следующем соотношении компонентов, об. %: биомасса вегетативных клеток и спор бактерий Bacillus amyloliquefaciens ВКПМ В-11008 - 1,24÷4,30×1010 КОЕ/мл культуральной жидкости и содержанием спор 94% от общего количества КОЕ - 99,0, гуматы - 1,0. Биопрепарат позволяет защитить растения от грибных и бактериальных болезней, улучшить фитосанитарное состояние почвы и повысить ее плодородие, увеличить урожайность культур.
Недостатком является ограниченная область применения (только зерновые культуры: пшеница и ячмень), а также необходимость высокого значения титра клеток и спор штамма-продуцента в составе препарата для эффективного его применения.
Известен патент РФ №2528058 на изобретение «Штамм бактерий Bacillus amyloliquefaciens, обладающий фунгицидным и бактерицидным действием, и биологический препарат на его основе для защиты зерновых растений от заболеваний, вызываемых фитопатогенными грибами» по заявке 2013125726 с приоритетом от 04.06.2013 г. на имя ФГУП «ГосНИИгенетика», МПК A01N 63/02, А01С 1/06, C12N 1/20, C12R 1/07, публикация 10.09.2014 г.
Описан штамм бактерий Bacillus amyloliquefaciens ВКПМ В-11475, обладающий фунгицидным и бактерицидным действием. Также предложен биологический препарат для защиты зерновых растений от заболеваний, вызываемых фитопатогенными грибами. Биологический препарат получают путем смешивания активного начала в виде культуральной жидкости указанного штамма с титром 2-3×109 КОЕ/мл и носителя в виде мелкодисперсных гранул диатомита в соотношении по объему 1:3 с последующим высушиванием.
Изобретения позволяют повысить урожайность зерновых растений и уменьшить процент их зараженности фитопатогенными грибами.
Недостатком является ограниченная область применения (только зерновые культуры) и отсутствие у штамма бактерицидной активности.
Известны патентная заявка Китая CN 102703354 (A) от 03.10.2012 г. на бактерии штамма Bacillus amyloliquefaciens subsp. plantarum B203, проявляющего фунгицидный эффект против антракноза клубники и некоторых др. болезней, вызываемых грибами; МПК A01N 63/00, 63/02; A01P 3/00; C12N 1/20; C12R 1/07 и патентная заявка Китая CN 104195072 (A) от 10.12.2014 г. на базе национальной заявки CN 20141385641 с приоритетом от 06.08.2014 г. на бактерии штамма Bacillus amyloliquefaciens subsp. plantarum B232, проявляющего фунгицидный эффект против дотихициевого некроза тополя и некоторых других грибковых болезней; МПК A01N 63/00; A01P 3/00; C12N 1/20; C12R 1/07.
Недостатком описанных штаммов является ограниченная область их применения (клубника, тополь) и отсутствие у них бактерицидной активности. Кроме того, в патентах не указаны титры препарата, при которых они эффективны для контроля грибных болезней клубники и, соответственно, тополя.
Известна патентная заявка Румынии RO 127468 (A2) от 29.06.2012 г. на базе национальной заявки RO 20100001379 с приоритетом от 21.12.2010 г. на изобретение «Штамм Bacillus amyloliquefaciens subsp. plantarum B100 для роста сельскохозяйственных культур», МПК A01N 63/00; C12N 1/20.
Штамм проявляет фунгицидный (продукция липопептидных и поликетидных антибиотиков) и бактерицидный эффект против широкого спектра фитопатогенных грибов в почве и бактериальных болезней фруктовых деревьев, а также стимулирующий эффект за счет эндофитного производства ростовых факторов. Способен продуцировать ряд ферментов: протеазы, лактоназы, амилазы, фитазы и целлюлазы. Способен растворять неорганические соединения фосфора, селена. Может использоваться для укрепления зерна зерновых культур (пшеницы и кукурузы) в регионах с дефицитом селена.
В данной публикации не указан титр Bacillus amyloliquefaciens subsp. plantarum В100, который необходим в препарате при использовании штамма этих бактерий для контроля болезней растений. Недостатком также является ограниченная область применения (зерновые культуры и плодовые деревья).
Известна также международная заявка WO 2012130221 (A2) от 24.03.2012 г. на базе национальной заявки Германии DE 20111015803 с приоритетом от 01.04.2011 г. на изобретение «Средство против фитопатогенных микроорганизмов», МПК A01N 63/00; C07K 14/32; C12N 1/20; C12R 1/07.
Описан новый штамм Bacillus amyloliquefaciens subsp. Plantarum_AB101, который характеризуется высокой эффективностью против болезни корневой гнили ("черная парша") в картофеле, вызванной Rhizoctonia solani.
Разработан противогрибковый препарат Бактериоцин для лечения грибных и других микробных и вирусных инфекций, который получают на основе спор бактерий Bacillus amyloliquefaciens subsp. plantarum AB101, имеющих сильный эффект в отношении грамположительных бактерий.
Штамм Bacillus amyloliquefaciens subsp. Plantarum AB101 продуцирует 10 различных веществ: фунгицидных (различных групп антибиотических веществ: дипептидных, липопептидных и сидерофоров), бактерицидных (поликетидов и бактериоцинов) и антивирусных, против широкого спектра болезней растений и особенно против корневой гнили картофеля, вызываемой фитопатогенным грибом Rhizoctonia solani. Может использоваться в сельском хозяйстве, защите растений и биотехнологии.
В данной публикации не указан титр Bacillus amyloliquefaciens subsp. plantarum AB101, который необходим в препарате при использовании штамма этих бактерий для контроля болезней растений.
Недостатком также является ограниченная область применения - в основном описан эффект против корневой гнили картофеля, вызываемой фитопатогенным грибом Rhizoctonia solani.
Известен патент №2495119 на изобретение «Штамм бактерий Bacillus subtilis 8A в качестве средства повышения продуктивности растений и их защиты от фитопатогенных микроорганизмов» по заявке №2012151104 с приоритетом от 29.11.2012 г. на имя ГНУ ВНИИСХМ Россельхозакадемии, который выбран в качестве прототипа.
Штамм депонирован в коллекции ГНУ ВНИСХМ Россельхозакадемии 14.11.2011 г. под номером RCAM 00876 в качестве средства повышения продуктивности растений и их защиты от фитопатогенных микроорганизмов. Указанный штамм обладает высокой фунгицидной и бактерицидной активностью. Установлена также высокая ростостимулирующая активность штамма Bacillus subtilis 8A и биопрепарата на его основе, что приводит к повышению урожайности растений. Опытным путем подтверждено, что эффективность штамма обусловлена способностью его бактерий создавать с растениями микробно-растительную систему путем колонизирования ризосферы и корневой системы растений.
В связи с тем что штаммы бактерий таксономической группы Bacillus amyloliquefaciens subsp. plantarum депонированы в территориально удаленных от заявителя коллекциях (в том числе в других государствах), а также, что в некоторых публикациях не указан титр штамма бактерий, который необходим при его использовании в биопрепарате, в качестве прототипа выбран доступный заявителю штамм бактерий Bacillus subtilis 8A, депонированный в коллекции ГНУ ВНИСХМ.
Задачей изобретения является выявление штамма ризосферных бактерий, пригодного для использования в сельском хозяйстве в качестве средства для защиты растений от фитопатогенных микроорганизмов, улучшения питания сельскохозяйственных культур, увеличения продуктивности растений, а также позволяющего расширить арсенал подобных средств.
Указанная задача решается за счет того, что в качестве средства повышения продуктивности растений и их защиты от фитопатогенных микроорганизмов в сельском хозяйстве используется штамм ризосферных бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, позволяющий расширить арсенал подобных средств.
Штамм ризосферных бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 был выделен из корней озимой пшеницы с. Лира, произрастающей на черноземных почвах Краснодарского края Российской Федерации.
Штамм депонирован в Ведомственной коллекции полезных микроорганизмов сельскохозяйственного назначения (RCAM) ФГБНУ ВНИИСХМ 09.07.2015 г. под номером RCAM 03458 в качестве средства повышения продуктивности растений и их защиты от фитопатогенных микроорганизмов (копия справки о депонировании прилагается).
Штамм Bacillus amyloliquefaciens subsp. plantarum BS89 характеризуется следующими морфолого-культуральными и физиолого-биохимическими признаками.
Клетки имеют форму правильных палочек с закругленными концами и монополярным перитрихиальным расположением жгутиков. Размер клеток (0,9-1,8) мкм. Штамм образует споры, расположенные в центре клетки, положительно окрашивается по Граму. Через 24 часа роста на жидкой питательной среде наблюдается накопление поли-β-оксибутирата. Рост в жидкой и полужидкой питательной среде микроаэрофильный, метаболизм дыхательный и бродильный. На мясопептонном агаре образует сухие колонии кремового цвета, пастообразной консистенции с неровными изрезанными краями. Диаметр колоний (5-12) мм. Оптимальная температура для роста 33°C. При температуре более 45°C и менее 15°C рост замедленный. Оптимальное значение pH среды 6,8, рост происходит также при pH от 4,5 до 9,0. Штамм гидролизует казеин, желатину, крахмал и лакмусовое молоко. Лакмус при этом обесцвечивается. Штамм обладает сильной каталазной активностью, амилазной, протеазной, липазной и фосфолипазной активностью. Штамм способен расти при 50°C, 10% NaCl и 0,001% лизоцима.
В качестве единственного источника углерода штамм использует с образованием кислоты арабинозу, ксилозу, маннит, глюкозу, галактозу, фруктозу, мальтозу, сорбит, глицерин, декстрин, крахмал и с образованием щелочи рамнозу и дульцит. Использует преимущественно минеральные формы азота - соли аммония и нитраты, а также аминокислоты и белки.
Опытным путем было установлено, что штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 увеличивает урожай растений и проявляет антагонистические свойства по отношению к возбудителям болезней сельскохозяйственных культур, в частности:
- пшеница озимая и яровая - против мучнистой росы (Erysiphe graminis), бурой ржавчины (Puccinia recondita), фузариозной корневой гнили (Fusarium culmorum), базального бактериоза (Pseudomonas syringae);
- ячмень яровой - против плесневения семян (Penicillium, Alternaria), корневых гнилей (Bipolaris sorokiniana), темно-бурой пятнистости (Drechlera sorokiana);
- капуста белокочанная и цветная - против сосудистого бактериоза (Xan-thomonas campestris), черной ножки (Rhizoctonia solani), питиозной корневой гнили (Pythium irregulare);
- картофель - против фитофтороза (Phytophtora infestans), ризоктониоза (Rhizoctonia solani), фузариозного увядания (Fusarium oxysporum);
- сахарная свекла - против корнееда (Pythium debarianum, Phoma betae), церкоспороза (Cercospora beticola).
- подсолнечник - против белой гнили (Sclerotinia sclerotiorum), фомопсиса (Phomopsis helianthi);
- лен - против фузариоза (Fusarium avenaceum Sacc, Fusarium oxysporum v. orthoceros f. lini (Boll) Bilai), бактериоза (Clostridium macerans Schard).
Опытным путем было также установлено, что штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает фунгицидной активностью против фитопатогенных грибов Fusarium culmorum, Fusarium graminearum, Fusarium sporotrichioides, Erysiphe graminis, Phytophtora infestans, Rhizoctonia solani, Pythium irregular, Plasmopara viticola, Uncinula necator, Botrytis cinerea, а также бактерицидной активностью против фитопатогенных бактерий Xan-thomonas campestris, Pseudomonas syringae, Clavibacter michiganense.
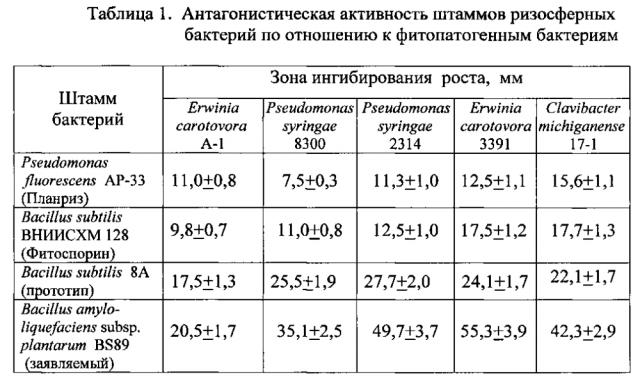
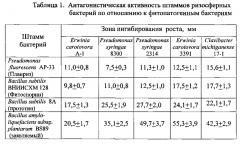
В таблицах 1, 2 представлены результаты проверки антагонистической активности против фитопатогенных микроорганизмов 3-х штаммов ризосферных бактерий: Pseudomonas fluorescens AP-33 (микробный препарат Планриз), Bacillus subtilis ВНИИСХМ 128 (микробный препарат Фитоспорин), Bacillus subtilis 8А (прототип), Bacillus amyloliquefaciens subsp. plantarum BS89 (заявляемый штамм).
Бактерицидную активность проверяли на 5 штаммах фитопатогенных бактерий: Pseudomonas syringae 8300, Pseudomonas syringae 2314, Erwinia carotovora A-1, Erwinia carotovora 3391, Clavibacter michiganense 17-1.
Вначале высевали бактерии бактериологической петлей сплошным газоном на поверхности питательного агара и культивировали 48 часов при 28°C. В день проверки на бактерицидную активность высевали сплошным газоном на голодном картофельном агаре штаммы указанных фитопатогенных бактерий. Затем переносили на поверхность только что засеянной среды вырезанные стерильным пробочным сверлом агаровые блочки со зрелой культурой тестируемых бактерий. Перенос осуществляли с помощью стерильного скальпеля и прокаленного пинцета. Чашки с блочками культивировали в течение 24 часов при температуре 28°C, после чего замеряли диаметр зоны ингибирования вокруг блочков.
Результаты измерений представлены в Таблице 1.
Из данных, приведенных в Таблице 1, видно, что заявленный штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает большей антагонистической активностью по отношению к фитопатогенным бактериям по сравнению с прототипом - штаммом Bacillus subtilis 8А.
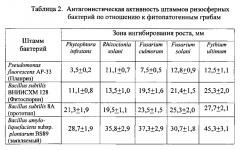
Фунгицидную активность проверяли в отношении 5 фитопатогенных грибов: Phytophtora infestans, Rhizoctonia solani, Fusarium culmorum, Fusarium solani, Pythium ultimum с использованием метода «колодцев».
В разогретый и остывший до температуры 37°C картофельно-декстрозный агар добавляли суспензию спор грибов (105 КОЕ/мл) из расчета 1 мкл суспензии на 1 мл среды. Полученную смесь разливали по чашкам Петри, после застывания в ней делали прокаленным пробочным сверлом 4 ровных сквозных отверстия, расположенных квадратом. В эти отверстия заливали по 100 мкл бактериальной суспензии с титром клеток 108 КОЕ/мл. Одна чашка была оставлена с пустыми «колодцами» как контрольный вариант. Все чашки с «колодцами» культивировали в течение 72 ч при температуре 28°C. Фунгицидную активность определяли как зоны ингибирования роста фитопатогенного гриба вокруг «колодцев». Результаты измерений представлены в Таблице 2.
Из данных, приведенных в Таблице 2, видно, что заявленный штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает большей антагонистической активностью по отношению к фитопатогенным грибам по сравнению со штаммом-прототипом Bacillus subtilis 8А.
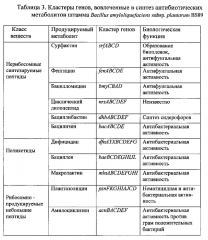
Как показал анализ полногеномного секвенирования, такая активность штамма Bacillus amyloliquefaciens subsp. plantarum BS89 обусловлена наличием в его геноме генов, кодирующих продукцию фунгицидных и бактерицидных веществ: сурфактинов, фенгицинов, бацилломицина Д, циклических липопептидов, бациллобактина, бациллолизина, бациллена, макролактина, плантазолицина, амилоциклизина (Таблица 3).
Нерибосомные синтезированные пептиды (НСП) включают в себя широкий круг структурно неоднородных антибиотических соединений. Наиболее известные и изученные НСП включают сурфактины, фенгицины и итурины.
Итурины и фенгицины известны как основные факторы, определяющие антифунгальную активность различных бацилл [1].
Фенгицины особенно активны в отношении мицелиальных грибов [2].
Сурфактины необходимы для формирования биопленки и распространение бактерий в окружающей среде, тем самым способствуя их колонизации в корнях и тканях растений и проявлению их биоконтрольной активности [3]. Кроме того, сурфактины и, в меньшей степени, фенгицины способны запускать защитные механизмы растений [1].
Кроме липопептидов кластер генов dhb вовлечен в синтез сидерофора бациллибактина. Бактериальные сидерофоры имеют высокое сродство для трехвалентного железа и способны эффективно связывать его в железодефицитных средах, например в грунтах, в результате чего ионы железа становятся менее доступны фитопатогенам и тем самым способствуют биоконтрольной деятельности сидерофор-продуцирующих бактерий [4]. Оперон dhb, управляющий синтезом бациллибактина, сходен с таким же опероном у грамотрицательных бактерий, продуцирующих энтеробактин.
Штамм Bacillus amyloliquefaciens subsp. plantarum BS89 имеет три больших кластера генов, кодирующих поликетиды: дифицидин, бациллен и макролактин (Таблица 3). Все три метаболита обладают широкой антибактериальной активностью в отношении патогенов растений и человека и могут быть потенциально использованы в медицине [5, 6].
Геном штамма Bacillus amyloliquefaciens subsp. plantarum BS89 содержит кластер генов для производства двух рибосомно продуцируемых небольших пептидов: плантазолицина и амилоциклизина (Таблица 3). Плантазолицин является новым типом рибосомально продуцируемых небольших пептидов с узким спектром антимикробной активности в отношении других бацилл, особенно В. anthracis (возбудитель сибирской язвы) [7]. Кроме того, этот метаболит способен подавлять нематоды, образующие галлы (новообразования) на корнях растений. Несколько других грамположительных бактерий, включая Clavibacter michiganensis subsp. sepedonicus, Corynebacterium urealyticum DSM7109 и Brevibacterium linens BL2 также имеют похожий биосинтетический кластер в своих геномах [8]. Амилоциклизин - это циклический пептид, принадлежащий к группе бактериоцинов. Он обладает высокой антибактериальной активностью в отношении тесно связанных грамположительных бактерий - это преимущество может использоваться для подавления бактериальных конкурентов в ризосфере [7]. Кластер генов acn, управляющий синтезом этого бактериоцина, широко распространен среди видов рода Bacillus/Paenibacillus таксономических групп. Еще один небольшой пептид мерасцидин был найден в нескольких видах Bacillus amyloliquefaciens subsp. Plantarum [9], но штамм BS89 содержит лишь фрагментарные части всего кластера генов и может быть не в состоянии синтезировать мерасцидин.
Экспериментально установлено, что штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает не только фунгицидной активностью против фитопатогенных бактерий и фитопатогенных грибов, но и фитостимулирующим эффектом по отношению к различным сельскохозяйственным культурам (например, редис, пшеница).
Анализ ростостимулирующей активности штаммов бактерий проводили по оригинальной методике с использованием растений редиса сорта «Дуро» и пшеницы сорта «Веда». Для этого семена сначала стерилизовали в течение 2-х минут в 70% этаноле и отмывали в стерильной водопроводной воде. Затем семена замачивали на 30 мин в суспензии бактерий с титром клеток 107 КОЕ/мл и раскладывали в стерильные влажные камеры по 20 шт. в 3-кратной повторности. Контрольные семена замачивали в стерильной водопроводной воде. Далее растения инкубировали в фитотроне 72 ч при t=28°C. После инкубирования измеряли длину корешков и побегов, а ростостимулирующую активность тестируемых штаммов бактерий рассчитывали по отношению к контрольным проросткам. Результаты представлены в таблицах 4, 5.
Из данных, приведенных в Таблице 4, видно, что заявленный штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает более сильной ростостимулирующей активностью на проростках редиса по сравнению со штаммом-прототипом Bacillus subtilis 8A.
Из данных, приведенных в Таблице 5, видно, что заявленный штамм бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 обладает более сильной ростостимулирующей активностью на проростках пшеницы по сравнению со штаммом-прототипом Bacillus subtilis 8А.
Высокая ростостимулирующая активность штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 предположительно вызвана способностью продуцировать целый ряд витаминов: тиамина (B1), рибофлавина (B2), никотинат (B3), пантотенат (B5), биотин (B7), фолат (B9), кобаламин (B12), менакуинон (K2) (Таблица 6). Витамины - незаменимые элементы питания, произведенные с помощью различных растений и бактерий [10]. Основная физиологическая роль витаминов состоит в том, чтобы служить в качестве кофакторов в многочисленных метаболических процессах и в качестве антиоксидантов. Из восьми известных витаминов группы B шесть из них были обнаружены в геноме Bacillus amyloliquefaciens subsp. plantarum BS89 аннотации онтологии KEGG (используя KAAS сервер) и интеллектуального анализа генома (Таблица 6). Это: тиамин (B1), рибофлавин (B2), пантотенат (B5), витамин B6 (пиридоксин), биотин (B7) и фолат (B9). Кроме того, был обнаружен белок, синтезирующий кобаламин CobW (Prokka_00310), который участвует в синтезе витамина В12, и двух ферментов, участвующих в метаболизме никотината (витамин B3), а именно никотинат-фосфорибозилтрансфераза (Prokka_02867) и никотинат-нуклеотидпирофосфорилаза (Prokka_02473). Кроме того, в геноме штамма Bacillus amyloliquefaciens subsp. plantarum BS89 была обнаружена диметилметакуинонметилтрансфераза (Prokka_02063) - фермент, который катализирует последний шаг в биосинтезе витамина K2. Эти результаты позволяют предположить, что Bacillus amyloliquefaciens subsp. plantarum BS89 может быть также способен производить витамины B3, В12 и К2.
Ниже приведен пример получения биопрепарата на основе штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 в жидкой форме.
Маточная культура
Для получения маточной культуры штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 использовали жидкую питательную среду КСБ (картофельно-сахарозный бульон), для чего сначала готовили картофельный отвар, нарезав 200 г очищенного картофеля ломтиками и отварив его в 800 мл дистиллированной воды в течение 20 минут, затем отвар отфильтровали через ватно-марлевый фильтр, добавили в него 10 г сахарозы и довели значение pH смеси до 7,0.
Полученную жидкую питательную среду разлили в 750 мл качалочные колбы по 100 мл и стерилизовали 30 минут при 1 атм. Затем провели инокуляцию питательной среды в колбах из расчета: 1 пробирка со скошенным питательным агаром (ПА), содержащим чистую культуру Bacillus amyloliquefaciens subsp. plantarum BS89 на 1 колбу. После этого колбы поместили на качалку (180 об/мин) и культивировали в течение 48 ч при температуре 28°C. Таким образом, в колбах получили маточную культуру Bacillus amyloliquefaciens subsp. plantarum BS89 с титром бактерий около 4·109 КОЕ/мл, которая может храниться в холодильнике до 1 месяца при температуре 4-6°C для последующего засева в ферментеры.
Рабочая культура
Рабочую культуру штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89 для промышленного культивирования получали в ферментерах на среде с мелассой и кукурузным экстрактом. Норма инокуляции маточной культурой 1-3%, продолжительность культивирования 72 часа при температуре 33°C. При выращивании рабочих культур допускается повышение температуры до 37°C. Так получили концентрат бактериальной суспензии на основе штамма Bacillus amyloliquefaciens subsp. plantarum BS89 с титром бактерий не менее 1·109 КОЕ/мл.
Жидкая форма микробного препарата на основе штамма Bacillus amyloliquefaciens subsp. plantarum BS89
Полученный концентрат бактериальной суспензии на основе штамма Bacillus amyloliquefaciens subsp. plantarum BS89 развели стерильной водой в соотношении 1:10 или 1:20 в зависимости от получаемого титра концентрата бактериальной суспензии. Полученную жидкую форму выдерживали в течение 3-5 дней при температуре 20-25°C до получения титра бактерий не менее 1·108 КОЕ/мл препарата, после чего микробный препарат готов к использованию в сельском хозяйстве. Жидкий препарат стерильно разливали в полиэтиленовые бутылки или канистры, предварительно ополаскивая их спиртом.
Срок хранения полученного препарата составляет не менее 24 мес.
Экспериментально установлено, что для эффективного использования штамма Bacillus amyloliquefaciens subsp. plantarum BS89 в составе различных микробных препаратов, концентрация (количество жизнеспособных клеток и спор) его бактерий должна составлять 104-109 клеток в 1 мл культуральной жидкости, так как использование штамма в концентрации менее 104 кл/мл ведет к снижению антагонистического и ростостимулирующего эффекта, а увеличение концентрации свыше 109 кл/мл не приводит к его увеличению.
Эффективность микробного препарата, полученного указанным выше способом на основе заявляемого штамма ризосферных бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, была проверена в вегетационных опытах на озимой пшенице сорта «Веда» и редисе сорта «Дуро Краснодарское»
Для проведения этих опытов сосуды объемом по 3 л (для пшеницы и редиса) набивали почвой до веса 3,4 кг. Перед посадкой семян почву проливали до полной полевой влагоемкости водопроводной водой объемом 200 мл. Семена редиса и пшеницы были предварительно отобраны по размеру, простерилизованы и пророщены в стерильных чашках Петри со стерильной фильтровальной бумагой.
Одинаковые по размеру ростки растений поделили на три части. Одну часть ростков в течение 30 мин инокулировали в жидком препарате на основе штамма-прототипа Bacillus subtilis 8A с титром 107 КОЕ/мл, другую часть - в препарате, полученном указанным выше способом на основе заявляемого штамма Bacillus amyloliquefaciens subsp. plantarum BS89 с титром 107 КОЕ/мл, а третью часть проростков обработали стерильной водой (контроль). Через 25 дней провели измерение биомассы растений редиса, а через 30 дней - измерение биомассы растений пшеницы. Результаты опытов приведены в Таблицах 7 и 8.
Сравнение данных, полученных по результатам вегетационных опытов на пшенице сорта «Веда» и редисе сорта «Дуро Краснодарское», приведенных в таблицах 7 и 8, позволяют сделать вывод, что биопрепарат, полученный на основе заявленного штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, является более эффективным при воздействием на пшеницу и редис по сравнению с препаратом на основе штамма-прототипа Bacillus subtilis 8A.
Опытным путем было установлено, что для обработки семян сельскохозяйственных растений оптимальным является применение 10% раствора микробного препарата на основе заявляемого штамма ризосферных бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, а для вегетирующих растений - (0,1-3)% его раствор.
Эффективность использования штамма Bacillus amyloliquefaciens subsp. plantarum BS89 для увеличения продуктивности и качества продукции была проверена в полевых опытах на зерновых, овощных и технических культурах (яровой, озимой пшенице, ячмене, картофеле, капусте, льне, подсолнечнике, сахарной свекле) с применением трех биопрепаратов: Фитоспорина на основе штамма бактерий Bacillus subtilis ВНИИСХМ 128), препарата на основе штамма-прототипа Bacillus subtilis 8A и препарата на основе заявленного штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, полученного указанным выше способом.
Полевой опыт с яровой пшеницей районированного сорта «Лада» проводили в Краснодарском крае на почве: чернозем мощный среднесуглинистый, среднегумусный, гумус по Тюрину - 3,24%, нитратный азот - 8,3 мг/кг, фосфор - 64 мг/кг, калий - 150 мг/кг, pH водная 6,46.
Полевой опыт проводили согласно методике проведения исследований в Географической сети опытов ВИУА (Оценка эффективности микробных препаратов в земледелии / Под ред. Завалина А.А. - М.: Россельхозакадемия, 2000 г. - 82 с.). Посевная площадь делянки 40 м2, учетная - 30 м2. Повторность опыта четырехкратная. Посев пшеницы проводили на участке, предшественником которой был пар. Фон удобрения - N6P52 (аммофос). Предпосевная обработка - культивация на глубину 5-7 см, норма высева яровой пшеницы 5,0 млн всхожих зерен на гектар.
В день посева часть семян пшеницы ничем не обрабатывали (контроль), другую часть семян обрабатывали жидким биопрепаратом Фитоспорин на основе штамма Bacillus subtilis 128 ВНИИСХМ (стандарт), третью часть семян - жидким биопрепаратом на основе штамма Bacillus subtilis 8A (прототип), а последнюю часть семян - жидким препаратом на основе штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, полученным описанным выше способом. При этом обработку семян пшеницы проводили из расчета на 1 т семян - 1 л соответствующего биопрепарата на 9 л воды с добавлением 20-30 г Na-КМЦ - натриевой соли карбоксиметилцеллюлозы.
Перед посевом проводили культивацию почвы, для чего в нее дополнительно вручную вносили минеральные удобрения в виде аммофоса (N6P52) согласно схеме опыта, после чего осуществляли посев семян пшеницы с выделением определенных посевных зон согласно обработке соответствующим биопрепаратом и зону контроля (без обработки).
Некорневую обработку растений проводили в фазу 3-5 листьев и в фазу конца кущения начала выхода в трубку путем их опрыскивания вручную с помощью ранцевого опрыскивателя из расчета 1 л соответствующего биопрепарата на 300 л воды на гектар.
Агротехника выращивания пшеницы соответствовала зональной технологии. Учет урожая сплошной, поделяночный, произведен комбайном САМПО-130. Урожай приведен к 100% чистоте и 14% влажности. Количество клейковины определяли по ГОСТ 13586.1/68, количество белка - по ГОСТ 10846/91. Статистическая оценка достоверности полученных результатов проведена на основе дисперсионного анализа при 95% уровне значимости. Результаты опыта с яровой пшеницей приведены в Таблице 9.
Полевой опыт с озимой пшеницей сорта «Мироновская 808» проводили в Ульяновской области на почве: чернозем выщелоченный среднемощный суглинистый, среднегумусный, гумус по Тюрину - 2,89%, нитратный азот - 9,5 мг/кг, фосфор - 79 мг/кг, калий - 140 мг/кг, pH водная 6,62.
Посевная площадь делянки 30 м2, учетная - 25 м2. Повторность опыта четырехкратная. Посев пшеницы проводили на участке, предшественником которой был пар. Фон удобрения - N6P52 (аммофос). Предпосевная обработка - культивация на глубину 5-7 см, норма высева озимой пшеницы 4,8 млн. всхожих зерен на гектар.
В день посева часть семян пшеницы ничем не обрабатывали (контроль), другую часть семян обрабатывали жидким биопрепаратом Фитоспорин на основе штамма Bacillus subtilis 128 ВНИИСХМ (стандарт), третью часть семян - жидким биопрепаратом на основе штамма Bacillus subtilis 8A (прототип), а последнюю часть семян - жидким препаратом на основе штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, полученным описанным выше способом.
При этом обработку семян пшеницы проводили из расчета на 1 т семян - 1 л соответствующего биопрепарата на 9 л воды с добавлением 20-30 г Na-КМЦ - натриевой соли карбоксиметилцеллюлозы.
Во всех вариантах опыта посев проводили при дополнительном внесении минерального удобрения в виде аммофоса (N6P52), который вносили вручную под предпосевную культивацию согласно схемы опыта, после чего осуществляли посев семян пшеницы с выделением определенных посевных зон согласно обработке соответствующим биопрепаратом и зоны контроля.
Некорневую обработку растений проводили в фазу кущения и в фазу начала выхода в трубку путем их опрыскивания вручную ранцевым опрыскивателем из расчета 1 л соответствующего биопрепарата на 200 л воды на 1 га.
Агротехника выращивания озимой пшеницы соответствовала зональной технологии. Уборку урожая проводили комбайном САМПО-130. Урожай приведен к 100% чистоте и 14% влажности. Количество клейковины определяли по ГОСТ 13586.1/68.
Статистическая оценка достоверности полученных результатов проведена на основе дисперсионного анализа при 95% уровне значимости.
Результаты опыта с озимой пшеницей приведены в Таблице 10.
Полевой опыт с яровым ячменем, сорт «Прерия», проводили в Краснодарском крае на почве: чернозем мощный среднесуглинистый, среднегумусный, гумус по Тюрину - 3,24%, нитратный азот - 8,3 мг/кг, фосфор - 64 мг/кг, калий - 150 мг/кг, pH водная 6,46.
Посевная площадь делянки 40 м2, учетная - 30 м2. Повторность опыта четырехкратная. Посев ячменя проводили на участке, предшественником которой был пар. Фон удобрения - N6P52 (аммофос). Предпосевная обработка - культивация на глубину 5-7 см, норма высева - 4,0 млн всхожих зерен на 1 га.
В день посева часть семян ячменя ничем не обрабатывали (контроль), другую часть семян обрабатывали жидким биопрепаратом Фитоспорин на основе штамма Bacillus subtilis 128 ВНИИСХМ (стандарт), третью часть семян - жидким биопрепаратом на основе штамма Bacillus subtilis 8A (прототип), а последнюю часть семян - жидким препаратом на основе штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, полученным описанным выше способом. При этом обработку семян ячменя проводили из расчета на 1 т семян - 1 л соответствующего биопрепарата на 9 л воды с добавлением 20-30 г Na-КМЦ - натриевой соли карбоксиметилцеллюлозы.
Перед посевом проводили культивацию почвы, для чего в нее дополнительно вручную вносили минеральные удобрения в виде аммофоса (N6P52) согласно схеме опыта, после чего осуществляли посев семян ячменя с выделением определенных посевных зон согласно обработке соответствующим биопрепаратом и зону контроля (без обработки).
Некорневую обработку растений проводили в фазу 3-5 листьев и в фазу конца кущения начала выхода в трубку путем их опрыскивания вручную с помощью ранцевого опрыскивателя из расчета 1 л соответствующего биопрепарата на 300 л воды на 1 гектар.
Агротехника выращивания ярового ячменя соответствовала зональной технологии. Учет урожая - сплошной, поделяночный, произведен комбайном САМПО-130. Урожай приведен к 100% чистоте и 14% влажности.
Количество белка определяли по ГОСТ 10846/91.
Статистическая оценка достоверности полученных результатов проведена на основе дисперсионного анализа при 95% уровне значимости.
Результаты опыта с яровым ячменем приведены в Таблице 11.
Из данных, приведенных в таблицах 9, 10 и 11, следует, что биопрепарат, полученный на основе заявленного штамма бактерий Bacillus amyloliquefaciens subsp. plantarum BS89, оказывает более сильное воздействие на урожайность и улучшение качества зерновых сельскохозяйственных культур по сравнению с биопрепаратом на основе штамма-прототипа Bacillus subtilis 8A.
Полевой опыт с картофелем сорта «Невский» проводили в Ленинградской области на почве: слабоподзолиста