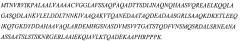Макромолекулярный комплекс бактериального происхождения и его применение для предотвращения или лечения ревматоидного артрита
Иллюстрации
Показать всеПредложен бактериальный макромолекулярный комплекс для профилактики или лечения воспалительного ревматизма и остеоартрита. Комплекс продуцирован штаммом бактерий Bifidobacterium longum CNCM I-3994. Комплекс состоит из цепей, объединяющих липопротеин и олигосахарид. При этом липопротеин имеет молекулярную массу в интервале от 30 кДа до 60 кДа, а олигосахарид - меньше чем 15 кДа и предпочтительно меньше чем 10 кДа. Липопротеиновая компонента, состоящая из всех липопротеинов каждой цепи, составляет от 75 до 99%, предпочтительно от 80 до 98%, более предпочтительно от 85 до 95% по массе от общей массы комплекса, и олигосахаридная компонента, состоящая из всех олигосахаридов, объединенных с каждой из цепей, составляет от 1 до 25%, предпочтительно от 2 до 20% и более предпочтительно от 5 до 15% от общей массы комплекса. Аминокислотная последовательность липопротеина является SEQ ID 2. Сахариды, образующие олигосахаридную компоненту комплекса, выбраны из галактозы (Gal), N-ацетилгалактозамина (Gal Nac), глюкозы (Glc), N-ацетилглюкозамина (Glc Nac), рамнозы (Rham) и маннозы (Man) и смесей вышеперечисленного. Средняя массовая доля Gal составляет 5-20 мкг/мг комплекса, Man 1-10 мкг/мг комплекса, Glc 10-50 мкг/мг комплекса, Gal Nac 2-10 мкг/мг комплекса, Glc Nac 1-5 мкг/мг комплекса, Rham 1-5 мкг/мг комплекса. Липиды, составляющие липопротеиновую компоненту комплекса, выбраны из группы, состоящей из насыщенных жирных кислот длиной C14:0, C16:0 и C18:0 и их смесей. Предложены также фармацевтическая, пищевая и нутрицевтическая композиции на основе указанного комплекса. 5 н. и 7 з.п. ф-лы, 9 ил., 5 табл., 9 пр.
Реферат
Настоящее изобретение касается макромолекулярного комплекса бактериального происхождения и также применения указанного макромолекулярного комплекса для профилактики и лечения ревматоидного артрита.
Многие научные исследования продемонстрировали роль, которую играет флора кишечника в патогенезе хронических ревматических воспалительных заболеваний, таких как ревматоидный артрит, анкилозирующий спондилоартрит или постинфекционный ревматизм.
Например, никаких симптомов артрита не наблюдаются у стерильных животных (трансгенные крысы или мыши), в то время как их однопометные животные, имеющие кишечную флору демонстрируют симптомы артрита (Rath НС, et al; J. Clin. Invest; 98(4); 945-953; 1996 and Abdollahi-Roodsaz S., et al; J. Clin. Invest; 118; 205-216; 2008)
Кроме того, исследования на людях показали, что пациенты, у которых был недавно диагностирован ревматоидный артрит, имели незначительное число бифидобактерий по сравнению с контрольными субъектами (Vaahtovuo J, et al; J. Rheumatol; 35; 690-693; 2008) и, было найдено, что когда равновесие кишечной флоры было частично восстановлено посредством введения вегетарианской диеты, состояние пациента, как улучшалось (Peltonen R, et al; J. Rheumatol; 36; 64-68; 1997). Наконец, известно, что использование некоторых антибиотиков, которые изменяют состав кишечной флоры, улучшает симптомы ревматоидного артрита (Stone M. et al.; J. Rheumatol; 30; 2112-2122; 2003).
Один из механизмов, который объясняет причастность кишечной флоры к патогенезу хронического ревматического заболевания, заключается в ее способности регулировать транслокацию бактерий. Механизм транслокации бактерий определяется как пересечение кишечного барьера кишечными бактериями. Эти кишечные бактерии поглощаются и затем транспортируются клетками иммунной системы кишечника, такими как дендритные клетки или макрофаги, в межсуставные участки, становясь источником воспаления ревматического типа, причиняющего боль в суставах.
Состав кишечной флоры оказывает влияние на этот процесс.Таким образом, когда бифидобактерии широко колонизируют нижнюю часть кишечника, они демонстрируют способность уменьшать транслокацию бактерий (Romond MB, et al.; Anaerobe; 14; 43-48; 2008).
Кроме того, состав кишечной флоры также оказывает влияние на уровень экспрессии генов, вовлеченных в воспалительный ответ, таких как галектины (Romond MB, et al; Ferns Immunol Med Microbiol; 55; 85-92; 2009).
Существует в настоящее время много продуктов, способных модифицировать кишечную флору, такие как пребиотики или пробиотики. С другой стороны, незначительное их количество оказывает положительное влияние на транслокацию бактерий. Среди продуктов, которые имеют благоприятное действие относительно транслокации бактерий, находится макромолекула, выделенная из культуры Bifidobacterium breve. Действительно, было продемонстрировано в документах WO 2004/093898 и WO 2006/040485, что пероральный прием этой макромолекулы приводит к уменьшению транслокации и бактериальной диссеминации и что упомянутая молекула демонстрирует профилактическую активность против коллаген-индуцированного артрита у мышей. Однако, остаточная провоспалительная активность всегда наблюдается при использовании макромолекулы, выделенной из культуры Bifidobacterium breve, таким образом, ограничивая ее использование в области воспалительных заболеваний. Поэтому было бы полезно иметь продукт, который позволял бы уменьшать получаемую транслокацию бактерий и который не проявлял какой-либо остаточной провоспалительной активности.
Заявитель случайно обнаружил, что применение макромолекулярного комплекса, выделенного из комплекса Bifidobacterium longurn, позволяет удовлетворить эти требования.
Макромолекулярный комплекс в соответствии с настоящим изобретением, продуцированный посредством Bifidobacterium longum штамм CBi0703, депонированный в соответствии с Будапештским договором под номером CNCM 1-3994 от имени BIFINOVE, 23 мая 2008, в Национальной Коллекции Культур Микроорганизмов находящаяся в собственности (поддерживаемая) Institut Pasteur, 25 rue du docteur Roux 75015 Paris.
Указанный макромолекулярный комплекс состоит из цепей, объединяющих липопротеин и олигосахарид, в котором:
- липопротеин имеет молекулярную массу от 30 кДа до 60 кДа;
- олигосахарид имеет молекулярную массу меньше чем 15 кДа и предпочтительно меньше чем 10 кДа;
- липопротеиновая компонента, которая состоит из всех липопротеинов каждой цепи, составляет от 75 до 99%, предпочтительно от 80 до 98%, более предпочтительно от 85 до 95% по массе от общей массы комплекса, и олигосахаридная компонента, который состоит из всех олигосахаридов, связанных с каждой из цепей, составляет от 1 до 25%, предпочтительно от 2 до 20%, и более предпочтительно от 5 до 15% от общей массы комплекса.
Макромолекулярный комплекс включает несколько цепей, объединяющих липопротеин и олигосахарид, причем указанные цепи, являются идентичным или отличаются по природе.
В соответствии с настоящим изобретением, для макромолекулярного комплекса, содержащего несколько цепей, необходимо быть в агломерированной форме, чтобы наблюдался противоревматический эффект. Действительно, введение низкомолекулярных (как правило приблизительно 15-50 кДа) мономерных структур мышам привело к существенному увеличению артритного показателя.
У макромолекулярного комплекса в соответствии с настоящим изобретением поэтому обязательно должна быть молекулярная масса больше чем 150 кДа, предпочтительно больше, чем 400 кДа и особенно предпочтительно больше, чем или равно 600 кДа.
В соответствии с настоящим изобретением, липопротеин содержит аминокислотную последовательность SEQ ID No.1:
Аминокислотная последовательность липопротеина является SEO ID No.2:
Сахариды, образующие олигосахаридную компоненту макромолекулярного комплекса в соответствии с настоящим изобретением могут быть выбраны из галактозы (Gal), N-ацетилгалактозамина (Gal Nac), глюкозы (Glc), N-ацетилглюкозамина (Glc Nac), рамнозы (Rham) и маннозы (Man) и смеси вышеперечисленного.
В соответствии с настоящим изобретением массовая доля сахара, который является частью композиции макромолекулы, составляет от 1% до 25%, предпочтительно от 2% до 20% и еще более предпочтительно от 5% до 15%.
Средняя массовая доля галактозы находится между 1 и 50 мкг/мг макромолекулярного комплекса, предпочтительно между 5 и 20 мкг/мг макромолекулярного комплекса, и маннозы между 0,5 и 10 мкг/мг макромолекулярного комплекса, предпочтительно между 1 и 10 мкг/мг макромолекулярного комплекса; средняя массовая доля глюкозы находится между 3 и 80 мкг/мг макромолекулярного комплекса, предпочтительно между 5 и 50 мкг/мг макромолекулярного комплекса и еще более предпочтительно между 10 и 50 мкг/мг макромолекулярного комплекса; средняя массовая доля N-ацетилгалактозамина находится между 2 и 30 мкг/мг макромолекулярного комплекса, предпочтительно между 2 и 20 мкг/мг макромолекулярного комплекса и еще более предпочтительно между 2 и 10 мкг/мг макромолекулярного комплекса; средняя массовая доля N-ацетилглюкозамина находится между 1 и 10 мкг/мг макромолекулярного комплекса, предпочтительно между 1 и 5 мкг/мг макромолекулярного комплекса; средняя массовая доля рамнозы находится между 0,05 и 10 мкг/мг макромолекулярного комплекса, предпочтительно между 0,05 и 5 мкг/мг макромолекулярного комплекса и еще более предпочтительно между 1 и 5 мкг/мг макромолекулярного комплекса.
Липиды, составляющие липидную компоненту макромолекулярного комплекса в соответствии с настоящим изобретением, могут быть выбраны из группы, состоящей из длинных С14, С16 и С18 насыщенных жирных кислот и их смесей.
Кроме того, было показано, что эта макромолекулярная структура узнается галектином-1 и TLR 6, которые показывают, во-первых, что галактозные остатки находятся во внешнем положении, доступном для рецептора галектина-1 (галектин-1 узнает галактозу, присутствующую в лактозе, и особенно галактозу во внешнем положении, находящуюся в гликоконъюгатах) и, во-вторых, что макромолекулярный комплекс сохраняет липопротеиновые фрагменты, которые могут быть узнаны с помощью липопротеин-специфичной субъединицы комплекса TLR2/6.
Исследования, выполненные заявителем, показали, что введение указанного макромолекулярного комплекса вызывает противоревматическую активность у мышей в модели коллаген-индуцированного артрита.
Эта противоревматическая активность была продемонстрирована посредством нескольких наблюдений:
- улучшение транскриптомного ответа дендритных клеток на транслокацию бактерий у мышей, ассоциированных с биотопом пациента, страдающего от артрита;
- кондиционирование этих дендритных клеток, приводящих к коэволюции с популяцией регуляторных Т-лимфоцитов, ответственных за продукцию интерлейкина-10 (цитокин, который играет важную роль в иммуномодуляции в пищеварительной системе и который имеет, в частности, противовоспалительные эффекты).
Макромолекулярный комплекс в соответствии с настоящим изобретением получали посредством способа, включающего следующие стадии:
(i) инокуляция и инкубация в течение 16-60 ч при анаэробных условиях и при температуре между приблизительно 30°С и 39°С, штамма Bifidobacterium longum, депонированного в соответствии с Будапештским договором под номером CNCM 1-3994 в Collection Nationale de Cultures de Microorga nismes (CNCM) [Национальная Коллекция Культур Микроорганизмов] в питательной среде, содержащей природную или гидролизованную фракцию белка молочной сыворотки, лактозу и антиоксидант;
(ii) отделение указанных бактерий от указанной питательной среды;
(iii) ультрафильтрация супернатанта на фильтрующих мембранах, которых имеют порог фильтрации от 10 до 100 кДа, приводящая к получению концентрированного ультраконцентрата;
(iv) обогащение макромолекулярным комплексом с помощью промывки объемом от 5 до 50 кратного объема концентрированного ультраконцентрата;
(v) очистка макромолекулярного комплекса с помощью хроматографии на молекулярных ситах (гельпроникающей хроматографии) в стерильных условиях, например на геле Superdex 200;
(vi) обработка фракции, выходящей с исключенным объемом и содержащей бактериальный макромолекулярный комплекс
Важно предотвратить окисление во время проведения методики, следовательно, необходимо вводить антиоксидант, такой как аскорбиновая кислота, гидрохлорид цистеина или тиогликолят.
В соответствии с одним примером осуществления питательная среда также содержит другие соединения, такие как дигидрофосфат калия, необходимый для стабилизации значения рН.
В соответствии с одним примером осуществления, инокуляция бифидобактерий в указанную питательную среду может быть выполнена с использованием замороженного концентрата или 16-24 ч прекультур, которые способствуют быстрой пролиферации бактерий.
В соответствии с другим примером осуществления, который может быть объединен с предыдущим, бактерии инокулируют в указанную питательную среду в пропорции 105-1010 колоние-формирующих единиц на мл среды.
В соответствии с одним предпочтительным примером осуществления изобретения, питательная среда содержит 1-20 г/л среды природных или гидролизованных белков молочной сыворотки, 30-80 г/л среды лактозы и 0,1-0,5 г/л среды аскорбиновой кислоты.
В соответствии с другим предпочтительным примером осуществления изобретения, питательная среда содержит 1-20 г/л среды природных или гидролизованных белков молочной сыворотки, 30-80 г/л лактозной среды, 0,1-0,5 г/л среды аскорбиновой кислоты и 0,5-3 г/л среды дигидрофосфата калия.
В соответствии с одним примером осуществления, который может быть объединен с предыдущими примерами, значение рН указанной питательной среды не регулируется во время инкубации.
Наконец, в соответствии с другим примером осуществления, значение рН указанной питательной среды поддерживается между 4 и 7 во время инкубации.
Настоящее изобретение касается применения макромолекулярного комплекса бактериального происхождения в соответствии с настоящим изобретением для предотвращения и лечения болезней суставов, и для регуляции кишечной флоры и транслокации бактерий.
В соответствии с другим аспектом, предметом в соответствии с настоящим изобретением является применение указанного макромолекулярного комплекса бактериального происхождения, полученного в соответствии со способом, описанным ранее, в продуктах, предназначенных для фармацевтической, пищевой и/или нутрицевтической промышленности.
Предметом изобретения является, в частности, фармацевтическая композиция, содержащая по меньшей мере указанный макромолекулярный комплекс в качестве активного ингредиента и по меньшей мере один фармацевтически приемлемый носитель. Массовая концентрация указанного макромолекулярного комплекса составляет от 0,1 мкг/г до 50 мкг/г фармацевтической композиции.
Термин "фармацевтически приемлемый" предназначен, чтобы означать любой носитель, который позволяет не только сохранить иммуномодуляторные свойства макромолекулярного комплекса, полученного в соответствии со способом, описанным ранее, но также и заключать в себе указанный макромолекулярный комплекс.
Применение фармацевтической композиции позволяет регулировать кишечную флору и транслокацию бактерий. Она, следовательно, предназначена для профилактики и лечения воспалительного ревматизма, такого как ревматоидный артрит и анкилозирующий спондилоартрит, остеоартрит и фибромиалгия.
Настоящее изобретение поэтому касается применения фармацевтической композиции для получения лекарства, предназначенного для регуляции кишечной флоры и транслокации бактерий.
Таким образом, изобретение касается фармацевтической композиции для применения для регулирования кишечной флоры и транслокации бактерий.
Изобретение также касается использования фармацевтической композиции для того, чтобы получить лекарство, предназначенное для лечения или предотвращения ревматоидного артрита, остеоартрита и фибромиалгии.
Таким образом, изобретение касается фармацевтической композиции для применения в лечении и профилактике ревматоидного артрита, остеоартрита и фибромиалгии.
Изобретение также касается использования фармацевтической композиции для того, чтобы получить лекарство, предназначенное для лечения ревматоидного артрита и анкилозирующего спондилоартрита, остеоартрита и фибромиалгии.
Таким образом, настоящее изобретение касается фармацевтической композиции для применения в лечении ревматоидного артрита и анкилозирующего спондилоартрита и фибромиалгии. Фармацевтическая композиция в соответствии с настоящим изобретением может быть в любой галеновой форме, требуемой для введения либо перорально людям или животным, например в жидкой форме (сироп, раствор, спрей), либо в твердой форме (порошок, таблетка, гелевая капсула, капсула, порошковый спрей, жевательная резинка, паста, гранулы в их различных формах, для немедленного или программированного высвобождения), или ректально, интраназально, через легочный путь, или парентерально, или в форме, удобной для введения ингаляцией или вдуванием. Предпочтительным способом введения является в большинстве случаев пероральное введение.
Фармацевтическая композиция, содержащая указанный макромолекулярный комплекс, может храниться при температуре от -70°С до +4°С для жидких форм и до +40°С для твердых форм в течение 3 лет.
Кроме того, макромолекулярный комплекс, полученный в соответствии со способом, описанным ранее, может также быть включен как компонент в пищевые композиции.
Следовательно, предметом изобретения является также пищевая композиция, содержащая по меньшей мере макромолекулярный комплекс и по меньшей мере один компонент пищевого продукта. Компонент пищевого продукта может быть, например, молочным препаратом, хлебными злаками и т.д.
Такая пищевая композиция может быть предназначена для людей или животных, и может, в частности, быть в форме диетических или недиетических пищевых продуктов для госпитального использования и использования вне больниц. В частности, эта композиция может быть кишечным раствором.
Массовая концентрация указанного макромолекулярного комплекса составляет от 10 нг/г до 2 мкг/г, предпочтительно от 10 нг/г до 1 мкг/г пищевой композиции.
Наконец, макромолекулярный комплекс, полученный в соответствии со способом, описанным ранее, может быть включен, как компонент пищевого продукта, в нутрицевтические композиции.
Предметом настоящего изобретения является поэтому нутрицевтическая композиция, содержащая по меньшей мере указанный макромолекулярный комплекс и по меньшей мере нутрицевтически приемлемый носитель.
Массовая концентрация указанного макромолекулярного комплекса составляет от 10 нг/г до 5 мкг/г нутрицевтической композиции.
Предполагается, что термин "нутрицевтическая композиция" означает композицию, которая имеет полезные или защитные физиологические эффекты, превышающие те, которых могла бы предоставить обычная пища.
Такая нутрицевтическая композиция может быть в форме пищевых добавок. Эти пищевые добавки могут быть в твердой форме, такой как таблетки, порошки, гелевые капсулы или капсулы или в жидкой форме, такие как напитки или эмульсии.
Нутрицевтическая композиция в соответствии с настоящим изобретением может поэтому использоваться для предотвращения ревматоидного артрита, остеоартрита и фибромиалгии.
Настоящее изобретение поэтому касается применения указанной нутрицевтической композиции для получения пищевой добавки, предназначенной для предотвращения ревматоидного артрита, остеоартрита и фибромиалгии.
Таким образом, изобретение касается нутрицевтической композиции для применения в профилактике ревматоидного артрита, остеоартрита и фибромиалгии.
Фиг.1 изображает узнавание in vitro галектином-1 макромолекулярного комплекса, полученного ферментацией либо при регулируемом рН, либо без регуляции рН в соответствии с настоящим изобретением.
Фиг.2 изображает узнавание, in vitro, рецептором TLR-6 макромолекулярного комплекса, полученного ферментацией либо при регулируемом рН, либо без регуляции рН в соответствии с настоящим изобретением.
Фиг.3 изображает артритный показатель у мышей DBA1 после двух инъекций коллагена с или без лечения с макромолекулярным комплексом, полученным в соответствии с примером 2 (0,2 мг/л, то есть 30-40 мкг/кг).
Фиг.4 изображает развитие артрита, индуцированного коктейлем антител и ЛПС, у мышей DBA1.
Фиг.5 изображает изменение артритного показателя у мышей DBA1, леченных (обработанных) гидролизованным макромолекулярным комплексом (0,2 мг гидролизованного макромолекулярного комплекса/л).
Фиг.6а изображает суставы левых задних конечностей (которые не подверглись инъекции иодацетата натрия: MIA) крыс, принадлежащих контрольной группе, не леченных макромолекулярным комплексом в соответствии с настоящим изобретением.
Фиг.6b изображает суставы левых задних конечностей (которые не подвергались инъекции MIA) крыс, принадлежащих к группе, леченных макромолекулярным комплексом в соответствии с настоящим изобретением.
Фиг.7а и 7b представляют суставы правых задних конечностей (подвергавшихся инъекции MIA) крыс, принадлежащих контрольной группе, не леченных макромолекулярным комплексом в соответствии с настоящим изобретением.
Фиг.7с и 7d представляют суставы правых задних конечностей (подвергавшихся инъекции MIA) крыс, принадлежащих группе, леченных макромолекулярным комплексом в соответствии с настоящим изобретением.
Настоящее изобретение будет проиллюстрировано следующими примерами.
ПРИМЕРЫ
Пример 1: Приготовление и выделение макромолекулярного комплекса в соответствии с настоящим изобретением (рН, регулируемый во время ферментации)
Готовили питательную среду, содержащую следующие компоненты:
- 1-20 г/л белковой основы, составленной из пермеата молочных белков, которые были гидролизированы или находились в нативной форме
- 30-80 г/л лактозы
- 0,1-0,5 г/л аскорбиновой кислоты
- 0,5-3 г/л дигидрофосфата калия.
Первый раствор разводили только с лактозой и стерилизовали при 108°С в течение 130 минут. Второй раствор разводили с оставшимися компонентами и стерилизовали при 121°С в течение 20 минут.
Ферментацию проводили как периодическую ферментацию с регулируемым рН в течение 24 часов.
1 - Периодическая ферментация с регулируемым рН:
Значение рН доводили до значения 6,5, как только два раствора выливали в ферментатор. Питательную среду инокулировали 6-10% (объем/объем) 24-часовым иноку лятом, содержащим между 1×106 и 2×108 колоние-формирующих единиц (CFU) бифидобактерий, производных от штамма Bifidobacterium longum, депонированного под номером CNCM I-3994 в Collection Nationale de Cultures de Microorganismes (CNCM) [Национальная Коллекция Культур Микроорганизмов] на мл питательной среды. Бактерии культивировали при встряхивании без аэрации среды и при температуре 37°С. Значение рН поддерживали при 6,5, добавляя гидроокись натрия (1 н.-3 н.) во время ферментации. Ферментация продолжалась 24 часа, и популяция Bifidobacterium longum в конце культивирования составляла между 2×108 и 1×1010 CFU на мл питательной среды.
2 - Выделение макромолекулярного комплекса
В конце культивирования бактерии удаляли центрифугированием при 13000 g в течение 30 минут при температуре 4°С или микрофильтрацией на кассетах Millistack (Millipore), имеющих площадь поверхности, подходящую для объема ферментации.
Супернатант подвергали ультрафильтрации при температуре окружающей среды и в стерильных условиях на приборе Amicon Pro flux M12 (Millipore). Первую ультрафильтрацию осуществляли на Helicon spiral-wound cartridge (Millipore) с порогом фильтрации 10 кДа.
Супернатант концентрировали более чем 15-кратно, затем промывали непрерывно стерильной водой после осмоса 30-кратным объемом. Полученный 10 кДа ультраконцентрат (ретентат) хранили при 4°С или замораживали для второй ультрафильтрации.
Вторую ультрафильтрацию также осуществляли при температуре окружающей среды и в стерильных условиях на том же самом аппарате как ранее, но оборудованном держателем кассет Pellicon (Millipore). Используемая кассета имеет Biomax type с площадью поверхности 0,5 м2 и порогом фильтрации 100 кДа. 10 кДа ультраконцентрат концентрировали более чем 2-кратно и затем промывали непрерывно 30 объемами воды после осмоса.
Ультраконцентрат >100 кДа хранили до очистки в замороженной или лиофилизованной форме.
Макромолекулярный комплекс, содержавший >100 кДа ультраконцентрат, впоследствии получали в стерильных условиях с помощью эксклюзионной хроматографии на геле Superdex 200 (GE Healthcare). Макромолекулярный комплекс таким образом отделяли и затем элюировали во фракции, выходящей с исключенным объемом (>600 кДа), буфером Трис/50 мМ HCl - 150 мМ NaCl, pH 8,0.
Эту фракцию, выходящую с исключенным объемом, затем обессоливали фильтрацией, затем подвергали диафильтрации с 5-7 объемами стерильной воды после осмоса. Макромолекулярный комплекс таким образом извлекали и хранили в лиофилизованной форме.
Пример 2: Приготовление и выделение макромолекулярного комплекса в соответствии с настоящим изобретением (pH, нерегулируемый во время ферментации)
Состав питательной среды и стадии те же самые, что в примере 1, за исключением того, что в этом примере pH не регулировали во время ферментации, стадия 1 таким образом заменена стадией, описанной ниже.
1 - Периодическая ферментация с нерегулируемым pH во время ферментации:
Значение pH доводили до значения 6,5, как только два раствора выливали в ферментатор. Питательную среду инокулировали с 6 - 10% (объем/объем) 24-часового инокулята, содержащего между 1×106 и 2×108 колоние-формирующих единиц (CFU) бифидобактерий, производных от штамма Bifidobacterium longum, депонированного под номером CNCM 1-3994 в Collection Nationale de Cultures de Microorganismes (CNCM) [Национальная Коллекция Культур Микроорганизмов] на мл питательной среды. Бактерии культивировали при встряхивании без аэрации среды и при температуре 37°С. Значение pH не поддерживали во время ферментации. Ферментация продолжалась 24 часа, и популяция Bifidobacterium longum в конце культивирования составляла между 2×107 и 1×109 CFU на мл питательной среды.
Выделение макромолекулярного комплекса может быть впоследствии осуществлено в соответствии с стадией 2 примера 1.
В оставшейся части настоящего текста С1 обозначает макромолекулярный комплекс, полученный в соответствии с примером 2 настоящего изобретения.
Пример 3: Характеристика макромолекулярного комплекса
Сахарид, белок и липидные компоненты, которые составляют макромолекулярный комплекс, характеризовали качественно и количественно с использованием различных аналитических методов.
Концентрацию белка определяли методом Лори. Она составляла от 80 до 400 мкг/мг порошка (8-40% макромолекулярного комплекса).
Концентрацию сахарида определяли газовой хроматографией после метанолиза (в 0,5 н.
MeOH/HCl), затем дериватизировали с помощью гептафторбутанового ангидрида (20 мкл в 100 мкл безводного ацетонитрила). Она составляла от 20 до 150 мкг/мг порошка (2-15% макромолекулярного комплекса).
- Липопротеин: последовательность SEQ ID No.2 является следующей:
Кроме того, липидная композиция, установленная с помощью газовой хроматографии-масс-спектрометрии, демонстрирует присутствие главных пиков жирных кислот длиной С14:0, С16:0 и С18:0.
- Сахар: сахаридная компонента макромолекулы содержит сахариды, упомянутые в таблице 1 в соответствии со следующими мольными отношениями:
| Таблица 1 | ||||||
| Массовое распределение сахаров, которые входят в состав макромолекулярного комплекса | ||||||
| Gal | Man | Glc | Gal NAc | Glc NAc | Rham | |
| Массовая доля (мкг/мг макромолекулярного комплекса) | 15,35 | 4,95 | 35,10 | 6,75 | 1,5 | 1,45 |
- Макромолекулярный комплекс узнается in vitro галектином-1 (Фиг.1).
В настоящем примере макромолекулярный комплекс в соответствии с настоящим изобретением и получающийся в результате ферментации с регулируемьм или нерегулируемым рН узнается после адсорбции в ячейках микроплашек галектином-1 (визуализация с использованием системы биотин-стрептоавидин). В соответствии с Фиг.1 насыщение наблюдается для концентраций приблизительно от 10 до 20 мкг макромолекулярного комплекса на 10 нг галектина-1.
- Макромолекулярный комплекс узнается in vitro TLR-6 (Фиг.2).
В настоящем примере макромолекулярный комплекс в соответствии с настоящим изобретением, получающийся в результате ферментации с регулируемым или нерегулируемым рН, узнается после адсорбции в ячейках микроплашек TLR6 (визуализация с использованием системы биотин-стрептоавидин). В соответствии с Фиг.2, насыщение наблюдается для концентраций приблизительно от 10 до 20 мкг макромолекулы на 10 нг TLR6. Экспрессия с точки зрения пептидогликанового фрагмента составляет приблизительно от 0,2 до 0,4 мкг пептидогликана на 1 мкг макромолекулы.
Пример 4: Эффект макромолекулярного комплекса С1 у мышей с флорой артрических больных
Для этого исследования используемые мышей разделяли на две группы:
- исследовательская группа, в которой аксенические мыши были ассоциированы с флорой пациента, страдающего от прогрессирующего артрита (FA);
- контрольная группа, в которой аксенические мыши были инокулированы флорой здорового добровольца (FN).
Для исследования использовали потомков от первого до четвертого поколения.
Макромолекулярный комплекс С1 [нерегулируемый рН], вводили перорально в течение 15 дней в дозе 0,2 мг/л (средняя доза, приходящаяся на мышь, находится между 25-50 мкг/кг).
Мышей, которых не кормили с предыдущего дня, подвергали эвтаназии. Селезенку удаляли в стерильных условиях и обрабатывали коллагеназой, чтобы высвободить спленоциты. Дендритные клетки CD11c и лимфоциты CD4(+) Th и Treg выделяли, используя систему MACs. Кишечную флору анализировали в подвздошной кишке, слепой кишке и толстом кишечнике. Транслокацию бактерий оценивали с помощью бактериологического анализа Пейеровых бляшек, печени, легкого, почек и крови.
Результаты сопоставляются в таблице 2 и ясно демонстрируют увеличение уровня бифидобактерий на протяжении всего кишечника мышей, обработанных (леченных) С1, и таким образом показывает благоприятное воздействие введения последнего на флору кишечника.
| Таблица 2 | |||
| Эффект введения макромолекулярного комплекса С1 на кишечную флору | |||
| Контроль | Исследование | Р | |
| Мыши (n) | 6 | 5 | |
| Подвздошная кишка | |||
| E.coli | 5,38±0,6 (5) | 4,89±1,3 (5) | NS |
| Bifidobacteria | 2,68±0,7 (2) | 3,49±1,7 (5) | 0,0398 |
| Слепая кишка | |||
| E.coli | 7,89±0,3 (6) | 7,52±0,4 (5) | NS |
| Bifidobacteria | 3,06±0,4 (3) | 6,43±1,5 (5) | 0,0061 |
| Толстая кишка | |||
| E.coli | 7,61±1,4 (6) | 8,11±0,4(5) | NS |
| Bifidobacteria | 3,0±0,8 (6) | 6,56±1,5 (5) | 0,0057 |
Пример 5: Вовлеченность кишечных бактерий в артрит у мышей DBA1 и эффект макромолекулярного комплекса С1 в соответствии с настоящим изобретением
Для этого исследования были созданы две модели в соответствии с типом выбранной инъекции:
- модель 1: две дозы коллагена с промежутком в три недели вводили мышам DBA1;
- модель 2: инъекция коктейля антиколлагеновых антител (MD Biosciences) с последующей через три дня инъекцией ЛПС (липополисахарида) мышам DBA1.
Независимо от модели эти инъекции вызывают клиническую картину, которая наводит на мысль о РА (ревматоидный артрит). Артритный показатель устанавливали, оценивая покраснение и оттек лап.
Лечение посредством макромолекулярного комплекса С1 начинали либо за 15 дни до первой инъекции индуктора (модель 1 - Фиг.3), либо после появления симптомов (модель 2 - Фиг.4). Концентрации макромолекулярного комплекса С1 находятся между 0,1 мг/л и 0,5 мг/л, то есть оценочные суточные дозы находятся между 10 и 100 мкг/кг массы тела. Эффективная доза находится в пределах диапазона от 30 до 90 мкг/кг в зависимости от артрит-индуцирующей модели (Фиг.3 и 4).
Показатель увеличивается спустя приблизительно десять дней после второй инъекции коллагена в первой модели и спустя 3-4 дня после инъекции ЛПС во втором случае. После трех дней без лечения (модель 2), лечение снова применили (в количественном соотношении 0,2 мг/л, то есть 0,01-0,05 мг макромолекулярного комплекса С1/кг массы тела).
Таблица 3 представляет конкомитантный анализ кишечной флоры и показывает, что интенсивность воспаления суставов более сильное, когда число дендритных клеток селезенки понижается в процессе лечения макромолекулярным комплексом С1 в соответствии с настоящим изобретением, в то время как нет никакой зависимости между этими двумя факторами в отсутствии лечения.
Дело в том, что у леченных мышей наблюдается, что число дендритных клеток селезенки связано не только с популяцией lactobacillae (Lb09), но также и с популяцией Bacteroides caecaux. В отсутствие лечения число дендритных клеток определяется исключительно популяцией lactobacillae. В двух группах мышей чем выше число Lactobacillus 09 в толстом кишечнике, тем меньше дендритных клеток заселяется в селезенку. Однако, корреляция между Lactobacillus 09 и интенсивностью воспаления суставов становится существенной только, когда лечение аннулирует эффект второй популяции lactobacillae (Lactobacillus 081) на дендритные клетки (таблица 3). Корреляция поэтому отмечена между этой популяцией lactobacillae (Lb 081), локализованной в слепой кишке и Пейеровых бляшках, и интенсивностью воспаления в отсутствие лечения, в то время как никакая зависимость не найдена с лечением, хотя популяция Lactobacillus 081 не уменьшается (таблица 3).
В заключение: лечение поэтому не имеет никакого антибактериального эффекта относительно популяции lactobacillus, но влияет на метаболический баланс Lb 081 lactobacillae, один или более конечных продуктов которого могли быть вовлечены в воспаление суставов.
| Таблица 3 | |||
| Корреляция между популяциями бактерий кишечника, артритным показателем и дендритными клетками в соответствии с лечением | |||
| Контрольная мышь | rs* | Р | |
| против артритного показателя | |||
| Расположение | Бактерия | ||
| Тонкий кишечник | Lactobacillus reuteri | -0,736 | 0,04 |
| Streptococcus sp. | -0,812 | 0,02 | |
| Слепая кишка | Lactobacillus sp. 081 | 0,88 | 0,01 |
| Bacteroides fragilis | -0,862 | 0,006 | |
| Толстый кишечник | Streptococcus sp. | -0,986 | 0,0004 |
| Пейеровы бляшки | Lactobacillus sp. 081 | 0,88 | 0,01 |
| Streptococcus sp. | -0,736 | 0,05 | |
| против DCs селезенки | |||
| Тонкий кишечник | Lactobacillus sp. 081 | 0,771 | 0,05 |
| Толстый кишечник | Lactobacillus sp. 09 | -0,829 | 0,01 |
| Мыши, леченные макромолекулярным комплексом | rs* | ||
| Расположение | против артритного показателя | ||
| Слепая кишка | Bacteroides sp. | -0,791 | 0,05 |
| Толстый кишечник | Lactobacillus sp.09 | 0,805 | 0,02 |
| Пейеровы бляшки | Lactobacillus sp.082 | -0,77 | 0,02 |
| против CD | |||
| против | |||
| Слепая кишка | Bacteroides fragilis | DCs селезенки | 0,05 |
| Слепая кишка | Lactobacillus sp.09 | -0,829** | 0,05 |
| * rs = коэффициент Спирмена** корреляция артритного показателя как функция количества дендритных клеток rs=-0,812р<0,05 |
Пример 6: Важность агрегации цепей, составляющих макромолекулярный комплекс С1 в соответствии с настоящим изобретением
Этот пример демонстрирует эффект кислотного гидролиза на противоревматическую эффективность.
28 мг макромолекулярного комплекса, полученного в соответствии с примером 2, растворяли в 100 мл 70% раствора уксусной кислоты. Раствор выдерживали при 75°С в течение 100 минут. Деградацию в низкомолекулярных молекул проверяли хроматографией на Superdex 200 (остаточная концентрация макромолекул составляет около 2,5%). После лиофилизации продукта деградации, которая позволяет удалить уксусную кислоту, порошок растворяют в эквивалентном объеме стерилизованной воды для введения мышам DBA1 (модель 1).
В соответствии с Фиг.5, наблюдается эффект, усугубляющий артрит, причем артритный показатель повышается со временем в группе, в которой лечение проводилось гидролизованной макромолекулой (двумерные повторные измерения Anova, р=5,43852×10-8). В заключение: для того, чтобы наблюдалась противоревматическая активность, необходимо, чтобы фрагменты расщепленного липопротеина, связанного с олигосахаридами, были агрегированы в форме макромолекул.
Пример 7: Сравнение между эффектами введения макромолекулярного комплекса, полученного из штамма Bifidobacterium breve, и комплекса, полученного из штамма Bifidobacterium longum
Таблица 4 демонстрирует эффект лечения посредством макромолекулярного комплекса, полученного из штамма_Bifidob acterium longum (С1), в первую очередь, и сравнивает последний с эффектом, полученным в результате введения макромолекулярного комплекса, полученного из Bifidobacterium breve (как это описано в WO 2006/040485).
В оставшейся части настоящего текста С2 обозначает макромолекулярный комплекс, полученный в соответствии с примером 1 из WO 2006/040485.
Экспериментальный протокол идентичен описанному в примере 4.
Результаты, приведенные в таблице 4, показывают что:
- количество CD4(+) Th лимфоцитов селезенки ниже у мышей, леченных С2 (макромолекулярный комплекс, полученный из штамма Bifidobacterium breve) no сравнению с контрольными мышами или с теми, которых лечили С1 (макромолекулярный комплекс, полученный из штамма Bifidobacterium longum);
- количество Treg лимфоцитов (регуляторные клетки) ниже у мышей, леченных С2 по сравнению с контрольными мышами или с теми, с которых лечили С1. Эти результаты, таким образом, показывают, что лечение менее эффективно в случае введения макромолекулярного комплекса, полученного из штамма Bifidobacterium breve, чем макромолекулярным комплексом, полученным из штамма Bifidobacterium longum, депонированного под номером CNCM 1-3994. Действительно, введение комплекса в соответств