Модифицированный генетически кодируемый фотосенсибилизатор
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и может быть использовано для рекомбинантного получения мутантов фототоксического флуоресцентного белка. Рекомбинантным путем получают мутанты фототоксического флуоресцентного белка KillerRed. Мутант KillerOrange с SEQ ID NO: 02 содержит замены Y68W, D115G, N147S, F179L, Y223H и E238Q, а KillerGreen с SEQ ID NO: 04 содержит замены V46A, Y68W, А74Т, D115G, N147S, Y223H и E238Q. Изобретение позволяет получить мутанты фототоксического флуоресцентного белка KillerRed, обладающие измененными спектральными характеристиками. 6 н.п. ф-лы, 3 ил., 1 табл., 5 пр.
Реферат
Предлагаемое изобретение относится в основном к области биологии и химии, и направлено, в частности, на флуоресцентные белки.
Флуоресцентные белки, включая зеленый флуоресцентный белок (Green Fluorescent Protein, GFP), его мутанты и гомологи, сегодня широко известны благодаря их интенсивному использованию в качестве флуоресцентных маркеров in vivo в биомедицинских исследованиях, что детально рассмотрено Lippincott-Schwartz и Patterson в Science (2003) 300(5616):87-91.
Флуоресцентные белки - это белки, которые способны к флуоресценции при облучением светом подходящей длины волны. Флуоресцентные свойства этих белков обусловлены взаимодействием двух или более аминокислотных остатков, формирующих хромофор, а не флуоресценцией какого-либо одного аминокислотного остатка.
GFP гидромедузы Aequorea aequorea (синоним A. victoria), был описан Johnson et al. в J Cell Comp Physiol. (1962), 60:85-104, как часть биолюминесцентной системы медузы, где GFP играет роль вторичного эммитера, преобразовывающего синий свет от фотобелка экворина в зеленый свет кДНК, кодирующая A. victoria GFP была клонирована Prasher et al. (Gene (1992), 111(2):229-33). Оказалось, что этот ген может быть гетерологично экспрессирован в практически любом организме благодаря уникальной способности GFP автокаталитически образовывать хромофор (Chalfie et al., Science 263 (1994), 802-805). Эти сведения открыли широкие перспективы для использования GFP в клеточной биологи, в качестве генетически кодируемой флуоресцирующей метки.
GFP был использован в широком спектре приложений, включая исследование экспрессии генов и локализацию белков (Chalfie et al., Science 263 (1994), 802-805, and Heim et al. in Proc. Nat. Acad. Sci. (1994), 91: 12501-12504), как инструмент для визуализации внутриклеточного распределения органелл (Rizzuto et al., Curr. Biology (1995), 5: 635-642), для визуализации транспорта белков по секреторному пути (Kaether and Gerdes, FEBS Letters (1995), 369: 267-271).
Были проведены многочисленные исследования для улучшения свойств avGFP (Aequorea victoria GFP) и для получения вариантов GFP, пригодных и оптимизированных для различных исследовательских целей. Была проведена оптимизация генетического кода avGFP (codon usage) для повышения уровня экспрессии в клетках млекопитающих ("гуманизированный" GFP, Haas, et al., Current Biology (1996), 6: 315-324; Yang, et al., Nucleic Acids Research (1996), 24: 4592-4593). Были получены различные мутанты GFP, в том числе "усиленный зеленый флуоресцентный белок" (EGFP), имеющий две аминокислотные замены: F64L и S65T (Heim et al., Nature 373 (1995), 663-664). Другие мутанты являются синим, голубым и желто-зеленым спектральными вариантами avGFP и содержат замены аминокислотных остатков, формирующих хромофор, и\или остатков, формирующих окружение хромофора.
В 1999 г. гомологи GFP были клонированы из небиолюминесцентных видов Anthozoa (Matz et al., Nature Biotechnol. (1999), 17: 969-973). Это открытие продемонстрировало, что эти белки не являются обязательно компонентом биолюминесцентной системы. GFP-подобные белки из Anthozoa обладали большим спектральным разнообразием и включали циановые, зеленые, желтые, красные флуоресцентные белки и фиолетово-синие нефлуоресцентные хромопротеины (CPs) (Matz et al., Bioessays (2002), 24(10):953-959). В дальнейшем кДНК GFP-подобных белков были клонированы из ряда гидроидных медуз и из копепод (Shagin et al., Mol Biol Evol. (2004), 21(5):841-850). Сегодня семейство GFP-подобных белков включает сотни флуоресцентных и окрашенных гомологов GFP. Сходство этих белков с GFP варьирует от 80-90% до менее чем 25% идентичности аминокислотной последовательности.
Были получены кристаллические структура avGFP дикого типа, GFP S65T мутанта и ряда гомологов GFP (Ormo et al. Science (1996) 273: 1392-1395; Wall et al. Nat Struct Biol (2000), 7: 1133-1138; Yarbrough et al. Proc Natl Acad Sci USA (2001) 98: 462-467; Prescott et al. Structure (Camb) (2003), 11: 275-284; Petersen et al. J Biol Chem (2003), 278: 44626-44631; Wilmann et al. J Biol Chem (2005), 280: 2401-2404; Remington et al. Biochemistry (2005), 44, 202-212; Quillin et al. Biochemistry (2005), 44: 5774-5787). Было постулировано, что все члены семейства обладают общей 3D структурой, представляющей собой так называемый бочонок из 11 бета-слоев, образующих компактную встречно-параллельную структуру, внутри которой располагается альфа-спираль, содержащая хромофор. Хромофор формируется путем окислительной циклизации трех консервативных аминокислотных остатков в центральном регионе альфа-спирали (Cody et al., Biochemistry (1993) 32, 1212-1218). Положения аминокислотных остатков, формирующих хромофор, соответствует Ser65-Tyr66-Gly67 региону avGFP. Эти аминокислотные остатки легко могут быть идентифицированы у любого GFP-подобного белка путем выравнивания его последовательности с последовательностью avGFP.
Процесс автокаталитического формирования хромофора белков с различными спектральными свойствами подробно описан в ряде статей и включает несколько химических реакций (Heim et al. Proc Natl Acad Sci USA. 1994; 91:12501-12504; Ormo et al. Science. 1996;273:1392-1395; Yang et al. Nat Biotechnol. 1996; 14:1246-1251; Brejc et al. J. Proc Natl Acad Sci USA. 1997; 94: 2306-2311; Palm et al. Nat Struct Biol. 1997; 4:361-365; Gurskaya et al., BMC Biochem. 2001; 2:6; Gross et al. Proc Natl Acad Sci USA. 2000; 97:11990-11995; Wall et al. Nat Struct Biol. 2000; 7:1133-1138; Yarbrough et al., J. Proc Natl Acad Sci USA. 2001; 98:462-467; Pakhomov, A.A. and Martynov, V. I. Chem. Biol. 2008, 15, 755- 764; Quillinet al. (2005) Biochemistry 44, 5774- 5787; Yampolsky et al. (2005) Biochemistry 44, 5788-5793; Shu et al. (2006) Biochemistry 45, 9639-9647; Kikuchi et al. (2008) Biochemistry 47, 11573- 11580; Yampolsky et al., Biochemistry, 2009, 48 (33), pp 8077-8082).
Было показано, что флуоресцентный белок KillerRed обладает фототоксическими свойствами, что позволяет использовать его для прицельного уничтожения клеток и биологических молекул (белков, ДНК) непосредственно в живых организмах (Bulina et al., Nat Biotechnol. 2006 Jan; 24(1):95-9; Bulina et al., Nat Protoc. 2006; 1(2):947-53). В неактивном состоянии KillerRed - красный флуоресцентный белок, малотоксический для клеток и белков. Под воздействием зеленого света KillerRed начинает продуцировать активные формы кислорода. Активация фототоксичности белка сопровождается структурной перестройкой хромофора и утратой способности к флуоресценции.
Пространственная организация мономера KillerRed представляет собой типичный для флуоресцентных белков β-бочонок, образованный 11-ю β-сегментами, с центральной δ-спиралью, содержащей хромофор, полученный в результате посттрансляционной модификации хромофор-образующей последовательности Gln65-Ty66-Gly67 (Pletnev et al., J Biol Chem. 2009; 284(46): 32028-32039). В белке KillerRed GFP-подобный домен (β-бочонок) составляют аминокислотные остатки в положениях с 6 по 225, соответствующие положениям с 6 по 229 последовательности avGFP.
Хромофор KillerRed в активной флуоресцентной форме представляет собой планарную бициклическую систему сопряженных двойных связей, состоящую из пятичленного имидазолинонового и фенольного циклов. Фенольный цикл Тук66 принимает цис-ориентацию по отношению к связи Ca-N(66), отвечающую активному флуоресцентному состоянию белка. Эта ориентация стабилизируется двумя водородными связями с Asn145 и через молекулу воды с Thr201. В процессе формирования хромофора Сα атом первого остатка Gln65 принимает sp2 гибридизацию, характеризующуюся плоским тригональным расположением примыкающих связей. При этом, образующаяся частично двойная N-ацилиминная связь N=Cα(Gln65) приводит к расширению сопряженной л-электронной системы, вызывающему сдвиг максимумов длин волн возбуждения и эмиссии в красную область спектра. Ближайшее окружение хромофора сформировано из боковых цепей 17-ти остатков, включая каталитические Arg94 и Glu218. Большинство этих остатков вовлечено в развитую систему водородных связей, как непосредственно, так и через молекулы воды.
Уникальной особенностью пространственной структуры KillerRed является наличие заполненного водой канала, идущего от торца β-цилиндрической архитектуры белка к центральной области хромофора. Этот канал может облегчать доступ кислорода к хромофору, способствовать выходу активных форм кислорода из белка наружу, а также служить проводником протонов или электронов при фотовозбуждении хромофора. Эта особенность, по-видимому, является одним из ключевых структурных факторов наблюдаемых фототоксических свойств белка.
Белок KillerRed является единственным на сегодняшний день GFP-подобным флуоресцентным белком, проявляющим выраженные фототоксические свойства. Создание мутантов этого белка, имеющих иные спектральные характеристики, существенно расширяет возможности прицельной инактивации клеточных белков (метод хромофор-зависимой световой инактивации, CALI, от chromophore-assisted light inactivation), так как открывает возможность, меняя длину волны облучения, прицельно инактивировать светом не один клеточный белок, а несколько. Введение в клетку сразу нескольких фототоксических белков, обладающих различными спектральными характеристиками, позволяет также увеличить общую фототоксичность для клеток при облучении белым светом. Кроме того, создание мутантов, фототоксичность которых активируется светом с длиной волны 450-470 нм, позволяет использовать их в двухфотонной микроскопии.
Предлагаемый в настоящей заявке подход направлен на создание таких мутантов и расширение линейки фототоксических GFP-подобных флуоресцентных белков.
Сущность изобретения
Предлагаемое изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующие мутантные формы KillerRed, обладающие иными спектральными характеристиками, чем исходный белок.
В преимущественных воплощениях указанные белки характеризуются аминокислотной последовательностью, которая отличается от последовательности белка KillerRed по крайней мере заменой Y68W (тирозина в положении 68 на триптофан; здесь и далее аминокислотные остатки указаны в однобуквенном коде, нумерация аминокислот соответствует нумерации аминокислот в KillerRed, SEQ ID NO: 6).
В преимущественных воплощениях указанные белки содержат также несколько дополнительных замен, выбранных из группы V46A, А74Т, D115G, N147S, F179L, Y223H, E238Q.
Примеры аминокислотных последовательностей функциональных белков предлагаемого изобретения приведены в SEQ ID NO: 02 и SEQ ID NO: 04. Примеры их нуклеотидных последовательностей приведены в SEQ ID NO: 01 и SEQ ID NO: 03.
Так же обеспечиваются нуклеиновые кислоты, кодирующие белки предлагаемого изобретения, слитые с сигналом внутриклеточной локализации. Будучи экспрессированы в клетках, эти белки направляются в определенные клеточные компартменты или органеллы, чувствительные к окислению активными формами кислорода.
Молекулы нуклеиновых кислот, которые отличаются от представленных нуклеотидных последовательностей вследствие вырожденности генетического кода так же входят в рамки предлагаемого изобретения.
Белки предлагаемого изобретения могут быть экспрессированы в живых клетках и использованы для прицельного уничтожения целевых белков, выбранных клеток или клеточных популяций, как в клеточной культуре, так и в целых организмах.
В других воплощениях также обеспечиваются векторы, включающие нуклеиновую кислоту предлагаемого изобретения. Кроме того, предлагаемое изобретение обеспечивает кассеты экспрессии, включающие нуклеиновую кислоту предлагаемого изобретения и регуляторные элементы, необходимые для экспрессии нуклеиновой кислоты в выбранной клетке-хозяине. Кроме того, также обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты предлагаемого изобретения.
В других воплощениях обеспечиваются функциональные флуоресцентные белки предлагаемого изобретения, которые кодируются нуклеиновыми кислотами указанными выше (например, выделенные белки имеющие аминокислотные последовательности SEQ ID NO: 02 и SEQ ID NO: 04).
Кроме того, обеспечиваются наборы, содержащие нуклеиновые кислоты или векторы или экспрессионные кассеты, включающие указанные нуклеиновые кислоты предлагаемого изобретения.
Краткое описание представленных фигур
На фиг.1 показано выравнивание белка KillerRed (KillR, SEQ ID NO: 06) и других флуоресцентных белков - хромобелка amn2CP (SEQ ID NO: 7) из антомедузы, на основе которого был получен KillerRed, красного флуоресцентного белка DsRed (SEQ ID NO: 8) из кораллового полипа Discosoma, и зеленого флуоресцентного белка avGFP (SEQ ID NO:9) из медузы Aequorea victoria. Аминокислотные остатки, формирующие хромофор, подчеркнуты. Аминокислотные остатки, чьи боковые цепи погружены внутрь белковой глобулы, показаны на сером фоне.
На фиг.2 представлены спектры возбуждения (1) и эмиссии (2) флуоресценции белка KillerOrange (SEQ ID NO: 1, 2).
На фиг.3 представлены спектры возбуждения (1) и эмиссии (2) флуоресценции белка KillerGreen (SEQ ID NO: 3, 4).
Подробное описание предлагаемого изобретения
Предлагаемое изобретение направлено на молекулы нуклеиновых кислот, которые кодируют мутантные формы KillerRed. Нуклеиновые кислоты настоящего изобретения получены с помощью рекомбинантных технологий. В предпочтительных воплощениях, нуклеиновые кислоты предлагаемого изобретения кодируют белки, обладающие иными спектральными характеристиками, нежели KillerRed. В некоторых воплощениях нуклеиновые кислоты предлагаемого изобретения кодируют мутантные формы KillerRed оперативно слитые с сигналами внутриклеточной локализации.
Также обеспечиваются векторы и кассеты экспрессии, включающие нуклеиновую кислоту предлагаемого изобретения. Кроме того, обеспечиваются клетки, стабильные клеточные линии, трансгенные животные и трансгенные растения, включающие нуклеиновые кислоты, векторы или экспрессионные кассеты предлагаемого изобретения.
В других воплощениях обеспечиваются функциональные флуоресцентные белки предлагаемого изобретения, которые кодируются нуклеиновыми кислотами, указанными выше.
Указанные белковые и нуклеотидные композиции применяются во многих различных приложениях и методах, в частности, в приложениях инактивации целевых белков и прицельного уничтожения клеток с помощью облучения светом определенной длины волны. Наконец, обеспечиваются наборы для их использования в таких методах и приложениях.
Определения
Различные термины, относящиеся к биологическим молекулам предлагаемого изобретения, используются выше и также в описании и в формуле изобретения.
Как здесь используется, термин "флуоресцентный белок" означает белок, относящийся к семейству GFP-подобных белков, который содержит GFP-домен и обладает способностью к флуоресценции; например, он может проявлять низкую, среднюю или интенсивную флуоресценцию при облучении светом с подходящей для возбуждения длиной волны. Флуоресцентное свойство этих белков представляет собой такое свойство, которое является результатом работы хромофора, образующегося путем автокаталитической циклизации трех или более аминокислотных остатков в полипептидной цепи. Как таковые флуоресцентные белки предлагаемого изобретения не включают белки, которые обладают флуоресценцией за счет отдельных флуоресцирующих остатков, таких как триптофан, тирозин и фенилаланин.
Как здесь используется, термин "avGFP" относится к зеленому флуоресцентному белку из медузы Aequorea victoria, включая варианты avGFP, известные из уровня техники, сконструированные для обеспечения большей флуоресценции или флуоресценции в других цветовых областях. Последовательность дикого типа avGFP была раскрыта в Prasher et al. (1992, Gene 111:229-33).
Термин "гуманизированный" относится к изменению нуклеотидной последовательности флуоресцентного белка, сделанной для оптимизации генетического кода кодонов для экспрессии в клетках млекопитающих (Yang et al., 1996, Nucleic Acids Research 24:4592-4593).
Как здесь используется, термин "выделенный" означает молекулу или клетку, которые находятся в среде, отличной от среды, в которой молекула или клетка находятся в естественных условиях.
Как здесь используется, термин "мутант" или "производное" относятся к белку, раскрытому в предлагаемом изобретении, в котором одна или более аминокислот добавлены и/или замещены и/или удалены (делетированы) и/или вставлены (инсертированы) в N-конец и/или С-конец, и/или в пределах нативных аминокислотных последовательностей белков настоящего изобретения. Как здесь используется, термин "мутант" относится к молекуле нуклеиновой кислоты, которая кодирует мутантный белок. Кроме того, термин "мутант" здесь относится к любому варианту, который короче или длиннее белка или нуклеиновой кислоты.
Как здесь используется, "гомология" - это термин, использующийся для описания взаимосвязи последовательностей нуклеотидов или аминокислот с другими последовательностями нуклеотидов или аминокислот, которая определена степенью идентичности и/или сходства между указанными сравниваемыми последовательностями.
[001] Как здесь используется, аминокислотная или нуклеотидная последовательности "по существу сходны" или "по существу такие же как референсная последовательность, если аминокислотная или нуклеотидная последовательности имеют, по крайней мере, 85% идентичности с указанной последовательностью внутри выбранного для сравнения региона. Таким образом, по существу сходные последовательности включают те, которые имеют, например, по крайней мере, 85% идентичности, по крайней мере, 90% идентичности, по крайней мере, 95% идентичности или, по крайней мере, 96%, 97%б 98% или 99% идентичности. Две последовательности, которые идентичны одна другой, так же по существу сходны.
Для целей предлагаемого изобретения длина сравниваемых последовательностей флуоресцентных белков соответствует длине GFP-домена. GFP-домен может быть идентифицирован с помощью анализа кристаллической структуры флуоресцентного белка или с помощью выравнивания аминокислотной последовательности белка с avGFP. GFP-домен может быть идентифицирован так же с помощью программ для анализа доменной организации белков, таких как Conserved Domain Database (CDD) и SMART (a Simple Modular Architecture Research Tool). Было показано, что в состав домена, формирующего "бочонок" входят аминокислотные остатки, соответствующие положениям с 6 по 229 последовательности avGFP, где позиции соответствующих аминокислотных остатков определяются с помощью выравнивания аминокислотной последовательности белка с avGFP (рис.1). Для белка KillerRed в состав домена входят аминокислотные остатки, соответствующие положениям с 6 по 225. Было показано, что аминоксилотные фрагменты, не входящие в состав GFP-домена, могут содержать делеции, инсерции и замены аминокислотных остатков; при этом не происходит существенного изменения спектральных свойств флуоресцентного белка (Shimozono et al., Biochemistry 2006, 45, 6267-6271; Crameri et al., Nat. Biotechnol. 1996, 14:315-319).
Процент идентичности последовательностей определяется на основании референсной последовательности. Алгоритмы для анализа последовательности известны в данной области, такие как BLAST, описанный в Altschul et al., J. Mol. Biol., 215, pp.403-10 (1990). Для целей предлагаемого изобретения сравнение нуклеотидных и аминокислотных последовательностей производимое с помощью пакета программ Blast, предоставляемого National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/blast) с использованием содержащего разрывы выравнивания со стандартными параметрами, может быть использовано для определения уровня идентичности и сходства между нуклеотидными последовательностями и аминокислотными последовательностями.
Как здесь используется, термин "подобные флуоресцентные белки" или "по существу сходные флуоресцентные белки" относится к флуоресцентным белкам, которые имеют GFP-домены, идентичные по крайней мере на 85%, как правило идентичные на 90% или более, чаще всего идентичные, по крайней мере, на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%).
В некоторых воплощениях, термин "подобные флуоресцентные белки" или "по существу сходные флуоресцентные белки" относится к флуоресцентным белкам, которые имеют аминокислотные последовательности целого белка, идентичные, по крайней мере, на 85%, как правило, идентичные на 90% или более, чаще всего идентичные, по крайней мере, на 95% или более (например на 96% и более, 97% и более, 98% и более, 99% и более, 100%).
Как здесь используется, термин "функциональный" означает, что нуклеотидная или аминокислотная последовательность может функционировать для указанного испытания или задачи. Термин "функциональный", используемый для описания KillerRed и химерного белка предлагаемого изобретения, означает, что белок имеет фототоксические свойства.
Как здесь используется, "биохимические свойства" относятся к белковому фолдингу (сворачиванию) и скорости созревания, времени полужизни, способности к агрегации, способности к олигомеризации, pH и температурной стабильности, и другим подобным свойствам.
Как здесь используется, "флуоресцентные свойства" или "спектральные свойства " относятся к коэффициенту молярной экстинкции при подходящей длине волны, к квантовому выходу флуоресцентции, форме спектра возбуждения флуоресценции или спектра испускания, длине волны, соответствующей максимуму возбуждения флуоресценции, и длине волны, соответствующей максимуму испускания, отношению амплитуды возбуждения флуоресценции при двух разных длинах волн, отношению амплитуды испускания при двух разных длинах волн, времени жизни возбужденного состояния, и анизотропии оптических свойств. Измеряемая разница может быть определена как количество любого количественного флуоресцентного свойства, например, интенсивность флуоресцентции при определенной длине волны, или интегральная флуоресценция на всем спектре испускания.
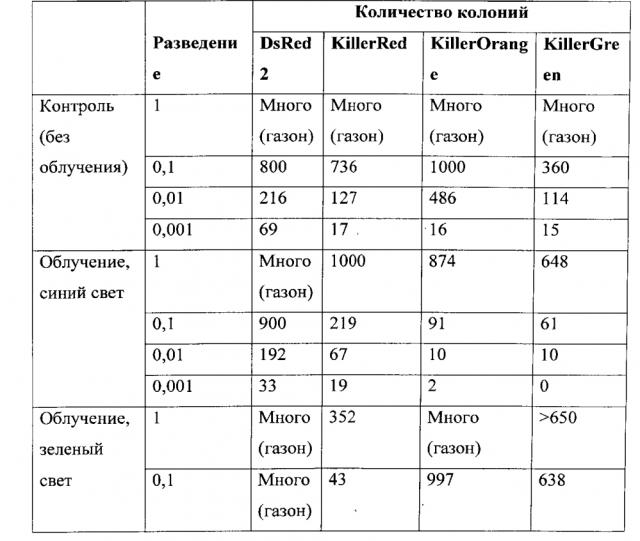
Как здесь используется, термины "фототоксические свойства" или "фототоксичность" относятся к способности белка вызывать повреждение близлежащих молекул, например близлежащих белков, нуклеиновых кислот, и/или липидов, что в свою очередь может вызывать гибель клеток, остановку клеточных делений или нарушение клеточной дифференцировки и/или пролиферации. Для сравнения фототоксических свойств может быть использована бактериальная система. Например, белки могут быть экспрессированы в клетках бактерий (например, Е. coli) путем трансфекции подходящими экспрессирующими векторами, кодирующими указанные белки под контролем промотора, обеспечивающего экспрессию белка в данных бактериальных клетках. Колонии выращивают в течение ночи при 37°C и далее чашки инкубируют при 4°С до полного созревания белков. Для каждого белка отбирают единичную колонию, которую суспендируют в 0.1 мл буфера PBS, после чего половину объема 30 мин облучают активирующим светом определенной интенсивности, а половину оставляют в темноте в качестве контроля. Полученные суспензии клеток высеивают на чашки Петри в различных разведениях и после ночного роста при 37°C подсчитывают число выросших колоний. Чем сильнее фототоксические свойства белка, тем меньше колоний вырастает после облучения.
Ссылка на нуклеотидную последовательность "кодирующую" полипептид означает, что с нуклеотидной последовательности в ходе трансляции и транскрипции мРНК продуцируется этот полипептид. При этом может быть указана как кодирующая цепь, идентичная мРНК и обычно используемая в списке последовательностей, так и комплементарная цепь, которая используется как матрица при транскрипции. Как очевидно для любого специалиста в данной области техники, термин так же включает любые вырожденные нуклеотидные последовательности кодирующие одинаковую аминокислотную последовательность. Нуклеотидные последовательности кодирующие полипептид включают последовательности, содержащие интроны.
Термин "оперативно связанный" или ему подобный при описании химерных белков относится к полипептидным последовательностям, которые находятся в физической и функциональной связи одна с другой. В наиболее предпочтительных воплощениях, функции полипептидных компонентов химерной молекулы не изменены по сравнению с функциональными свойствами выделенных полипептидных компонентов. Например, белок настоящего изобретения может быть сшит с представляющим интерес партнером слияния. В этом случае химерный белок сохраняет фототоксические свойства белка предлагаемого изобретения, а представляющий интерес полипептид (например, сигнал определенной внутриклеточной локализации) сохраняет его оригинальную биологическую активность. Например, когда белок предлагаемое изобретения сшит с представляющим интерес сигналом внутриклеточной локализации, химерный белок сохраняет флуоресценцию и фототоксичность, но локализуется в определенном клеточном компартменте. Как очевидно для любого специалиста в данной области техники, нуклеотидные последовательности, кодирующие химерный белок, включающий "оперативно связанные" компоненты (белки, полипептиды, линкерные последовательности, белковые домены и т.д.), состоят из фрагментов, кодирующих указанные компоненты, где эти фрагменты ковалентно связаны таким образом, что в ходе трансляции и транскрипции нуклеотидной последовательности продуцируется полноразмерный химерный белок. Иными словами, фрагменты соединены таким образом, что в местах их соединения отсутствуют 'сбойки' рамки считывания и стоп-кодоны.
Молекулы нуклеиновых кислот
Предлагаемое изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующие мутант белка KillerRed, имеющий измененные спектральные характеристики. В частности, предлагаемое изобретение обеспечивает выделенные молекулы нуклеиновых кислот, кодирующие белок, имеющий аминокислотную последовательность, выбранную из SEQ ID NO: 02, 04 и подобную ей. Примеры нуклеотидных последовательностей, обеспечиваемых предлагаемым изобретением, показаны в SEQ ID NO: 01 и SEQ ID NO: 03.
Как здесь используется, молекула нуклеиновой кислоты это молекула ДНК, такая как геномная ДНК или кДНК молекула, или молекула РНК, такая как молекула мРНК. Как здесь используется, термин "кДНК" относится к нуклеиновым кислотам, которые обладают размещением элементов последовательности найденным в нативных зрелых видах мРНК, где элементы последовательности - это экзоны и 5′ и 3′ некодирующие области.
[002] Молекула нуклеиновой кислоты, кодирующая белок согласно данному изобретению может быть синтезирована из подходящих нуклеозидтрифосфатов. Метод хорошо описан в известных в данной области протоколах. Например, доступность информации о последовательности аминокислот (например, SEQ ID NO: 02 или SEQ ID NO: 04) или информации о нуклеотидной последовательности (например, SEQ ID NO: 01 или SEQ ID NO: 03) дает возможность изготовить выделенные молекулы нуклеиновых кислот настоящего изобретении с помощью олигонуклеотидного синтеза. В случае информации о последовательности аминокислот, несколько нуклеиновых кислот отличающихся друг от друга вследствие вырожденности генетического кода может быть синтезировано. Методы выбора вариантов кодонов для требуемого хозяина хорошо известны в данной области.
Синтетические олигонуклеотиды могут быть приготовлены с помощью фосфорамидитного метода, и полученные конструкты могут быть очищены с помощью методов хорошо известных в данной области, таких как высокоэффективная жидкостная хроматография (ВЭЖХ) или других методов как описано, например, в Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd Ed., (1989) Cold Spring Harbor Press, Cold Spring Harbor, NY, и по инструкции, описанной в, например, United States Dept. of HHS, National Institute of Health (NIH) Guidelines for Recombinant DNA Research. Длинные двухцепочечные молекулы ДНК настоящего изобретения могут быть синтезированы за следующие стадии: несколько меньших фрагментов с необходимой комплементарностью, которые содержат подходящие концы способные к когезии с соседним фрагментом, могут быть. Соседние фргменты могут быть сшиты с помощью ДНК-лигазы или метода, основанного на ПЦР.
[003] В некоторых воплощениях, молекула нуклеиновой кислоты настоящего изобретения - это ДНК (или кДНК) молекула, содержащая открытую рамку считывания, которая кодирует химерный белок настоящего изобретения и способна в подходящих условиях (например, экспрессии белка в клетке-хозяине. Настоящее изобретение так же охватывает нуклеиновые кислоты, которые гомологичны, по существу сходны, идентичны, или получены из нуклеиновых кислот, кодирующих белки настоящего изобретения. Указанные нуклеиновые кислоты находятся в среде, отличной от среды, в которой они находятся в естественных условиях, например, они выделены, представлены в увеличенном количестве, находятся или экспрессированы в системах in vitro или в клетках или организмах, отличных от тех, в которых они находятся в естественных условиях.
Изменения или различия в нуклеотидной последовательности между высоко сходными нуклеотидными последовательностями могут представлять нуклеотидные замены в последовательности, которые возникают в процессе нормальной репликации или дупликации. Другие замены могут быть специально рассчитаны и вставлены в последовательность для определенных целей таких, как изменение кодонов определенных аминокислот или нуклеотидной последовательности регуляторного региона. Такие специальные замены могут быть произведены in vitro с помощью различных технологий мутагенеза или получены в организмах-хозяевах, находящихся в специфических селекционных условиях, которые индуцируют или отбирают эти изменения. Такие специально полученные варианты последовательности могут быть названы "мутантами" или "производными" исходной последовательности.
Нуклеотидные последовательности предлагаемого изобретения кодируют мутанты белка KillerRed, имеющие GFP-домен, который по крайней мере на 85% идентичен (чаще по крайней мере на 90% идентичен, как правило по крайней мере на 95% идентичен) GFP-домену белка KillerRed.
Например, указанный GFP-домен может быть по крайней мере на 96%, 97%, 98%, 99%, или 100% идентичен GFP-домену белка KillerRed. Мутантные или производные нуклеиновые кислоты могут быть получены на матричной нуклеиновой кислоте, выбранной из вышеописанных нуклеиновых кислот, путем модификации, делеции или добавления одного или более нуклеотидов в матричной последовательности или их комбинации, для получения варианта матричной нуклеиновой кислоты. Модификации, добавления или делеции могут быть выполнены любым способом, известным в данной области (см. например Gustin et al., Biotechniques (1993) 14: 22; Barany, Gene (1985) 37: 111-123; и Colicelli et al., Mol. Gen. Genet. (1985) 199:537-539, Sambrook et al., Molecular Cloning: A Laboratory Manual, (1989), CSH Press, pp.15.3-15.108), включая подверженный ошибкам ГЩР (error-prone PCR), shuffling, олигонуклеотид-направленный мутагенез, ПЦР со сборкой, парный ГШР мутагенез, мутагенез in vivo, кассетный мутагенез, рекурсивный множественный мутагенез, экспоненциальный множественный мутагенез, сайт-специфический мутагенез, случайный мутагенез, генная реассемблирование (gene reassembly), генный сайт-насыщающий мутагенез (GSSM), искусственное перестройку с лигированием (SLR) или их комбинации. Модификации, добавления или делеции могут быть также выполнены методом, включающим рекомбинацию, рекурсивную рекомбинацию последовательностей, фосфотиоат-модифицированный мутагенез ДНК, мутагенез на урацил-содержащей матрице, мутагенез с двойным пропуском, точечный восстановительный по рассогласованию мутагенез, мутагенез штамма, дефицитного по восстановлениям, химический мутагенез, радоактивный мутагенез, делетационный мутагенез, рестрикционно-избирательный мутагенез, рестрикционный мутагенез с очисткой, синтез искусственных генов, множественный мутагенез, создание химерных множественных нуклеиновых кислот и их комбинации. В некоторых воплощениях флуоресцентные белки, кодируемые мутантными или производными нуклеиновыми кислотами, имеют те же самые флуоресцентные или биохимические свойства как флуоресцентный белок дикого типа. В других воплощениях, мутантные или производные нуклеиновые кислоты кодируют флуоресцентные белки с измененными свойствами.
Кроме того, также обеспечиваются вырожденные варианты нуклеиновых кислот, которые кодируют белки настоящего изобретения. Вырожденные варианты нуклеиновых кислот включают замены кодонов нуклеиновой кислоты на другие кодоны, кодирующие те же самые аминокислоты. В частности вырожденные варианты нуклеиновых кислот создаются, чтобы увеличить экспрессию в клетке-хозяине. В этом воплощении, кодоны нуклеиновой кислоты, которые не являются предпочтительными или являются менее предпочтительными в генах клетки-хозяина, заменены кодонами, которые обильно представлены в кодирующих последовательностях генов в клетке-хозяине, где указанные замененные кодоны кодируют ту же самую аминокислоту. Особенный интерес представляют гуманизированные версии нуклеиновых кислот настоящего изобретения. Как здесь используется, термин "гуманизированный" относится к заменам, сделанным в последовательности нуклеиновой кислоты для оптимизации кодонов для экспрессии белка в клетках млекопитающих (человека) (Yang et al., Nucleic Acids Research (1996) 24: 4592-4593). См. также патент США №5795737, который описывает гуманизацию белков, и раскрытие которого здесь включено ссылкой. Примеры вырожденных вариантов, представляющих интерес, описаны более подробно в экспериментальной части, ниже.
Нуклеиновые кислоты, кодирующие укороченные и удлиненные варианты белков предлагаемого изобретения так же входят в рамки предлагаемого изобретения. Как здесь используется, эти варианты белков содержат аминокислотные последовательности с измененными С-, N-, или обоими концами. В удлиненных вариантах, С- или N-конец белка может содержать дополнительные аминокислотные остатки. В укороченных вариантах одна или более (обычно до 11, чаще до 7 и преимущественно до 5) аминокислотных остатков могут быть удалены из последовательности или заменены на любые другие аминокислотные остатки. Такие модификации не изменяют по существу свойства белков, но могут облегчать белковый фолдинг в клетке-хозяине, снижать способность к агрегации или модулировать другие биохимические свойства белков, например, полупериод распада. В некоторых воплощениях, эти модификации не изменяют биохимические свойства белка. Все виды модификаций и мутаций, указанные выше, осуществляются на уровне нуклеиновой кислоты.
Также обеспечиваются нуклеиновые кислоты, кодирующие химерные белки, состоящие из белка настоящего изобретения и сигнала определенной внутриклеточной локализации. Такие химерные белки могут быть получены путем оперативного соединения нуклеиновой кислоты настоящего изобретения, кодирующей мутант KillerRed, и нуклеиновой кислоты, кодирующей сигнал внутриклеточной локализации. Методы получения таких нуклеиновых кислот хорошо известны специалистам в данной области.
Заявленные нуклеиновые кислоты могут быть выделены и получены по существу в очищенной форме. По существу очищенная форма означает, что нуклеиновые кислоты являются, по меньшей мере, на 50% чистыми, обычно, по меньшей мере, на 90% чистыми и обычно являются "рекомбинантными", то есть, фланкированы одним или более нуклеотидов, - с которыми она обычно не связана в хромосоме, встречающейся в природе в ее естественном организме-хозяине.
Также обеспечиваются вектор и другие конструкции нуклеиновой кислоты, содержащие заявленные нуклеиновые кислоты. Подходящие векторы включают вирусные и невирусные векторы, плазмиды, космиды, фаги и т.д., предпочтительно плазмиды, и используются для клонирования, амплификации, экспрессии, переноса и т.д., последовательности нуклеиновой кислоты предлагаемого изобретения в подходящего хозяина. Выбор подходящего вектора является понятным для квалифицированного специалиста в данной области, и много таких векторов доступны коммерчески. Для приготовления конструкции, полноразмерная нуклеиновая кислота или ее часть обычно вставляются в вектор посредством прикрепления ДНК-лигазой к расщепленному ферментами рестрикции сайту в векторе. Альтернативно, желательная нуклеотидная последовательность может быть вставлена гомологичной рекомбинацией in vivo, обычно, присоединением гомологичных участков к вектору на флангах желательной нуклеотидной последовательности. Гомологичные участки добавляются лигированием олигонуклеотидов или полимеразной цепной реакцией, с использованием праймеров, включающих, например, как гомологичные участки, так и часть желательной нуклеотидной последовательности.
Также обеспечиваются кассеты экспрессии или системы, использованные inter alia для получения заявленных флуоресцентных белков или химерных белков на их основе или для репликации заявленных молекул нуклеиновой кислоты. Кассета экспрессии может существовать как внехромосомный элемент или может быть включена в геном клетки в результате введения указанной кассеты экспрессии в клетку. Для экспрессии генный продукт, кодируемый нуклеиновой кислотой изобретения, экспрессируется в любой удобной системе экспрессии, включая, например, бактериальные системы, дрожжевые, насекомых, земноводных или клетки млекопитающих. В экспрессионном векторе, указанная нуклеиновая кислота является функционально связанной с регуля