Новые конъюгаты олигонуклеотидов и их применение
Иллюстрации
Показать всеИзобретения относятся к области биохимии. Описана группа изобретений, включающая конструкцию терапевтическое средство-полимер для доставки олигонуклеотида, наночастицу для доставки олигонуклеотида, содержащую вышеуказанное терапевтическое средство-полимер, конъюгат антисмысловой олигонуклеотид (ASO)-полимер для доставки антисмыслового олигонуклеотида, наночастицу для доставки антисмыслового олигонуклеотида, содержащую вышеуказанный конъюгат ASO-полимер и способ получения конъюгата ASO-полимер. Изобретение расширяет арсенал средств, позволяющих обеспечить доставку олиго-РНК в организм. 5 н. и 22 з.п. ф-лы, 21 ил., 12 пр.
Реферат
Область техники
Настоящее изобретение имеет отношение к новой конструкции олигонуклеотида с присоединенными к нему гидрофильным и гидрофобным материалами, улучшающими доставку одноцепочечных или двухцепочечных олигонуклеотидов, пригодных для лечения рака и инфекционных болезней, и ее применению.
Первый аспект настоящего изобретения имеет отношение к конструкции двуспиральной олиго-РНК, содержащей мишень-специфический лиганд, связанный с гидрофильным материалом, содержащимся в конструкции, к наночастице, состоящей из соединенных с лигандом двуспиральных олиго-РНК конструкций, фармацевтической композиции, содержащей РНК-конструкцию, фармацевтической композиции, содержащей наночастицу, состоящую из соединенных с лигандом двуспиральных олиго-РНК конструкций, способу получения данной конструкции, способу получения наночастицы, состоящей из РНК-конструкций, и способу доставки связанной с лигандом двуспиральной олиго-РНК конструкции.
Второй аспект настоящего изобретения имеет отношение к конъюгату антисмыслового олигонуклеотида (именуемому в дальнейшем "ASO"), который содержит гидрофильный материал и гидрофобный материал, связанный с двумя концами ASO, путем простой ковалентной связи или ковалентной связи, через промежуточный линкер, для усиления эффективности внутриклеточной доставки ASO, способу получения конъюгата и методу доставки наночастицы, состоящей из ASO конъюгатов.
Уровень техники
С тех пор, как была установлена роль РНК-интерференции (в дальнейшем называемой 'РНКи'), было обнаружено, что РНКи оказывает воздействие на специфическую последовательность мРНК в целом ряде клеток млекопитающих (Silence of the transcripts: RNA interference in medicine. J Mol Med (2005) 83: 764-773). После доставки в клетки длинной двухцепочечной РНК, доставленная РНК разрезается эндонуклеазой dicer на малые интерферирующие РНК (в дальнейшем называемые 'миРНК') длиной 21-23 пар оснований (по). миРНК связывается с RISC (РНК-индуцированный комплекс сайлесинга) и ингибирует экспрессию гена-мишени специфичным к последовательности образом с помощью процесса, в котором антисмысловая цепь распознает и разрушает целевую мРНК (NUCLEIC-ACID THERAPEUTICS: BASIC PRINCIPLES и RECENT APPLICATIONS. Nature Reviews Drug Discovery. 2002. 1, 503-514).
Bertrand et al. сообщил, что миРНК оказывает превосходное ингибирующее действие на экспрессию мРНК in vitro и in vivo по сравнению с антисмысловым олигонуклеотидом (ASO) в отношении одного и того же целевого гена, и что этот эффект является продолжительным (Comparison of antisense oligonucleotides and siRNAs in cell culture и in vivo. Biochem. Biophys. Res. Commun.2002. 296: 1000-1004). Кроме того, поскольку миРНК комплементарно связывается с целевой мРНК для регуляции экспрессии целевого гена специфичным к последовательности образом, ее можно успешно использовать во множестве практических применений по сравнению с обычными лекарственными средствами на основе антител или химическими препаратами (низкомолекулярными лекарственными средствами) (Progress Towards in Vivo Use of siRNAs. Molecular Therapy. 2006 13(4): 664-670).
миРНК демонстрирует превосходные свойства и может иметь широкое применение, однако, для того, чтобы разработать клеточные терапевтические средства на основе миРНК, необходимо улучшить стабильность и эффективность внутриклеточной доставки миРНК, для того, чтобы эффективно доставлять миРНК в клетки-мишени (Harnessing in vivo siRNA delivery for drug discovery and therapeutic development. Drug Discov. Today. 2006 Jan; 11(1-2): 67-73).
В попытке удовлетворить эти требования используются устойчивые к действию нуклеаз аналоги или носители, такие как вирусные векторы, липосомы или наночастицы.
Вирусные носители, такие как аденовирус и ретровирус, имеют высокую эффективность трансфекции, однако несут риски иммуногенности и онкогенности. Тем не менее, известно, что невирусные носители, включающие наночастицы, имеют низкую эффективность внутриклеточной доставки по сравнению с вирусными носителями, однако имеют преимущества, включая высокую безопасность in vivo, мишень-специфическую доставку, эффективное поглощение и интернализацию олигонуклеотидов РНКи в клетки или ткани, низкую цитотоксичность и стимуляцию иммунитета. Таким образом, считается, что эти невирусные носители являются наиболее многообещающим способом доставки, который обеспечивает эффективное ингибирование экспрессии гена-мишени (Nonviral delivery of synthetic siRNAs in vivo. J. Clin Invest. 2007 December 3; 117(12): 3623-3632).
Разработаны системы доставки с использованием различных наночастиц для специфической доставки в раковую опухоль. Подобные системы наночастиц, как правило, создаются таким образом, что поверхность покрывается гидрофильным материалом с целью увеличения времени циркуляции в крови и является положительно заряженной для увеличения эндоцитоза (Active targeting schemes for nanopartical systems in cancer therapeutics. Advanced Drug Delivery Reviews 60 (2008) 1615-1626). В то же время, опухолевая ткань является очень ригидной (устойчивой) и в отличие от нормальной ткани имеет диффузионное ограничение, причем преодолевает диффузионное ограничение посредством образования кровеносных сосудов в близлежащей области путем ангиогенеза, поскольку это диффузионное ограничение оказывает побочное действие на перемещение питательных веществ, необходимых для опухоли, и истощение таких материалов, как кислород и двуокись углерода. Кровеносные сосуды, образованные в опухолевой ткани путем ангиогенеза могут быть подтекающими и дефектными и включают кровеносные сосуды, имеющие щели с размером в пределах примерно от 100 нм до 2 мкм в зависимости от вида опухоли.
Таким образом, наночастицы свободно проходят через эндотелий капилляров опухолевой ткани, имеющей подтекающие и дефектные кровеносные сосуды, по сравнению со структурированными капиллярными сосудами нормальной ткани, так что они легко доставляются в ходе их циркуляции в крови. Кроме того, опухолевая ткань не имеет лимфодренажа, и таким образом, лекарственное средство накапливается в ней. Этот механизм известен как эффект усиленного проникновения и удерживания (EPR). Посредством этого эффекта наночастицы легко доставляются напрямую в опухолевую ткань, а этот механизм известен под названием пассивный таргетинг (пассивное нацеливание) (Nanoparticals for drug delivery in cancer treatment. Urol Oncol. 2008 Jan-Feb; 26(1): 57-64).
С целью преодоления неспецифического распределения in vivo, неспецифического нацеливания (таргетинга) и отсутствия растворимости в воде терапевтических средств, включая противоопухолевые лекарственные препараты, были проведены исследования по оптимизации размера наночастиц, нагруженных лекарственными средствами, или модификации поверхности с целью увеличения времени их циркуляции в крови. В частности, были проведены исследования в отношении полимерных наночастиц, содержащих конъюгаты полимера с лекарственным средством, касающиеся увеличения опухолеспецифической доставки противоопухолевых препаратов путем связывания противоопухолевых препаратов с водорастворимыми, биодеградируемыми материалами, такими как альбумин, поли-L-глутамат (PGA) или сополимер N-(2-гидроксипропил)-метакриламид (Therapeutic Nanoparticals for Drug Delivery in Cancer. Clin Cancer Res 2008; 14: 1310-1316). В дополнение к этому были проведены исследования в отношении соединения амфифильного материала с противоопухолевым препаратом, для того, чтобы получить полимерные мицеллы, состоящие из гидрофобной сердцевины, состоящей из противоопухолевого лекарственного средства, и гидрофильной оболочки (Development of the polymer micelle carrier system for doxorubicin. J Control Release 2001; 74: 295-302).
Таким образом, в том случае, когда гидрофобный материал дополнительно связывается с терапевтическим средством, таким как противоопухолевое лекарственное средство, для увеличения когезионной прочности сердцевины, мицеллы могут образовываться даже при низкой концентрации, и могут формироваться полимерные мицеллы, обладающие повышенной устойчивостью, благодаря гидрофильному материалу оболочки. Терапевтическое средство, имеющее гидрофобный и гидрофильный материалы, связанные с его концами с помощью биодеградируемой связи, может формировать улучшенные полимерные мицеллы, которые могут стабильно доставлять терапевтическое средство в раковую ткань-мишень.
Недавно в качестве технологии доставки двухцепочечной олиго-РНК была разработана технология самосборки наночастицы SAMiRNA, которая образуется за счет свойств материалов, связанных с концами нуклеиновой кислоты (Korean Patent Laid-Open Publication No. 2009-0042297). SAMiRNA представляет собой самособирающуюся наночастицу, состоящую из двухцепочечных олиго-РНК структур с присоединенными к ним гидрофильным и гидрофобным материалами, увеличивающими доставку двухцепочечной олиго-РНК, при этом технология образования SAMiRNA может быть технологией улучшения внутриклеточной доставки двухцепочечной олиго-РНК.
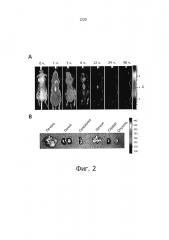
Было обнаружено, что при введении SAMiRNA, меченой флуоресцентной меткой, в хвостовую вену мыши на модели ксенотрансплантата опухоли, наночастица специфично доставлялась в опухоль с помощью упомянутого выше пассивного нацеливания (смотри фиг. 2).
В то же время, наночастицы для активного нацеливания, имеют присоединенный к ним нацеливающий фрагмент. Сообщалось также, что нацеливающий фрагмент вызывает преимущественное накопление наночастиц в ткани-мишени или увеличивает интернализацию наночастиц в клетках-мишенях (Does a targeting ligand influence nanoparticle tumor localization or uptake Trends Biotechnol. 2008 Oct; 26(10): 552-8. Epub 2008 Aug 21).
Активное нацеливание означает увеличение доставки наночастиц в клетки-мишени с использованием нацеливающего фрагмента, такого как антитело или лиганд, связанный с наночастицами. В последние годы были проведены исследования по локализации миРНК в желательной ткани с использованием различных нацеливающих фрагментов, связанных с. миРНК.
Например, было обнаружено, что миРНК с присоединенным к ней α-токоферолом была эффективной, стабильно доставлялась in vivo и ингибировала экспрессию гена-мишени посредством РНК-интерференции (Kazutaka Nishina et al., The American Society of Gene therapy, 2008, 16(4): 734-740). Кроме того, было показано, что миРНК с присоединенным к ней холестерином более эффективно доставлялась в ткань печени по сравнению с проникающим в клетки пептидом (ССР), который в основном используется для доставки миРНК (US-20060014289; Moschos S.A. et al., Bioconjug. Chem. 18:1450-1459). Было сообщено, что эффект доставки объясняется не только специфичностью опухолевой ткани, но также специфичностью клетки, на которую нацеливается прикрепленный нацеливающий фрагмент.
В активном нацеливании используются материалы, обладающие способностью связываться с углеводородами, рецепторами или антигенами, которые являются специфическими для клетки-мишени или сверхэкспрессируются на поверхности клетки-мишени (Nanotechnology in cancer therapeutics: bioconjugated nanoparticals for drug delivery. Mol Cancer Ther 2006; 5(8): 1909-1917). Так что, наночастицы, имеющие связанный с ними активный фрагмент, накапливаются в опухолевой ткани в ходе их циркуляции в крови посредством пассивного таргетинга, причем доставка наночастиц в клетки-мишени увеличивается с помощью нацеливающего фрагмента, таким образом увеличивается терапевтический эффект лекарственного средства, доставленного в клетки. В качестве нацеливающего средства преимущественно используется лиганд или антитело. Лиганд или антитело связывается со своим рецептором на клеточной поверхности с высокой авидностью и специфичностью и способствует интернализации наночастиц с помощью рецептор-опосредованного эндоцитоза (RME) (Kinetic analysis of receptor-mediated endocytosis (RME) of proteins и peptides: use of RME as a drug delivery system. J Control Release 1996; 39: 191-200).
Рецептор клеточной поверхности или антиген, на который нацеливается этот лиганд или антитело, имеет характерную особенность, в том смысле, что он является специфическим для клеток-мишеней или сверхэкспрессируется в клетках-мишенях для облегчения доступа к ним нацеленного лиганда, тем самым увеличивая скорость эндоцитоза. В дополнение к этому, рецептор или антиген доставляет наночастицы с присоединенным к ним лигандом в клетки и возвращается назад на поверхность клетки (Receptor-mediated endocytosis: An overview of a dynamic process. J. Biosci., Oct. 1984, 6(4), pp. 535-542.). Фрагментами, нацеленными на опухоль, являются материалы, которые специфически связываются или с рецепторами, специфически экспрессирующимися на линии клеток-мишеней, такими как эпидермальный фактор роста или рецептор липопротеина низкой плотности, или с опухолеспецифическими рецепторами, такими как фолатный рецептор, которые, как известно, сверхэкспрессируются на поверхности различных раковых клеток (Nanotechnology in cancer therapeutics: bioconjugated nanoparticals for drug delivery. Mol Cancer Ther 2006, 5(8): 1909-1917).
Если нацеленный фрагмент, в частности, рецептор-специфический лиганд, увеличивающий интернализацию посредством рецептор-опосредованного эндоцитоза (RME), связывается с SAMiRNA, он может оказывать эффективное содействие доставке SAMiRNA в клетки-мишени, в частности, раковые клетки, и таким образом, SAMiRNA может доставляться в целевые клетки даже при относительно низкой концентрации и дозе, так что двухцепочечная олиго-РНК может демонстрировать высокую активность, и может быть ингибирована неспецифическая доставка двухцепочечной олиго-РНК в другие органы и клетки.
В дополнение к этому, технология образования SAMiRNA может применяться не только к двухцепочечным олиго-РНК, но также к одноцепочечным олигонуклеотидам, в частности, одноцепочечному антисмысловому олигонуклеотиду (ASO) с терапевтическими целями.
Технология ASO - это технология контролирования переноса информации от гена к белку путем изменения метаболизма мРНК с использованием одноцепочечной РНК или ДНК. Другими словами, это технология осуществления предпочтительного ингибирования экспрессии представляющего интерес белка с использованием выбранной нуклеотидной последовательности, которая комплементарно и специфически гибридизуется с данным белком. Поскольку ASO связывается с геном-мишенью в соответствии со специфической последовательностью, он не влияет на экспрессию генов, отличных от гена-мишени. Таким образом, технология ASO может служить в качестве полезного средства при анализе функции in vivo конкретного белка и также может использоваться в качестве генной терапии против определенных болезней (FASEBJ. 9, 1288-1296, 1995).
В последние годы был создан антагомир, представляющий собой новый тип одноцепочечного антисмыслового олигонуклеотида, и использован для ингибирования функции микроРНК в клетках. Известно, что антагомир или ингибитор микроРНК, который представляет собой синтезированную химическим путем короткую РНК, комплементарно связывается с целевой микроРНК, чтобы ингибировать функцию микроРНК. Предпочтительно антагомир имеет модифицированную химическую структуру, такую как 2′ метокси или фосфотионат для предотвращения деградации антагомира. В настоящее время известны антагомиры, ингибирующие функции микроРНК, связанных с различными болезнями, включая рак, фиброз сердца и легких ("Silencing of microRNAs in vivo with 'antagomirs'" Nature, Dec. 2005, 438(7068): 685-689; "MicroRNAs as Therapeutic Targets" New England J. Medicine, 2006, 354 (11): 1194-1195; Meister G. et al., "Sequence-specific inhibition of microRNA- and siRNA-induced RNA silencing" RNA, Mar. 2004, 10 (3): 544-550).
Антисмысловая ДНК связывается с целевой мРНК с образованием РНК/ДНК дуплекса, который разрушается РНКазой H (разновидность рибонуклеазы, которая специфически разрушает мРНК, имеющую сформированный РНК/ДНК гибридный дуплекс) in vivo. Антисмысловая РНК образует дуплекс РНК/РНК, а деградация целевой мРНК индуцируется РНКазой L. РНКаза L представляет собой рибонуклеазу, которая преимущественно разрушает одноцепочечную РНК вокруг двухцепочечной РНК (Pharmacol. Toxicol. 32, 329-376, 1992).
Однако, ASO, содержащий антагомир-ингибитор микроРНК должен эффективно доставляться в клетки-мишени для достижения желательного эффекта, причем ASO может быть разрушен рибонуклеазой в крови. Таким образом, чтобы использовать ASO в терапевтических целях, конъюгат ASO должен эффективно доставляться через клеточную мембрану, при этом должна быть обеспечена стабильность ASO in vivo (Shigeru Kawakami и Mitsuru Hashida, Drug Metab. Pharmacokinet. 22(3): 142-151, 2007).
Таким образом, для стабильности in vivo большинство ASO имеют форму олигодезоксинуклеотидов (ODN), полученных с помощью различных модификаций, обеспечивающих устойчивость к нуклеазам. Модификация может представлять собой замену -ОН группы в 2′ положении углерода молекулы сахара одного или более нуклеотидов на -CH3 (метил), -OCH3, -NH2, -F (фтор), -O-2-метоксиэтил, -О-пропил, -O-2-метилтиоэтил, -О-3-аминопропил, -О-3-диметиламинопропил, -O-N-метилацетамидо или -О-диметиламидоксиэтил; замену кислорода в молекуле сахара нуклеотида на серу; модификацию связи между нуклеотидами в фосфортиоатную, боранфосфонатную или метилфосфонатную связь; или комбинацию одного или более из этого; или модификацию в форме PNA (пептидо-нуклеиновой кислоты) или LNA (закрытой нуклеиновой кислоты) (смотри Crooke et al., Ann. Rev. Med. Vol. 55: pp 61-65 2004, США 5,660,985, США 5,958,691, США 6,531,584, США 5,808,023, США 6,326,358, США 6,175,001 Braasch D.А. et al., Bioorg. Med. Chem. Lett. 14: 1139-1143, 2003; Chiu Y. L. et al., RNA, 9: 1034-1048, 2003; Amarzguioui M. et al., Nucleic Acid Res. 31: 589-595, 2003).
Для доставки ASO в клетки-мишени разработаны методы доставки генов, использующие вирусы, такие как аденовирус и ретровирус, и методы доставки генов, использующие невирусные носители, такие как липосомы, катионные липиды или катионные полимеры. Однако, с вирусными носителями связаны проблемы, касающиеся безопасности, поскольку не гарантируется, что эти носители не вызывают нарушений нормальных функций генов хозяина после включения в хромосому хозяина или не активируют онкогены. Кроме того, если вирусный ген постоянно экспрессируется даже на низких уровнях, вызывая аутоиммунные заболевания, или если вирусный носитель вызывает модифицированную вирусную инфекцию, ASO не могут эффективно доставляться.
Для преодоления таких проблем и недостатков изучаются методы слияния гена с невирусным липосомальным носителем или методы использования катионных липидов или полимеров. Хотя эти невирусные векторы являются менее эффективными, чем вирусные носители, их преимущество заключается в безопасности in vivo, меньшем числе побочных эффектов и в производстве с меньшими затратами (Lehrman S. Nature. 401(6753): 517-518, 1999).
Для того чтобы добиться эффективной стабильной доставки молекул ODN, включая ASO, с использованием невирусных носителей, требуется эффективный способ предотвращения ферментативного и неферментативного расщепления. Поэтому предложены способы химической модификации ASO, чтобы сделать ASO устойчивыми в отношении нуклеаз и увеличить внутриклеточное поглощение ASO (Shigery Kawakami и Mitsuru Hashida. Drug Metab. Parmacokinet. 22(3): 142-151, 2007).
В то же время, полимеры, содержащие PEG (полиэтиленгликоль), образуют композиты, имеющие мицеллярные структуры, спонтанно образованные взаимодействием между ними, эти композиты известны как полимерно-композитные мицеллы (Kataoka K. et al. Macromolecules, 29: 8556-8557, 1996). Эти полимерно-композитные мицеллы обладают преимуществом, заключающимся в том, что они имеют очень маленький размер по сравнению с другими системами доставки лекарственного средства, такими как микросферы или наночастицы, притом, что распределение их является очень однородным, при этом они формируются спонтанно (самопроизвольно), облегчая возможность контролировать качество композиции и обеспечивать воспроизводимость.
В последние годы с целью увеличения эффективности внутриклеточной доставки ASO была разработана технология обеспечения стабильности ASO и эффективного проникновения ASO через клеточную мембрану путем конъюгирования гидрофильного материала, такого как биосовместимый полимер PEG, с ASO путем простой ковалентной связи или ковалентной связи через промежуточный линкер (Корейский патент, номер 0466254). Однако трудно достичь улучшения стабильности ASO in vivo и обеспечения эффективной доставки ASO в ткань-мишень посредством только химической модификации и пегилирования.
Как описано выше, была разработана технология SAMiPHK в отношении наночастиц, полученных путем введения гидрофобного и гидрофильного материалов в миРНК для увеличения внутриклеточной доставки миРНК, однако о применении этой технологии для доставки ASO еще не сообщалось. Таким образом, существует необходимость в разработке системы доставки ASO и способа ее получения путем введения различных химических модификаций в ASO и конъюгирования различных полимеров с ASO с целью защиты ASO от ферментов, чтобы тем самым увеличить их устойчивость и эффективное проникновение через клеточную мембрану.
Сущность изобретения
В первом аспекте цель настоящего изобретения заключалась в получении терапевтической лекарственной конструкции, которая содержит гидрофильный и гидрофобный материалы, представляющие собой биосовместимые полимерные соединения, присоединенные к обоим концам лекарственного средства простой ковалентной связью или ковалентной связью через промежуточный линкер, с целью увеличения эффективности внутриклеточной доставки лекарственного средства, и дополнительно содержит лиганд, связанный с гидрофильным материалом, наночастицу, состоящую из терапевтической лекарственной конструкции, и предложении способа ее получения.
Другая цель настоящего изобретения заключалась в получении двуспиральной олиго-РНК конструкции, которая содержит биосовместимый гидрофильный и гидрофобный полимерный материалы, присоединенные к обоим концам двуспиральной олиго-РНК простой ковалентной связью или ковалентной связью через промежуточный линкер, с целью увеличения эффективности внутриклеточной доставки двуспиральной олиго-РНК, и дополнительно содержит рецептор-специфический лиганд, связанный с гидрофильным материалом, который обладает способностью усиливать интернализацию клеткой-мишенью (в частности, раковой клеткой) путем рецептор-опосредованного эндоцитоза (RME); наночастицу, состоящую из связанных с лигандом двуспиральных олиго-РНК конструкций; и фармацевтической композиции, содержащую или связанную с лигандом двуспиральную олиго-РНК конструкцию или наночастицу, состоящую из связанных с лигандом двуспиральных олиго-РНК конструкций.
Еще одна цель настоящего изобретения заключалась в предложении способа получения связанной с лигандом двуспиральной олиго-РНК конструкции и наночастицы, содержащей то же самое, и способа доставки двуспиральной олиго-РНК с использованием лиганд-связанной двуспиральной олиго-РНК конструкции.
Когда мишень-специфический лиганд связывается с двуспиральной олиго-РНК конструкцией, наночастица, состоящая из лиганд-связанных двуспиральных олиго-РНК конструкций, может эффективно доставляться в клетку-мишень. Таким образом, даже когда лиганд-связанная двуспиральная олиго-РНК конструкция вводится в относительно низкой концентрации, она может проявлять активность двуспиральной олиго-РНК в клетке-мишени. Кроме того, поскольку присоединенный лиганд может предотвратить неспецифическую доставку двуспиральной олиго-РНК в другие органы и клетки, лиганд-связанная двуспиральная РНК конструкция может использоваться для лечения различных болезней и также может эффективно использоваться в качестве системы доставки нового типа двуспиральной олиго-РНК. В частности, лиганд-связанная двуспиральная РНК конструкция может эффективно использоваться для лечения болезней, включая рак и инфекционные болезни.
Во втором аспекте цель настоящего изобретения заключалась в получении конъюгата ASO-полимер, содержащий биосовместимый гидрофильный и гидрофобный полимерный материалы, присоединенные к обоим концам ASO посредством простой ковалентной связи или ковалентной связи через промежуточный линкер с целью повышения эффективности внутриклеточной доставки ASO, и предложении способа его получения.
Другая цель настоящего изобретения заключалась в предложении метода доставки ASO с использованием наночастицы, состоящей из конъюгатов ASO-полимер, и фармацевтической композиции, содержащую или конъюгат ASO-полимер или наночастицу, состоящую из конъюгатов ASO-полимер.
Конъюгат ASO-полимер согласно настоящему изобретению и наночастица, состоящая из конъюгатов ASO-полимер, может увеличивать стабильность ASO in vivo, делая возможной эффективную доставку терапевтического ASO в клетки. Кроме того, они могут проявлять активность ASO при относительно низких концентрациях по сравнению с ASO, концы которого не модифицированы, даже при отсутствии трансфекционного агента. Таким образом, конъюгат ASO-полимер и наночастица, состоящая из конъюгатов ASO-полимер, могут использоваться для лечения различных болезней, включая рак и инфекционные заболевания, и также могут очень эффективно использоваться в качестве нового типа системы доставки ASO в основных биоинженерных исследованиях и медицинской промышленности.
Краткое описание чертежей
Фиг. 1 - это схематическое изображение наночастицы (SAMiPHK), состоящей из двуспиральных структур олиго-РНК с присоединенным к ней лигандом.
Фиг. 2 показывает опухолеспецифическую доставку SAMiPHK. Фиг. 2А - это фотография, показывающая биораспределение SAMiPHK с течением времени после однократного введения Су5.5-меченой SAMiPHK в хвостовую вену мыши с трансплантированной опухолью в дозе 5 мг/кг веса тела (участок, показанный серой пунктирной линией - это участок с трансплантированной опухолью). Фиг. 2(B) - ex vivo фотография тканей, собранных через 48 часов после введения SAMiPHK.
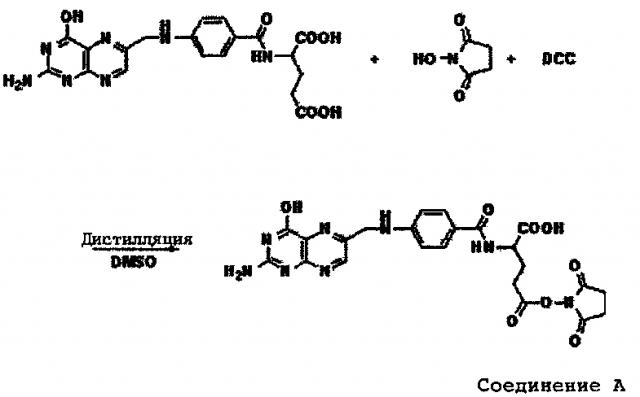
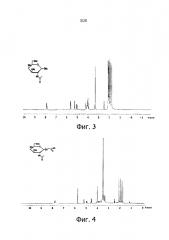
Фиг. 3 показывает результаты ЯМР-анализов 1,3,4,6-тетра-ацетил-NAG (соединение A). 1H ЯМР (300 MHz, DMSO-D6); δ 7.89 ppm (1H, d, J=9.3 Hz), 5.64 ppm (1H, d, J=8.7 Hz), 5.27 ppm (1H, d, J=3.3 Hz), 5.07 ppm (1H, dd, J=11.7, 3.6 Hz), 4.22 ppm (1H, t, J=6.3 Hz), 4.14-3.96 ppm (2H, m), 2.12 ppm (3H, s), 2.04 ppm (3H, s), 1.99 ppm (3H, s), 1.91 (3H, s), 1.78 ppm (3H, s).
Фиг. 4 показывает результаты ЯМР-анализов 3,4,6-триацетил-1-гекса(этиленгликоль)-N-ацеталгалактозамина(NAG) (соединение В). 1H ЯМР (300 MHz, DMSO-D6); δ 7.71 ppm (1Н, d, J=9.3 Hz), 5.21 ppm (1H, d, J=3.0 Hz), 4.97 ppm (1H, dd, J=11.1, 3.0 Hz), 4.56 ppm (1H, d, J=8.7 Hz), 3.88 ppm (1H, q, J=8.7 Hz), 3.83-3.74 ppm (1H, m), 3.62-3.39 ppm (25H, m), 2.10 ppm (3H, s), 2.01 ppm (3H, s), 1.89 ppm (3H, s), 1.77 ppm (3H,s).
Фиг. 5 показывает результаты ЯМР-анализов 1-гекса(эталенгликоль)-NAG-фосфорамидита) (соединение С). (А) 1H ЯМР (300 MHz, DMSO-D6); δ 7.78 ppm (1H, d, J=9.3 Hz), 5.21 ppm (1H, d, J=3.0 Hz), 4.97 ppm (1H, dd, J=11.1, 3.6 Hz), 4.56 ppm (1H, d, J=8.1 Hz), 3.88 ppm (1H, d, J=9.0 Hz), 3.81-3.41 ppm (ЗОН, m), 2.89 ppm (2H, t, J=5.7 Hz), 2.11 ppm (3H, s), 2.00 ppm (3H, s), 1.89 ppm (3H, s), 1.77 ppm (3H, s), 1.20-1.12 ppm (12H, m), (В) 31P ЯМР data (121 MHz, DMSO-D6); δ 147.32 ppm.
Фиг. 6 показывает процесс получения одноцепочечной РНК.
Фиг. 7 показывает процесс получения двуспиральной олиго-РНК конструкции, содержащей PEG, связанный с 5′ концом двуспиральной олиго-РНК, и результаты анализа конструкции РНК. Фиг. 7(A) показывает процесс связывания PEG с двуспиральной олиго-РНК с использованием PEG-фосфорамидита. Фиг. 7(B) показывает результаты MALDI-TOF MS-анализа одноцепочечной РНК (21 нукл), которая не была модифицирована на 5′ конце (SEQ ID NO: 1; MB 6662.1). Фиг. 7(C) показывает результаты MALDI-TOF MS одноцепочечной РНК (21 нукл), имеющей PEG, связанный с 5′ концом (SEQ ID NO: 1; MB 6662.1).
Фиг. 8 показывает процесс получения моно-NAG-PEG-PHK конструкции и результаты анализа данной конструкции. Фиг. 8(A) показывает процесс связывания N-ацетил галактозамина (NAG) с PEG-RNA с использованием N-ацетил-галактозамин-фосфорамидита. Фиг. 8(B) показывает результаты MALDI-TOF MS анализа NAG-PEG-РНК конструкции (синий, MB 9171.2), конструкции, содержащей N-ацетил-галактозамин, связанный с PEG-РНК (зеленый, MB 8624.1), и показывает, что центральный пик сдвинут по молекулярной массе N-ацетил-галактозамина (MB 547).
Фиг. 9 показывает процесс получения тройной конструкции NAG-PEG-PHK и результат анализа данной конструкции. Фиг. 9(A) показывает процесс связывания N-ацетил-галактозамина с PEG-РНК с использованием дендримера фосфорамидита и NAG-фосфорамидита, и фиг. 9(B) показывает результаты MALDI-TOF MS анализа PEG-РНК (зеленый, MB 8624.1), и моно-NAG-PEG конструкции (синий, MB 9171.2) и тройной-NAG-PEG-PHK конструкции (красный, MB 10630), содержащей связанный с ней N-ацетил галактозамин.
Фиг. 10 показывает процесс получения 5′ фолат-PEG-PHK конструкции и результаты анализа данной конструкции. Фиг. 10(A) показывает процесс связывания фолата с PEG-РНК с использованием NHS-фолата, и фиг. 10(B) показывает результаты MALDI-TOF MS анализа PEG-РНК (зеленый, MB 8624.1) и фолат-PEG-PHK конструкции (синий, MB 9277.8) и показывает, что центральный пик сдвинут молекулярной массой фолата (MB 615).
Фиг. 11 показывает результаты анализов 5′ C24-РНК конструкции. Фиг. 11(A) показывает результаты MALDI-TOF MS анализа одноцепочечной РНК, комплементарной SEQ ID NO: 1 (MB 7349.5), и фиг. 11(B) показывает анализ MALDI-TOF MS 5′ С24-РНК конструкции, комплементарной SEQ ID NO: 1 (MB 7830.2).
Фиг. 12 показывает процесс получения 3′ CPG-амин-PEG-PHK конструкции с помощью амин-CPG.
Фиг. 13 показывает процесс получения 3′ CPG-амин-PEG-RNA-C24 конструкции с помощью амин-CPG.
Фиг. 14 показывает процесс получения 3′ фолат-PEG-PHK конструкции и результаты анализа данной конструкции. Фиг. 14(A) показывает процесс связывания фолата с 3′ амин-PEG-PHK структурой с помощью NHS-фолата; и фиг. 14(B) показывает результаты MALDI-TOF MS анализа 3′ фолат-PEG-PHK конструкции (SEQ ID NO: 1; MB 9277.7):
Фиг. 15 показывает результаты исследования физических свойств наночастицы (фолат-SAMiPHK), состоящей из структур 5′ фолат-РНК-полимер. Фиг. 15(A) - графическая диаграмма, показывающая размер и коэффициент полидисперсности (PDI) фолат-SAMiPHK, и фиг. 15(B) - графическая диаграмма, показывающая критическую концентрацию мицелл фолат-SAMiPHK.
Фиг. 16 показывает эффект фолат-SAMiPHK на ингибирование экспрессии гена-мишени в линии клеток, сверхэкспрессирующих фолатный рецептор. Уровень мРНК гена мишени в линии опухолевых клеток KB, сверхэкспрессирующих фолатный рецептор, был измерен с помощью количественной ПЦР через 48 часов после введения фолат-SAMiPHK и SAMiPHK. На фиг. 16, в отсутствие фолата в культуральной среде: условия без фолата; с фолатом в культуральной среде: содержание избыточного количества (1 мМ) фолата; Контроль (Con): группа, обработанная наночастицей SAMiPHK-Con, состоящей из структур двуспиральная олиго-РНК-полимер, содержащих последовательность SEQ ID NO: 2 (контрольная последовательность); SAM: группа, обработанная наночастицей SAMiPHK-Sur, состоящей из конструкций двуспиральная олиго-РНК-полимер, содержащих последовательность SEQ ID NO: 1 (последовательность сурвивина); Фолат-SAM: тестируемая группа, обработанная наночастицей Фолат-SAMiPHK-Sur, состоящей из фолат-двуспиральных олиго-РНК, содержащих последовательность SEQ ID NO: 1 (последовательность сурвивина), и имеющей присоединенный к ней фолат.
Фиг. 17 показывает эффект фолат-SAMiPHK на ингибирование экспрессии гена-мишени в опухолевой ткани. Уровень мРНК гена-мишени (сурвивина) в опухолевой ткани был измерен с помощью количественной ПЦР через 48 часов или 72 часа после однократного введения SAMiPHK и фолат-SAMiPHK в дозе 5 мг/кг веса тела в хвостовую вену мыши с опухолью из линии клеток KB, которая сверхэкспрессирует фолатный рецептор 48. На фиг. 17, PBS: отрицательный контроль; SAMiPHK: группа, которой вводили наночастицу SAMiPHK-Sur состоящую из двуспиральных олиго-РНК-полимер-структур, содержащих последовательность SEQ ID NO: 1 (последовательность сурвивина) и без присоединенного лиганда; Фолат-SAMiPHK: группа с введением наночастицы фолат-SAMiPHK-Sur с последовательностью SEQ ID NO: 1 (последовательность сурвивина), имеющей связанный с ней фолатный лиганд.
Фиг. 18 - это схематическое изображение наночастицы, содержащей конъюгат ASO-полимер.
Фиг. 19 показывает MALDI-TOF MS-спектр ASO и конъюгата ASO-полимер согласно настоящему изобретению. Четыре нуклеотида на обоих концах (5′ и 3′ концы) модифицированы 2-ОСН3 (метокси), и 'm' обозначает ОСН3 (метокси) группу. Фиг. 19(A) показывает MALDI-TOF-результаты в отношении ASO (М.В. 5967.9 Да), и фиг. 19(B) показывает MALDI-TOF-результаты конъюгата ASO-полимер (М.В. 8448 Да).
Фиг. 20 показывает результаты исследования физических свойств наночастицы, состоящей из конъюгатов ASO-полимер. Фиг. 20(A) - диаграмма, показывающая размер и коэффициент полидисперсности (PDI) наночастицы, состоящей из конъюгатов ASO-полимер; и фиг. 20(B) - диаграмма, показывающая критическую концентрацию мицелл наночастицы, состоящей из конъюгатов ASO-полимер.
Фиг. 21 показывает результаты анализа уровня мРНК экспрессии при различных лечебных концентрациях (10, 50 и 100 нМ) в целях проверки эффектов ASO и конъюгата ASO-полимер на ингибирование экспрессии гена-мишени в опухолевых клетках. Перетасованная ASO SEQ ID NO: 4 (контрольная последовательность); Сурвивин: ASO SEQ ID NO: 3 (последовательность сурвивина); ASO: ASO, без присоединенного к нему материала; конъюгат ASO-полимер: конъюгат ASO-полимер в форме 3′PEG-ASO-5′липида).
Наилучшее техническое выполнение изобретения
1. Первый аспект настоящего изобретения
В первом аспекте настоящего изобретения термин "антисмысловая цепь" означает цепь, которая проявляет РНКи-активность, необходимую для связывания и разрушения целевой мРНК в RISC (индуцированный РНК комплекс сайленсинга), а термин "смысловая цепь" означает цепь, имеющую последовательность, комплементарную антисмысловой цепи.
Использованный в описании термин "комплементарный" или "комплементарное связывание" означает, что две последовательности связываются друг с другом с образованием двухцепочечной структуры. Термин включает не только полное совпадение между двумя последовательностями, но также несоответствие (ошибочное спаривание) между двумя последовательностями.
Настоящее изобретение предоставляет терапевтическую конструкцию лекарство-полимер, имеющую следующую формулу (1), и содержащую соединенный к ней лиганд:
Формула 1
L-A-X-R-Y-B
в которой А представляет собой гидрофильный материал; В представляет собой гидрофобный материал; X и Y каждый независимо представляют собой простую ковалентную связь или ковалентную связь через промежуточный линкер; R представляет собой лекарственное средство; и L представляет собой рецептор-специфический лиганд, обладающий свойством усиливать интернализацию клеткой-мишенью путем рецептор-опосредованного эндоцитоза (RME).
В данном документе лекарственное средство может быть выбрано из числа противоопухолевых препаратов, двуспиральных олиго-РНК, противовирусных препаратов, стероидных противовоспалительных препаратов (SATO), нестероидных противовоспалительных лекарственных средств (NSAID), антибиотиков, противогрибковых средств, витаминов, гормонов, ретиноевой кислоты, простагландинов, простациклинов, антиметаболических средств, микотиков, агонистов холина, антагонистов адреналина, противосудорожных средств, анксиолитических средств, транквилизаторов, антидепрессантов, анестезирующих средств, болеутоляющих средств, анаболических стероидных средств, эстрогенов, прогестеронов, гликозаминогликанов, полинуклеотидов, иммуносупрессорных средств и иммуностимулирующих средств.
В настоящем изобретении лекарственное средство предпочтительно представляет собой двуспиральную олиго-РНК или противоопухолевое лекарственное средство. Если терапевтическое средство представляет собой двуспиральную олиго-РНК, гидрофильный материал может быть присоединен к 3′ или 5′ концу двуспиральной олиго-РНК.
В терапевтической конструкции лекарство-полимер изобретения, содержащей соединенный к ней лиганд, лиганд может быть дополнительно присоединен к конкретному месту (в частности, концу) гидрофильного материала, соединенного с двуспиральной олиго-РНК или противоопухолевым препаратом. Лиганд может быть выбран из числа антитела, специфического к рецептору-мишени, аптамера (одноцепочечной нуклеиновой кислоты (ДНК, РНК или модифицированной нуклеиновой кислоты), способной связываться с молекулой-мишенью с высокой аффинностью и специфичностью), пептида или химических веществ, включая фолат (фолат используется взаимозаменяемо с фолиевой кислотой, и использованный в описании термин "фолат" относится к фолату, который является активным в природе или в организме человека), N-ацетилгалактозамин (NAG) и маннозу, обладающих свойством специфически связываться с рецептором, усиливающим интернализацию клеткой-мишенью посредством RME. В данном описании лиганд является материалом, осуществляющим доставку к мишени-рецептору специфическим образом, и не ограничивается только перечисленными выше антителом, аптамером, пептидом и химическими веществами.
Предпочтительно двуспиральная олиго-РНК состоит из 19-31 нуклеотидов. Двуспиральная олиго-РНК, используемая в настоящем изобретении, может быть любой двуспиральной олиго-РНК для любого гена, который используется или может использоваться для генной терапии или исследований.
Гидрофобный материал используется для формирования наночастицы, состоящей из двуспиральных олиго-РНК структур, посредством гидрофобного взаимодействия. Из числа гидрофобных матер