Способ оценки микробного спектра эндометрия для этиологической диагностики хронического эндометрита
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к способу оценки микробного спектра эндометрия для этиологической диагностики хронического эндометрита (ХЭ), заключающейся в том, что производят забор фрагмента слизистой оболочки полости матки, далее методом ПЦР в реальном времени количественно оценивают значение контроля взятия материала, при снижении данного показателя ниже 104 ГЭ/образец результат считают недостоверным, общей бактериальной массы, положительный результат при значении более 103 ГЭ/образец, определяют количество геном-эквивалентов микроорганизмов и сравнивают его с пороговым значением (ПЗ), применяя диагностическую панель, включающую Lactobacillus spp., абсолютно- или условно-патогенные микроорганизмы, такие как Eubacterium spp., Enterobacteriaceae, Escherichia coli, Streptococcus spp., Streptococcus agalactiae, Staphylococcus spp., Staphylococcus aureus, Enterococcus spp., Peptostreptococcus spp., Prevotella bivia/Porphyromonas spp., Gardnerella vaginalis, Atopobium vaginae, Mycoplasma hominis, Ureaplasma spp., Candida spp., Trichomonas vaginalis, Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Herpes simplex 1 и 2 типов, Cytomegalovirus; при выявлении абсолютно- или условно-патогенных микроорганизмов в количестве, превышающем пороговое значение, делают заключение о потенциальном значении данного микроорганизма в этиологической диагностике хронического эндометрита. Предложенный способ позволяет в течение 1-2 суток качественно и количественно охарактеризовать микробный спектр в слизистой оболочке полости матки у женщин, что повышает точность этиологической диагностики ХЭ. 4 табл., 3 пр.
Реферат
Изобретение относится к медицине, в частности к акушерству и гинекологии, и может использоваться для качественной и количественной оценки представленности абсолютных патогенов, вирусов и условно-патогенных микроорганизмов (УПМ) в слизистой оболочке полости матки у женщин, что необходимо для этиологической диагностики хронического эндометрита (ХЭ).
Трудности этиологической диагностики ХЭ в значительной мере сопряжены с методикой взятия биоматериала из эндометрия. При этом выявление этиологически значимых микроорганизмов, инициирующих запуск воспалительного процесса в эндометрии, имеет принципиальное значение с точки зрения целесообразности и адекватности назначения антибактериальной терапии.
Ведущая роль в этиопатогенезе ХЭ принадлежит факультативно и облигатно анаэробным УПМ, частота выявления которых достигает 59,7-77,5%. Наиболее часто среди факультативных анаэробов встречаются энтеробактерии, стафилококки, энтерококки, стрептококки; среди облигатных анаэробов - представители семейства бактероидов; среди микроаэрофилов - гарднерелла [Cicinelli Е., De Ziegler D., Nicoletti R. 2009, Cicineli Ε., Ballini Α., Marinaccio M., et al. 2012, Ness R.B., Soper D.E., Holley R.L., et al. 2002].
В современных условиях культуральный метод остается ведущим в оценке микробного пейзажа слизистой оболочки полости матки.
В настоящее время подробно изучена микробиота влагалища как с позиции классической микробиологии, так и с помощью молекулярно-генетических исследований. В отечественной и зарубежной литературе предложены методические рекомендации по исследованию вагинальной микрофлоры, в которых разработаны критерии нормы и инфекционной патологии [Воропаева Е.А., Караулов А.В., Афанасьев С.С. и др. 2012, Кочеровец В.И., Бунятян Н.Д. 2012].
Способ интегральной оценки состояния микробиоты влагалища и диагностика оппортунистических вагинитов [Анкирская А.С., Муравьева В.В. «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов» (медицинская технология). - Москва 2011. - 19 с.] позволяет установить видовой состав аэробных, факультативно- и облигатно-анаэробных бактерий, микроаэрофилов, в том числе лактобацилл, а также дрожжевых грибов рода Candida. Данная технология включает комплексное исследование вагинального отделяемого с помощью микроскопии мазка, окрашенного по Граму, и культурального исследования. При микроскопии оценивают состояние вагинального эпителия, лейкоцитарную реакцию, количественный и качественный состав микрофлоры по бактериальным морфотипам. На основании количественной оценки роста микроорганизмов на питательных средах определяется их этиологическая значимость. Разработаны критерии нормы вагинальной микробиоты у женщин репродуктивного возраста: общая микробная обсемененность не превышает 106-108 КОЕ/мл; абсолютное преобладание лактобацилл; условно-патогенные микроорганизмы определяются в низком титре (менее 104 КОЕ/мл) или отсутствуют. Также приведены характеристики различных нарушений вагинальной микрофлоры (бактериальный вагиноз (БВ), кандидозный вагинит (KB), сочетание БВ и KB, бессимптомное носительство грибов, неспецифический (аэробный) вагинит, мезоценоз, цитолитический вагиноз, вагинальная эпителиальная атрофия). Однако вышеописанные критерии разработаны для оценки вагинального биотопа и не учитывают особенности микрофлоры слизистой оболочки полости матки.
В 2007 г. Е. Cicinelli и соавторы [Cicinelli Ε., De Ziegler D., Nicoletti R., et al. Chronic endometritis: correlation among hysteroscopic, histologic, and bacteriologicfindings in a prospective trial with 2190 consecutive office hysteroscopies // Fertil Steril. - 2008. - Vol. 89, N 3. - P. 677-684] изучили микробный спектр слизистой оболочки матки у женщин с гистероскопически и морфологически верифицированным диагнозом ХЭ. Наиболее часто выявляемыми инфекционными агентами были УПМ (58% женщин). В частности стрептококки выделены в 27,9% случаев, представители кишечной флоры (Enterococcus faecalis и Escherichia coli) - в 25,5%, Ureaplasma urealyticum - в 10,0%, при этом абсолютные патогены (Chlamydia trachomatis) обнаружены только в 2,7% случаев. В данной работе авторы характеризуют относительно узкий спектр наиболее часто встречаемых микроорганизмов в полости матки и не описывают представленность других УПМ, которые также могут иметь клиническое значение в патогенезе ХЭ. Поэтому, используя только данные характеристики, не представляется возможным адекватно оценить качественный и количественный состав микрофлоры, что необходимо для этиологической диагностики ХЭ.
Одним из ближайших аналогов для оценки микробного спектра слизистой оболочки полости матки является способ оценки микробиоценоза полости матки у женщин с полипами эндометрия в постменопаузальном периоде (RU 2430365). Суть метода заключается в определении количественного и качественного состава микрофлоры эндометрия, а также в оценке количественных показателей локального гуморального иммунитета. Предложенная методика включает получение биоптатов эндометрия с последующим проведением культурального исследования с целью выявления УПМ факультативно- и облигатно-анаэробного происхождения и определения их чувствительности к антибиотикам. В данном способе отсутствуют указания конкретных групп микроорганизмов и их количественные значения, что делает невозможным его использование для этиологической диагностики ХЭ.
Представленные выше исследования по изучению микрофлоры полового тракта ориентированы на традиционный культуральный метод диагностики, который является «золотым стандартом» этиологической лабораторной диагностики любого инфекционного процесса [Анкирская А.С, Муравьева В.В. 2001]. К недостаткам культуральной диагностики можно отнести длительность исследования при выявлении полимикробных ассоциаций УПМ, особенно строгих анаэробов, трудоемкость и необходимость оснащения микробиологических лабораторий специальным оборудованием для видовой идентификации микроорганизмов. Кроме того, при микробиологическом исследовании не представляется возможным выявлять некультивируемые формы, а также затруднена индикация микроорганизмов, требующих длительной инкубации (Megasphaera spp., Mobiluncus spp., и др.). Также существенным ограничением культурального метода является необходимость обеспечения жизнеспособности микроорганизмов, что накладывает жесткие требования к транспортировке биоматериала.
В последние годы появился новый подход к исследованию УПМ - метод полимеразной цепной реакции (ПЦР) в режиме «реального времени» - «Фемофлор 16», который дает возможность исследовать микрофлору и оценить степень и характер дисбаланса микробиоты влагалища. Ближайшим аналогом предлагаемого способа является метод диагностики дисбаланса микробиоты различных биотопов человека и степени его выраженности (RU 2362808). Суть метода ПЦР в режиме «реального времени» заключается в том, что с помощью метода ПЦР в «реальном времени» в исследуемой биопробе определяют общее число геномов микроорганизмов, характерных для конкретного биотопа, число геномов нормобиоты и условно-патогенной биоты. Полученные величины сопоставляют между собой, определяют соотношение числа геномов нормобиоты и условно-патогенной биоты и при превышении числа геномов нормобиоты относительно числа геномов условно-патогенной биоты в 1000 раз констатируют отсутствие дисбаланса в составе микрофлоры, оценивая данный показатель как вариант нормы. При значении данного показателя менее чем в 1000 раз, диагностируют дисбаланс и устанавливают степень его выраженности путем определения соотношения между числом геномов нормобиоты и общим числом геномов микроорганизмов, присутствующих в исследуемой пробе, а также между числом геномов условно-патогенной биоты и нормобиоты и при снижении числа геномов нормобиоты относительно общего числа геномов микроорганизмов в 10-100 раз и снижении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 100-1000 раз устанавливают легкую степень дисбаланса. При превышении числа геномов нормобиоты относительно общего числа геномов микроорганизмов более чем в 100 раз и превышении числа геномов условно-патогенной биоты относительно числа геномов нормобиоты в 10 раз и более или менее этой величины устанавливают выраженную степень дисбаланса. В основу способа положена предлагаемая авторами комплексная оценка микробиоты человека методом ПЦР в «реальном времени» с проведением сравнительного анализа конкретных представителей нормо- и условно-патогенной биоты с общим количеством микроорганизмов с целью определения дисбаланса биоты, степени его выраженности при условии контролирования качества получения исследуемой биопробы. Однако указанный способ не учитывает особенности микробного пейзажа слизистой оболочки полости матки, отсутствует указание конкретных групп микроорганизмов, что затрудняет его использование для этиологической диагностики ХЭ.
Другой способ диагностики инфекционно-воспалительных урогенитальных заболеваний у женщин предложен М.Н. Болдыревой и соавторами [Болдырева М.Н., Липова Е.В., Витвицкая Ю.Г. Урогенитальные инфекции у женщин, обусловленные условно-патогенной биотой: способы выявления и коррекция // Научные исследования. - 2010. №2 - с. 26-31]. Авторы с помощью ПЦР в режиме «реального времени» определяют общую бактериальную массу, а также присутствие в биоматериале следующих микроорганизмов: Lactobacillus spp., Enterobacteriaceae, Streptococcus spp., Mobiluncus spp./Corynebacterium spp., Lachnobacterium spp./Clostridium spp., Peptostococcus spp., Eubacterium spp., Prevotella bivia/ Porphyromonas spp., Megasphera spp./Veilonella spp./Dialister spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Atopobium vaginae, Gardnerella vaginalis, Candida albicans. В зависимости от качественного и количественного состава микрофлоры авторы проводят микробиологическую диагностику (анаэробный вагиноз, аэробный вагинит, смешанный аэробно-анаэробный вагинит), а также оценивают степень выраженности нарушений: 1 степень (слабовыраженная) или 2 степень (выраженная). Данный способ, как и описанный выше, ориентированы только на изучение микробиоты влагалища и не учитывают возможные особенности микробного пейзажа слизистой оболочки полости матки.
Ряд исследователей полагают, что к настоящему времени сформировалась необходимость использования метода ПЦР в «реальном времени» для определения микробной обсемененности слизистой матки по аналогии с тест-системами, используемыми для диагностики биоценоза влагалища [Ferris M.J., Masztal A. et al. 2004, Khan К., Fujishita Α., Kitajima M., et al. 2014].
Задача исследования - создание диагностической панели с использованием метода ПЦР в режиме «реального времени» для изучения и разработки критериев оценки микробного спектра слизистой оболочки полости матки для этиологической диагностики ХЭ у женщин репродуктивного возраста.
Методика исследования
Молекулярно-генетическое исследование микрофлоры эндометрия проведено у 132 женщин: у 101 пациентки с морфологически подтвержденным ХЭ и у 31 условно здоровой женщины с гистологически нормальным эндометрием (эндометрий ранней, средней и поздней фаз пролиферации без патологических включений).
Критерии включения в группу обследованных женщин:
- возраст пациенток от 18 до 45 лет;
- показания для проведения гистероскопии и диагностического выскабливания и/или пайпель-биопсии;
- морфологически подтвержденный диагноз ХЭ;
- морфологически подтвержденная картина ранней, средней или поздней стадии пролиферации эндометрия без патологических изменений.
Всем пациенткам, включенным в исследование, выполнено физикальное обследование, сбор анамнеза, УЗИ органов малого таза на 5-8 и 22-24 дни менструального цикла, гистероскопия, диагностическое выскабливание слизистой оболочки полости матки или пайпель-биопсия эндометрия с помощью аспирационной кюретки «Pipelle de Cornier» (Франция) с последующей морфологической диагностикой и исследованием методом-ПЦР в «реальном времени» микрофлоры биоптата эндометрия. У 40 пациенток с ХЭ и у 9 условно-здоровых женщины проведено культуральное исследование биоптатов эндометрия.
Взятие образцов эндометрия производилось методом пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки «Pipelle de Cornier»; предварительно влагалище и шейку матки тщательно обрабатывали антисептиком. Перед сбором материала в пробирки типа «эппендорф» для последующего исследования, кюретка (с тканью эндометрия в ее просвете) обрабатывалась 70% раствором этилового спирта. Первую порцию биоматериала из кюретки подвергали утилизации, что необходимо для чистоты сбора материала и исключения возможной контаминации микрофлорой из нижних отделов полового тракта. Далее кюретку снаружи повторно обрабатывали 70% этиловым спиртом и вторую порцию эндометрия из кюретки помещали в пробирки типа «эппендорф» с физиологическим раствором для исследования микрофлоры урогенитального тракта методом ПЦР в «реальном времени» Биоматериал в эппендорфах маркировали и сохраняли в морозильной камере при -20°С для последующего исследования. Третью порцию сразу же засевали на стандартные питательные среды и культивировали в аэробных, анаэробных условиях и в условиях пониженного содержания кислорода.
В процессе исследования количественного и качественного состава биоты эндометрия методом ПЦР в «реальном времени» проводили контроль качества взятия материала (КВМ). Показателем адекватности получения биоматериала считали достаточное количество геномной ДНК в пробе из эпителиоцитов, попадающих в образец. При этом показатель КВМ оценивали в абсолютных значениях, за минимальный пороговый уровень принимали показатель 104 ГЭ/образец. При снижении данного показателя результат ПЦР-диагностики в режиме «реального времени» считали недостоверным. После анализа КВМ лабораторный контроль полученного материала (биоптата эндометрия) был валиден во всех случаях. На последнем этапе проводили статистический анализ полученных клинико-лабораторных данных.
Полученные результаты
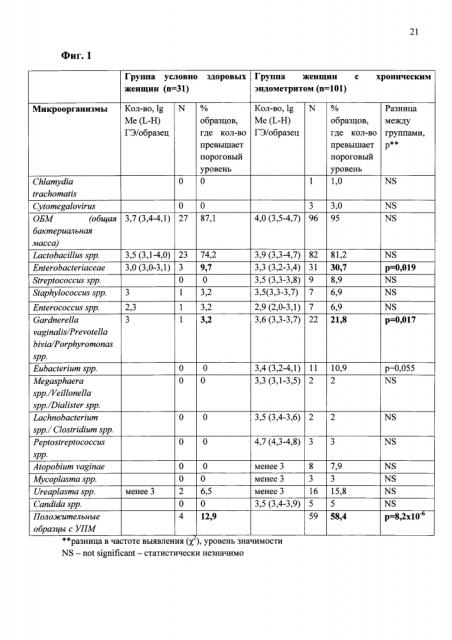
В ходе работы при исследовании микрофлоры биоптата эндометрия методом ПЦР в режиме «реального времени» установлено, что у женщин репродуктивного возраста в норме и при наличии ХЭ бактериальная обсемененность полости матки составила в среднем 103-104 ГЭ/образец. На фиг. 1 представлен спектр микроорганизмов, выявленных в эндометрии у обследованных женщин. Представителей нормальной вагинальной флоры (Lactobacillus spp.) в эндометрии у пациенток с ХЭ и условно-здоровых женщин обнаруживали в 74,2 и 81,2% случаях соответственно (р>0,05). При этом у пациенток с ХЭ наиболее часто в сравнении с условно-здоровыми женщинами определяли следующие микроорганизмы: Enterobacteriaceae (р=0,019), Gardnerella vaginalis/Prevotella bivia/Porphyromonas spp. (p=0,017), Eubacterium spp. (p=0,055). Обсемененность полости матки представителями УПМ также статистически чаще выявляли при ХЭ (58,4%), чем у условно-здоровых женщин (12,4%) (р=8,2×10-6).
Для качественного сравнения метода ПЦР в режиме «реального времени» с традиционным методом культуральной диагностики проведено параллельное исследование микрофлоры эндометрия с использованием двух методов у 49 женщин (ХЭ - 40 пациенток, условно-здоровые женщины - 9) (фиг. 2, 3). Сопоставление результатов показало, что у пациенток с ХЭ при использовании ПЦР-диагностики и культурального метода Lactobacillus spp. выявляли в 75 и 67,5% случаев соответственно (p>0,05); частота условно-стерильных образцов составила 10 и 15% соответственно (p>0,05), выявление УПМ в образцах составило 45 и 40%, соответственно (p>0,05). Метод ПЦР-диагностики оказался более чувствительным при выявлении Ureaplasma spp. (15%), при культуральном методе частота их выделения составила 2,5%, что может объясняться ограничением метода культуральной диагностики уреаплазм: использованная тест-система («Mycoplasma DUO», BIO RAD)» предполагает индикацию только одного вида - Ureaplasma urealyticum, в то время как ПЦР-диагностика выявляет два вида (Ureaplasma urealyticum, Ureaplasma parvum). В группе условно-здоровых женщин отмечено почти полное совпадение полученных результатов двумя методами, исключение составило обнаружение Ureaplasma spp. (102,1 ГЭ/образец) только методом ПЦР «в реальном времени» у одной пациентки.
Задача исследования - создание диагностической панели с использованием метода ПЦР в режиме «реального времени» для изучения и разработки критериев оценки микробного спектра слизистой оболочки полости матки для этиологической диагностики ХЭ.
Сущность способа заключается в том, что взятие биоматериала из эндометрия проводят методом пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки «Pipelle de Cornier»; предварительно влагалище и шейку матки обрабатывают антисептиком. Используя метод ПЦР в «реальном времени», определяют количество геном-эквивалентов Lactobacillus spp., УПМ, абсолютных патогенов и вирусов, затем его сравнивают с пороговым значением, при котором результат является диагностически значимым для конкретного микроорганизма. При выявлении абсолютно- или условно-патогенных микроорганизмов в количестве, превышающем пороговое значение, делают заключение о потенциальном этиологическом значении данного микроорганизма в развитии воспалительного процесса в эндометрии.
В связи с вышеизложенным предлагается следующая диагностическая панель для оценки микробного спектра в эндометрии при использовании метода ПЦР в «реальном времени» (фиг. 4). В панели представлено: определение значений контроля взятия материала (КВМ), общей бактериальной массы (ОБМ), а также наиболее часто встречаемых микроорганизмов в эндометрии. Представители нормальной вагинальной флоры (Lactobacillus spp.) не имеют этиологического значения в генезе ХЭ, однако их включение в диагностическую панель необходимо для выявления возможной контаминации при взятии биоматериала, а также для более полного представления о количественном и качественном составе микробного спектра в эндометрии. Следующие микроорганизмы: Megasphaera spp., Veillonella spp., Dialister spp., Lachnobacterium spp., Clostridium spp., Mobiluncus spp., Corynebacterium spp., Sneathia spp., Leptotrichia spp., Fusobacterium spp. при использовании метода ПЦР-диагностики встречались в единичных случаях или вовсе отсутствовали, поэтому перечисленные УПМ не включены в предлагаемую диагностическую панель для этиологической диагностики ХЭ. У 101 пациентки с ХЭ при использовании метода ПЦР в «реальном времени» из абсолютных патогенов и вирусов в одном случае выявлена Chlamydia trachomatis и в 3 случаях - Cytomegalovirus. Chlamydia trachomatis и Cytomegalovirus несмотря на редкую их встречаемость, а также не выявленные в данном исследовании Trichomonas vaginalis, Neisseria gonorrhoeae, Mycoplasma genitalium и Herpes simplex 1 и 2 типов рекомендованы нами для исследования при подозрении на ХЭ, так как данные возбудители ассоциируются с инфекциями, передаваемыми половым путем, и с развитием воспалительных процессов в нижнем и верхнем отделах полового тракта.
Способ позволяет путем доступного взятия ткани эндометрия в течение 1-2 суток получить объективную количественную и качественную оценку микробного пейзажа слизистой оболочки полости матки у женщин. В основу способа положена впервые предлагаемая авторами диагностическая панель для определения микробного спектра в эндометрии методом ПЦР в режиме «реального времени», который позволит охарактеризовать представленность микроорганизмов в слизистой оболочки полости матки, что необходимо для этиологической диагностики ХЭ и подбора этиотропной терапии.
Способ осуществляется следующим образом.
Производят забор фрагмента слизистой оболочки полости матки путем пайпель-биопсии с помощью атравматической аспирационной кюретки «Pipelle de Cornier», предварительно влагалище и шейку матки тщательно обрабатывают антисептиком. Перед сбором материала в пробирки типа «эппендорф» для последующего исследования кюретка (с тканью эндометрия в ее просвете) обрабатывается 70% раствором этилового спирта. Первую порцию биоматериала из кюретки подвергают утилизации, что необходимо для чистоты сбора материала и исключения возможной контаминации микрофлорой из нижних отделов полового тракта. Далее кюретку снаружи повторно обрабатывают 70% этиловым спиртом и вторую порцию эндометрия из кюретки помещают в пробирки типа «эппендорф» с физиологическим раствором для исследования микрофлоры урогенитального тракта методом ПЦР в реальном времени. Методом ПЦР в реальном времени исследуют микрофлору эндометрия и определяют количество геном-эквивалентов микроорганизмов, применяя диагностическую панель, включающую Lactobacillus spp. и абсолютно- или условно-патогенные микроорганизмы, такие как Eubacterium spp., Enterobacteriaceae, Escherichia coli, Streptococcus spp., Streptococcus agalactiae, Staphylococcus spp., Staphylococcus aureus, Enterococcus spp., Peptostreptococcus spp., Prevotella bivia/Porphyromonas spp., Gardnerella vaginalis, Atopobium vaginae, Mycoplasma hominis, Ureaplasma spp., Candida spp., Trichomonas vaginalis, Chlamydia trachomatis, Neisseria gonorrhoeae, Mycoplasma genitalium, Herpes simplex 1 и 2 типов, Cytomegalovirus, при этом осуществляют контроль взятия материала и оценивают общую бактериальную массу (фиг. 4). Затем полученные данные количества геном-эквивалентов микроорганизмов сравнивают с пороговым значением, при котором результат является диагностически значимым для конкретного микроорганизма. При выявлении абсолютно- или условно-патогенных микроорганизмов в количестве, превышающем пороговое значение, делают заключение о потенциальном значении данного микроорганизма в этиологической диагностике хронического эндометрита.
Клинические примеры
Пример 1. Пациентка К. 32 лет, обратилась с жалобами на АМК по типу менструальных маточных кровотечений, привычное невынашивание беременности. На основании анализа лабораторных исследований выявлено: по данным УЗИ эхо-признаки ХЭ, при морфологическом исследовании биоптата эндометрия верифицирован диагноз ХЭ. Произведено взятие биоматериала (биоптата эндометрия) для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 106,2 ГЭ/образец, ОБМ - 104,5 ГЭ/образец Lactobacillus spp. - 104,1 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 103,2 ГЭ/образец, Streptococcus spp. - 103,1 ГЭ/образец, Staphylococcus spp. - 101,8 ГЭ/образец, Eubacterium spp. - 102,5 ГЭ/образец. Количество прочих УПМ, абсолютных патогенов и вирусов соответствовало - 0 ГЭ/образец. Таким образом, у пациентки К. с наличием ХЭ обнаружены Lactobacillus spp. - 104,1 ГЭ/образец и следующие УПМ в количестве выше порогового значения: Enterobacteriaceae - 103,2 ГЭ/образец, Streptococcus spp. - 103,1 ГЭ/образец, количество остальных микроорганизмов было ниже порогового уровня. Пациентке К. с учетом выявленного микробного спектра в эндометрии была назначена этиотропная терапия (защищенные пенициллины).
Пример 2. Пациентка М. 38 лет, обратилась с жалобами на АМК по типу межменструальных маточных кровотечений, вторичное бесплодие в течение двух лет. На основании анализа лабораторных исследований выявлено: по данным УЗИ эхо-признаки ХЭ, при морфологической диагностике биоптата эндометрия верифицирован диагноз ХЭ. Произведен забор биоматериала (биоптата эндометрия) для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 105,7 ГЭ/образец, ОБМ - 104,3 ГЭ/образец, Lactobacillus spp. - 103,6 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 104,0 ГЭ/образец, Streptococcus spp. - 103,1 ГЭ/образец, Streptococcus agalactiae - 102,8 ГЭ/образец, Candida spp. - 103,2 ГЭ/образец. Количество прочих УПМ, абсолютных патогенов и вирусов соответствовало - 0 ГЭ/образец. Таким образом, у пациентки М. с наличием ХЭ обнаружены Lactobacillus spp. - 103,6 ГЭ/образец и следующие УПМ в количестве выше порогового значения: Enterobacteriaceae - 104,0 ГЭ/образец, Streptococcus spp. - 103,1 ГЭ/образец, Streptococcus agalactiae - 102,8 ГЭ/образец, Candida spp. - 103,2 ГЭ/образец, количество остальных микроорганизмов было ниже порогового уровня. Пациентке М. с учетом выявленного микробного спектра в эндометрии назначена этиотропная терапия (защищенные пенициллины и антимикотики).
Пример 3. Пациентка Г. 29 лет, обратилась с жалобами на первичное бесплодие в течение 4 лет. На основании анализа лабораторных исследований выявлено: по данным УЗИ обнаружены эхо-признаки неоднородного эндометрия, при морфологической диагностике биоптата слизистой оболочки полости матки эндометрий соответствовал средней стадии пролиферации без патологических включения. Произведен забор биоматериала (биоптат эндометрия) для исследования с помощью ПЦР в «реальном времени». При этом выявлено: КВМ - 104,6 ГЭ/образец, ОБМ - 103,7 ГЭ/образец, Lactobacillus spp. - 103,7 ГЭ/образец. УПМ были представлены: Enterobacteriaceae - 102,3 ГЭ/образец, Streptococcus spp. - 101,1 ГЭ/образец, Staphylococcus spp. - 101,1 ГЭ/образец, Eubacterium spp. - 102,6 ГЭ/образец. Таким образом, у пациентки Г. с морфологически нормальным эндометрием в слизистой оболочке матки выявлены Lactobacillus spp. - 103,7 ГЭ/образец. При этом не были обнаружены диагностически значимые количества УПМ и абсолютных патогенов. В проведении этиотропной терапии пациентка Г. не нуждалась, так как присутствие Lactobacillus spp. в эндометрии не является клинически значимым, а количество остальных микроорганизмов было ниже порогового уровня.
Литература
1. Анкирская А.С., Муравьева В.В. Опыт микробиологической диагностики оппортунистических инфекций влагалища// Клиническая микробиология и антимикробная химиотерпия. - 2001. - том 3. - №2. - с. 190-194.
2. Анкирская А.С., Муравьева В.В. «Интегральная оценка состояния микробиоты влагалища. Диагностика оппортунистических вагинитов» (медицинская технология). - Москва, 2011. - 19 с.
3. Болдырева М.Н., Липова Е.В., Витвицкая Ю.Г. Урогенитальные инфекции у женщин, обусловленные условно-патогенной биотой: способы выявления и коррекция // Научные исследования. - 2010. №2 - с. 26-31.
4. Воропаева Е.А., Караулов А.В., Афанасьев С.С. др. Оценка микробиоценоза влагалища при акушерской и гинекологической патологии (новая медицинская технология). - Москва-Астрахань: АГМА. - 2012. - 50 с.
5. Ворошилина Е.С., Тумбинская Л.В., Донников А.Е., Плотко Е.Э., Хаютин Л.В. Биоценоз влагалища с точки зрении количественной полимеразно-цепной реакции: что есть норма? // Акушерство и гинекология. - 2011. - №1. - с. 57-65
6. Кочеровец В.И., Бунятян Н.Д. Нормальная микрофлора женских мочеполовых путей и препараты для ее коррекции. Учебное пособие. - Москва: Издательский дом «Актеон». - 2012. - 72 с.
7. Унанян А.Л., Коссович Ю.М. Хронический эндометрит: этиопатогенез, диагностика, клиника и лечение. Роль антифиброзирующей терапии // Лечащий врач. - 2012. - №11. - С. 35-40.
8. Шипицына Е.В., Мартикайнен З.М., Воробьева Н.Е., Ерошкина М.С., Степанова О.С., Донников А.Е., и др. Применение теста Фемофлор для оценки микробиоценоза влагалища // Журнал акушерства и женских болезней. - 2009. - том LVIII. - выпуск 3. - с. 44-50.
9. Шуршалина А.В. Роль хронического эндометрита в развитии патологии репродуктивной функции // Российский медицинский журнал. - 2007. - №4. - С.25-27.
10. Andrews W.W., Hauth J.С, Cliver S.P., Conner M.G. et al. Association of asymptomatic bacterial vaginosis with endometrial microbial colonization and plasma cell endometritis in nonpregnant women. Am J Obstet Gynecol 2006; 195:1611-1616.
11. Cicineli Ε., Ballini Α., Marinaccio M., Poliseno A. Coscia M.F. et al. Microbiological findings in endometrial specimen: our experience. Arch Gynecol Obstet. 2012; 285(5): 1325-9.
12. Cicinelli E., Matteo M., Tinelli R., Lepera Α., Alfonso R., Indraccolo U. et al. Prevalence of chronic endometritis in repeated unexplained implantation failure and the IVF success rate after antibiotic therapy. Human Reprod. 2015; 30(2): 323-330.
13. Cicinelli E., De Ziegler D., Nicoletti R., Colafiglio G. et al. Chronic endometritis: correlation among hysteroscopic, histologic, and bacteriologicfindings in a prospective trial with 2190 consecutive office hysteroscopies. Fertil Steril 2008; 89:3:677-684.
14. Cicinelli E., De Ziegler D., Nicoletti R., Tinelli R., SalianiN., Resta L. et al. Poor Reliability of Vaginal and Endocervical Cultures for Evaluating Microbiology of Endometrial Cavity in Women with Chronic Endometritis. Gynecol Obstet Invest 2009; 68:108-115.
15. Espinoza J., Erez O., Romero R., Preconceptional antibiotic treatment to prevent preterm birth in women with a previous preterm delivery Am J Obstet Gynecol 2006; 194:630-637.
16. Ferris M.J., Masztal Α., Aldridge K.E. et al. Association of Atopobium vaginae, a recently described metronidazole resistant anaerobe, with bacterial vaginosis. BMC Infect Dis. 2004 Feb 13; 4:5.
17. Johnston-MacAnanny E.B., Hartnett J., Engmann L.L., Nulsen J.C. et al. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization. Fertil Steril 2010; 93:2:437-441.
18. Khan K., Fujishita Α., Kitajima M., Hiraki K., Nakashima M., Masuzaki H. Intra-uterine microbial colonization and occurrence of endometritis in women with endometriosis. Human Repr. 2014; 29 (11): 2446-2456.
19. Ness R.B., Soper D.E., Holley R.L., Peipert J.F., et al. Effectiveness of inpatient and outpatient treatment strategies for women with pelvic inflammatory disease: results from the Pelvic Inflammatory Disease Evaluation and Clinical Health (PEACH) randomized trial. Am J Obstet Gynecol 2002; 186:929-937.
20. Swidsinski A, Verstraelen H, Loening-Baucke V, Swidsinski S, Mendling W. et al. Presence of a Polymicrobial Endometrial Biofilm in Patients with Bacterial Vaginosis. PLoS ONE. 2013; 8(1):e53997.
21. Takebayashi A, Kimura F, Kishi Y, Ishida M, Takahashi A, et al. The Association between Endometriosis and Chronic Endometritis. PLoS ONE. 2014; 9(2): e88354.
Фигура 1. Спектр выявленных микроорганизмов в биоптатах эндометрия у обследованных женщин (ПЦР-диагностика в «реальном времени»)*.
*В таблице приведены лишь те микроорганизмы, которые были выявлены в эндометрии у обследованных пациенток.
Фигура 2. Результаты исследования микробного спектра слизистой оболочки полости матки, полученные при параллельном использовании двух диагностических методов (культурального и ПЦР в «реальном времени») у пациенток с морфологически подтвержденным ХЭ (абс. число женщин).
Фигура 3. Результаты исследования микробного спектра слизистой оболочки полости матки, полученные при параллельном использовании двух диагностических методов (культурального и ПЦР в «реальном времени») у женщин с нормальным состоянием эндометрия по морфологии (абс. число женщин).
Фигура 4. Диагностическая панель для оценки микробного спектра эндометрия для этиологической диагностики ХЭ у женщин репродуктивного возраста.
Способ оценки микробного спектра эндометрия для этиологической диагностики хронического эндометрита (ХЭ), отличающийся тем, что производят забор фрагмента слизистой оболочки полости матки путем пайпель-биопсии эндометрия с помощью атравматической аспирационной кюретки «Pipelle de Cornier», далее методом ПЦР в реальном времени количественно оценивают значение контроля взятия материала, минимальный пороговый уровень соответствует 104 ГЭ/образец, при снижении данного показателя результат считают недостоверным, общей бактериальной массы, положительный результат при значении более 103 ГЭ/образец, определяют количество геном-эквивалентов микроорганизмов и сравнивают его с пороговым значением (ПЗ), применяя диагностическую панель, включающую Lactobacillus spp., которые не имеют этиологического значения в генезе ХЭ ПЗ=103 ГЭ/образец, и абсолютно- или условно-патогенные микроорганизмы, такие как Eubacterium spp. ПЗ=103 ГЭ/образец, Enterobacteriaceae ПЗ=103 ГЭ/образец, Escherichia coli ПЗ=0, Streptococcus spp. ПЗ=103 ГЭ/образец, Streptococcus agalactiae ПЗ=0, Staphylococcus spp. ПЗ=103 ГЭ/образец, Staphylococcus aureus ПЗ=0, Enterococcus spp. ПЗ=103 ГЭ/образец, Peptostreptococcus spp. ПЗ=103 ГЭ/образец, Prevotella bivia/Porphyromonas spp. ПЗ=103 ГЭ/образец, Gardnerella vaginalis ПЗ=103 ГЭ/образец, Atopobium vaginae ПЗ=0, Mycoplasma hominis ПЗ=0, Ureaplasma spp. ПЗ=0, Candida spp. ПЗ=103 ГЭ/образец, Trichomonas vaginalis ПЗ=0, Chlamydia trachomatis ПЗ=0, Neisseria gonorrhoeae ПЗ=0, Mycoplasma genitalium, ПЗ=0 Herpes simplex 1 и 2 типов ПЗ=0, Cytomegalovirus ПЗ=0; при выявлении абсолютно- или условно-патогенных микроорганизмов в количестве, превышающем пороговое значение, делают заключение о потенциальном значении данного микроорганизма в этиологической диагностике хронического эндометрита.