Способ прогнозирования течения хронической сердечной недостаточности у больных ишемической болезнью сердца
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой способ прогнозирования течения хронической сердечной недостаточности у больных ишемической болезнью сердца, характеризующийся тем, что в сыворотке крови определяют содержание белка апоптоз-опосредуемого фактора - растворимого Fas-лиганда - и при наличии уровня растворимого Fas-лиганда более 99,9 пг/мл прогнозируют неблагоприятное течение заболевания. Осуществление изобретения позволяет повысить точность прогнозирования течения сердечной недостаточности. 4 табл., 2 ил., 2 пр.
Реферат
Изобретение относится к медицине и может быть использовано в кардиологии, ангиологии, кардиохирургии, реабилитологии для прогнозирования риска неблагоприятного течения хронической сердечной недостаточности (ХСН) и, следовательно, снижения риска исключительно высокой преждевременной смертности у больных ИБС с учетом провоспалительных цитокинов сыворотки крови.
В настоящее время во всем мире отмечается резкий подъем заболеваемости хронической сердечной недостаточностью (ХСН). За последние 40 лет число больных с ХСН выросло в 5 раз. В России распространенность клинически выраженной ХСН составляет 5,5%, в странах Западной Европы ХСН встречается у 1-4% взрослого населения. Прогноз больных с ХСН по-прежнему остается одним из самых неблагоприятных. Наличие сердечной недостаточности ассоциируется с 4-кратным возрастанием летальности по сравнению с сопоставимой популяционной группой. По данным Фрамингемского исследования средняя 5-летняя смертность во всей популяции больных ХСН составляет 65% для мужчин и 47% для женщин. Примерно половина больных умирает в течение первых 4 лет с момента постановки диагноза, а в тяжелых случаях столько же пациентов умирает в течение первого года. Кроме того, ХСН является довольно финансово затратной в лечении патологией; расходы на ее лечение составляют 1-2% всех расходов на здравоохранение [1-5]. Исходя из этого, легко объясняется возрастание потребности в фундаментальных и прикладных исследованиях, направленных на разработку вопросов патогенеза, лечения и профилактики ишемической дисфункции сердца, лежащей в основе манифестации сердечной недостаточности.
Известен способ прогнозирования развития гипертонической болезни по генетическим факторам риска, сущность которого заключается в проведении анализа полиморфизма генов PON1 и СЕРТ [6].
Недостатком данного способа является то, что у пациентов риск развития заболевания прогнозируют при анализе полиморфизмов генов, выделенных из ДНК лимфоцитов периферической венозной крови, что приводит к более высоким финансовым затратам на идентификацию генотипов.
В проанализированной патентной и научной медицинской литературе адекватного прототипа не обнаружено.
Задачей изобретения является разработка объективного неинвазивного высокоинформативного способа прогнозирования течения хронической сердечной недостаточности по содержанию в крови одного из провоспалительных цитокинов - растворимого Fas-лиганда.
Поставленная задача решается путем определения растворимого Fas-лиганда в сыворотке крови посредством иммуноферментного метода у больных ИБС. При выявлении у пациентов с ИБС уровня растворимого Fas-лиганда более 99,9 пг/мл прогнозируют неблагоприятное течение заболевания.
Новым в предлагаемом способе является то, что для прогнозирования течения хронической сердечной недостаточности у пациентов с ИБС в сыворотке крови определяют содержание растворимого Fas-лиганда. Если уровень растворимого Fas-лиганда превышает 99,9 пг/мл, у больных ИБС прогнозируют неблагоприятное течение хронической сердечной недостаточности.
Предложенный способ прогнозирования течения хронической сердечной недостаточности с использованием одного из провоспалительных цитокинов основан на том, что в его основе лежит влияние трансмембранного рецептора Fas и его лиганда на молекулярный путь ишемического ремоделирования миокарда, который и обусловливает темп прогрессирования ХСН и, в конечном итоге, определяет прогноз [7, 8]. Ключевым механизмом этого процесса признан Fas-опосредованный апоптоз, активатором которого, в свою очередь, является растворимый Fas-лиганд (sFas-L), а ингибитором -растворимый Fas-рецептор (sFas) [9, 10].
В настоящее время установлено важное значение апоптоза, играющего ключевую роль в регуляции деятельности сердечно-сосудистой системы [8]. Согласно современным представлениям при ХСН апоптоз индуцируется ишемией, реперфузией, цитокинами, нейрогормонами [11]. Гибель клеток путем апоптоза происходит также при уменьшении кровоснабжения органа, в частности при ИБС [12-14]. В силу того, что кардиомиоциты являются клетками конечно детерминированными, их потеря в значительной мере определяет степень нарушения сократительной способности оставшегося миокарда [15]. Отмечена прямая зависимость между выраженностью ХСН и количеством погибших кардиомиоцитов. На фоне хронической ишемии миокарда апоптоз кардиомиоцитов запускается по внешнему (рецепторному) пути [15]. Основанием для этого может служить как повышение содержания проапоптотических лигандов (sFas-L), фактора некроза опухоли-α (ФНО-α) в плазме крови, так и повышение количества рецепторов к соответствующим факторам на поверхности кардиомиоцитов (Fas-R, ФНО-R1) [16]. Вместе с тем, механизмы программированной гибели клетки, последовательность биохимических изменений при сердечной недостаточности на настоящий момент до конца не изучены, а литературные данные по этому вопросу весьма противоречивы.
Таким образом, оценка содержание белка апоптоз-опосредуемого фактора - растворимого Fas-лиганда является ранним предиктором стратификации риска развития ишемического ремоделирования ЛЖ и апоптоза миокарда, приводящих к неблагоприятному течению ХСН.
Техническим результатом предлагаемого изобретения является повышение точности прогноза заболевания.
Технический результат достигается путем определения в сыворотке крови методом иммуноферментного метода растворимого Fas-лиганда и дает возможность:
- оценить персональный риск прогрессирования ХСН у больных ИБС еще на ранней стадии манифестации заболевания и назначить соответствующую патогенетическую профилактическую терапию, направленную на ингибирование процессов ишемического ремоделирования ЛЖ и апоптоза миокарда;
- повысить предсказательную ценность неблагоприятного прогноза течения ХСН;
- снизить большие финансовые затраты, связанные с идентификацией полиморфизмов генов, позволяющих стратифицировать риск развития неблагоприятного прогноза сердечно-сосудистого заболевания;
- определить приоритетную группу больных ИБС для диспансерного наблюдения и оптимизации эффективных целевых профилактических мероприятий, направленных на профилактику развития ХСН и предотвращение у них исключительно высокой преждевременной смертности.
Существенные признаки проявили в заявляемой совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области и не очевидные для специалиста. Идентичной совокупности признаков в проанализированной литературе не обнаружено. Предлагаемое изобретение может быть использовано в здравоохранении.
Исходя из вышеизложенного, следует считать изобретение соответствующим условиям патентоспособности "Новизна", "Изобретательский уровень", "Промышленная применимость".
Изобретение будет понятно из следующего описания и приложенного к нему рисунка.
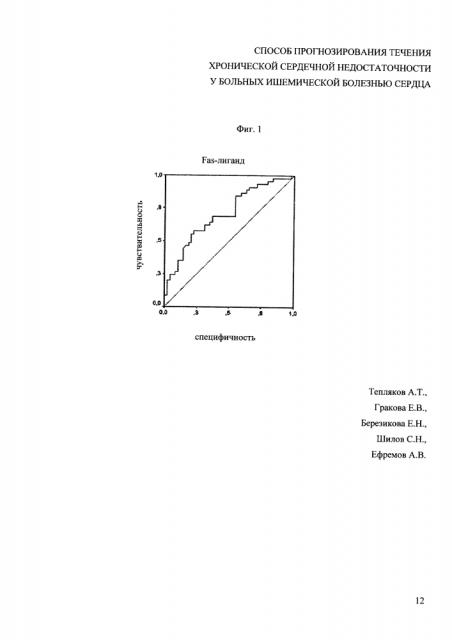
На фиг. 1 изображена характерологическая кривая (ROC-кривая) чувствительности и специфичности значений растворимого Fas-лиганда; на фиг. 2 - ROC-кривая фракции выброса левого желудочка (ФВ ЛЖ) в неблагоприятном прогнозе течения ХСН.
Способ осуществляется следующим образом:
Определение уровня растворимого Fas-лиганда в сыворотке крови проводили методом иммуноферментного твердофазного анализа (ELISA). Использовали коммерческий набор фирмы Bender MedSystems (Австрия).
Используемый материал: сыворотка крови.
Приготовление образцов: перед исследованием 1 часть сыворотки разводится в 30 раз трис-буфером.
Ход определения:
1) подготовка микротитрационных стрипов;
2) добавление разведенного буфером материала в лунку микротитрационного стрипа и инкубация в течение 1 часа при комнатной температуре;
3) промывание;
4) добавление в лунку микротитрационного стрипа иммуноконъюгатов и инкубация в течение 1 часа при комнатной температуре;
5) промывание;
6) добавление раствора субстрата о-фенилдиамина/H2O2;
7) ровно через 3 минуты добавление соляной кислоты (1 моль/л);
8) чтение результатов на ИФА-анализаторе через 10-120 минут.
Специфические моноклональные антитела (СМА) к определяемому агенту (OA) в избытке фиксированы на внутренней стенке ячейки микротитрационного планшета. В первой иммунореакции свободный плазменный антиген OA взаимодействует и образует комплекс с пристеночными моноклональными антителами. Затем присутствующие в тест-системе компоненты плазмы удаляются промыванием на промывателе микротитрационных микропланшет. Поскольку антиген имеет постоянную антигенную детерминанту, то добавление (в избытке) меченых пероксидазой антител к OA приводит к формированию сэндвич-комплексов (вторая иммунореакция), в которых антиген OA закрыт антителами с обеих сторон. Число меченых пероксидазой антител пропорционально количеству OA, содержащемуся в исследуемом материале.
Индикаторная реакция (детекция) запускается добавлением субстрата - о-фенил-диамина/H2O2, который расщепляется пероксидазой фиксированного на внутренней стенке комплекса антитело-антиген-антитело, с выделением хромогена (красящего вещества), определяемого фотометрически (на иммуноферментном фотометре длиной волны 492 нм).
Статистическая обработка результатов проводилась с использованием пакета прикладных программ SPSS 11.5 for Windows. Критический уровень значимости при проверке статистических гипотез в данном исследовании принимался равным 0,05. Описание качественных данных проводилось путем построения таблиц сопряженности с указанием абсолютных и относительных частот встречаемости признаков. Оценку значимости межгрупповых различий проводили при помощи критерия χ2.
В основную группу включено 94 больных ИБС (57 мужчин и 37 женщин) в возрасте от 45 до 65 лет (средний возраст 57,3±6,7) с ХСН II-IV ФК. В группу контроля вошли 32 здоровых волонтеров без сердечно-сосудистой патологии и тяжелых хронических заболеваний (17 мужчин и 15 женщин) в среднем возрасте 54,2±4,3 лет.
В начале исследования и через 12 месяцев наблюдения в сыворотке крови с помощью иммуноферментного метода определяли содержание апоптоз-опосредуемого фактора - растворимого Fas-лиганда.
На каждого больного заполнялась специально разработанная клиническая карта. Все пациенты давали свое письменное информированное согласие для участия в исследовании. Состояние больных оценивали исходно и через 12 месяцев с анализом частоты комбинированной конечной точки, включавшей: летальность, повторные госпитализации по поводу обострений ХСН, эпизоды ухудшения течения сердечно-сосудистой патологии. Оценивали в динамике показатели ЭхоКГ - конечный диастолический размер (КДР), конечный систолический размер (КСР), фракция выброса ЛЖ (ФВ ЛЖ), межжелудочковая перегородка (МЖП), задняя стенка ЛЖ (ЗСЛЖ).
С целью выявления возможности ассоциации растворимого Fas-лиганда с характером течения ХСН больные были разделены по итогам годичного наблюдения на две группы: группа А (49 человек) - пациенты с благоприятным течением заболевания и группа Б (45 человек) - пациенты с неблагоприятным течением патологии.
В исследование включили пациентов, состояние которых сохранялось стабильным в течение не менее 2-3-х недель на постоянной базовой терапии, включавшей ингибиторы АПФ или антагонисты рецепторов к ангиотензину II, β-адреноблокаторы, диуретики, при необходимости антагонисты альдостерона, сердечные гликозиды.
Результаты исследования уровня растворимого Fas-лиганда (sFas-L) в группе контроля и в группе больных представлены в табл. 1.
По данным анализа выявлено, что у больных ХСН уровень растворимого Fas-лиганда в крови был достоверно выше, чем в группе контроля, и возрастал по мере увеличения ФК заболевания. Так у пациентов с ФК II уровень растворимого Fas-лиганда был в 3,7 раза выше группы контроля (р<0,05), при этом в 1,4 и 1,7 раза меньше, чем у пациентов с ФК III и ФК IV (р<0,05), соответственно. У пациентов с ФК III данный показатель составил 101,4±11,3 пг/мл, что 5,3 раза выше, чем в группе контроля (р<0,05). Наиболее высокий уровень sFas-L в начале наблюдения был отмечен в крови пациентов с ФК IV, он составил 124,2±15,5пг/мл, что в 6,5 раза выше контрольной группы (р<0,05).
При анализе ассоциации растворимого Fas-лиганда с характером течения ХСН установлено, что у пациентов с неблагоприятным течением заболевания (группа Б) в начале исследования (114,6±12,5 пг/мл и 87,4±9,7 пг/мл соответственно, р<0,05) и через 12 месяцев наблюдения (145,3±15,2 пг/мл и 73,4±10,5 пг/мл соответственно, р<0,05) уровень sFas-L в сыворотке крови был значительно выше по сравнению с группой А с благоприятным течением ХСН (табл. 2).
В динамике через 12 месяцев наблюдения у больных ХСН группы с неблагоприятным течением ХСН отмечалось достоверное повышение уровня растворимого Fas-лиганда (в 1,3 раза) по отношению к исходному уровню (р<0,05).
Анализ показателей структурно-функционального состояния ЛЖ по данным Эхо-КГ показал, что нарастание тяжести ХСН характеризовалось прогрессивным снижением сократительной способности миокарда, увеличением размеров полостей сердца, что, в свою очередь, сопровождалось повышенным высвобождением растворимого Fas-лиганда. При этом отмечена достоверная прямая корреляционная связь ФВ ЛЖ с концентрацией sFas-L (r=0,51, р<0,05), а также прямая корреляционная зависимость (р<0,05) между концентрацией растворимого Fas-лиганда в сыворотке и размерами полостей ЛЖ (КСР - r=0,43; КДР - r=0,54). Данные результаты позволяют сделать вывод о значимом влиянии апоптоза на структурно-функциональное состояние ЛЖ при ХСН.
При применение ROC-анализа показателей чувствительности и специфичности прогнозирования неблагоприятного сердечно-сосудистого события по значениям растворимого Fas-лиганда и ФВ ЛЖ выявлена преимущественная прогностическая значимость биохимического маркера (фиг. 1). Площадь под кривой (ROC-Area±S.E.) для растворимого Fas-лиганда составила 0,71±0,05 (95%ДИ=0,60-0,81, р=0,0005), превысив таковой показатель для ФВ ЛЖ - ROC-Area±S.E=0,63±0,06 (95%ДИ=0,52-0,74, р=0,0325). Сопоставление данных диагностического определения растворимого Fas-лиганда и ЭхоКГ убедительно продемонстрировало преимущества биохимического определения растворимого Fas-лиганда перед «традиционной» ультразвуковой диагностикой ХСН в отношении предсказательной ценности неблагоприятного прогноза течения ХСН.
При определении на ROC-кривой точки, соответствующей оптимальному соотношению чувствительности и специфичности, выявлено, что уровень sFas-L более 99,9 пг/мл позволяет с наибольшей вероятностью (чувствительность - 69%, специфичность - 63%) прогнозировать неблагоприятные сердечно-сосудистые события у больных ХСН.
Таким образом, прогрессирующее увеличение концентрации растворимого Fas-лиганда с повышением тяжести ХСН указывает на выраженность погибающих по программе Fas-зависимого апоптоза кардиомиоцитов у таких больных, что может быть вызвано усилением выработки некоторых провоспалительных цитокинов, обнаруженным у больных с ХСН [7]. У пациентов с благоприятным течением заболевания уровень растворимого Fas-лиганда к концу наблюдения имел тенденцию к снижению, тогда как у пациентов с неблагоприятным течением, напротив, достоверно повышался (р<0,05).
Способ прогнозирования течения хронической сердечной недостаточности у пациентов с ИБС по анализу содержания растворимого Fas-лиганда иллюстрируется следующими клиническими примерами, свидетельствующими о том, что определение его уровня в сыворотке крови обеспечивает объективную оценку тяжести процесса, а содержание растворимого Fas-лиганда более 99,9 пг/мл является важным прогностическим тестом течения ХСН у больных ИБС.
ПРИМЕР 1: Пациент Н., 56 лет. Поступил 21.01.2011 г. с жалобами на утомляемость, одышку, учащенное сердцебиение при небольшой физической нагрузке; давящие боли за грудиной, без иррадиации, возникающие при физической нагрузке (подъем на 2-й этаж, ходьба на 200-300 м). Боли купировались приемом нитроглицерина под язык, в покое. Суточная потребность в нитроглицерине составляла до 4 таб./сут. При объективном исследовании: пульс 80 уд/мин. АД 120/75 мм рт. ст., частота дыхания 20 в минуту, выраженные отеки стоп и голеней. Клинико-лабораторные показатели пациента при поступлении представлены в таблице 3.
Клинический диагноз: ИБС: Стенокардия напряжения 2 ФК. Постинфарктный (2010 г.) кардиосклероз. Стенозирующий атеросклероз коронарных артерий: ПКА ср/3 70%, пр/3 ПКА≥50%, ВТК 20-25%. НК 2А, III ФК ХСН по NYHA.
Назначено лечение: аспирин 75 мг/сут, гипотиазид 25 мг/сут, спиронолактон 25 мг/сут, эналаприл 10 мг/сут, карведилол 12,5 мг/сут, аторвастатин 20 мг/сут, нитроглицерин сублингвально при ангинозных болях.
Через 12 мес наблюдения отмечено улучшение переносимости физической нагрузки по данным теста 6-минутной ходьбы, уменьшение частоты ангинозных болей до 1-2 приступов в день, снижение суточной потребности в нитроглицерине до 0-1 таб./сут. Гемодинамика стабильна АД 100-110/65-70 мм рт. ст., частота сердечных сокращений (ЧСС) 65/мин; сохранялась пастозность на уровне стоп. Уменьшился ФК ХСН - до II по NYHA. По данным Эхо-КГ: увеличилась ФВ ЛЖ, уменьшились КСР и КСР ЛЖ, толщина ЗСЛЖ и МЖП.
ПРИМЕР 2: Пациент К., 54 года. Поступил 14.10.2010 г. с жалобами на утомляемость, инспираторную одышку, учащенное сердцебиение при небольшой физической нагрузке; давящие боли за грудиной, без иррадиации, возникающие, при физической нагрузке (подъем на 2-й этаж, ходьба на 200-300 м). Боли купировались приемом нитроглицерина под язык, в покое. Суточная потребность в нитроглицерине составляла до 4 таб./сут. При объективном исследовании: пульс 73 уд/мин. АД 125/70 мм рт. ст., частота дыхания 18 в минуту, выраженные отеки стоп и голеней. Клинико-лабораторные показатели пациента при поступлении представлены в таблице 4.
Клинический диагноз: ИБС: Стенокардия напряжения 2 ФК. Постинфарктный (2009 г.) кардиосклероз. Стенозирующий атеросклероз коронарных артерий: п/3 и с/3 75%, OA д/3 30-40%, ПКА п/3 25-30%, 3НА с/3 25-30%. НК 2А, III ФК ХСН по NYHA.
Назначено лечение: аспирин 75 мг/сут, гипотиазид 25 мг/сут, эналаприл 20 мг/сут, спиронолактон 25 мг/сут, бисопролол 7,5 мг/сут, симвастатин 20 мг/сут, нитроглицерин сублингвально при ангинозных болях.
К исходу 12-месячного проспективного наблюдения отмечено ухудшение толерантности к физической нагрузке, сохранялись жалобы на инспираторную одышку, быструю утомляемость, головокружение, учащенное сердцебиение при небольшой физической нагрузке, частота возникновения ангинозных болей сохранилась на прежнем уровне, суточная потребность в нитроглицерине - 3-4 таб./сут. АД 100/60 мм рт. ст. ЧСС 82/мин, выраженные отеки стоп и голеней. Увеличился ФК ХСН - до IV по NYHA. По данным Эхо-КГ: уменьшилась ФВ ЛЖ, увеличились КДР и КСР ЛЖ.
Результаты нашего исследования убедительно продемонстрировали, что неблагоприятное течение ХСН у пациентов с ИБС, обусловленное апоптозом кардиомиоцитов и ремоделированием миокарда с явными нарушениями инотропной функции сердца, сопровождается повышенным (более 99,9 пг/мл) уровнем растворимого Fas-лиганда и имеет прогностическое значение.
Таким образом, полученные нами данные о значимости содержания растворимого Fas-лиганда при манифестации хронической сердечной недостаточности у больных ИБС характеризуются научной новизной и приоритетностью.
Предлагаемый способ применен у 94 пациентов и позволяет прогнозировать неблагоприятное течение ХСН, обусловленное растворимого Fas-лиганда в сыворотке крови у больных ИБС, путем иммуноферментного метода у больных ИБС, что позволяет выделить приоритетную группу больных ИБС для диспансерного наблюдения с организацией эффективных целевых мероприятий, направленных на профилактику развития ХСН и предотвращение у них исключительно высокой преждевременной смертности.
СПИСОК ЛИТЕРАТУРЫ
1. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П. и соавт. Национальные рекомендации ОССН, РКО и РНМОТ по диагностике и лечению ХСН (четвертый пересмотр). ISSN 1728-4651 // Журнал сердечная недостаточность. - Том 14. - №7 (81). - 2013. - С. 2-3.
2. Остроумова О.Д., Шорикова Е.Г., Мамаев В.И. Фармакоэкономические аспекты лечения больных с хронической сердечной недостаточностью в условиях стационара // Кардиология. - 2004. - №2. - С. 108-111.
3. Фомин И.В. Эпидемиология хронической сердечной недостаточности в Российской Федерации // Хроническая сердечная недостаточность / Агеев Ф.Т., Арутюнов Г.Л., Беленков Ю.Н. и др. - М.: ГЭОТАР - Медиа, 2010. - С. 16-17.
4. Ho K.K., Pinsky J.L., Kannel W.B. et. al. The epidemiology of heart failure: the Framingham study // J Am Coll Cardiol. - 1993. - Vol. 22. - P. 6A-13A.
5. Tendera M. Epidemiology, treatment, and guidelines for the treatment of heart failure in Europe // Eur Heart J. - 2005. - Vol. 7 (Suppl. J). - P. 5-9.
6. Мустафина O.E., Сахаутдинова Г.М., Туктарова И.А., Насибуллин Т.Р., Мингазетдинова Л.Н. Способ прогнозирования развития гипертонической болезни по генетическим факторам риска. Патент РФ RU 2287158, опубликован 10.11.2006 г.
7. Тепляков А.Т., Болотская Л.Я., Дибиров М.М. и др. Клинико-иммунологические нарушения у больных с постинфарктным ремоделирование левого желудочка с ХСН // Терапевтический архив. - 2008. - №11. - С. 52-57.
8. Eltyeb A., Graham S. Apoptosis in chronic heart failure // Cardiology. - 2007. - Vol. 114 (3). - P. 375-379.
9. Pangonyte D., Stalioraityte E., Ziuraitiene R. et al. Cardiomyocyte remodeling in ischemic heart disease // Medicina (Kaunas). - 2008. - 44. - P. 848-854.
10. Терещенко С.Н., Бармотин Г.В., Соколовская А.А. и др. Апоптоз и иммунный статус больных острым инфарктом миокарда и сердечной недостаточностью // Успехи клинической иммунологии и аллергологии. - 2000 - 1. - С. 179-190.
11.Stamatis A., John Т.Р., Michael G. et al. Growth hormone administration reduces circulating proinflammatory cytokines and soluble Fas/soluble Fas ligand system in patients with chronic heart failure secondary to idiopathic dilated cardiomyopathy // Am Heart J. - 2002 - Vol. 144 (2). - P. 359-364.
12. Симоненко В.Б., Бойцов С.А., Глухов А.А. Апоптоз и патология миокарда // Клиническая медицина. - 2000. - №8. - С. 12-16.
13. Das A., Xi L., Kukreja R.C. Phosphodiesterase-5 Inhibitor Sildenafil Preconditions Adult Cardiac Myocytes against Necrosis and Apoptosis // J Biol Chem. - 2005. - Vol. 280 (13). - P. 12944-12955.
14. Ricci C, Pastukh V., Schaffer S.W. Involvement of the mitochondrial permeability transition pore in angiotensin II mediated apoptosis // Exper and Clin Cardiology. - 2005. - Vol. 10 (3). - P. 160-164.
15. Ярилин А.А. Апоптоз. Природа феномена. Его роль в целостном организме // Патофизиология и экспериментальная терапия. - 1998 - №2. - С. 43-48.
16. Garg S., Narula J., Chandrashekhar Y. Apoptosis and heart failure: clinical relevance and therapeutic target // J of Molecular and Cellular Cardiology. - 2005. - Vol.38. - P. 73-79.
Способ прогнозирования течения хронической сердечной недостаточности у больных ишемической болезнью сердца, характеризующийся тем, что в сыворотке крови определяют содержание белка апоптоз-опосредуемого фактора - растворимого Fas-лиганда - и при наличии уровня растворимого Fas-лиганда более 99,9 пг/мл прогнозируют неблагоприятное течение заболевания.