Способ подавления роста опухоли основе in vitro репрограммирования макрофагов на м1 фенотип с повышенной способностью к продукции оксида азота в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к иммунологии, клеточным биотехнологиям, и может быть использовано для восстановления противоопухолевого иммунитета и подавления роста опухоли с последующим применением в клинической практике. Технический результат заключается в получении M1 фенотипа макрофага с эффективными антиопухолевыми механизмами, характеризующегося высокой продукцией NO, что позволит обеспечить более высокую устойчивость формирующегося фенотипа к репрограммирующему действию самой опухоли. Предлагается способ подавления роста опухоли на основе in vitro репрограммирования макрофагов на m1 фенотип с повышенной способностью к продукции оксида азота в эксперименте при культивировании макрофагов в бессывороточной среде, при котором к бессывороточной среде добавляют IFN-γ 20 нг/мл. 3 ил., 3 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к иммунологии, клеточным биотехнологиям, и может быть использовано для восстановления противоопухолевого иммунитета и подавления роста опухоли с последующим применением в клинической практике.
Известно, что одна из важнейших функций иммунной системы заключается в удалении опухолевых клеток. Несмотря на то что каждый тип опухолей имеет свои существенные особенности развития, в патогенезе многих, особенно злокачественных, видов опухолей, несомненно, отмечены и общие механизмы, прежде всего, - это подавление антиопухолевой активности иммунной системы, т.е. проопухолевая трансформация иммунного ответа. Несмотря на тот факт, что первая линия противоопухолевой защиты реализуется при непосредственном участии клеток системы врожденного иммунитета - макрофагов и данные клетки призваны уничтожать опухоль, в результате проопухолевой трансформации иммунного ответа клетки иммунной системы и в том числе макрофаги теряют способность уничтожать опухолевые клетки, и даже начинают способствовать росту и метастазированию опухоли [Condeelis, J., Pollard, J.W. Macrophages: obligate partners for tumor cellmigration, invasion, and metastasis Cell 2006; 124:263-266; Lewis, С.E., Pollard, J.W. Distinct role of macrophages in different tumormicr oenvironments Cancer Res. 2006; 66: 605-12; Sica, Α., Schioppa, T., Mantovani, Α., Allavena, P. Tumor-associated macrophages are adistinct M2 polarized population promoting tumor progr ession: potential targets of anti-cancer therapy Eur. J. Cancer.2006; 42:717-27]. Макрофаги в зоне опухоли (опухоле-ассоциированные макрофаги, tumor associated macrophages, ТАМ) под действием опухолевого микроокружения приобретают, преимущественно проопухолевый, проангиогенный фенотип и состоят, предпочтительно, из популяции поляризованных макрофагов М2 (CD206+, F4/80+) с низкой цитотоксичностью по отношению к опухолевым клеткам из-за ограниченного продуцирования ими провоспалительных цитокинов, оксида азота [Mills et al. 2000 J. Immunol. 164:6166-6173], характеризуются низкой антиген-презентирующей способностью и эффективно подавляют активацию Т-клеток. Фактически, эти макрофаги фенотипа М2 действительно способствуют пролиферации опухолевых клеток и метастазированию, секретируя широкий спектр факторов роста и проангиогенных факторов, а также металлопротеиназ, с вовлечением в сигнальную циркуляцию, что регулирует функцию фибробластов опухолевой стромы [Mantovani et al. 2004, Novartis. Found. Symp.256:137-145].
Рассматривая ТАМ в качестве терапевтической «мишени» в разработке новой противоопухолевой стратегии и создании новой клеточной биотехнологии, целесообразно обеспечить возможность эффективного репрограммирования ТАМ в сторону антиопухолевого M1 фенотипа, способного к ограничению роста опухолевых клеток не только за счет таких механизмов, как увеличение продукции провоспалительных цитокинов [Lum HD, Buhtoiarov IN, Schmidt BE, Berke G, Paulnock DM, Sondel PM, Rakhmilevich AL. Tumoristatic effects of anti-CD40 mAb-activated macrophages involve nitric oxide and tumour necrosis factor-α. Immunology, 2006;118(2):261-70], свободных радикалов [Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell, 2010;140(6):883-99] или презентации опухолевых антигенов и формирования Th1 и цитотоксических лимфоцитов [Backer R, Schwandt Τ, Greuter M, Oosting M, Jngerkes F, Tting Τ et al. Effective collaboration between marginal metallophilic macrophages and CD8+ dendritic cells in the generation of cytotoxic Τ cells. Proc Natl Acad Sci USA, 2010; 107(1):216-21; Barrio MM, Abes R, Colombo M, Pizzurro G, Boix C, Roberti MP et al. Human macrophages and dendritic cells can equally present MART-1 antigen to CD8(+) Τ cells after phagocytosis of gamma-irradiated melanoma cells. PLoS One, 2012; 7(7):e40311], но и повышенной продукции оксида азота (nitric oxide, NO) [Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell, 2010; 140(6):883-99; Lum HD, Buhtoiarov IN, Schmidt BE, Berke G, Paulnock DM, Sondel PM, Rakhmilevich AL. Tumoristatic effects of anti-CD40 mAb-activated macrophages involve nitric oxide and tumour necrosis factor-α. Immunology, 2006; 118(2):261-70].
Известны подходы и способы подавления роста опухоли, основанные на перепрограммировании М2 фенотипа на антиопухолевый M1 фенотип, которые заключаются в проведении селективной стимуляции Toll-like рецепторов и ингибировании рецепторов трансформирующего фактора роста (TGF)-бета (β) [Peng J, Tsang JY, Li D et. al. Inhibition of TGF-β signaling in combination with TLR7 ligation re-programs a tumoricidal phenotype in tumor-associated macrophages. Cancer Lett. 2013 Mayl; 331(2):239-49], что обеспечивает репрограммирование ТАМ в сторону M1 фенотипа, снижение продукции ангиогенных факторов, увеличение апоптоза опухолевых клеток и увеличение лимфоцитов и нейтрофилов в опухоли. Существенным недостатком данного подхода является то, что перепрограммирование макрофагов на провоспалительный M1 фенотип или стимулирование их провоспалительных функций может замедлить рост опухоли, однако провоспалительные цитокины могут также активировать Τ регуляторные (Treg) клетки и миелоидные Τ супрессорные лимфоциты (MDSC). Эти клетки могут подавить антиопухолевую активность M1 макрофагов, Тh1 и Τ клеток. Кроме того, показано, что взаимодействие Toll-likе рецепторов со своими лигандами может также оказывать влияние на апоптоз, индуцированный химиопрепаратом, и формирование резистентности как к киллерному действию эффекторных клеток, так и непосредственно химиопрепаратам [Szajnik M, Szczepanski MJ, Whiteside TL, et al. TLR4 signaling induced by lipopolysaccharide or paclitaxel regulates tumor survival and chemoresistance in ovarian cancer. Oncogene 2009; 28 (49): 4353-63; H.M. Бережная. Toll-like рецепторы и онкогенез. Онкология, Т.15, №2, 2013, С. 76-87]. Таким образом, антиопухолевый эффект M1 макрофагов через активацию Treg клетки и MDSC, напротив, может трансформироваться в проопухолевый эффект.
Предложен способ репрограммирования макрофагов в сторону антиопухолевого M1 фенотипа и усиления продукции провоспалительных цитокинов и усиления антиопухолевой активности макрофагов соответственно при культивировании моноцитов/макрофагов в среде без сыворотки [Rey-Giraud F, Hafner M, Ries CH. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. PLoS One. 2012; 7(8):e42656].
Предлагаемые способы первоначально действительно могут замедлить рост опухоли за счет доказанного усиления продукции провоспалительных цитокинов. Однако эти же цитокины могут активировать Τ регуляторные (Treg) клетки и Myeloid-Derived Suppressor Cells (MDSC) [Ostrand-Rosenberg S, Sinha P. Myeloid-derived suppressor cells: linking inflammation and cancer. J Immunol 2009; 182(8):4499-506]. Дальше активированные Treg клетки и MDSC могут подавить антиопухолевую активность не только M1 макрофагов, но и антигенпрезентирующих клеток, Th1 и Τ клеток [Ostrand-Rosenberg S, Sinha P. Myeloid-derived suppressor cells: linking inflammation and cancer. J Immunol 2009; 182(8):4499-506; Tiemessen et al. 2007; Pittet M., Mempel T. Regulation of T-cell migration and effector functions: insights from in vivo imaging studies. Immunol Rev 2008; 221:107-129]. Таким образом, достигаемый через активацию Treg клеток и MDSC антиопухолевый эффект M1 макрофагов может трансформироваться в проопухолевые последствия. В связи с этим, несомненно, обосновано формирование фенотипа макрофагов, достаточно провоспалительного, чтобы ограничивать рост опухоли, но при этом не вызывать избыточного воспаления, которое могло бы активировать Treg клетки и MDSC.
Известны подходы к подавлению роста опухоли, основанные на блокировании рецепторов, через которые опухоль перепрограммирует макрофаги на М2 фенотип.
Предлагается блокирование рецепторов для TGF-β, IL-10, IL-4, IL-13 и др., выделяемых опухолью [Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo veritas. J Clin Invest 2012; 122(3):787-95], что предупреждает трансформацию M1 макрофагов в проопухолевый М2 фенотип и сохранение антиопухолевой активности макрофагов. Недостатком данного подхода является то, что заблокировать все рецепторы одномоментно к указанным продуктам очень сложно. Формирующаяся в области опухоли гипоксия также способствует перепрограммированию макрофага. В этот процесс вовлечен HIF-1. Однако блокирование HIF-1 в макрофагах может привести к их гибели.
Известен способ подавления роста опухоли, основанный на селективном усилении антиопухолевых свойств макрофагов в зоне опухоли (опухоле-ассоциированные макрофаги, Tumor-Associated Macrophages, ТАМ): а именно предлагается воздействовать на IFN-γ ген, IL-12 гены [Burke е.а. 2002, Andrews К et. al. Adenovirus-interleukin-12-mediated tumor regression in a murine hepatocellular carcinoma model is not dependent on CD1-restricted natural killer Τ cells. Cancer Res. 2000 Nov 15; 60(22):6457-64; Nasu Y et al. Adenovirus-mediated interleukin-12 gene therapy for prostate cancer: suppression of orthotopic tumor growth and pre-established lung metastases in an orthotopic model. Gene Ther. 1999 Mar; 6(3):338-49; Satoh T, Saika T, Ebara S, Kusaka N, Timme TL, Yang G, Wang J, Mouraviev V, Cao G, Fattah el MA, Thompson TC. Macrophages transduced with an adenoviral vector expressing interleukin 12 suppress tumor growth and metastasis in a preclinical metastatic prostate cancer model. Cancer Res 2003; 63(22):7853-60], что обеспечивает использование ТАМ для доставки гена и ингибирования роста опухоли.
Перепрограммирование макрофагов на провоспалительный M1 фенотип или стимулирование их провоспалительных функций может замедлить рост опухоли, однако провоспалительные цитокины могут также активировать Treg клетки и MDSC. Эти клетки могут подавить антиопухолевую активность M1 макрофагов, Тh1 и Τ клеток. Таким образом антиопухолевый эффект M1 макрофагов через активацию Treg клетки и MDSC может трансформироваться в проопухолевый эффект.
Известны способы подавления роста опухоли, основанные на селективном угнетении проопухолевых свойств ТАМ:
1. Предлагается использование CSF-1 антисенс олигонуклеотидов [Aharinejad S, et al. Colony-stimulating factor-1 antisense treatment suppresses growth of human tumor xenografts in mice. Cancer Res 2002; 62: 5317-5324], что способствует замедлению деградации матрикса и подавлению роста опухоли и метастазирования.
2. Предлагается использование малой молекулы Bindarit [Gazzaniga S, Bravo AI, Guglielmotti A et al. Targeting tumor-associated macrophages and inhibition of CCL2 reduce angiogenesis and tumor growth in a human melanoma xenograft. J Invest Dermatol 2007; 127: 2031-2041], которая модулирует активность NFκB, что способствует ингибированию продукции CCL2, M-CSF и снижению плотности микрососудов в опухоли.
3. Известно применение HRG [Rolny С, Mazzone M, Tugues S. et al. HRG inhibits tumor growth and metastasis by inducing macrophage polarization and vessel normalization through downregulation of P1GF. Cancer Cell 2011; 19: 31-44], что обеспечивает снижение продукции PDGF и усиление антиопухолевого иммунитета.
4. Известно использование Silibinin [ Ribes M, Allen Ε, Hudock J, Takeda Τ, Okuyama Η, F, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell 2009; 15: 220-231], что способствует подавлению фосфорилирования NF-κΒ и STAT3 и ингибированию ангиогенеза.
5. Предложено применение LCL-PLP [Banciu M е.а. Antiangiogenic effects of liposomal prednisolone phosphate on B16 melanoma in mice. J Control Release 2006; 113: 1-8], что обеспечивает снижение продукции проангиогенных факторов и ингибирование ангиогенеза в зоне опухоли. Общим недостатком данного подхода является то, что цитокины М2 фенотипа макрофагов, которые способствуют росту опухоли, также участвуют в репарации тканей и формировании гуморального ответа. Поэтому угнетение продукции этих цитокинов может привести к снижению активности систем репарации ткани и снижению активности гуморального ответа.
Известен способ подавления роста опухоли, основанный на блокировании секреторных проопухолевых продуктов опухолеассоциированных макрофагов с помощью антител [Ваау M, Brouwer A, Pauwels Ρ, Peeters M, Lardon F. Tumor cells and tumor-associated macrophages: secreted proteins as potential targets for therapy. Clin Dev Immunol. 2011; 2011:565187], что обеспечивает снижение концентрации проопухолевых медиаторов в микроокружении растущей опухоли и ограничивает подавление иммунитета, ангиогенеза, деградации матрикса и метастазирования.
Наиболее близким к заявляемому является способ, основанный на использовании подхода перепрограммирования макрофагов на M1 фенотип при культивировании макрофагов в бессывороточной среде [Rey-Giraud F, Hafner M, Ries CH. In vitro generation of monocyte-derived macrophages under serum-free conditions improves their tumor promoting functions. PLoS One. 2012; 7(8):e42656]. Недостатком данного подхода является его применение для культивирования макрофагов, полученных из моноцитов, а также использование только одного фактора влияния на изменение фенотипа макрофагов - снижения концентрации сыворотки в культуральной среде, что приводит только к удалению TGF-β из микроокружения макрофагов (вместе с сывороткой) [см. FloraRey-Giraud Mathias Hafner, Carola H. Ries. In Vitro Generation of Monocyte-Derived Macrophages under Serum-Free Conditions Improves Their Tumor Promoting Functions. PLoS ONE | www.plosone.org, August 2012, Volume 7, Issue 8, e42656; Mills CD., Kincaid K., Jennifer M., et al. M-1/M-2 and the Th1/Th2 Paradigm. The Journal of Immunology, 2000, Vol.164 - pp. 6166-6173], но не приведет к должному вовлечению в процессе формирования M1 фенотипа дополнительных сигнальных путей, таких как, например, SMAD7, препятствующий фосфорилированию SMAD2/3 и приводящий на этапе репрограммирования на M1 фенотип к дополнительному ингибированию TGF-β/SMAD-(M2-) зависимого сигнального пути.
В известных авторам источниках патентной и научно-технической информации не описаны способ или клеточная биотехнология репрограммирования фенотипа макрофага на M1 фенотип, характеризующегося повышенной способностью к продукции NO, в отличие от прототипа с использованием комбинации факторов репрограммирования макрофагов, позволяющей достичь наиболее оптимального результата.
Задачей изобретения является повышение эффективности способа подавления роста опухоли.
Технический результат заключается в получении M1 фенотипа макрофага с эффективными антиопухолевыми механизмами, характеризующегося высокой продукцией NO, что позволит обеспечить более высокую устойчивость формирующегося фенотипа к репрограммирующему действию самой опухоли.
Это достигается за счет того, что к бессывороточной среде добавляют IFN-γ 20 нг/мл.
Известно, что в зоне опухоли основная продукция NO осуществляется макрофагами, что существенным образом способствует опухолевой регрессии [Shang ZJ, Li JR, Li ZB: Effects of exogenous nitric oxide on oral squamous cell carcinoma: an in vitro study. J Oral Maxillofac Surg 2002, 60(8):905-910; Li LM, Kibourn RG, Adams J, Filder IJ: Role of NO in lysis of tumor cells by cytokine activated endothelial cells. Cancer Res 1991, 51:2531-2535; Shang ZJ, Li JR: Expression of endothelial nitric oxide synthase and vascular endothelial growth factor in oral squamous cell carcinoma: its correlation with angiogenesis and disease progression. J Oral Pathol Med 2005, 4:134-139], поскольку доказано, что продуцируемый макрофагами NO активно участвует в уничтожении клеток опухолей различного типа [Li LM, Kibourn RG, Adams J, Filder IJ: Role of NO in lysis of tumor cells by cytokine activated endothelial cells. Cancer Res 1991, 51:2531-2535; Lechner M, Lirk P, Rieder J: Inducible nitric oxide synthase (iNOS) in tumor biology: the two sides of the same coin. Semin Cancer Biol 2005, 15:277-289]. Так, с одной стороны, показано, что NO может индуцировать апоптоз опухолевых клеток благодаря подавлению синтеза антиапоптотического Всl-2 и увеличению экспрессии проапоптотического Вах и р53 [см. Zeini M, PG, R, Pantoja C, Matheu A, Serrano M, L, Hortelano S. Specific contribution of p19(ARF) to nitric oxide-dependent apoptosis. J Immunol. 2006; 177(5):3327-36], и таким образом, обладать антиопухолевым действием действием [Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell, 2010; 140(6):883-99; Lum HD, Buhtoiarov IN, Schmidt BE, Berke G, Paulnock DM, Sondel PM, Rakhmilevich AL. Tumoristatic effects of anti-CD40 mAb-activated macrophages involve nitric oxide and tumour necrosis factor-α. Immunology, 2006; 118(2):261-270]. Однако, с другой стороны, NO благодаря, например, нитрозилированию каспаз [Maejima Y, Adachi S, Morikawa К, Ito H, Isobe M. Nitric oxide inhibits myocardial apoptosis by preventing caspase-3 activity via S-nitrosylation. J Mol Cell Cardiol. 2005 Jan; 38(1):163-74; NJ, Higuchi H, Bronk S, Gores GJ. Nitric oxide inhibits apoptosis downstream of cytochrome С release by nitrosylating caspase 9. Cancer Res. 2002; 62(6): 1648-53] и/или активации синтеза HSP70 [Malyshev IYu, Malugin AV, Golubeva LYu, Zenina TA, Manukhina EB, Mikoyan VD, Vanin AF. Nitric oxide donor induces HSP70 accumulation in the heart and in cultured cells. FEBS Lett. 1996; 391(1-2):21 3] может ограничивать развитие апоптоза в опухолевых клетках [Murphy ME. The HSP70 family and cancer. Carcinogenesis. 2013; 34(6): 1181-8] и, соответственно, обладать проопухолевым действием. Также высокий уровень NO подавляет метастазирование [Aranda Ε, С, De La JR, A: Nitric oxide and cancer: the emerging role of S nitrosylation. Curr Mol Med 2012, 12:50-67]. Локальная концентрация NO и свободных радикалов в зоне опухоли определяет, каким образом NO и его метаболиты будут взаимодействовать с ДНК, с системами репарации ДНК, опухолевым супрессором р53, другими активаторами и ингибиторами апоптоза опухолевых клеток. Эти взаимодействия, в свою очередь, будут формировать про- или антиопухолевые эффекты NO [Engin АВ. Dual function of nitric oxide in carcinogenesis, reappraisal. Curr Drug Metab. 2011 Nov; 12(9):891-9]. Изменение фенотипа опухолеассоциированных макрофагов в сторону M1, несомненно, будет способствовать ограничению роста опухолевых клеток не только за счет продукции NO, но также и за счет других механизмов, таких как увеличение продукции провоспалительных цитокинов Lum HD, Buhtoiarov IN, Schmidt BE, Berke G, Paulnock DM, Sondel PM, Rakhmilevich AL. Tumoristatic effects of anti-CD40 mAb-activated macrophages involve nitric oxide and tumour necrosis factor-α. Immunology, 2006; 118(2):261-70; Tsung, K., Dolan, J.P., Tsung, Y.L., Norton, J.A. Macrophages as effector cells in interleukin 12-induced Τ cell-dependent tumor rejection. Cancer Res.2002; 62:5069-75], увеличение продукции свободных радикалов [Grivennikov SI, Greten FR, Karin M. Immunity, inflammation, and cancer. Cell, 2010; 140(6):883-99], активация природных киллеров, которые могут эффективно уничтожать опухолевые клетки [Smyth, M.J., Thia, К.Y., Street, S.E., MacGregor, D., Godfrey, D.I., Trapani, J.A. Perforin-mediated cytotoxicity is critical for surveillance of spontaneous lymphoma J. Exp. Med. 2000; 192:755-60; Street, S.E., Cretney, E., Smyth, M.J. Perforin and interferon- activities independently control tumor initiation, growth, and metastasis. Blood. 2001; 97:192-97]; презентация опухолевых антигенов и формирование Тh1 и цитотоксических лимфоцитов [Backer R, Schwandt Τ, Greuter M, Oosting M, Jngerkes F, Tting Τ et al. Effective collaboration between marginal metallophilic macrophages and CD8+ dendritic cells in the generation of cytotoxic Τ cells. Proc Natl Acad Sci USA, 2010; 107(1):216-21; Barrio MM, Abes R, Colombo M, Pizzurro G, Boix C, Roberti MP et al. Human macrophages and dendritic cells can equally present MART-1 antigen to CD8(+) Τ cells after phagocytosis of gamma-irradiated melanoma cells. PLoS One, 2012; 7(7):e40311], которые инфильтрируют опухоль и убивают опухолевые клетки [Dunn, G.P., Old, L.J., Schreiber, R.D. The immunobiology of cancer immunosurveillance and immunoediting Immunity. 2004; 21:137-148].
Для решения поставленной задачи впервые в способе иммунного подавления роста опухоли на основе репрограммирования макрофагов на M1 фенотип с повышенной способностью к продукции оксида азота используется комбинация факторов для репрограммирования макрофагов на M1 фенотип - бессывороточная среда и добавление IFN-γ 20 нг/мл. В предлагаемой комбинации используется сочетание нескольких факторов репрограммирования макрофагов (цитокиновая и сывороточная модели), поскольку добавление цитокина IFN-γ (цитокиновая модель) к пониженным (0%) концентрациям сыворотки (сывороточная модель) во время репрограммирования на M1 фенотип приводит к активации IFN-γ-зависимого сигнального пути и увеличивает экспрессию ингибиторного SMAD7 (только лишь пониженные концентрации сыворотки таким эффектом не обладают). SMAD7 препятствует фосфорилированию SMAD2/3. Таким образом, накопление SMAD7 на этапе репрограммирования на M1 фенотип будет способствовать ингибированию TGF-β/SMAD-(M2-) зависимого сигнального пути. Целесообразность использования пониженных концентраций сыворотки (сывороточная модель) в комбинированной модели репрограммирования обусловлена тем, что в сыворотке содержится TGF-β и его удаление (вместе с сывороткой) облегчит не только формирование M1 фенотипа, но и будет способствовать более эффективному блокированию TGF-β/SMAD-(M2) зависимого сигнального пути с помощью SMAD7.
В ходе экспериментов проанализировано влияние репрограммированных in vitro на M1 фенотип опухолеассоциированных макрофагов на продолжительность жизни мышей с АКЭ, что позволяет судить о возможности подавления опухолевого роста.
Графические материалы, поясняющие сущность изобретения:
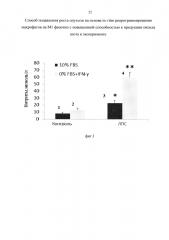
фиг. 1 - репрограммирование опухолеассоциированных макрофагов на M1 фенотип с помощью комбинированной модели. Достоверность отличий: * - р<0.05; ** - р0.01;
фиг. 2 - внешний вид мышей с АКЭ, которым вводили (слева, А) и не вводили (справа, Б) репрограммированные на M1 фенотип опухолеассоциированные макрофаги.
Способ осуществляется следующим образом.
Эксперименты проводились на культуре перитонеальных макрофагов мышей (n=) генетической линии C57/BL6J. Мыши были получены в питомнике животных «Андреевка» (http://andreevka.msk.ru/index.htm) и содержались в аккредитованном виварии в стандартных условиях, не допускающих попадания патогенных микроорганизмов при естественном освещении и свободном доступе к воде и пище [Приказ №63 МЗ СССР от 10.03.1966; «Санитарные правила по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)» за №1045-73, утвержденные Главным государственным санитарным врачом СССР от 06.04.1973. Все эксперименты на животных проводились в соответствии с положениями приказа №755 МЗ СССР от 12.08.1977, а также с соблюдением правил Надлежащей лабораторной практики (Good Laboratory Practice, РФ ГОСТ Р-53434-2009) и в соответствии с руководством ВОЗ для биомедицинских исследований (http://www.cioms.ch/publications/guidelines/1985_texts_of_guidelines.htm).
Опухолевый рост у мышей инициировали с помощью внутрибрюшинного введения клеток асцитной карциномы Эрлиха (АКЭ). Клетки опухоли были получены в «Российском онкологическом научном центре им. H.Н. Блохина». Мышам внутрибрюшинно вводили по 250 тысяч опухолевых клеток, разведенных в 0,2 мл физиологического раствора. Устойчивость мышей к АКЭ и способность репрограммированных in vitro опухолеассоциированных макрофагов на M1 фенотип подавлять опухолевый рост оценивали по продолжительности жизни после введения опухолевых клеток и по изменению веса животных, отражавшему накопление асцита в брюшной полости.
Макрофаги репрограммировали на M1 фенотип с помощью комбинированной модели с использованием двух факторов: 0% FBS [Mills CD, Kincaid К, Alt JM, Heilman MJ, Hill AM. M-1/M-2 macrophages and the Th1/Th2 paradigm. J Immunol. 2000; 164(12):6166-73] и 20 нг/мл IFN-γ [см. Martinez F.O., Sica Α., Mantovani Α., Locati M. Macrophage activation and polarization. Front Biosci.2008; 1(13): 453- 61].
Макрофаги выделяли из здоровых мышей и формировали 4 группы. Группа 1 или «Контроль» - макрофаги, которые культивировались в стандартных условиях с 10% FBS в течение 36 часов. Макрофаги этой группы использовали для внутрибрюшинного введения мышам без опухоли и мышам с АЭК в качестве контроля. Группа 2 или «ЛПС» - макрофаги, которые культивировались в течение 12 часов в стандартных условиях с 10% FBS, а затем стимулировались ЛПС (500 нг/мл) в течение 24 часов. Группа 3 или «Репрограммирование без стимуляции ЛПС» - макрофаги, которые культивировались в течение 36 часов без FBS с добавлением IFN-γ в концентрации 20 нг/мл. Группа 4 «Репрограммирование и стимуляция ЛПС» - макрофаги, которые инкубировались в течение 12 часов без FBS с добавлением IFN-γ в концентрации 20 нг/мл, а затем стимулировались ЛПС (500 нг/мл) в течение 24 часов. Макрофаги этой группы использовали для внутрибрюшинного введения нормальным мышам и мышам с АКЭ.
Репрограммированные in vitro на M1 фенотип опухолеассоциированные макрофаги и контрольные макрофаги из Группы 1 снимали со дна культуральной лунки и вводили внутрибрюшинно нормальным мышам и мышам с опухолью. Для снятия макрофагов с дна лунки использовали трипсин [Rey-Giraud F., Hafner M., Ries C.H. In Vitro Generation of Monocyte-Derived Macrophages under Serum-Free Conditionslmproves Their Tumor Promoting Functions. PLOSone. 2012; 7(8): е42656]. Из лунок удаляли среду и затем добавляли по 1 мл 0,25% раствора трипсина с 0,03% ЭДТА. Плашки инкубировали при 37°С в течение 3 мин. Затем плашки встряхивали. Дальше в каждую лунку добавляли по 1 мл среды и плашку встряхивали. Далее жидкость из лунки переносили в пробирку и добавляли в лунку 1 мл среды, еще раз встряхивали и сливали жидкость в ту же пробирку. Пробирки центрифугировали в течение 5 мин при 1000 оборотах в минуту. После этого надосадочную жидкость удаляли из пробирки, а к осадку макрофагов добавляли 1 мл среды и пипетировали до получения суспензии макрофагов. С помощью среды RPMI-1640 доводили концентрацию макрофагов до 1 млн клеток/1 мл среды (Раствор А).
Из раствора А готовили суспензию 4000 макрофагов в 0,5 мл PBS (Раствор Б). Каждой мыши вводили внутрибрюшинно раствор Б на 3, 7 и 11 дни после введения опухолевых клеток. Были сформированы 5 групп по 16 мышей в каждой: 1. «Опухоль» - мыши, которым вводили опухолевые клетки; 2. «Опухоль + PBS» - мыши, которым вводили опухолевые клетки и на 3, 7 и 11 дни по 0,5 мл PBS; 3. «Опухоль + М1» - мыши, которым вводили опухолевые клетки и на 3, 7 и 11 дни суспензию 4000 макрофагов M1 фенотипа в 0,5 мл PBS; 4. «Опухоль + М0» - мыши, которым вводили опухолевые клетки и на 3, 7 и 11 дни суспензию 4000 перепрограммированных макрофагов в 0,5 мл PBS; 5. «Опухоль + цисплатин» - мыши, которым вводили опухолевые клетки и на 3, 7 и 11 дни антиопухолевый препарат 0,05 мл раствора цисплатин в концентрации 0.5 мг/мл [Zhao Nan, Li YH, Wu XK, Wang GY, Cai DY, Han FJ. Effect of Brucea javanica fruit oil emulsion combined cisplatin on the growth inhibition of transplanted tumor in human ovarian cancer SKOV3 nude mice: an experimental study. Zhongguo Zhong Xi Yi Jie He Za Zhi. 2015 Jan; 35(l):57-62]. Цисплатин - препарат с хорошо известным антиопухолевым действием [Roco A, J, Contreras S, Stojanova J, L. Can pharmacogenetics explain efficacy and safety of cisplatin pharmacotherapy? Front Genet. 2014; 5:391]. Его использовали в качестве препарата сравнения. Эффект введенных макрофагов и цисплатина оценивали по изменению веса и продолжительности жизни животных с опухолью.
Для подтверждения эффективности репрограммирования макрофагов на M1 фенотип оценивали продукцию NO (спектрофотометрически), продукцию про- и антивоспалительных цитокинов и CD-маркеров фенотипа (проточная цитофлуориметрия). Содержание провоспалительных M1 цитокинов IL-2, IL-6, IFNγ и TNF-α и антивоспалительных М2 цитокинов IL-5 и IL-10 [Diehl S., M. The two faces of IL-6 on Th1/Th2 differentiation. Mol Immunol 2002; 39(9): 531-536; Liao W., Lin J.X., Leonard W.J. IL-2 family cytokines: new insights into the complex roles of IL-2 as a broad regulator of Τ helper cell differentiation. Curr Opin Immunol 2011; 23(5): 598-604; Mosser D.M., Edwards J.P. Exploring the full spectrum of macrophage activation. Nature Reviews Immunology 2008; 8(12): 958-69] определяли методом проточной цитофлуориметрии (Beckman Coulter FC500, США) с помощью набора для определения цитокинов (BMS810FF, BenderMedSystems, США) по инструкции производителя.
После репрограммирования макрофагов на M1 фенотип в условиях in vitro выявлено значимое изменение NO-генерирующей активности макрофагов. Так, культивирование макрофагов в среде, не содержащей FBS с добавленным IFN-γ, приводило к увеличению базальной нестимулированной продукции NO (фиг. 1), а также существенно увеличивало генерацию NO макрофагами в ответ на ЛПС (фиг. 1). Эти изменения указывают на процесс формирования M1 фенотипа с высокой NO-генерирующей активностью.
Таким образом, с помощью удаления FBS и добавления IFN-γ нам удалось репрограммировать функциональный фенотип макрофагов мышей в сторону M1 фенотипа.
Для подтверждения эффективности комбинированного репрограммирования макрофагов была также проанализирована секреторная активность ЛПС-индуцированных макрофагов по продукции цитокинов. Выявлено, что репрограммирование макрофагов на M1 фенотип приводило к снижению продукции антивоспалительных цитокинов IL-5 и IL-10 и повышению продукции провоспалительных цитокинов IL-2, IL-6, TNF-α и INF-γ по сравнению с продукцией перепрограммированными макрофагами (Табл. 1). Для всех указанных цитокинов изменения были достоверны (р<0,001). Наиболее заметно при комбинированном репрограммировании изменялся уровень провоспалительного цитокина IL-2 - его продукция возросла практически в 3,5 раза и уровень антивоспалительного цитокина IL-5 - его продукция снизилась в 1,9 раза (Табл. 1). Такое изменение в продукции цитокинов является характерной чертой репрограммирования макрофагов на M1 фенотип [Sica A, Mantovani A. Macrophage plasticity and polarization: in vivo Veritas. J Clin Invest. 2012; 122(3):787-95].
Достоверность отличий от контроля (10% концентрации FBS в питательной среде): *р<0,001 для одноименного цитокина; **р<0,001 для одноименного CD маркера. Фенотипический сдвиг в сторону M1 подтверждают CD маркеры фенотипа макрофагов. После репрограммирования макрофаги имели на своей поверхности больше маркеров M1 фенотипа, CD25 и CD80, и меньше маркеров М2 фенотипа, CD 163 и CD206, по сравнению с макрофагами до репрограммирования (Табл. 1). Таким образом, проведенный анализ маркеров фенотипа макрофагов, таких как продукция NO и цитокинов, а также содержание CD маркеров фенотипа позволяет обоснованно рассматривать предлагаемую комбинированную модель как эффективную для in vitro репрограммирования опухолеассоциированных макрофагов на M1 фенотип.
Анализ данных продолжительности жизни мышей с АКЭ и мышей с АКЭ, которым вводили репрограммированные с помощью комбинированной модели макрофаги, показал, что после введения опухолевых клеток продолжительность жизни мышей составляла 13,6±0,2 дней (Группа 1), тогда как мыши после введения репрограммированных M1 макрофагов (Группа 3) прожили 22,8±0,8 дней (р<0,01), то есть продолжительность жизни возрастала на 68%. Увеличение продолжительности жизни при введении репрограммированных M1 макрофагов было существенно больше, чем при использовании известного антиопухолевого препарата цисплатин (Группа 5). Введение PBS (Группа 2) или перепрограммированных макрофагов (Группа 4) достоверно не повлияло на продолжительность жизни мышей с опухолью (табл. 2).
Достоверность отличий от Группы 1 «Опухоль»: * - р<0,05, ** - р<0,01. Во все группах токсическое действие АКЭ проявлялось увеличением асцита в брюшной полости и соответственно увеличением веса животных. Однако у мышей, которым вводили M1 макрофаги (Группа 3), увеличение веса к 11 дню развития опухоли по сравнению с первым днем составило 6,5±1,1%, тогда как у мышей, которым не вводили макрофаги (Группа 1) - 12,7±1,8% (р<0,01), то есть было в два раза больше. На фиг. 2 представлена репрезентативная фотография мышей на 11 день после введения опухолевых клеток из группы 3, получавшей макрофаги M1 фенотипа (слева, А) и группы 1, не получавшей макрофаги (справа, Б). Видно, что у мышей, получавших M1 макрофаги накопление асцита в брюшной полости было существенно меньше, чем у мышей, не получавших такие макрофаги. Введение PBS (Группа 2) или перепрограммированных макрофагов (Группа 4) никак не повлияло на увеличение веса животных с АКЭ. Таким образом, введение репрограммированных in vitro на M1 опухолеассоциированных макрофагов достоверно повысило устойчивость мышей к развитию АКЭ по параметрам продолжительности жизни и накопления асцитической жидкости в брюшной полости, что свидетельствует о высокой перспективности предлагаемой разработки новой биотехнологии ограничения роста опухоли с помощью репрограммированных in vitro макрофагов.
Пример. При воздействии на макрофаги бессывороточной средой в сочетании с 20 нг/мл INF-γ достигалось увеличение продукции NO (таблица 3), о чем позволяет судить увеличение содержания нитритов в среде и содержание iNOS в макрофагах мышей генетических линий C57BL/6 (таблица 3, фиг. 3, вставка А) и BALB/c (таблица 3, фиг. 3, вставка Б). Фиг. 3. Содержание нитритов в культуральной среде и содержание iNOS в макрофагах мышей генетических линий C57BL/6 (вставка А) и BALB/c (вставка Б) при in vitro репрограммировании макрофагов на M1 фенотип.
Полученные значения продукции нитритов макрофагами при воздействии на них бессывороточной среды в сочетании с INF-γ 20 нг/мл при стимуляции ЛПС по сравнению с контролем (РФМ0) свидетельствовали о существенном сдвиге фенотипа в сторону M1. В верхней части каждой вставки фиг. 3 приведены изменения содержания нитритов в культуральной среде. В нижней части каждой вставки фиг. 3 представлены оригинальные иммунноблоты. Интенсивность окрашивания и толщина черных полос отражает содержание белка iNOS в макрофагах.
Способ подавления роста опухоли на основе in vitro репрограммирования макрофагов на M1 фенотип с повышенной способностью к продукции оксида азота в эксперименте при культивировании макрофагов в бессывороточной среде, отличающийся тем, что к бессывороточной среде добавляют IFN-γ 20 нг/мл.