Амиды n-(2-аминопурин-6-ил)-6-аминокапроновой кислоты, обладающие противоопухолевой активностью, и способ их получения
Иллюстрации
Показать всеИзобретение относится к амидам N-(2-ацетамидопурин-6-ил)-6-аминокапроновой кислоты общей формулы 1, которые обладают высокой противоопухолевой активностью и низкой токсичностью. В общей формуле 1
(1)
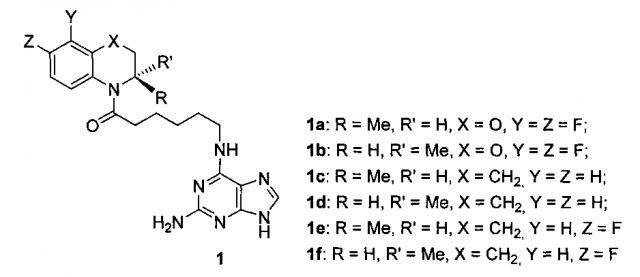
(1a) R=Me, R'=H, X=O, Y=Z=F; (1b) R=H, R'=Me, X=O, Y=Z=F; (1c) R=Me, R'=H, X=CH2, Y=Z=H; (1d) R=H, R'=Me, X=CH2, Y=Z=H; (1e) R=Me, R'=H, X=CH2, Y=Z=F; (1f) R=H, R'=Me, X=CH2, Y=Z=F. Изобретение также относится к способу получения амидов N-(2-аминопурин-6-ил)-6-аминокапроновой кислоты общей формулы (1). Способ заключается в ацилировании соответствующих энантиомерно чистых хиральных гетероциклических аминов общей формулы
где X, Y, Z, R и R′ имеют вышеуказанные значения, хлорангидридом 6-фталимидокапроновой кислоты, удалении фталоильной защитной группы под действием гидразин гидрата, нуклеофильном замещении полученными соединениями атома хлора в 2-ацетамидо-6-хлорпурине с последующим щелочным гидролизом ацетильной группы в полученном продукте. 2 н. и 1 з.п. ф-лы, 1 табл., 6 пр.
Реферат
Изобретение относится к области органической химии, а именно к новым производным пурина, которые обладают противоопухолевой активностью и могут найти применение в медицине.
В 2008 году на всей планете рак унес 7,6 миллиона жизней - такие данные приводит в своем информационном бюллетене за февраль 2012 года ВОЗ. Эта цифра колоссальна: она составляет около 13% всех умерших. По типам рака случаи смерти распределяются неравномерно: рак легких - 18,0%; желудка - 9,7%; печени - 9,1%; толстой кишки - 8,0% [http://www.knigamedika.ru/novoobrazovaniya-onkologiya/statistika-zabolevaemosti-rakom.html#ixzz3KkVMzLeZ].
В связи с этим существует острая необходимость в создании новых средств лечения онкологических заболеваний, в первую очередь наиболее летальных нозологий.
Среди производных пурина найдены соединения, обладающие значительной противоопухолевой активностью. В качестве примера можно назвать вошедшие в клиническую практику 6-меркаптопурин, неларабин и др. Однако в связи с важной ролью пурина и его производных в метаболизме опухолевых клеток, особенно биосинтезе ДНК, поиск новых препаратов на основе пурина, избирательно подавляющих рост опухолевых клеток, активно продолжается в настоящее время.
Задача предлагаемого изобретения - получение новой группы соединений, обладающих противоопухолевой активностью и низкой токсичностью, расширяющей арсенал известных противоопухолевых средств, и разработка способа их получения.
Техническим результатом данного изобретения является создание новой группы химических соединений - амидов N-(2-аминопурин-6-ил)-6-аминокапроновой кислоты общей формулы 1 и разработка способа их получения.
Соединения формулы 1, их физико-химические характеристики, а также способ получения в литературе не описаны.
Наиболее близки по строению к соединениям 1 производные пурина, например, формулы 2,
обладающие способностью ингибировать киназу Aurora A [Bioorg. Med. Chem. Lett. 2008, 18, 3978-3981]. Однако сведения об их противоопухолевой активности в литературе отсутствуют. В литературных источниках не имеется сведений о способах получения соединения 2.
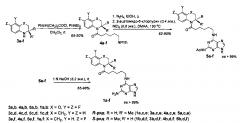
Соединения формулы 1 могут быть получены исходя из индивидуальных (S)- и (R)-энантиомеров аминов формулы 3а-f. В результате ацилирования аминов 3а-f хлорангидридом 6-фталимидокапроновой кислоты синтезированы (S)- и (R)-энантиомеры N-(6-фталимидогексаноил) производных гетероциклических аминов 4a-f. В результате удаления фталоильной защиты гидразинолизом и последующей конденсации с 2-ацетамидо-6-хлорпурином получены конъюгаты 2-ацетамидопурина (R)-конфигурации (5а,с,е) и (S-конфигурации (5b,d,f) (с выходом 62-85%). Щелочной гидролиз ацетамидо-группы в соединениях 5a-f приводит к производным пурина 1a-f.
Общая методика осуществления способа
К раствору соответствующего амина 3а-f (7,0 ммоль) и N,N-диэтиланилина (1,04 г, 7,0 ммоль) в дихлорметане (35 мл) добавляют раствор хлорангидрида 6-фталимидокапроновой кислоты (1,96 г, 7,0 ммоль) в дихлорметане (35 мл). Реакционную массу перемешивают при комнатной температуре в течение 6-48 ч, затем промывают водным раствором HCl (2×50 мл), насыщенным водным раствором NaCl (4×30 мл), водным раствором NaHCO3 (2×30 мл) и водой (2×30 мл). Органический слой сушат MgSO4 и упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент бензол-этилацетат), получая амиды 4a-f (выход 68-90%).
К раствору соответствующего амида 4a-f (5,0 ммоль) в этаноле (30 мл) добавляют гидразин гидрат (0,44 мл, 9,0 ммоль) и кипятят в течение 40-120 мин. Реакционную массу упаривают досуха, к остатку добавляют 2 М HCl (32 мл). Осадок отфильтровывают, фильтрат подщелачивают NaOH до рН 12-13, затем экстрагируют подходящим органическим растворителем (3×30 мл). Органический слой сушат и упаривают. Остаток растворяют в диметилацетамиде (4,8 мл) и добавляют к полученному раствору 2-ацетамидо-6-хлорпурин (0,40 г, 1,9 ммоль) и триэтиламин (0,53 мл, 3,8 ммоль). Реакционную массу нагревают при 90-120°С в течение 12-20 ч, затем выливают в воду и выдерживают при 5-10°С в течение 10-48 ч. Осадок отделяют центрифугированием (8000-15000 об/мин), сушат и перекристаллизовывают из водного этанола, получая конъюгаты 5a-f (выход 62-86%).
К N-[6-(2-ацетамидопурин-6-ил)аминогексаноил]аминам 5a-f (0,90 ммоль) добавляют 1 М NaOH (5,6 мл) и перемешивают при комнатной температуре в течение 36-72 ч. Раствор нейтрализуют 1 М HCl до рН 5-6 и упаривают досуха. Остаток очищают флеш-хроматографией (элюент CHCl3-МеОН), получая соответствующие N-[6-(2-аминопурин-6-ил)аминогексаноил]амины 1a-f (выход 55-98%).
Полученные соединения анализируют следующими методами.
Разработан метод анализа энантиомерного состава конъюгатов 2-аминопурина 1a-f с помощью ВЭЖХ на хиральной неподвижной фазе. Производные 2-аминопурина (R)-ряда (1а,с,е) и (5)-ряда (1b,d,f) получены в оптически чистом виде (ее >99%).
Температуры плавления определяют на приборе SMP3 (Barloworld Scientific, UK). Удельное вращение определяют на поляриметре Perkin Elmer 341. Элементный анализ проводят на анализаторе Perkin Elmer 2400 серии II. Спектры ЯМР 1Н, 19F и 13С регистрируют на приборе Bruker Avance 500 (рабочая частота 500, 470 и 125 МГц, соответственно) в (CD3)2SO с использованием тетраметилсилана и гексафторбензола в качестве внутренних стандартов. Спектры ЯМР регистрируют при температуре 100°С (соединения 1a-f, 4а и 5a-f) или 25°С (соединения 4b-g). Химические сдвиги приведены в миллионных долях (м.д.).
ВЭЖХ анализ соединений 1а и 1b проводят на приборе Agilent 1200 с использованием колонки Kromasil Cellucoat (150×4,6 мм, 5 мкм); скорость потока элюента 0,8 мл/мин, детектирование при 215 нм. ВЭЖХ анализ соединений 1c-f и 5a-f проводят на приборе Agilent 1100 с использованием колонки (S,S)-WHELK-01 (250×4,6 мм, 5 мкм); скорость потока элюента 0,8 мл/мин, детектирование при 215 нм. ВЭЖХ анализ соединений 4a-f проводят на приборе Knauer Smartline-1100 с использованием колонки Chiralcel OD-H (250×4,6 мм, 5 мкм); скорость потока элюента 1,0 мл/мин, детектирование при 220 нм.
Масс-спектры высокого разрешения получают на приборах Bruker maXis Impact HD (соединения 1a, 1b и 5f) и 1200 Infinity с детектором 6540 Accurate-Mass Q-TOF (Agilent Technologies) (соединения 1c-f) (ионизация электрораспылением, режим детектирования положительно заряженных ионов).
Характеристики новых соединений 1a-f, 4a-f, 5a-f приведены в примерах конкретного выполнения.
Примеры конкретного выполнения
Пример 1. Синтез соединения 1а из амина 3а
(3R)-3,4-Дигидро-3-метил-4-(6-фталимидогексаноил)-7,8-дифтор-2H-[1,4]бензоксазин (4а) (стадия 1)
К раствору амина 3а (7,0 ммоль) и N,N-диэтиланилина (1,04 г, 7,0 ммоль) в дихлорметане (35 мл) добавляют раствор хлорангидрида 6-фталимидокапроновой кислоты (1,96 г, 7,0 ммоль) в дихлорметане (35 мл). Реакционную массу перемешивают при комнатной температуре в течение 24 ч, затем промывают 4 М HCl (2×50 мл), насыщенным раствором NaCl (4×30 мл), 5% раствором NaHCO3 (2×30 мл) и водой (2×30 мл). Органический слой сушат MgSO4 и упаривают. Остаток очищают флеш-хроматографией на силикагеле (элюент бензол-этилацетат 90:10). Выход 2,31 г (77%). Бесцветное густое масло. [α]D 20=-68,2 (с 1,0, CHCl3). Ее >99%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH 5: 1): τ 22,0 мин. Спектр ЯМР 1Н: δ=1,11 (д, J=6,8 Гц, 3 Н, Me); 1,30-1,38 (м, 2 Н, 2×Н-4 гексаноил); 1,59-1,68 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,42-2,50 (м, 1 Н, Н-2 В гексаноил, перекрывание с сигналом ДМСО); 2,55-2,63 (м, 1 Н, Н-2А гексаноил); 3,58 (т, J=7,0 Гц, 2 Н, 2×Н-6 гексаноил); 4,12 (д. д, J=11,0,2,8 Гц, 1 Н, Н-2 В); 4,31 (д. д, J=11,0, 1,5 Гц, 1 Н, Н-2А); 4,72 (к. д. д, J=6,8, 2,8, 1,5 Гц, 1 Н, Н-3); 6,78-6,85 (м, 1 Н, Н-6); 7,53 (д. д. д, J=9,3, 5,4, 2,5 Гц, 1 Н, Н-5); 7,78-7,83 (м, 4 Н, Phth). Спектр ЯМР 19F: δ=1,99 (д. д. д, J=20,9, 8,2, 2,5 Гц, 1 F, F-8); 20,08 (д. д. д, J=20,9, 10,1, 5,4 Гц, 1 F, F-7). Спектр ЯМР 13С: δ=15,07; 24,20; 25,74; 27,68; 33,23; 37,22; 44,80; 69,80; 106,72 (д, J=17,8 Гц); 119,20 (м); 121,74; 122,89; 131,52; 134,27; 135,65 (д. д, J=9,8, 2,7 Гц); 138,88 (д. д, J=243,3, 15,4 Гц); 146,44 (д. м, J=241,8 Гц); 167,85, 170,82. Найдено: С 64,54; Н 4,99; F 8,82; N 6,28. Вычислено для C23H22F2N2O4 (М 428,43): С 64,48; Н 5,18; F 8,87; N 6,54.
(3R)-4-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин (5а) (стадия 2).
К раствору амида 4а (2,14 г, 5,0 ммоль) в этаноле (30 мл) добавляют гидразин гидрат (0,44 мл, 9,0 ммоль) и кипятят в течение 80 мин. Реакционную массу упаривают досуха, к остатку добавляют 2 М HCl (32 мл). Осадок отфильтровывают, фильтрат нейтрализуют Na2CO3 и подщелачивают NaOH до рН 12-13, затем экстрагируют диэтиловым эфиром (3×30 мл). Органический слой сушат NaOH и упаривают. Остаток растворяют в диметилацетамиде (4,8 мл) и добавляют к полученному раствору 2-ацетамидо-6-хлорпурин (0,40 г, 1,9 ммоль) и триэтиламин (0,53 мл, 3,8 ммоль). Реакционную массу нагревают при 100°С в течение 20 ч, затем выливают в воду (50 мл) и выдерживают при 5°С 16 ч. Осадок отделяют центрифугированием (15000 об/мин), сушат и перекристаллизовывают из 95% этанола. Дополнительное количество соединения 5а получают из маточного раствора с помощью флеш-хроматографии на силикагеле (элюент CHCl3-МеОН от 100:0 до 95:5). Выход 0,61 г (68%). Бесцветный порошок, т.пл. 195-196°С. [α]D 20=-41,7 (с 1,0, ДМФА). Ее>99%. ВЭЖХ (S,S)-WHELK-01, МеОН-H2O 80:20): τ 21,8 мин. Спектр ЯМР 1H: δ=1,10 (д, J=6,9 Гц, 3 Н, Me); 1,35-1,45 (м, 2 Н, 2×Н-4 гексаноил); 1,59-1,72 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,26 (с, 3 Н, Ас); 2,46 (м, 1 Н, Н-2В гексаноил, перекрывание с сигналом ДМСО); 2,60 (д. т, J=15,3, 7,5 Гц, 1 Н, Н-2А гексаноил); 3,55 (м, 2 Н, 2×Н-6 гексаноил); 4,12 (д. д, J=10,9, 2,8 Гц, 1 Н, Н-2 В); 4,32 (д. д, J=10,9, 1,3 Гц, 1 Н, Н-2А); 4,71 (к. д. д, J=6,8, 2,8, 1,5 Гц, 1 Н, Н-3); 6,82 (д. д, J=9,7, 9,7, 8,4 Гц, 1 Н, Н-6); 7,04 (с, 1 Н, NH-6 пурина); 7,56 (д. д. д, J=9,5, 5,4, 2,5 Гц, 1 Н, Н-5); 7,83 (с, 1 Н, Н-8 пурина); 9,05 (с, 1 Н, NH-Ac); 12,37 (уш. с, 1Н, NH-9 пурина). Спектр ЯМР 19F: δ=1,99 (д. д. д, J=21,0, 8,2, 2,4 Гц, 1 F, F-8); 20,09 (д. д. д, J=20,7, 10,3, 5,4 Гц, 1 F, F-7). Спектр ЯМР 13С: δ=14,61; 23,74; 23,97; 25,50; 28,54; 33,03; 39,5 (перекрывание с сигналом ДМСО); 44,43; 69,64; 106,20 (д, J=18,0 Гц); 115,34; 118,73 (м); 121,67; 135,57 (д, J=8,9 Гц); 137,18; 138,64 (д. д, J=244,2, 15,2 Гц); 146,26 (д. д, J=241,9, 9,7 Гц); 150,28; 152,30; 154,28; 168,84; 170,58. Найдено: С 56,06; Н 5,28; F 8,14; N 20,43. Вычислено для C22H25F2N7O3 (473,49): С 55,81; Н 5,32; F 8,02; N 20,71.
(3R)-4-[6-(2-Аминопурин-6-ил)аминогексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин (1а) (стадия 3)
Смесь ацетамида 5а (0,43 г, 0,90 ммоль) и 1 М NaOH (5,6 мл) перемешивают при комнатной температуре в течение 48 ч, затем нейтрализуют 1 М HCl до рН 5-6 и упаривают досуха. Остаток очищают с помощью флеш-хроматографии на силикагеле (элюент CHCl3-МеОН от 100: 0 до 90: 10). Выход 0,214 г (55%). Бесцветный порошок, т. пл. 110-114°С. [α]D 20=-42,6 (с 0,7, ДМФА). Ее 99,2%. ВЭЖХ (Kromasil Cellucoat, MeCN-H2O 25: 75): τ 23,8 мин. Спектр ЯМР 1Н: δ=1,12 (д, J=6,9 Гц, 3 Н, Me); 1,37-1,42 (м, 2 Н, 2×Н-4 гексаноил); 1,58-1,68 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,45-2,51 (м, 1 Н, Н-2 В гексаноил, перекрывается с сигналом ДМСО); 2,58-2,64 (м, 1 Н, Н-2А гексаноил); 3,48-3,52 (м, 2 Н, 2×Н-6 гексаноил); 4,13 (д. д, J=11,0, 2,8 Гц, 1 Н, Н-2 В); 4,32 (д. д, J=11,0, 1,4 Hz, 1 Н, Н-2А); 4,70-4,76 (м, 1 Н, Н-3); 5,25 (уш. с, 2 Н, NH2); 6,50 (уш. с, 1 Н, NH-6 гексаноил); 6,84 (д. д. д, J=9,8, 9,8, 8,3 Гц, 1 Н, Н-6); 7,54-7,58 (м, 2 Н, Н-5 и Н-8 пурина); 11,62 (уш. с, 1 Н, Н-9 пурина). Спектр ЯМР 19F: δ=1,98 (д. д. д, J=21,0, 8,2, 2,2 Гц, 1 F, F-8), 20,05-20,12 (м, 1 F, F-7). Спектр ЯМР 13С: δ=14,63; 23,99; 25,51; 28,73; 33,06; 39,5 (перекрывается с сигналом ДМСО); 44,45; 69,52; 106,22 (д, J=18,1 Гц); 112,30; 118,75 (д. д, J=7,8,4,2 Гц); 121,67; 134,79 (м); 135,57 (д. д, J=10,1,3,1 Гц); 138,64 (д. д,7=243,9, 15,4 Гц); 146,26 (д. д, J=242,1, 10,1 Гц); 152,08; 154,34; 159,49; 170,61. Масс-спектр высокого разрешения: вычислено для C20H24F2N7O2 [М+Н]+ 432,1954; найдено 432,1953.
Пример 2. Аналогично примеру 1 из соединения 3b получают соединение 1b через промежуточные соединения 4b и 5b.
(3S)-3,4-Дигидро-3-метил-4-(6-фталимидогексаноил)-7,8-дифтор-2H-[1,4]бензоксазин (4b)
Выход 68%. Бесцветное густое масло. [α]D 20=+67,7 (с 0,9, CHCl3). Ее >99%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH 5:1): τ 28,5 мин. Спектры ЯМР 1Н, 19F и 13С идентичны спектрам соединения 4а (Пример 1). Найдено: С 64,34; Н 5,44; F 8,52; N 6,43. Вычислено для C23H22F2N2O4 (М 428,43): С 64,48; Н 5,18; F 8,87; N 6,54.
(3S)-4-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин (5b)
Выход 62%. Бесцветный порошок, т.пл. 186-188°С. [α]D 20 =+42,8 (с 1,0, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-Н2O 80:20): τ 16,2 мин. Спектры ЯМР 1Н, 19F и 13С идентичны спектрам соединения 5а (Пример 1). Найдено: С 55,62; Н 5,37; F 7,86; N 20,67. Вычислено для C22H25F2N7O3 (473,49): С 55,81; Н 5,32; F 8,02; N 20,71.
(3S)-4-[6-(2-Аминопурин-6-ил)аминогексаноил]-3,4-дигидро-3-метил-7,8-дифтор-2H-[1,4]бензоксазин (1b)
Выход 75%. Бесцветный порошок, т. пл. 109-113°С. [α]D 20=+43,8 (с 0,3, ДМФА). Ее>99,5%. ВЭЖХ (Kromasil Cellucoat, MeCN-H2O 25:75): τ 26,9 мин. Спектры ЯМР идентичны спектрам соединения 1а (Пример 1). Масс-спектр высокого разрешения: вычислено для C20H24F2N7O2 [М+Н]+ 432,1954; найдено 432,1956.
Пример 3. Аналогично примеру 1 из соединения 3с получают соединение 1 с через промежуточные соединения 4с и 5с.
(2R)-2-Метил-1-(6-фталимидогексаноил)-1,2,3,4-тетрагвдрохинолин (4с)
Выход 90%. Бесцветное масло. [α]D 20=-192 (с 1,1, CHCl3). Ее 97%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH-МеОН 20: 0,6: 0,4): τ 30,6 мин. Спектр ЯМР 1Н: 8=0,99 (д, J=6,5 Гц, 3 Н, Me); 1,13-1,26 (м, 3 Н, 2×Н-4 гексаноил и Н-3В); 1,46-1,55 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,19-2,27 (м, 2 Н, Н-2 В гексаноил и Н-3 А); 2,35-2,50 (м, 2 Н, Н-2А гексаноил и Н-4 В); 2,58 (д. д. д, J=14,8, 5,0, 5,0 Гц, 1 Н, Н-4А); 3,51 (т, J=7,0 Гц, 2 Н, 2×Н-6 гексаноил); 4,62 (м, 1 Н, Н-2); 7,09-7,12 (м, 1 Н, Н-6); 7,17-7,20 (м, 2 Н, Н-5 и Н-7); 7,22-7,27 (м, 1 Н, Н-8); 7,82-7,87 (м, 4 Н, Phth). Спектр ЯМР 13С: δ=20,02; 24,66; 25,20; 25,73; 27,61; 32,01; 33,43; 37,18; 47,54; 122,88; 125,09; 125,82; 126,02; 127,30; 128,22; 131,51; 134,27; 134,72 (уш. с); 137,05; 167,81; 171,04. Найдено: С 73,82; Н 6,84; N 7,04. Вычислено для C24H26N2O3 (М 390,47): С 73,82; Н 6,71; N 7,17.
(2R)-1-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-2-метил-1,2,3,4-тетрагидрохинолин (5с)
Выход 71%. Бесцветный порошок, т. пл. 216-217°С. [α]D 20=-167 (с 1,0, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 80:20): τ 20,9 мин. Спектр ЯМР 1Н: δ=1,00 (д, J=6,5 Гц, 3 Н, Me); 1,26-1,33 (m, 3 Н, 2×Н-4 гексаноил и Н-3В); 1,49-1,62 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,22 (д. т, J=7,5, 5,7 Гц, 1 Н, Н-2В гексаноил / Н-3А); 2,27 (с, 3 H, Ас); 2,30 (д. т, J=15,1, 7,5 Гц, 1 Н, Н-2 В гексаноил / Н-3А); 2,39-2,46 (м, 2 Н, Н-2А гексаноил и Н-4 В); 2,58 (д. т, J=15,1, 5,5 Гц, 1 Н, Н-4А); 3,49 (м, 2 Н, 2×Н-6 гексаноил); 4,68 (т. д, J=6,7, 6,7 Hz, 1 Н, Н-2); 7,03 (уш. с, 1 Н, NH-6 гексаноил); 7,08 (м, 1 Н, Н-6); 7,15 (м, 2 Н, Н-5 и Н-7); 7,22 (м, 1 Н, Н-8); 7,84 (с, 1 Н, Н-8 пурина); 9,08 (с, 1Н, NH-Ac); 12,38 (уш. с, 1 Н, Н-9 пурина). Спектр ЯМР 13С: δ=19,35; 23,77; 24,39; 24,57; 25,53; 28,53; 31,36; 33,25; 39,5 (перекрывается с сигналом ДМСО); 46,97; 115,36; 124,49; 125,33; 125,40; 126,85; 133,99; 136,90; 137,23; 137,34; 152,29; 154,20; 168,86; 170,80. Найдено: С 63,30; Н 6,64; N 22,44. Вычислено для C23H29N7O2 (435,53): С 63,43; Н 6,71; N 22,51.
(2R)-1-[6-(2-Аминопурин-6-ил)аминогексаноил]-2-метил-1,2,3,4-тетрагидрохинолин (1 с)
Выход 69%. Бесцветный порошок, т.пл. 100-102°С. [α]D 20=-170 (с 0,7, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 75:25): τ 25,5 мин. Спектр ЯМР 1Н: δ=1,00 (д, J=6,5 Гц, 3 Н, Me); 1,25-1,34 (м, 3 Н, Н-3В, 2×Н-4 гексаноил); 1,48-1,60 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,22-2,33 (м, 2 Н, Н-2 В гексаноил и Н-3А); 2,40-2,47 (м, 2 Н, Н-2А гексаноил и Н-4 В); 2,60 (д. д. д, J=15,1, 5,5, 5,5 Гц, 1 Н, Н-4А); 3,42-3,47 (м, 2 Н, 2×Н-6 гексаноил); 4,69 (д. д. к, J=6,8, 6,7, 6,5 Гц, 1 Н, Н-2); 5,31 (уш. с, 2 Н, NH2); 6,45 (уш. с, 1 Н, NH-6 гексаноил); 7,09 (д. д. д, J=7,8, 7,3, 1,3 Hz, 1 Н, Н-6); 7,14-7,17 (м, 2 Н, Н-5 и Н-7); 7,22 (д. д, J=8,1, 1,3 Hz, 1 Н, Н-8); 7,57 (с, 1 Н, Н-8 пурина); 11,72 (уш. с, 1 Н, Н-9 пурина). Спектр ЯМР 13С: δ=19,15; 24,26; 24,39; 25,42; 28,55; 31,17; 33,16; 39,5 (перекрывается с сигналом ДМСО); 46,84; 111,98; 124,32; 125,20; 125,24; 126,73; 133,79; 135,02; 136,88; 151,89; 154,13; 159,07; 170,73. Масс-спектр высокого разрешения: вычислено для C21H28N7O [М+Н]+ 394,2350; найдено 394,2354.
Пример 4. Аналогично примеру 1 из соединения 3d получают соединение 1d через промежуточные соединения 4d и 5d.
(2S)-2-Метил-1-(6-фталимидогексаноил)-1,2,3,4-тетрагидрохинолин (4d)
Выход 80%. Бесцветное масло. [α]D 20=+201 (с 1,3, CHCl3). Ее>99%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH-МеОН 20:0,6:0,4): τ 28,2 мин. Спектры ЯМР 1Н и 13С идентичны спектрам соединения 4с (Пример 3). Найдено: С 73,73; Н 6,58; N 6,81. Вычислено для C24H26N2O3 (М 390,47): С 73,82; Н 6,71; N 7,17.
(2S)-1-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-2-метил-1,2,3,4-тетрагидрохинолин (5d)
Выход 85%. Бесцветный порошок, т.пл. 216-217°С. [α]D 20=+167 (с 1,0, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 80:20): τ 15,9 мин. Спектры ЯМР 1Н и 13С идентичны спектрам соединения 5с (Пример 3). Найдено: С 63,28; Н 6,85; N 22,48. Вычислено для C23H29N7O2 (435,53): С 63,43; Н 6,71; N 22,51.
(2S)-1-[6-(2-Аминопурин-6-ил)аминогексаноил]-2-метил-1,2,3,4-тетрагидрохинолин (1d)
Бесцветный порошок, т.пл. 101-103°С. [α]D 20=+165 (с 0,7, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 75:25): τ 19,0 мин. Спектры ЯМР идентичны спектрам соединения 1с (Пример 3). Масс-спектр высокого разрешения: вычислено для C21H28N7O [М+Н]+ 394,2350; найдено 394,2351.
Пример 5. Аналогично примеру 1 из соединения 3е получают соединение 1е через промежуточные соединения 4е и 5е.
(2R)-2-Метил-1-(6-фталимидогексаноил)-6-фтор-1,2,3,4-тетрагидрохинолин (4е)
Выход 89%. Бесцветное масло. [α]D 20=-172 (с 0,8, CHCl3). Ее 99%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH-МеОН 10:0,8:0,2): τ 21,8 мин. Спектр ЯМР lH: δ=0,98 (д, J=6,5 Гц, 3 Н, Me); 1,13-1,22 (м, 3 Н, 2×Н-4 гексаноил и Н-3В); 1,45-1,54 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,15-2,27 (м, 2 Н, Н-2 В гексаноил и Н-3А); 2,35-2,50 (м, 2 Н, Н-2а гексаноил и Н-4 В); 2,56-2,63 (м, 1 Н, Н-4А); 3,51 (т, J=7,0 Гц, 2 Н, 2×Н-6 гексаноил); 4,61 (м, 1 Н, Н-2); 7,00 (м, 1 Н, Н-7); 7,07 (м, 1 Н, Н-5); 7,30 (уш. с, 1 Н, Н-8); 7,85 (м, 4 Н, Phth). Спектр ЯМР 19F: δ=45,43 (уш. с, F-6). Спектр ЯМР 13С: δ=19,88; 24,56; 25,23; 25,72; 27,62; 31,52; 33,31; 37,17; 47,48; 95,34; 112,60 (д, J=22,2 Гц); 113,88 (д, J=22,4 Гц); 122,88; 127,56 (д, J=8,5 Гц); 131,51; 133,23; 134,26; 159,18 (д, J=243,0 Гц); 167,80; 170,99. Найдено: С 70,40; Н 6,13; F 4,28; N 6,61. Вычислено для C24H25FN2O3 (М 408,47): С 70,57; Н 6,17; F 4,65; N6,86.
(2R)-1-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-2-метил-6-фтор-1,2,3,4-тетрагидрохинолин (5е)
Выход 74%. Бесцветный порошок, т. пл. 200-202°С. [α]D 20=-137 (с 1,0, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 80:20): τ 20,4 мин. Спектр ЯМР 1H: δ=0,99 (д, J=6,5 Гц, 3 Н, Me); 1,27-1,34 (м, 3 Н, 2×Н-4 гексаноил и Н-3В); 1,51-1,60 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,26 (с, 3 Н, Ас); 2,19-2,31 (м, 2 Н, Н-2 В гексаноил и Н-3А); 2,39-2,49 (м, 2 Н, Н-2А гексаноил и Н-4 В); 2,61 (д. д. д, J=15,3, 5,6, 5,6 Гц, 1 Н, Н-4А); 3,50 (м, 2 Н, 2×Н-6 гексаноил); 4,67 (д. т, J=6,6, 6,6 Гц, 1 Н, Н-2); 6,92-7,05 (м, 3 Н, NH-6 гексаноил, Н-5 и Н-8); 7,26 (д. д, J=8,7, 5,2 Гц, 1 Н, Н-7); 7,82 (с, 1 Н, Н-8 пурина); 9,05 (с, 1 Н, NH-Ac); 12,32 (уш. с, 1 Н, Н-9 пурина). Спектр ЯМР 19F: δ=45,06 (д. д. д, J=8,2, 5,9, 5,9, F-6). Спектр ЯМР 13С: δ=19,19; 23,75; 24,30; 24,59; 25,52; 28,52; 30,88; 33,12; 39,5 (перекрывается с сигналом ДМСО); 46,95; 111,89; 111,98 (д, J=22,6 Гц); 113,35 (д, J=22,4 Гц); 127,01 (д, J=8,4 Гц); 133,05; 136,29 (д, J=7,2 Гц); 137,13; 137,37; 152,28; 154,09; 158,84 (д, J=242,4 Гц); 168,83; 170,75. Найдено С 60,93; Н 6,32; F 3,97; N 21,79. Вычислено для C23H28FN7O2 (453,52): С 60,91; Н 6,22; F 4,19; N 21,62.
(2R)-1-[6-(2-Аминопурин-6-ил)аминогексаноил]-2-метил-6-фтор-1,2,3,4-тетрагидрохинолин (1е)
Выход 98%. Бесцветный порошок, т.пл. 95-100°С. [α]D 20=-132 (с 0,8, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 75:25): τ 27,2 мин. Спектр ЯМР 1Н: δ=1,00 (д, J=6,5 Гц, 3 Н, Me); 1,27-1,36 (м, 3 Н, Н-3В и 2×Н-4 гексаноил); 1,51-1,60 (м, 4 Н, 2×Н-3 и 2×Н-5 гексаноил); 2,20-2,32 (м, 2 Н, Н-2В гексаноил и Н-3А); 2,40-2,47 (м, 2 Н, Н-2 А гексаноил и Н-4 В); 2,62 (д. д. д, J=15,4, 5,6, 5,6 Гц, 1 Н, Н-4А); 3,47 (м, 2 Н, 2×Н-6 гексаноил); 4,68 (д. д. к, J=6,7, 6,6, 6,5 Гц, 1 Н, Н-2); 5,44 (уш. с, 2 Н, NH2); 6,69 (уш. с, 1 Н, NH-6 гексаноил); 6,92-7,00 (м, 2 Н, Н-5 и Н-7); 7,28 (д. д, J=8,7, 5,2 Гц, 1 Н, Н-8); 7,61 (с, 1 Н, Н-8 пурина); 11,3-12,0 (уш. с, 1 Н, Н-9 пурина). Спектр ЯМР 19F: δ=45,02-45,08 (м, F-6). Спектр ЯМР 13С: δ=19,21; 24,33; 24,62; 25,54; 28,65; 30,90; 33,15; 39,5 (перекрывается с сигналом ДМСО); 46,98; 111,77; 112,01 (д, J=22,6 Гц); 113,37 (д, J=22,6 Гц); 127,04 (д, J=8,8 Гц); 133,08 (д, J=2,5 Гц); 135,33; 136,31 (д, J=7,5 Гц); 151,77; 154,12; 158,86 (д, J=242,7 Гц); 159,04; 170,81. Масс-спектр высокого разрешения: вычислено для C21H27FN7O [М+Н]+ 412,2256; найдено 412,2261.
Пример 6. Аналогично примеру 1 из соединения 3f получают соединение 1f через промежуточные соединения 4f и 5f.
(2S)-2-Метил-1-(6-фталимидогексаноил)-6-фтор-1,2,3,4-тетрагидрохинолин (4f)
Выход 77%. Бесцветное масло. [α]D 20=+171 (с 1,0, CHCl3). Ее>99%. ВЭЖХ (Chiralcel OD-H, н-гексан-iPrOH-МеОН 10: 0,8: 0,2): τ 19,6 мин. Спектры ЯМР 1Н, 19F и 13С идентичны спектрам соединения 4е (Пример 5). Найдено: С 70,45; Н 6,25; F 4,55; N 6,84. Вычислено для C24H25FN2O3 (М 408,47): С 70,57; Н 6,17; F 4,65; N 6,86.
(2S)-1-[6-(2-Ацетамидопурин-6-ил)аминогексаноил]-2-метил-6-фтор-1,2,3,4-тетрагидрохинолин (5f)
Выход 86%. Бесцветный порошок, т.пл. 198-201°С. [α]D 20=+137 (с 1,0, ДМФА). Ее>99%. ВЭЖХ ((S,S)-WHELK-01, МеОН-H2O 80: 20): τ 16,0 мин. Спектры ЯМР 1Н, 19F и 13С идентичны спектрам соединения 5е (Пример 5). Масс-спектр высокого разрешения: вычислено для C23H28FN7O2 [М+Н]+ 454,2361; найдено 454,2363.
(2S)-1-[6-(2-Аминопурин-6-ил)аминогексаноил]-2-метил-6-фтор-1,2,3,4-тетрагидрохинолин (1f)
Выход 70%. Бесцветный порошок, т.пл. 94-98°С. [α]D 20=+140 (с 0,7, ДМФА). Ее>99%. ВЭЖХ ((S,S-WHELK-01, МеОН-H2O 75:25): τ 21,7 мин. Спектры ЯМР идентичны спектрам соединения 1е (Пример 5). Масс-спектр высокого разрешения: вычислено для C21H27FN7O [М+Н]+ 412,2256; найдено 412,2258.
Биологическая активность
Новые соединения исследованы в лаборатории Института общей генетики им. Н.И. Вавилова РАН (ИОГен РАН), г. Москва.
Изучение противоопухолевой активности в опытах in vitro соединений проводились с использованием МТТ-теста на модели линии клеток НТ-29 (карцинома толстой кишки). МТТ-тест основан на способности дегидрогеназ живых клеток восстанавливать неокрашенные формы 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразола (МТТ-реагента) до голубого кристаллического формазана, растворимого в диметилсульфоксиде, с последующей спектрофотометрией. Восстановление клетками нитросинего тетразолия показывает метаболическую активность дегидрогеназ и является адекватным показателем жизнеспособности клеток в культуре, что позволяет оценить специфическую гибель клеток, вызванную тем или иным цитотоксическим агентом.
Все соединения растворяли в ДМСО до концентрации 500 мг/мл. Каждое соединение исследовали в концентрациях от 0,005 до 5 мг/мл в 3 повторностях. Культуру инкубировали при 37°С и 5% СО2 в течение 72 часов, после чего среду удаляли, в лунки вносили 200 мкл ростовой среды без сыворотки, добавляли 20 мкл готового раствора МТТ (исходная концентрация 5 мг/мл в фосфатном буфере). О жизнеспособности клеток судили по цветной реакции, развивающейся при восстановлении тетразолия в формазан дегидрогеназами митохондрий. Окраску регистрировали на ридере DTX 880 (Multimode Detector) при длине волны возбуждения 595 нм. Оптическую плотность в лунках, где клетки инкубировались только со средой (контроль), принимали за 100%. Индекс цитотоксичности (IC) рассчитывали по формуле:
IC=(K-О)+100%/K,
где К - контроль; О - опыт.
Полученные данные представлены в таблице 1.
В результате экспериментов определены ингибирующие концентрации (IC-50, мкг/мл) конъюгатов 2-аминопурина с энантиомерно чистыми гетероциклическими аминами 1a,c-f (табл. 1). Установлено, что изученные соединения проявили высокую цитотоксическую активность на модели линии клеток НТ-29, для наиболее активного соединения IC-50 менее 1 мкг/мл и отсутствие токсичности в отношении фибробластов эмбриона человека (ФЭЧ) IC-50 более 50 мкг/мл. Как видно из данных, представленных в табл. 1, противоопухолевая активность существенным образом зависит от стереоконфигурации фрагмента гетероциклического амина.
Производные 2-аминопурина общей формулы 1, включающие остатки энантиомерно чистых хиральных гетероциклических аминов и остаток 6-аминокапроновой кислоты в качестве линкера, отличаются высокой противоопухолевой активностью и низкой токсичностью. При этом биологическая активность зависит как от структуры фрагмента гетероциклического амина, так и от стереоконфигурации. Предложен удобный способ получения соединений общей формулы 1 в оптически чистом виде, предусматривающий использование легкодоступных реагентов, отличающийся простотой проведения синтетических операций и высоким выходом на каждой стадии.
1. Амиды N-(2-аминопурин-6-ил)-6-аминокапроновой кислоты общей формулы 1 (1) где (1a) R=Me, R'=H, X=O, Y=Z=F; (1b) R=H, R'=Me, X=O, Y=Z=F; (1c) R=Me, R'=H, X=CH2, Y=Z=H; (1d) R=H, R'=Me, X=CH2, Y=Z=H; (1e) R=Me, R'=H, X=CH2, Y=Z=F; (1f) R=H, R'=Me, X=CH2, Y=Z=F.
2. Соединения формулы 1 по п. 1, обладающие противоопухолевой активностью.
3. Способ получения амидов N-(2-аминопурин-6-ил)-6-аминокапроновой кислоты по п. 1 путем ацилирования соответствующих энантиомерно чистых хиральных гетероциклических аминов общей формулы где X, Y, Z, R и R′ имеют вышеуказанные значения, хлорангидридом 6-фталимидокапроновой кислоты, удаления фталоильной защитной группы под действием гидразин гидрата, нуклеофильного замещения полученными соединениями атома хлора в 2-ацетамидо-6-хлорпурине и последующего щелочного гидролиза ацетильной группы в полученном продукте.