Противовирусное средство и способ его получения
Иллюстрации
Показать всеИзобретение относится к средству, обладающему противогриппозной активностью, которое представляет собой соединения общей формулы (I) в виде смеси R- и S-диастереомеров или отдельных изомеров или их фармацевтически приемлемые соли. Изобретение относится также к применению соединений общей формулы (I) в качестве средства, обладающего противогриппозной активностью. 2 н. и 1 з.п. ф-лы, 2 табл., 8 пр.
Реферат
Изобретение относится к области органической химии, конкретно к производным циклопент-2-енонов, проявляющим противогриппозную активность. Изобретение также относится к способу получения производных циклопент-2-енонов и к применению соединений настоящего изобретения в качестве противовирусного средства.
Вирусные заболевания, в особенности грипп, представляют серьезную угрозу для человечества из-за возможностей пандемий и летальных исходов. Всемирной Организацией Здравоохранения (ВОЗ) в качестве основного средства борьбы против гриппа в настоящее время рекомендована вакцинация. Однако в связи с высокой и непредсказуемой изменчивостью поверхностных белков вируса гриппа состав вакцины постоянно меняется в зависимости от изменения антигенной структуры циркулирующих вирусов. Для создания, проверки на безопасность и эффективность, производства, а также распространения в достаточном количестве среди населения необходимой вакцины к такому, вновь возникшему, штамму вируса гриппа требуется около 6 месяцев. Кроме того, вакцинация не всегда эффективна у людей пожилого возраста и у пациентов, страдающих хроническими заболеваниями, нарушениями функций иммунной системы и аллергией к компонентам вакцины. Поэтому в дополнении к вакцинации ВОЗ рекомендовано применение противогриппозных этиотропных химиопрепаратов, оказывающих непосредственное воздействие на репродукцию вируса и направленных на определенную вирусспецифическую мишень в ее цикле ([1] Hayden F. WHO Guidelines on the Use of Vaccines and Antivirals during Influenza. - Annex 5-Considerations for the Use of Antivirals during an Influenza pandemic, Geneva, 2-4 October, 2002).
Особую опасность для здоровья людей представляют распространенные в последнее время штаммы вируса гриппа H1N1 (свиной грипп) и H1N5 (птичий грипп). В медицинской практике применяются 2 класса лекарств для лечения гриппа: адамантаны (N2-блокаторы) и ингибиторы нейраминидазы. В настоящее время среди противогриппозных препаратов безусловными лидерами являются применяемые на практике ингибиторы нейраминидазы озельтамивир и занамивир, известные под торговыми названиями Tamiflu и Zanamavir, а также производное циклопентанкарбоновой кислоты Перамивир (Rapiacta).
Тамифлю (озельтамивир), имеющий функционализированный циклогексеновый каркас, очень активен в отношении вирусов гриппа А и В, эффективен при пероральном приеме. Циклопентановое производное Перамивир также является мощным и селективным ингибитором нейраминидазы. Новый ингибитор нейраминидазы пирролидинового ряда А-315675 - высокоактивный и пригодный для перорального применения в виде пролекарства эфира или кислоты. На фармацевтическом рынке России широко представлен отечественный препарат Арбидол, который эффективно подавляет вирусы гриппа А и В. По механизму действия Арбидол относится к ингибиторам фузии - угнетает слияние липидной оболочки вируса и клеточных мембран, предотвращая проникновение вируса внутрь клетки.
Однако практически все известные препараты имеют недостатки и ограничения. Так, применение препаратов адамантанового ряда (амантадин и ремантадин) ограничено отсутствием эффективности у них в отношении вируса гриппа В, наличием серьезных побочных эффектов и возникновением резистентности к ним ([1, 2] Hayden F. WHO Guidelines on the Use of Vaccines and Antivirals during Influenza. - Annex 5-Considerations for the Use of Antivirals during an Influenza pandemic, Geneva, 2-4 October, 2002; Monto A. Viral susceptibility and the choice of influenza antivirals // Clinical Infectious Diseases. - 2008. - Vol. 47. - P. 346-348). Применение занамивира часто сопряжено с возникновением побочных эффектов в виде раздражения носоглотки, что ограничивает его использование у людей, страдающих астмой и ХОБЛ, которые относятся к группе риска по заболеваемости гриппом. При этом необходимость распылительного устройства осложняет применение этого препарата у пожилых людей и детей. При применении озельтамивира отмечены побочные эффекты, проявляющиеся в виде тошноты и рвоты [1] (Hayden F. WHO Guidelines on the Use of Vaccines and Antivirals during Influenza. - Annex 5-Considerations for the Use of Antivirals during an Influenza pandemic, Geneva, 2-4 October, 2002). Кроме того, в последние годы чрезвычайно возросло количество штаммов, резистентных к озельтамивиру. По данным Центра контроля заболеваний (Атланта, США) в эпидемический сезон 2008-2009 г. практически все циркулирующие в этот период штаммы вируса гриппа A H3N2 были резистентны к амантадину/ремантадину, а 98-100% штаммов H1N1 были резистентны к ингибитору нейраминидазы - озельтамивиру ([2] Monto A. Viral susceptibility and the choice of influenza antivirals // Clinical Infectious Diseases. - 2008. - Vol. 47. - P. 346-348). Помимо этих факторов большое значение имеет то, что противогриппозные препараты второго поколения (занамивир, озельтамивир), из-за патентной защиты не производятся в России, что обусловливает их высокую стоимость и полную зависимость от иностранных производителей в случае возникновения эпидемических и пандемических ситуаций. В связи с вышеперечисленным, создание и внедрение в практику российского здравоохранения эффективных и безопасных противовирусных препаратов, обладающих оригинальной химической структурой и отличным от существующих аналогов механизмом действия, является приоритетной задачей отечественной медицинской науки.
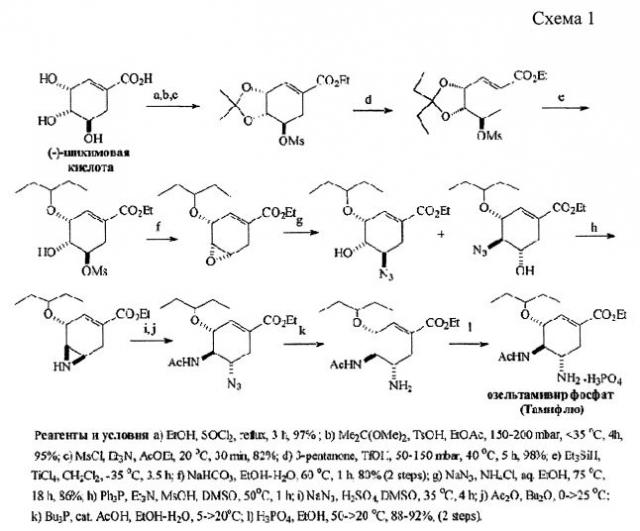
К существенным недостаткам известных препаратов можно отнести сложности, связанные с технологией их производства. Указанные на фиг. 1 соединения - действующие вещества соответствующих лекарств - производятся путем многостадийного синтеза. Так, ниже приведена схема крупномасштабного синтеза Тамифлю в компании Roche из шикимовой кислоты (схема 1) ([3, 4] Rohloff J.C., Kent K.М., Postich М. J., et. al. // J. Org. Chem., 1998, v. 63, p. 4545; Federspiel M., Fischer R., e.a. // Org. Process Res. Dev., 1999, v. 3., p. 266).
Как видно из данной схемы, в производстве препарата используются дорогостоящие, токсичные и взрывоопасные реагенты, существуют критические условия (высокие давления, низкие температуры) и главное, многостадийный синтез осуществляется из достаточно дорогой хиральной шикимовой кислоты, выделяемой из природных источников.
Из-за периодически возникающих реальных угроз вспышек гриппа и соответственно повышения спроса на препараты, в последнее время предложены десятки оригинальных подходов к синтезу Тамифлю из хиральных и ахиральных исходных с целью увеличения выхода целевого продукта (см. обзоры: Shibasaki М., Kanai М. // Eur. J. Org. Chem., 2008, p. 1839). Тем не менее все эти подходы не лишены упомянутых выше для схемы Roche недостатков.
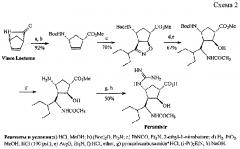
Синтез производного циклопентана - Перамивира (прототипа), аналогичного по строению с обсуждаемыми соединениями, приведен на схеме 2. В качестве исходного материала выбран коммерчески доступный (-)-лактам Vince. К недостаткам подхода можно отнести: многостадийность (8 стадий) и высокую стоимость исходного (-)-лактама Vince (1 г = 145.0 евро, 5 г = 598.0 евро, каталог Aldrich, 2012-2014, стр. 208).
Целью изобретения является получение оригинальных строений циклопентановых производных, обладающих противогриппозным действием. Технический результат заключается в расширении арсенала лекарственных средств, а также в сокращении времени синтеза заявляемых циклопентановых производных, повышении выхода целевого продукта и упрощении технологии его получения.
Согласно настоящему изобретению предлагаются новые производные циклопент-2-енонов, представляющие собой соединения общей формулы (I):
или их фармацевтически приемлемые соли.
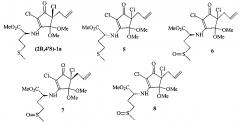
В предпочтительном варианте осуществления, настоящее изобретение относится к соединениям общей формулы (I), в виде смеси R- и S-диастереомеров или отдельных изомеров, выбранных из:
метил 2(S)-[4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ениламино]-4-(метилтио)бутаноат (соединение 1);
Метил 2(S)-[(4(S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоцикло-пент-1-енил)амино]-4-(метилтио)бутаноат (соединение (2S,4′S)-1a)
Метил 2(R)-[(4-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-енил)амино]-4-(метилтио)бутаноат (соединение 5);
Метил 2(S)-[(4-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (соединение 6);
Метил 2(S)-[(4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоцикло-пент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (соединение 7);
Метил 2(R)-[(4-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (соединение 8).
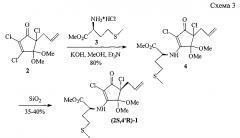
Изобретение также относится к способу получения заявленных соединений формулы (I). Способ основан на известной реакции SNE-замещения винильного атома хлора в 2,3,5-трихлорциклопент-2-енонах (Ахметвалеев P.P., Акбутина Ф.А., Иванова Н.А., Мифтахов М.С. // Изв. АН. Сер. хим. - 2001. - №9. - С. 1417-1435), и отличается тем, что 5-аллил-2,3,5-трихлорциклопент-2-енон-1-он 2 реагирует с гидрохлоридом метилового эфира L-метионина 3 в среде МеОН, содержащим КОН и NEt3 в молярном соотношении 1:1,7:1,7:1,7. Из образующейся при этом диастереомерной смеси 4 целевое соединение 1 выделяли хроматографированием на колонке с силикагелем с последующей перекристаллизацией. Указанная конфигурация хиральных центров 1 подтверждена данными рентгеноструктурного анализа.
Как видно из схемы 3, по сравнению с Тамифлю и Перамивиром способ получения хирального соединения 1 исключительно прост, значительно сокращает требуемое для синтеза время и, как далее показано в примере 1, значительно увеличивает выход целевого продукта. Схема включает легкодоступный из гексахлорциклопентадиена в 2 стадии (±)-блок 2 и источник хиральности - доступный, дешевый L-метионин (5 г=12,50 евро, 1 кг=350 евро, каталог Aldrich, 2012-2014, стр. 1687).
Сущность изобретения подтверждается следующими примерами:
Пример 1. 2(S)-[4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ениламино]-4-(метилтио)бутаноат формулы (1), которое проявляет противогриппозную активность:
К перемешиваемому раствору 0.3 г (1.43 ммоль) трихлоркетона 2 в 10 мл абсолютного МеОН добавляли 0.34 г (1.72 ммоль) гидрохлорида метилового эфира L-метионина 3, 0.96 г (1.72 ммоль) КОН и 1.0 мл Et3N. Реакционную массу перемешивали до израсходования исходного соединения (~24 ч, контроль методом ТСХ), разбавляли 5 мл воды, МеОН упарили, водный слой подкисляли 1н. HCl до pH 4 и экстрагировали хлороформом (4×10 мл). Объединенные экстракты промывали насыщенным раствором NaCl, сушили MgSO4, упарили. Остаток очищали двукратным хроматографированием на колонке с SiO2 (EtOAc - петролейный эфир, 1:10), получили 0.36 г (80%) смеси диастеромеров 4. Из этой смеси кристаллизацией из системы EtOAc - петролейный эфир (1:10) выделили 0.16 г (35%) диастереомерно чистого соединения 1. Т.пл. 77-79°С. (с 0.44, CHCl3). ИК спектр, ν, и см-1: 3287, 2951, 2920, 2853, 1749, 1715, 1593, 1539, 1456, 1377, 1364, 1283, 1252, 1220, 1180, 1171, 1093, 1065, 997, 957, 926, 733, 611. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.12 с (3Н, SCH3), 2.21 м (2Н, СН2), 2.56 т (2Н, SCH2, J 7.3 Гц), 2.75 д (2Н, С2″Н2, J 7.6 Гц), 3.42 с (3Н, ОСН3), 3.56 с (3Н, ОСН3), 3.84 с (3Н, CO2CH3), 5.16 м (2Н,=СН2), 5.18 м (1Н, NCH), 5.79 м (1H,=СН), 6.23 м (1Н, NH). Спектр ЯМР 13С (CDCl3) δ, м.д.: 15.43 (СН3), 29.28 и 32.45 (СН2), 42.72 (С2″Н2), 51.92 и 52.41 (ОСН3), 53.15 (CO2CH3), 54.63 (NCH), 75.04 (С4′), 99.28 (С2′), 101.75 (С5′), 119.15 (=СН), 131.94 (=СН2), 158.33 (С1′), 171.50 (CO2Me), 187.68 (С=О). Масс-спектр, m/z (I, %): 411 [M]+(12), 376 [М-Cl]+ (100), 344 [М-Cl-МеОН]+ (28), 320 (19), 258 (12), 222 (13), 147 (17), 75 (8), 61 (38) [H2C=SMe]+. Найдено, %: M+411.0662. C16H23Cl2NO5S. Вычислено, %: M+ 411.0669.
Аналогичным образом получают остальные заявленные соединения. Ниже приведены примеры получения конкретных соединений.
Пример 2. Метил 2(S)-[(4(S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоцикло-пент-1-енил)амино]-4-(метилтио)бутаноат ((2S,4′S)-1a) получен в смеси с 2S,4′R-изомером. Спектр ЯМР 1H (CDCl3) δ, м.д.: 2.12 с (3Н, SCH3), 2.21 м (2Н, СН2), 2.56 т (2Н, SCH2, J 7.5 Гц), 2.75 м (2Н, СН2), 3.42 с (3Н, ОСН3), 3.52 с (3Н, ОСН3), 3.84 с (3Н, CO2CH3), 5.16 м (2Н, =СН2), 5.18 м (1H, NCH), 5.79 м (1Н, =СН), 6.23 м (1Н, NH). Спектр ЯМР 13С (CDCl3) δ, м.д.: 15.48 (СН3), 30.54 и 32.70 (СН2), 40.78 (С2″Н2), 52.13 (ОСН3), 53.08 (CO2CH3), 54.87 (NCH), 74.19 (С4′), 100.0 (С2′), 102.25 (С5′), 119.15 (=СН), 131.94 (=СН2), 158.33 (С1′), 171.50 (CO2Me), 187.68 (С=O).
Пример 3. Метил 2(R)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-енил)амино]-4-(метилтио)бутаноат (5). Получен аналогично 4 из 0.5 г (1,75 ммоль) 5-аллил-2,3,5-трихлорциклопент-2-енон-1-она 2 и 0.42 г (2.10 ммоль) гидрохлорида метилового эфира D-метионина, в виде смеси диастереомеров в соотношении 3:1 (ЯМР 1Н), выход 0.57 г (79%). ИК спектр, ν, см-1: 3287, 2951, 2920, 2853, 1749, 1715, 1593, 1539, 1456, 1377, 1364, 1283, 1252, 1220, 1180, 1171, 1093, 1065, 997, 957, 926, 733, 611. Основной диастереомер. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.09 с (3Н, SCH3), 2.18 м (2Н, СН2), 2.53 т (2Н, SCH2, J 7.3 Гц), 2.71 м (2Н, С2″Н2), 3.39 с (3Н, ОСН3), 3.53 с (3Н, ОСН3), 3.80 с (3Н, CO2CH3), 5.07 м (2Н, =СН2), 5.15 м (1Н, =СН), 5.75 м (1Н, NCH), 6.25 м (1H, NH). Спектр ЯМР 13С (CDCl3) δ, м.д.: 16.82 (СН3), 29.21 и 31.31 (СН2), 42.39 (С2″Н2), 53.29 и 53.77 (ОСН3), 54.50 (CO2CH3), 55.96 (NCH), 74.98 (С4′), 98.27 (С2′), 101.22 (С5′), 118.36 (=СН), 131.54 (=СН2), 159.16 (С1′), 170.97 (CO2Me), 187.21 (С=O). Масс-спектр, m/z (I, %): 411 [M]+ (12), 376 [М-Cl]+ (100), 344 [М-Cl-МеОН]+ (28), 320 (19), 258 (12), 222 (13), 147 (17), 75 (8), 61 (38) [H2C=SMe]+. Минорный диастереомер. Спектр ЯМР 1Н (CDCl3) δ, м.д.: 2.09 с (3Н, SCH3), 2.18 м (2Н, СН2), 2.53 т (2Н, SCH2, J 73 Гц), 2.71 м (2Н, С2″Н2), 3.49 с (3Н, ОСН3), 3.53 с (3Н, ОСН3), 3.79 с (3Н, CO2CH3), 5.07 м (2Н, =СН2), 5.15 м (1H, =СН), 5.75 м (1Н, NCH), 6.25 м (1Н, NH). Спектр ЯМР 13С (CDCl3) δ, м.д.: 16.87 (СН3), 29.00 и 31.48 (СН2), 40.50 (С2″Н2), 53.29 и 53.51 (ОСН3), 54.50 (CO2CH3), 56.22 (NCH), 74.02 (С4′), 98-49 (С2′), 101.65 (С5′), 118.06 (=СН), 132.14 (=СН2), 158.74 (С1′), 170.97 (CO2Me), 187.57 (С=O). Масс-спектр, m/z (I, %): 411 [М]+ (12), 376 [М-Cl]+ (100), 344 [М-Cl-МеОН]+ (28), 320 (19), 258 (12), 222 (13), 147 (17).
Пример 4. Метил 2(S)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (6). К смеси 0.5 г (1.22 ммоль) соединения 4 [2] в 10 мл безводного хлористого метилена при -78°С при перемешивании по каплям добавляли 0.23 г (1.34 ммоль) м-хлорнадбензойной кислоты в 3 мл безводного CH2Cl2. Реакционную смесь перемешивали 30 мин при -78°С, затем температуру подняли до -10°С и перемешивали еще 20 мин, массу фильтровали, фильтрат упарили. Остаток очищали с помощью колоночной хроматографии на SiO2 (этилацетат-петролейный эфир, 1:10, 1:5, 1:1) и получили 0.42 г (81%) маслообразного соединения 5 в виде смеси диастереомеров в соотношении ~1:1 (ЯМР 1Н). ИК спектр, ν, см-1: 2998, 2983, 2953, 1747, 1711, 1669, 1607, 1534, 1437, 1273, 1216, 1183, 1167, 1092, 1072, 1037, 932, 732, 699. Спектр ЯМР 1H (CDCl3) δ, м.д.: 2.47 м (2Н, СН2), 2.58 с (3Н, SCH3), 2.77 т (2Н, SCH2, J 7.3 Гц), 2.86 д (2Н, С2″Н2, J 7.6 Гц), 3.39 с (3Н, ОСН3), 3.49 (3.50) с (3Н, ОСН3), (3Н, ОСН3), 3.80 с (3Н, CO2CH3), 5.11 м (2Н, =СН2), 5.87 м (1Н, =СН), 6.88 м (1Н, NCH). Спектр ЯМР 13С (CDCl3) δ, м.д.: 25.93 (26.02) (СН2), 38.35 (38.42) (СН3), 40.50 (40.14) (С2″Н2), 52.06 (52.14) (ОСН3), 54.50 (54.30) (CO2CH3), 53.18 (NCH), 74.21 (73.97) (С4′), 100.19 (С2′), 102.48 (102.40) (С5′), 118.75 (118.94) (=СН), 132.54 (131.92) (=СН2), 159.26 (С1'), 170.79 (CO2Me), 188.02 (С=O). Масс-спектр, m/z (I, %): 427 [М]+ (0.2), 396 [М-ОСН3]+ (5), 392 [М-Cl]+ (4), 376 (18), 340 (28), 296 (100), 272 (34), 264 (44), 236 (42), 194 (20), 147 (16), 61 (46).
Пример 5. Метил 2(S)-[(4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоцикло-пент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (7) получен аналогично 6 из соединения 1.
Пример 6. Метил 2(R)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноат (8) получен аналогично 6 из соединения 5.
Пример 7. Изучение цитотоксического действия соединений в культуре клеток MDCK, полученных из почек собаки.
В опытах использовали однослойные перевиваемые культуры клеток почки эмбрионов собаки MDCK, выращенные на минимальной среде Игла с добавлением 10% фетальной сыворотки телят и антибиотиков. В предварительной серии экспериментов в культуре клеток MDCK было изучено цитотоксическое действие представленных соединений (1-6). В качестве сравнения использовалась ранее изученная субстанция арбидола (серия 2188), предоставленная ОАО Фармстандарт Лексредства (г. Курск), а также озельтамивир карбоксилат. В опытах использовали однослойные перевиваемые культуры клеток почки эмбрионов собаки MDCK, выращенные на минимальной среде Игла с добавлением 10% фетальной сыворотки телят и антибиотиков.
Приготовление изучаемых соединений и препаратов сравнения для экспериментов осуществляли следующим образом. В культуре клеток к 5 мг субстанций добавляли 0,5 мл спирта и оставляли при 37°С на 30 минут до полного растворения. Далее к образцам добавляли 4,5 мл дистиллированной воды, и из полученного раствора концентрацией 1 мг/мл готовили для исследований необходимые концентрации препаратов на используемой культуральной среде. Озельтамивр карбоксилат разводили в стерильной дистиллированной воде до концентрации 1 мкг/мл, полученный раствор далее хранили при температуре 4°C, используя в нескольких опытах. Перед опытом из этого разведения готовили растворы необходимых концентраций на используемой культуральной среде, которые далее хранили при температуре 4°C, используя в дальнейших опытах. Вещества взвешивали с точностью до 0,1 мг на аналитических весах.
Определение цитотоксического действия препаратов в культуре клеток проводили, как описано (Assay Guidance Manual. http://www/ncgc.nih.gov/guidance/section2.html.). Клетки MDCK выращивали в 96-луночных планшетах фирмы "Costar" в среде Игла в присутствии 5% сыворотки телят и 10 мМ глутамина до полного монослоя. Затем среду удаляли и в планшеты вносили по 200 мкл предоставленных образцов в испытуемой концентрации в минимальной среде Игла без сыворотки. После инкубации клеток с препаратами в течение 24 часов при 37°C в атмосфере 5% CO2 визуально оценивали состояние клеточного монослоя, далее клетки отмывали 1-2 раза средой без сыворотки и к клеткам добавляли по 50 мкл раствора ПБС (фосфатно-солевой буфер) без красителя, содержащего 50 мкг на лунку ХТТ (2,3-бис(2-метокси-4-нитро-5-сульфофенил)-2Н-тетразолий -5-карбоксианимид) 5 мкл 5 мМ раствора PMS (фенозин метасульфат). После инкубации в течение 4 часов при 37°C результаты просчитывали на автоматическом колориметре при длине волны 450 нм. Концентрация соединений, уменьшающая значение ОП450 (оптическая плотность при длине волны 450) на 50% по сравнению с контролем клеток, принималась за 50% цитотоксическую дозу (ЦД50). Максимальная концентрация соединений, не изменяющая значение ОП450 по сравнению с контролем клеток, принималась за максимально переносимую концентрацию (МПК).
Визуальная оценка состояния клеточной культуры под инвертированным микроскопом после 48 часов инкубации с изученными концентрациями соединений 1-6 (до 160 мкг/мл) и озельтамивира карбоксилата (до 500 мкг/мл) не выявила каких-либо цитотоксических изменений в клетках (табл. 1). В то же время значения ЦД50 и МПК для изученной субстанции арбидола составляли 35 мкг/мл и 40 мкг/мл, соответственно. Количественное определение жизнеспособности клеток с использованием колориметрической пробы восстановления тетразолиевой соли (ХТТ метод) подтвердило визуальную оценку цитотоксичности соединений (табл. 1). Как видно из табл. 1, значения ЦД50 и МПК для соединений 1-6 и озельтамивира карбоксилата превышали 100-160 мкг/мл и 500 мкг/мл соответственно, в то время как для арбидола эти величины составляли 35 мкг/мл и 40 мкг/мл соответственно. Эти величины по арбидолу совпадали со значениями, ранее полученными для различных субстанций этого средства.
Таким образом, изучение цитотоксичности соединений 1-6 как при визуальном наблюдении, так и с использованием количественного метода ХТТ в культуре клеток MDCK, показало, что эти вещества не оказывают никаких токсических эффектов в концентрациях, не превышающих 160 мкг/мл.
Пример 8. Изучение действия соединений на репродукцию вируса гриппа в культуре клеток.
В опытах in vitro использовали аллантоисный пул эталонного вируса гриппа человека А/Калифорния /7/09 (H1N1).
Определение противовирусной активности проводили, как описано (Методические указания по изучению ИЛП: Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ // - Медицина, 2012. - том 1, стр. 410-1420). Для определения противовирусной активности соединений клетки MDCK рассаживали в 96-луночных планшетах фирмы "Costar" со средней плотностью 30000-35000 клеток на лунку и выращивали в минимальной среде Игла в присутствии 5% фетальной сыворотки телят и 10 мМ глутамина до полного монослоя. Перед заражением вирусом клетки 2 раза промывали средой без сыворотки. Исследуемые препараты добавляли к клеткам в 2-х кратной концентрации в 100 мкл минимальной среды Игла. К вирусному контролю добавляли по 100 мкл этой же среды, а к клеточному контролю по 200 мкл. В опытах использовали штамм вируса гриппа человека, поэтому изучаемые образцы и разведения вируса готовились на среде с добавлением 2,5 мкг/мл ТРСК трипсина. После инкубации клеток с исследуемыми препаратами в течение 2 часов при 37°C в лунки, исключая клеточный контроль, добавляли по 100 мкл аллантоисного вируса, разведенного на среде с добавлением 5 мкг/мл ТРСК трипсина (от 0,1 до 5 БОЕ на клетку). Далее планшеты инкубировали в течение 24 часов в атмосфере 5% CO2 при 37°C клетки. После инкубации среду удаляли и клетки фиксировали 80% ацетоном на фосфатно-солевом буфере (ПБС) в течение 20 минут, хорошо высушивали, а затем отмывали 3 раза ПБС с 0,05% Твин-20 (ИФА-раствор). Эти и все дальнейшие процедуры отмывки проводили указанным раствором. Далее к клеткам добавляли по 100 мкл раствора ПБС с 1% фетальной сывороткой и 0,05% Твин-20 и инкубировали при 37°C в течение 30 минут. После удаления раствора к клеткам добавляли по 100 мкл моноклональные антитела (МКА) к внутренним белкам вируса гриппа A (NP+M1), разведенным 1:1000 на ИФА-растворе. После инкубации с антителами в течение 1 часа при 37°C и последующей 3-кратной промывки в лунки вносили по 100 мкл IgG кролика против IgG мыши, меченных пероксидазой хрена в разведении 1:5000 и инкубировали еще 1 час при 37°C. После 4-кратной промывки связанную пероксидазу выявляли добавлением в лунки 100 мкл 0,05% раствора ортофенилендиамина (ОФД) в 0,003% цитратном буфере рН=5,0, содержащем 0,003% H2O2. Планшеты выдерживали 15-30 минут в темноте до появления окраски, реакцию останавливали добавлением 50 мкл 4N H2SO4, далее оптическую плотность (ОП) измеряли на автоматическом спектрофотометре при 492 нм. В качестве клеточного контроля использовали лунки, не зараженные вирусом. Процент ингибирования вирусной репродукции изучаемыми соединениями определяли по формуле: процент ингибирования = 100-(ОП опыта - ОП клеточного контроля / ОП вирусного контроля в отсутствии соединения - ОП клеточного контроля). Для одной точки опыта использовали четыре лунки планшета, а каждое значение представляет среднее арифметическое, вычисленное из этого опыта. Концентрация препарата, уменьшающая значение величины ОП на 50%, принималась за ингибирующую концентрацию 50 (ИК 50).
Результаты проведенных исследований противовирусной активности соединений 1-6, а также препаратов сравнения Арбидола и Озельтамивира карбоксилата показали, что все исследуемые вещества в культуре клеток MDCK эффективно ингибировали репродукцию вируса гриппа А /Калифорния /7/09 (H1N1). Определение противовирусной активности в нетоксичных концентрациях изучаемых образцов показало, что эффективность ингибирования для каждого из них увеличивалась с повышением концентраций препаратов. На основании полученных данных были получены зависимости доза-ответ и определены ИК50 (табл. 2). Из полученных данных следует, что ИК50 была высокой для соединений 1-6 и находилась в пределах 5-10 мкг/мл, ИК50 для арбидола составляла 3-5 мкг/мл. При этом ИК50 для озельтамивира карбоксилата была наименьшей и составила 1 мкг/мл.
Таким образом, ИК50 для всех изученных препаратов были сравнимы, а для арбидола и озельтамивира карбоксилата совпадали с ингибирующими концентрациями, полученными ранее для этих препаратов в отношении эталонных и эпидемических штаммов вирусов гриппа А и В (Boriskin Y., Leneva I., Pecheur E. et al. // Current Med. Chem., 2008, v. 15, p. 997-1005 (Review Invited, English); Ленева И.А., Федякина И.Т., Гуськова T.A., Глушков Р.Г. // Терапевтический архив, 2005, №8, с. 84-88; Бурцева Е.И., Шевченко Е.С., Ленева И.А. и др. // Вопросы вирусологии, 2007, №2, с. 24-29; Ленева И.А., Федякина И.Т., Еропкин М.Ю., Гудова Н.В., Романовская А.А., Даниленко Д.М, Виноградова С.М., Лепешкин А.Ю., Шестопалов A.M. // Вопросы вирусологии, 2010, т. 55, №3, с. 19-27).
1. Средство, обладающее противогриппозной активностью, представляющее собой соединения общей формулы (I) в виде смеси R- и S-диастереомеров или отдельных изомеров или их фармацевтически приемлемые соли:
2. Средство по п.1, где соединения общей формулы (I) выбраны изметил 2(S)-[4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ениламино]-4-(метилтио)бутаноата,метил 2(S)-[(4(S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-енил)амино]-4-(метилтио)бутаноата,метил 2(R)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-енил)амино]-4-(метилтио)бутаноата,метил 2(S)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноата,метил 2(S)-[(4(R)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноата,метил 2(R)-[(4(R,S)-аллил-5,5-диметокси-2,4-дихлор-3-оксоциклопент-1-ен-1-ил)амино]-4-(метилсульфинил)бутаноата.
3. Применение соединений общей формулы (I), указанной в п.1, в качестве средства, обладающего противогриппозной активностью.