Система и способ измерения концентрации радиофармацевтических препаратов
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике, а именно к средствам подачи радиофармацевтических материалов. Система измерения радиоактивной концентрации радиофармацевтического препарата содержит контейнер, связанную с ним анализируемую область, сформированную из части контейнера, детектор радиации, апертурную систему, имеющую по меньшей мере один оптический элемент, расположенный между анализируемой областью и детектором радиации, и выполненную с возможностью передачи в нее радиоактивной концентрации радионуклида в анализируемой области, устройство сбора данных, обеспечивающее измерение радиации анализируемой области, и микропроцессорную систему. Микропроцессорная система выполнена с возможностью вычисления радиоактивной концентрации, излучаемой радиофармацевтическим препаратом, находящимся в анализируемой области. Способ измерения радиоактивной концентрации радиофармацевтического препарата в системе измерения концентрации включает облучение детектора радиации радиацией, излучаемой радиофармацевтическим препаратом, сбор данных с выхода детектора радиации через электронный вход устройства сбора данных, преобразование данных в цифровое представление и передачу его в микропроцессорную систему, анализ цифрового представления и вычисление радиоактивной концентрации на основе общей величины радиации, рассчитанной по меньшей мере по одному алгоритму анализа. Использование изобретений позволяет повысить точность измерения удельной активности или радиоактивной концентрации фармацевтического препарата. 2 н. и 14 з.п. ф-лы, 7 ил.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка заявляет приоритет предварительной заявки США № 61/322555, поданной 9 апреля 2010 года, содержание которой раскрывается ниже посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способам подачи, системам и их компонентам для использования с радиофармацевтическими материалами и, в частности, к способам и компонентам, используемым для определения удельной активности или радиационной концентрации подаваемого радиофармацевтического материала.
Радиофармацевтические материалы широко используются в области медицины как в лечебных, так и в диагностических целях. С помощью инкапсулированных радиофармацевтических материалов (в виде зерен), введенных в твердые опухоли, например, опухоли предстательной железы, проводят облучение и последующее разрушение клеток опухоли. Для уменьшения риска возникновения рестеноза после ангиопластики используют кратковременное облучение просветных клеток в кровеносных сосудах радиоактивными материалами (которые удерживаются балонным катетером).
Кроме этих лечебных целей, радиофармацевтические препараты могут выступать в качестве радиоизотопного индикатора в специальных методах получения изображения для облегчения диагностики тканей, требующих медицинского вмешательства. Известны два таких метода получения изображения: позитронно-эмиссионная томография (PET) и однофотонная эмиссионная компьютерная томография (SPECT). При формировании изображения посредством PET, радиофармацевтический препарат, переносящий позитронно-активный нуклид (например, 18F) вводится в сосудистую систему пациента. Позитрон, излучаемый радионуклидом, сталкивается с расположенными вблизи электронами, высвобождая пару гамма-лучей с противоположными траекториями. Парные гамма-лучи регистрируются датчиками, расположенными с противоположных от пациента сторон, определяя тем самым расположение радиофармацевтического препарата. Например, 18F-фтордеоксиглюкоза (FDG) обычно используется для выявления клеток опухоли, которые преимущественно потребляют FDG. При формировании изображения SPECT, радиофармацевтическим препаратом переносится радионуклид, который излучает одиночный гамма-квант во время его дезинтеграции. Как и при PET, гамма-излучение регистрируется датчиками, расположенными возле пациента, определяя тем самым расположение радиофармацевтического препарата. Неограничивающим примером является использование препарата 99mTc сестамиби, который вводится в сосудистую систему пациента, после чего проводятся наблюдения прохождения нуклида через сердце. Этот способ снабжает кардиолога информацией о способности сердца выкачивать кровь из желудочков.
Если для отдельного пациента, проходящего одну процедуру визуализации, доза облучения диагностическими радиофармацевтическими препаратами минимальна, то суммарная доза как для медицинского техника, так и для врача, вводящего радиоизотопный индикатор, может быть значительной. Это связано с количеством пациентов, которых ежедневно необходимо инъецировать медицинскому технику или врачу. А следовательно, определенное количество устройств было разработано для экранирования врача или техника от чрезмерного облучения его радиофармацевтическими препаратами. Для ручной инъекции радиофармацевтического препарата разработаны шприцы, в корпусе которых находится экранирующий материал (патент США № 4968305 изобретателя Takahashi и других), а также разработаны ручные экранированные держатели шприцов (патент США № 4994012 изобретателя Nakayama и других). В дополнение к таким ручным устройствам также известны автоматические устройства. Примеры таких устройств можно найти в патенте США № 6767319 изобретателя Reilly и других (далее по тексту в виде ссылки), публикация WO 2004/004787 заявки PCT на патент (изобретателя Van Naemen и других, далее по тексту в виде ссылки), публикация EP 1616587 заявки EPO на патент (изобретателя Buck, далее по тексту в виде ссылки) и публикация 2008/0177126 заявки на патент США (изобретателя Tate и других, далее по тексту в виде ссылки). Несмотря на то, что применение этих устройств направлено в основном на формирование изображения посредством PET (а конкретно на использование FDG), устройства подобного типа можно использовать для введения радиофармацевтических препаратов SPECT в методах получения изображения посредством SPECT.
Из описания изобретений Buck и Tate и других, в частности, автоматические инъекционные устройства содержат, как правило, следующие элементы. Основной источник радиофармацевтического препарата, например, флакон или другой контейнер, который расположен в экранированном пространстве внутри инъекционного устройства. Игла, канюля или другое устройство доступа, которое вставляется в контейнер для получения доступа к радиофармацевтическому материалу. Канал подачи, который прокладывается далее от устройства доступа к первому устройству перекачки, которое может содержать шприц и активатор или перистальтический насос. Источник нерадиоактивного промывочного материала, например, солевого раствора, который также снабжен вторым каналом подачи жидкости и который может быть подключен ко второму перекачивающему устройству или может иметь жидкостную связь с первым перекачивающим устройством через клапанный механизм. В примере, использующем второе перекачивающее устройство, выход последнего может быть связан по каналам подачи жидкости с выходом первого перекачивающего устройства посредством вспомогательного клапанного механизма. Выходной конец первого перекачивающего устройства связан по каналам жидкости с третьим каналом подачи жидкости, который пропущен через устройство регистрации излучений, например, ионизационную камеру. Третий канал подачи жидкости связан со вторым клапанным механизмом, который управляет направлением жидкости, направляя ее либо в контейнер отходов, либо на подающее устройство, которое может подавать радиофармацевтический материал либо в приемный патрон, либо пациенту, для медицинских целей. Компьютер с соответствующим программным обеспечением управляет действием первого и второго перекачивающих устройств через блоки управления двигателями и, кроме того, управляет клапанными механизмами. Инъекционное устройство также может содержать монитор для отображения информации пользователю (например, количества радиации, выявленной детектором излучений), а также устройство ввода компьютера (например, клавиатуру), позволяющее пользователю вводить информацию о работе инъекционного устройства.
С функциональной точки зрения такое автоматическое устройство может использоваться следующим образом. Техник или врач может загружать основной контейнер или флакон, заполненный раствором, содержащим радиоактивный материал, в экранированный приемник в инъекционном устройстве. Количество радиоактивного материала, например, удельная активность (представленная, например, в Бк или Ки на единицу объема) может быть напечатана на этикетке заполненного флакона. В качестве альтернативы, на флаконе с известным или предполагаемым объемом жидкости можно указать общую активность флакона (в Бк или Ки). После загрузки заполненного флакона или контейнера в экранированный приемник, в контейнер вводится устройство доступа, либо вручную, врачом или техником, либо автоматически, с помощью инъекционного устройства. Аналогичным образом подводится источник нерадиоактивного промывочного материала, например, от контейнера или подвесного пакета. Затем, врач или техник может подключить промывочный материал ко второму каналу подачи жидкости, предусмотренному в инъекционном устройстве. Удалить воздух из разных каналов подачи жидкости в инъекционном устройстве можно с помощью нерадиоактивного промывочного материала посредством процесса прокачки. Процесс удаления воздуха приводит к заполнению каналов подачи жидкости промывочным материалом, что обеспечивает отсутствие воздуха при использовании. После этого врач или техник активирует инъекционное устройство путем задания дозы радиофармацевтического препарата для подачи. Можно выбрать разные способы настройки инъекционного устройства на подачу определенного количества радиации, необходимой для введения. Например, врач или технический пользователь может ввести общий объем подачи радиофармацевтического препарата через интерфейс на инъекционном устройстве. Кроме этого, пользователь может ввести величину общей радиационной активности для конечной дозы. В таком случае, программное обеспечение в компьютере инъекционного устройства должно иметь данные по удельной активности жидкости в источнике радиофармацевтического препарата и выполнять такие вычисления, как определение конечного объема подачи. Если получателем дозы является пациент, то можно ввести в инъекционное устройство параметры пациента (например, рост и вес). В данном примере программное обеспечение компьютера инъекционного устройства может использовать данные для определения соответствующего количества подаваемого радиофармацевтического препарата, например, активность, для последующего вычисления общего объема, необходимого для подачи из источника радиофармацевтического препарата. Суть вопроса не ограничена данными примерами и для настройки инъекционного устройства на доставку определенного объема подаваемого радиофармацевтического препарата можно использовать другие способы.
После определения объема радиофармацевтического препарата инъекционное устройство активирует соответствующие механизмы перекачки для переноса требуемого объема от контейнера-источника радиофармацевтического препарата в третий канал подачи жидкости от первого механизма перекачки. Способ перекачки, который затем активируется для перекачки промывочной жидкости от источника промывочной жидкости в третий канал подачи жидкости, заключается в том, что болюс промывочной жидкости проталкивает дозу радиофармацевтического препарата по каналу подачи жидкости. Посредством этого доза радиофармацевтического препарата продвигается по третьему каналу подачи жидкости до тех пор, пока не попадает в зону вблизи детектора радиации. По описанию изобретателя Tate и других, такой детектор радиации может содержать детектор ионизации. Такой детектор ионизации можно коротко описать в виде закрытого контейнера с центральным анодом и собирающим катодом, между которыми прикладывается электрический потенциал. Контейнер детектора заполнен регистрирующим газом (например, аргоном). Когда радиация, излучаемая радиофармацевтическим препаратом, попадает в детектор ионизации, происходит ионизация некоторого количества газа, что приводит к возникновению положительных и отрицательных зарядов. Отрицательные заряды притягиваются к собирающему аноду и, таким образом, образуется ток из заряженных частиц. Затем электрический ток, формируемый детектором радиации, обрабатывается электронными устройствами и программным обеспечением для получения показаний измеренного количества дезинтеграций в секунду (в Бк или Ки). В результате, инъекционное устройство предоставляет непосредственную информацию о количестве радиации, излучаемой дозой радиофармацевтического препарата, подаваемого инъекционным устройством. Как описано в Buck, если измеренная активность дозы не соответствует достаточному количеству радиофармацевтического препарата, то можно запрограммировать инъекционное устройство на подачу второй дозы, которая, в совокупности с первой, будет обеспечивать необходимое количество подаваемого радиоактивного фармацевтического препарата.
После получения в третьем канале подачи жидкости необходимого объема радиофармацевтического препарата, полная доза радиофармацевтического препарата выкачивается из инъекционного устройства через устройство подачи в конечный пункт назначения. В случае, если радиационная активность дозы превышает требуемую величину, в инъекционном устройстве активируются клапанные механизмы, выводящие эту дозу в контейнер для отходов на утилизацию.
По описанию в приведенном выше примере автоматического инъекционного устройства радиофармацевтических препаратов, концентрация радиации основного объема фармацевтического препарата должна быть точно указана среди данных на этикетке основного флакона, для ее определения техником или пользователем. Данная информация должна вводиться в инъекционную систему для расчета дозы. Обычно, данные о концентрации, предоставляемые на этикетке, имеют погрешность ±30%. Такая неточность может привести к понижению или превышению уровней дозировки пациента, относительно требуемых уровней. По этой причине желательно предусмотреть в инъекционном устройстве систему прямого измерения удельной активности или радиоактивной концентрации фармацевтического препарата, находящегося в основном контейнере.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном описании представлены различные варианты реализации системы и способа измерения радиоактивной концентрации радиофармацевтического препарата. В одном из вариантов осуществления система содержит контейнер, анализируемую область, связанную с контейнером, детектор радиации для фокусирования радиации, излучаемой анализируемой областью, устройство сбора данных обеспечивающее измерение радиации анализируемой области, и микропроцессорную систему, которая обменивается данными с устройством сбора данных. Микропроцессорная система осуществляет вычисления радиоактивной концентрации излучаемой радиофармацевтическим препаратом, излучающим радиацию, заключенную в анализируемой области, при обработке данных с устройства сбора данных.
Система может дополнительно содержать апертуру, содержащую по меньшей мере один оптический элемент, расположенный между анализируемой областью и детектором радиации. Для контроля выбора по меньшей мере одного из оптических элементов на апертуре в анализируемой области обеспечивается радиоактивная концентрация радиоактивного нуклида. Кроме того, рядом с апертурой можно установить коллиматор. Оптические элементы могут выбираться из апертур или ослабляющих материалов. Кроме того, датчик может содержать кристалл, соизмеримый с открытым участком анализируемой области для фокусировки для регистрации радиации, излучаемой из анализируемой области.
Предлагается способ измерения радиоактивной концентрации радиофармацевтического препарата в системе измерения концентрации, содержащей контейнер, включающий, по меньшей мере, анализируемую область, детектор радиации, содержащий, по меньшей мере, выход для регистрации радиации, излучаемой, по меньшей мере, из анализируемой области, устройство сбора данных, содержащего электронный вход и цифровой выход, причем электронный вход электрически связан с выходом детектора радиации, и микропроцессорную систему, обменивающуюся данными с цифровым выходом устройства сбора данных, при этом способ включает облучение детектора радиацией, излучаемой радиофармацевтическим препаратом, находящимся, по меньшей мере, в анализируемой области, по меньшей мере, сбор данных с выхода детектора радиации через электронный вход устройства сбора данных, преобразование сигнала, принятого с выхода детектора радиации, в цифровое представление, передачу сигнала цифрового представления с цифрового выхода электроники сбора данных на микропроцессорную систему, анализ цифрового представления с использованием, по меньшей мере, одного программного модуля, находящегося в микропроцессорной системе и обеспечивающего, по меньшей мере, один алгоритм анализа; и вычисление радиоактивной концентрации на основе общей величины радиации, рассчитанной, по меньшей мере, по одному алгоритму анализа.
Способ дополнительно заключается в том, что, по меньшей мере, один программный модуль, может содержать несколько программных модулей. Дополнительно, способ содержит анализ цифрового представления, причем этот анализ дополнительно содержит вычисление гистограммы, содержащей несколько энергетических величин и несколько экземпляров проявлений каждой из нескольких энергетических величин, из нескольких цифровых представлений, выделение окон гистограммы, по меньшей мере, по одной энергетической величине, и, по меньшей мере, по одному из экземпляров проявлений, по меньшей мере, одной энергетической величины, образуя при этом гистограмму с выделенными окнами, интегрирование экземпляров проявлений, по меньшей мере, одной энергетической величины в гистограмме с выделенными окнами, образуя при этом интегральную величину, и преобразование интегральной величины в общую величину радиации. Кроме того, можно дополнительно ввести корректировку нелинейности интегральной величины в цифровом представлении.
Дополнительные подробности и преимущества различных вариантов осуществления, подробно рассмотренных в данном описании, будут ясны из нижеследующего подробного описания предпочтительных вариантов осуществления и приложенных графических материалов.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
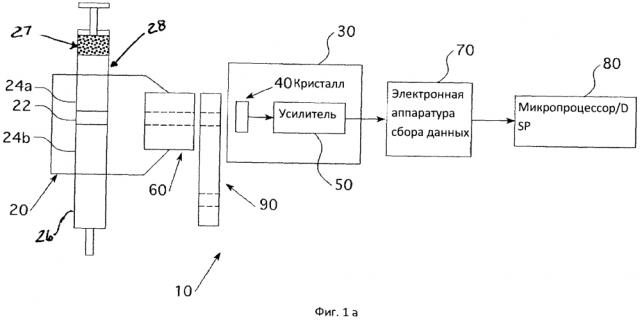
На фиг. 1a представлена блок-схема системы измерения концентрации радиофармацевтического препарата.
На фиг. 1b представлена блок-схема альтернативной системы измерения концентрации радиофармацевтического препарата.
На фиг. 2 представлен схематический вид сбоку механической части и детектора сигналов измерительной системы.
На фиг. 3 представлен вариант осуществления коллиматора и контейнер настоящего изобретения.
На фиг. 4a представлена блок-схема одного из вариантов осуществления измерительной системы, содержащей детектор, узел электронного оборудования и модули программной обработки, основанные на системе, содержащей трансимпедансный усилитель.
На фиг. 4b представлена блок-схема другого варианта осуществления измерительной системы, содержащей интегрирующий усилитель.
На фиг. 4c представлена блок-схема еще одного варианта осуществления измерительной системы, содержащей трансимпедансный усилитель, в котором несколько аппаратных функций сосредоточены в аппаратных модулях.
На фиг. 5a представлена блок-схема одного из вариантов модуля программной обработки измерительной системы.
На фиг. 5b представлена блок-схема другого варианта осуществления модуля программной обработки измерительной системы, содержащей модули вычисления эффективного периода полураспада радионуклида.
На фиг. 6 представлен спектр излучения радиации двух радиоактивных изотопов.
На фиг. 7 представлена блок-схема другого варианта осуществления детекторного узла системы измерения концентрации, демонстрирующего использование нескольких анализируемых областей и детекторов радиации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
На фиг. 1a представлена блок-схема системы 10 измерения концентрации активности (или удельной активности) радиофармацевтических препаратов. Измерительная система содержит контейнер радиофармацевтической жидкости, расположенный в держателе 20, детектор 30 радиации, содержащий, по меньшей мере, кристаллический датчик 40 и усилитель 50, расположенные на соответствующем расстоянии для регистрации радиоактивности, коллиматор, расположенный между контейнером жидкости и детектором радиации, электронную аппаратуру 70 сбора данных, которая, по меньшей мере, оцифровывает аналоговый сигнал, формируемый детектором, и микропроцессорную подсистему программного обеспечения ЦОС 80, связанную с выходом электроаппаратуры сбора данных детектора. Необязательно, для регулировки потока радиации, падающего на детектор, между коллиматором и детектором можно установить держатель 90 апертуры. Измерительная система вычисляет концентрацию активности радиофармацевтического препарата (далее - концентрацию) в жидкости. В качестве альтернативы, на фиг. 1b представлен вариант системы 11 измерения без дополнительного коллиматора 61 или держателя 91 апертуры. Кроме того, необязательно, для измерения концентрации в анализируемой области, можно соответствующим образом расположить детектор рядом с анализируемой областью 22, чтобы кристалл 40 примыкал к измеряемому участку.
На фиг. 1a, в качестве контейнера жидкости 26 может выступать любая подходящая емкость для содержания радиофармацевтического препарата во время процесса измерения, включая, кроме всего прочего, пакет для инфузий или формованную бутылку. Контейнер 26 для жидкости имеет форму любой хорошо известной геометрической фигуры, например, цилиндра с предопределенным, измеряемым или заданным объемом и поперечным сечением. Дополнительно, контейнер для жидкости 26 изготовляется из материала, который как поглощает, так и рассеивает минимальное количество радиации, излучаемой радиофармацевтическим препаратом, содержащимся в контейнере, чтобы детектор мог произвести точное измерение радиации фармацевтического препарата. Примерами таких материалов могут быть материалы с низкой плотностью, такие как, кроме всего прочего, поликарбонат, полиэтилен-терефталат, акрил- или акрилонитрил-бутадиен-стирол. Часть контейнера для жидкости формирует "анализируемую область" 22, которая представляет собой экранированный фиксированный объем с наличием радиационной жидкости. Анализируемая область исследуется с помощью детектора.
Контейнер 26 для жидкости может быть расположен в держателе 20 контейнера для жидкости. Держатель контейнера 26 для жидкости может состоять из экранирующего радиацию материала, преимущественно материала с высокой плотностью, например, из вольфрама, для минимизации величины радиации, излучаемой фармацевтическим препаратом в окружающее пространство. Другими вариантами осуществления такого материала высокой плотности могут выступать, без ограничений, полимерные смеси с высокой удельной массой, представленные наполненным полимерным композитом высокой плотности Trilliant™ НС GRV, который поставляется компанией Radiation Protection Technologies. Держатель 20 может иметь фиксирующее устройство, с помощью которого контейнер для жидкости 26 может быть прочно закреплен с возможностью быстрого съема, причем контейнер может удерживаться в фиксированном положении по отношению к другим узлам системы.
Как показано на фиг. 1а, анализируемая область 22 со всех сторон окружена границей 24а, 24b радиофармацевтической жидкости. Эта граница обеспечивает непрерывность радиации вокруг анализируемой области 22. Если при наполнении контейнера 26 для жидкости, над жидкостью образуется воздушное пространство 27, то граница 28 воздух/жидкость будет вызывать чрезмерное рассеивание радиации на границе, что в конечном счете приведет к неверному показанию удельной активности, определяемой детектором, если область, наполненная воздухом, находится близко к анализируемой области 22. Данный эффект минимизируется достаточным запасом жидкости вокруг анализируемой области 22.
Для получения заданного определенного объема или анализируемой области, можно расположить рядом с держателем контейнера или встроить в него коллиматор 60. Кроме того, как показано на фиг. 2, экранированный держатель контейнера (и контейнер для жидкости) может упираться в коллиматор 60, обеспечивая тем самым фиксированное расположение контейнера 26 для жидкости и коллиматора 60 друг относительно друга. Коллиматор 60 может быть изготовлен из любого материала с высокой плотностью, например, без ограничений, из вольфрама. Коллиматор 60 ограничивает радиацию, измеряемую системой, до величины, излучаемой радиофармацевтической жидкостью, находящейся в анализируемой области контейнера 26. Точный объем анализируемой области 22 можно получить исходя из длины и
диаметра коллиматора (образующего оптическое окно в контейнере для жидкости), в сочетании с известной геометрией и поперечным сечением контейнера для жидкости. Детектором 30 измеряется только радиация, излучаемая из анализируемой области 22.
Кроме этого, между коллиматором и детектором может быть дополнительно установлена избирательная апертура 90. Избирательная апертура может иметь любую геометрию подходящей формы, в том числе колесо или задвижку с меняющимися отверстиями, пропускающими радиацию. Поскольку радиофармацевтические препараты содержат разные радионуклиды, например, 99mTc или 201Tl, их концентрации могут изменяться в широких пределах. Одним из неограничивающих примеров может быть радиофармацевтический препарат, содержащий 99mTc, концентрация активности которого может находиться в диапазоне от 1 мКи/мл до 150 мКи/мл, в то время как препараты, содержащие 201Tl, могут иметь концентрацию активности от 1 мКи/мл до 10 мКи/мл. Можно использовать апертурное колесо для уменьшения количества радиации, проходящей через коллиматор в детектор, чтобы предотвратить насыщение. Избирательная апертура 90 позволяет детектору 30 подстраиваться под большой диапазон концентраций потенциальных радиофармацевтических препаратов, и таким образом детектор не будет доходить до насыщения (высокий уровень концентрации) или требовать слишком много времени на проведение измерений (низкий уровень концентрации). На фиг. 2 представлен один вариант осуществления избирательной апертуры 190.
В альтернативном варианте осуществления контроля падающего на детектор потока радиации может быть основан на средствах изменения длины оптического пути между фармацевтическим препаратом в анализируемой области и кристаллическим детектором. В данном варианте осуществления (не показан) колесо, содержащее ослабляющие элементы, заменено вторым телескопическим коллиматором, прикрепленным к детектору на подвижной опоре. Телескопический коллиматор примыкает к фиксированному коллиматору, образуя таким образом один коллимационный путь переменной длины. Путем перемещения опоры пользователь может укорачивать или удлинять оптический путь от анализируемой области до детектора, изменяя тем самым количество радиации, падающей на детектор, в соответствии с известными правилами оптики.
Детектор 30 радиации расположен после держателя 20 контейнера коллиматора 60 и дополнительной апертуры/аттенюатора 90. В детекторе 30 радиации могут быть использованы разные современные технологии регистрации радиации, подходящие для интересующего энергетического диапазона. Примерами техники регистрации радиации являются матрицы кремниевых PIN-фотодиодов или лавинных фотодиодов (кремниевые PMT) со сцинтилляционным материалом или детекторы на основе кристаллов кадмий-цинк-теллура (CZT) или кадмий-теллура (CT). Преимущество такого датчика заключается в высокой чувствительности, а также в маленьких габаритах и низкой стоимости. Датчик на основе CZT содержит кристалл CZT (датчик), к которому через анод и катод прикладывается электрический потенциал. Падающие гамма или Х-лучи (здесь ионизирующие фотоны или фотоны) создают импульс электронно-дырочных пар, которые мигрируют к аноду и катоду, соответственно. Импульс электронов движется намного быстрее, благодаря высокой подвижности, и накапливается на аноде, как правило, через разделительный конденсатор (который защищает усилитель заряда от высоковольтного смещения, присутствующего на аноде). Количество образованных электронно-дырочных пар пропорционально энергии фотонов, поглощаемых кристаллом, и представляет собой импульс заряда на аноде.
Детектор 30 может дополнительно содержать усилитель 50, так как может потребоваться усиление тока на выходе кристалла для дальнейшего использования. Двумя не ограничивающими примерами таких усилителей, которые могут принимать импульс тока, вырабатываемый кристаллом, являются широкополосный трансимпедансный усилитель с короткой постоянной времени затухания или интегрирующий усилитель. Электронная аппаратура 20 сбора данных детектора 30 радиации и микропроцессор/DSP 80 являются дополнительными элементами, представленными на фиг. 4a-c.
Детектор 30 вырабатывает аналоговый сигнал, который накапливается и оцифровывается электронной аппаратурой сбора данных. На фиг. 4a представлен детектор 130, который содержит трансимпедансный усилитель. Импульс на выходе детектора может быть дополнительно обработан с использованием аппаратных узлов перед переводом в цифровую форму АЦ преобразователем в модуле сбора данных или в модуле 170 формирования и сбора импульсов. Этот процесс дополнительно представлен на фиг. 4a. В варианте осуществления, представленном на фиг. 4c, импульс на выходе трансимпедансного усилителя может быть захвачен непосредственно АЦ преобразователем, с дальнейшей обработкой сигнала, обеспечиваемой программными модулями в программном обеспечении ЦОС. В другом варианте осуществления, представленном на фиг. 4b, просто производится оцифровка аналогового выхода интегрирующего усилителя 238 АЦ преобразователем 272 для дальнейшей обработки микропроцессорной/DSP-системой 280.
Затем, оцифрованные выходные данные детектора передаются на микропроцессор 180, 280 или 380 системы регистрации концентрации, как показано на фиг. 4a-c. Для анализа данных, микропроцессор может использовать любое количество алгоритмов цифровой обработки сигнала (DSP). Такие алгоритмы могут содержать, без ограничений: алгоритмы выделения окон в форме импульсов, для определения энергии фотона, связанной с каждым импульсом, алгоритмы построения гистограмм энергии, связанной с данными импульса в спектре излучения, алгоритмы формирования энергетического спектра для определения характерных энергетических пиков, алгоритмы определения нуклида, на основании энергетического спектра, алгоритмы расчета удельной активности пробы радиофармацевтического препарата, и алгоритмы вычисления периода полураспада пробы радиофармацевтического препарата в анализируемой области.
На фиг. 2 представлен альтернативный вариант осуществления системы измерения концентрации активности радиофармацевтического препарата, по описанию фиг. 1. На фиг. 2, в частности, представлен предпочтительный вариант осуществления, содержащий контейнер для жидкости шприцевого типа с поршнем, экранированный канал подачи жидкости для радиофармацевтического препарата, измеренного в контейнере для жидкости, экранированный держатель контейнера для жидкости с устройством фиксации, апертурное колесо и узел детектора радиации. Узел детектора радиации может дополнительно содержать чувствительный кристалл, усилитель и электронную аппаратуру формирования и сбора импульсов (не показаны), расположенные внутри электрически экранированного корпуса.
В варианте осуществления, представленном на фиг. 2, контейнер для жидкости содержит шприц для помещения в него радиофармацевтического препарата во время процесса измерения. Шприц наполняется или опорожняется путем активации поршня, расположенного под шприцем. Такая активация выполняется либо вручную, либо с помощью механических приспособлений под управлением электронной аппаратуры или компьютера (не показаны).
На фиг. 3 представлен другой вариант осуществления контейнера 320 для жидкости. Радиофармацевтическая жидкость подается в отверстие контейнера посредством клапанного механизма, для возможности управления направлением потока жидкости в контейнер для жидкости и из него. Контейнер 320 для жидкости представляет собой восьмиугольник, охватывающий шприц.
Контейнер для жидкости расположен внутри экранированного держателя контейнера для жидкости. Держатель контейнера жидкости изготавливается преимущественно из вольфрама или другого материала с высокой плотностью для минимизации количества радиации, излучаемой фармацевтическим препаратом в окружающее пространство. На фиг. 2, показан экран, содержащий экранирующий блок 191, который надевается на контейнер для жидкости и фиксируется на месте. Держатель 120 обеспечивает поддержку контейнера 126 для жидкости в фиксированном положении по отношению к другим оптическим узлам (коллиматору и дополнительным апертурам/аттенюаторам), а также по отношению к датчику радиации.
Рядом с контейнером для жидкости 126 может быть расположен коллиматор. На фиг. 3, экранированный держатель 120 контейнера прижимает контейнер 126 для жидкости вплотную к коллиматору или избирательной апертуре 190, обеспечивая фиксированное расположение контейнера для жидкости и коллиматора. Например, в варианте осуществления, представленном на фиг. 2, коллиматор 60 вставлен между контейнером 20 для жидкости и избирательным апертурным колесом 90.
Как показано на фиг. 3, избирательное апертурное колесо 190 может содержать множество шайб или дисков 190a, 190b, 190c. Каждый диск может представлять собой отдельный ослабляющий/экранирующий материал, который выбирается в соответствии с типом радионуклида, вводимого в пациента. Ослабляющий/экранирующий материал подбирается под уровень радиации, чтобы детектор 30 мог правильно определить уровень радиоактивности. Примерами таких материалов являются свинец и вольфрам. Каждый из дисков содержит микроотверстие(ия) 195 или микропрорезь(и) 197, причем каждый из этих элементов обеспечивает соответствующий уровень ослабления. Микроотверстия могут иметь различные диаметры, а микропрорези могут иметь разную толщину, причем каждая из форм пропускает большее или меньшее количество радиации, попадающей на детектор. Имея разные апертуры, каждая конкретная апертура может быть связана с конкретным радионуклидом, например, апертура диаметром 0,12 дюйма связана с фармацевтическим препаратом, содержащим 201Tl.
Апертурные микроотверстия могут составлять часть апертурного колеса, или могут быть изготовлены в виде отдельных съемных дисков с апертурными отверстиями, которые вставляются в приемные гнезда колеса. Затем, съемные апертурные диски могут быть зафиксированы в гнездах с помощью любых известных креплений, например, с помощью установочных винтов. Использование съемных апертурных дисков может оказаться удобным для пользователя системы измерения концентрации, когда в процедуре необходимо будет использовать радиофармацевтический препарат с концентрацией или радионуклидом, который отличается от ранее используемого. В таком случае для ослабления радиации, попадающей на датчик, может потребоваться набор апертур, отличный от того, который использовался для другого радионуклида. Апертурное колесо перемещается вручную оператором или с помощью механической системы, под управлением микропроцессора. В каждом из вариантов апертурное колесо может временно фиксироваться в точно установленном положении для обеспечения соосности микроотверстия апертуры и коллиматора. В варианте, представленном на фиг. 3, выемки в кромке апертурного колеса совмещаются с подпружиненным шариком для обеспечения правильного выравнивания колеса.
Апертурное колесо или избирательная апертура также могут содержать известный радиоактивный контрольный источник для проверки правильного функционирования датчика и связанной с ним электроники, например, 241Am. Контрольный источник может быть использован, например, при первом включении датчика концентрации, для ежедневной проверки правильности работы детектора и электроники. Пользователем могут быть использованы разные альтернативные источники радиации, либо пользователь измерительной системы может отказаться от наличия какого-либо источника радиации на апертурном колесе. Такие калибровочные источники также могут быть выполнены в виде дисков, подобных съемным апертурным дискам, которые можно вставлять или извлекать из гнезд в апертурном колесе. Кроме того, вместо апертур можно использовать другие элементы оптического ослабления, например, ослабляющую фольгу или тонколистовые материалы из свинца, вольфрама или другого ослабляющего материала. Радиация, излучаемая фармацевтическим препаратом в анализируемой области, после прохождения через коллиматор и апертуру, регистрируется детектором радиации. Как показано в примере на фиг. 1a, в качестве такого детектора может быть использован детектор на основе КЦТ с усилительными электронными устройствами. Такой КЦТ-детектор может быть помещен в узел кубической формы, размером 20 мм, и может быть смонтирован на небольшой печатной пл