Прогностические факторы для лечения рака
Иллюстрации
Показать всеИзобретение относится к медицине и представляет собой способ прогнозирования ответа онкологического пациента с неходжкинской лимфомой на противораковую терапию, включающую бортезомиб и ритуксимаб, отличающийся тем, что способ включает определение уровня или количества первого прогностического фактора и определение присутствия или количества второго прогностического фактора, причем низкий уровень СD68 или присутствие полиморфизма PSMB1 (P11A) коррелирует по меньшей мере с одним положительным исходом. Также изобретение относится к диагностическому набору для выявления онкологических пациентов с неходжкинской лимфомой, которые являются кандидатами для лечения рака бортезомибом и ритуксимабом, а также способу лечения рака у онкологических пациентов с неходжкинской лимфомой. Осуществление изобретения позволяет прогнозировать положительный ответ онкологического пациента на комбинированную терапию бортезомибом и ритуксимабом. 3 н. и 4 з.п. ф-лы, 5 пр., 25 табл., 8 ил.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА СМЕЖНЫЕ ИЗОБРЕТЕНИЯ
Настоящая заявка испрашивает приоритет по предварительной заявке № 61/522596, поданной 11 августа 2011 года, и предварительной заявке № 61/560555, поданной 16 ноября 2011 года, которые обе полностью включены в настоящий документ путем ссылки.
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к лечению онкологических пациентов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Несмотря на достижения в разработке успешных способов лечения рака, на ту или иную конкретную терапию всегда отвечает лишь подгруппа пациентов. При столь узком терапевтическом индексе и высоком токсическом потенциале многих доступных средств терапии рака из-за таких дифференцированных ответов пациентам могут назначаться излишние, неэффективные и даже потенциально опасные схемы лечения.
Один из способов оптимизации терапии для индивидуального лечения пациентов включает в себя возможность выявить у пациента один или более прогностических факторов, которые коррелируют с тем или иным конкретным результатом в ответ на выбранную схему лечения. См., например, публикации WO 2004/053066; WO 2006/133420; WO 2008/021183 и WO 2009/148528. Способность прогнозировать чувствительность пациентов к лекарственным средствам вызывает особенно большие трудности, поскольку реакция на лекарственное средство отражает как собственные характеристики клеток-мишеней, так и особенности метаболизма организма-хозяина.
Существует потребность в нахождении дополнительных прогностических маркеров для выявления онкологических пациентов, для которых можно ожидать благоприятных результатов при проведении конкретных схем лечения рака.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен способ установления того, имеются ли у пациента более высокие шансы благоприятного исхода в ответ на ту или иную схему лечения рака, содержащий: определение присутствия, отсутствия или количества одного или более прогностических факторов у пациента, причем присутствие, отсутствие или количество прогностического фактора коррелируют с по меньшей мере одним благоприятным исходом.
Присутствие прогностических факторов можно определять по результатам анализа биологической пробы, взятой у указанного пациента. Лечение рака может содержать введение ингибитора протеосом, такого как бортезомиб. Прогностические факторы могут представлять собой один или более из низкого уровня CD68, полиморфизмов PSMB1 (P11A), PSMB5 (R24C), P65, времени с момента последней терапии рака, одного предыдущего лечения, низкого индекса FLIPI, возраста (65 лет или моложе) и низкой опухолевой нагрузки.
Также предложены диагностические наборы для выявления пациентов, которые будут с наибольшей вероятностью демонстрировать положительные результаты в ответ на используемую схему лечения рака.
В изобретении также предложены способы лечения онкологических пациентов путем определения присутствия, отсутствия или количества одного или более прогностических факторов у пациента и выбора способа лечения в зависимости от того, насколько вероятен ответ пациента на лечение.
Также предложены варианты использования ингибиторов протеосом для лечения рака, причем пациенты характеризуются одним или более из: низкого уровня CD68, полиморфизмов PSMB1 (P11A), PSMB5 (R24C), P65, времени с момента последней терапии рака, одного предыдущего лечения, низкого индекса FLIPI, возраста и низкой опухолевой нагрузки.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1-8 представлены деревья решений для определения того, будут ли у конкретного пациента более высокие шансы благоприятного исхода в ответ на ту или иную схему лечения. «Выбран» означает, что у пациента будут более высокие шансы благоприятного исхода в ответ на выбранную схему лечения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описываются прогностические факторы, которые служат подходящими инструментами для прогнозирования и планирования при лечении рака. Прогностические факторы предсказывают, будет ли получен благоприятный исход в ответ на ту или иную конкретную схему лечения, например, лечение с использованием ингибитора протеосом.
В настоящем изобретении без ограничений предложены (a) способы прогнозирования ответа на схему лечения у онкологического пациента путем определения присутствия или отсутствия одного или более прогностических факторов, (b) наборы, которые можно использовать для определения присутствия или количества одного или более прогностических факторов, (c) способы лечения рака путем выбора пациентов, исходя из присутствия или количества одного или более прогностических факторов, и (d) лечение рака у пациентов с одним или более прогностическими факторами.
В некоторых вариантах осуществления предложен способ прогнозирования ответа на схему лечения рака (например, лечение с использованием ингибитора протеосом, такого как бортезомиб) у онкологических пациентов, содержащий определение присутствия или количества прогностического фактора у пациента или в биологической пробе, взятой у пациента; и причем присутствие или количество прогностического фактора коррелируют с по меньшей мере одним положительным исходом. Некоторые варианты осуществления содержат определение присутствия или количества второго прогностического фактора у пациента или в биологической пробе, взятой у пациента, при этом присутствие или количество второго прогностического фактора коррелируют с по меньшей мере одним положительным исходом.
Настоящее изобретение включает идентификацию прогностических факторов, которые в настоящем документе называются «вариантами», «маркерами», «биомаркерами» и/или «факторами» и которые коррелируют с более высокой вероятностью благоприятного ответа на используемую схему лечения рака. Связь ответа пациента на схему лечения рака с такими прогностическими факторами может укрепить или повысить уверенность в отношении безопасности и/или эффективности конкретной выбранной схемы лечения. В качестве прогностических факторов могут выступать ген, белок, характеристика пациента или аспект истории болезни пациента.
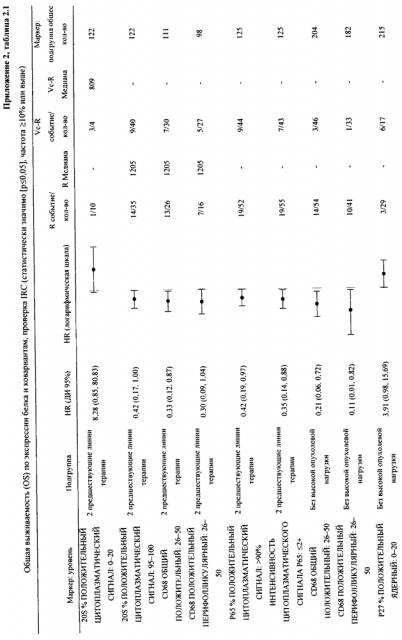
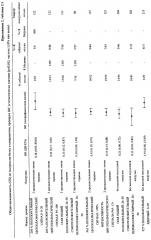
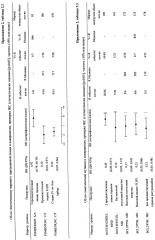
Прогностические факторы в соответствии с настоящим изобретением, которые коррелируют с по меньшей мере одним благоприятным исходом, включают в себя низкий уровень CD68, полиморфизм PSMB1 (P11A), полиморфизм PSMB5 (R24C), P65, возраст (до 65 лет), одно предыдущее лечение, низкий показатель Международного прогностического индекса для фолликулярных лимфом (FLIPI), время с момента последней противораковой терапии и низкую опухолевую нагрузку. У пациента предпочтительно должен быть низкий уровень CD68 или полиморфизм PSMB1 (P11A), а также еще по меньшей мере один прогностический фактор. В одном варианте осуществления пациент имеет низкий уровень CD68 и полиморфизм PSMB1 (P11A). Пары прогностических факторов в соответствии с настоящим изобретением, которые коррелируют с по меньшей мере одним благоприятным исходом, включают в себя пары, приведенные в таблицах 6 и 7.
Выражение «низкий уровень CD68» означает, что у субъекта или в биологической пробе, взятой у пациента, обнаруживается меньшее количество CD68, чем у среднего пациента или в биологических пробах, взятых у среднего пациента, который страдает тем же заболеванием. В некоторых вариантах осуществления низкий уровень CD68 означает, что 25% или менее клеток в биологической пробе экспрессируют CD68; 50% или менее клеток в биологической пробе экспрессируют CD68; 25% или менее фолликулярных клеток в биологической пробе экспрессируют CD68; 50% или менее фолликулярных клеток в биологической пробе экспрессируют CD68; 25% или менее перифолликулярных клеток в биологической пробе экспрессируют CD68; или 50% или менее перифолликулярных клеток в биологической пробе экспрессируют CD68.
Выражение «низкий индекс FLIPI» означает показатель 0 или 1 балл по шкале Международного прогностического индекса для фолликулярных лимфом (индекс FLIPI). При определении индекса FLIPI каждому из перечисленных ниже факторов присваивается один балл: возраст более 60 лет, III или IV стадия заболевания, поражение более 4 групп лимфатических узлов, уровень сывороточного гемоглобина ниже 12 г/дл и повышенный уровень сывороточной ЛДГ.
Термины «содержащий», «состоящий», «имеющий» и «включающий» используются в настоящем документе в их открытом, неограниченном значении.
«Количество» может означать величину, интенсивность, концентрацию, количество, степень или уровень экспрессии. Например, под количеством того или иного гена может пониматься число раз, которое этот ген или его часть присутствует в геноме субъекта или в клетках субъекта. Количество может также подразумевать численность клеток в биологической пробе, экспрессирующих тот или иной маркер, или общий уровень экспрессии или интенсивность маркера в биологической пробе. Под количеством может также пониматься число типов или линий терапии пациента, которые могли в прошлом применяться для лечения данного пациента. Количество может сопоставляться с абсолютной величиной, со стандартной пробой здорового пациента, со средним показателем здоровых пациентов или сравниваться со средним показателем пациентов, страдающих аналогичным заболеванием.
Схема лечения рака может включать в себя введение одного лекарственного средства или проведение одной терапии или же представлять собой комбинированную терапию, предусматривающую введение более одного лекарственного средства или проведение более одной терапии. Схема лечения рака может представлять собой химиотерапию, радиотерапию или иммунотерапию; или схема лечения рака может представлять собой трансплантацию костного мозга.
В некоторых вариантах осуществления схема лечения рака содержит введение пациенту ингибитора протеосом. Ингибитор протеосом представляет собой любое вещество, которое подавляет ферментативную активность протеосомы 20S или 26S in vitro или in vivo. В некоторых вариантах осуществления ингибитор протеосом представляет собой пептидилборную кислоту. Пептидилборные кислоты включают в себя бортезомиб. Ингибиторы протеосом включают в себя соединения, раскрытые в патентах США №№ 5756764; 5693617; 6831099; 6096778; 6075150; 6018020; 7119080; 6747150; 6617317; 6548668; 6465433; 6297217; 6083903; 6066730; 5780454; 7422830; 7109323; 6958319; 6713446 и 6699835. Ингибитор протеосом может представлять собой бортезомиб.
В некоторых вариантах осуществления схема лечения рака содержит применение противораковых агентов, включая, без ограничений, применение ацеманнана, акларубицина, альдеслейкина, алемтузумаба, алитретиноина, алтретамина, амифостина, аминоглютетимида, амсакрина, анагрелида, анастрозола, анцестима, аспарагиназы, бевацизумаба, бексаротена, броксуридина, капецитабина, целмолейкина, цетрореликса, цетуксимаба, кладрибина, клофарабина, клотримазола, даклизумаба, дексразоксана, дилазепа, докозанола, доксифлуридина, бромокриптина, кармустина, циклофосфамида, цитарабина, диклофенака, эделфосина, эдреколомаба, эфлорнитина, эмитефура, эксеместана, экзисулинда, фадрозола, филграстима, финастерида, флударабина фосфата, форместана, фотемустина, нитрата галлия, гемцитабина, гликопина, гептаплатина, гидроксимочевины, ибандроновой кислоты, имиквимода, йобенгуана, иринотекана, ирсогладина, ланреотида, лефлуномида, ленограстима, лентинана сульфата, летрозола, лиарозола, лобаплатина, лонидамина, мазопрокола, мелазопрола, мелфалана, меркаптопурина, метотрексата, метоклопрамида, мифепристона, милтефозина, миримостима, митогуазона, митолактола, митомицина, митоксантрона, молграмостима, нафарелина, нартограстима, недаплатина, нилутамида, носкапина, опрелвекина, озатерона, оксалиплатина, памидроновой кислоты, пегаспаргазы, пентозана полисульфата натрия, пентостатина, пицибанила, пирарубицина, порфимера натрия, преднизолона, ралоксифена, ралтитрекседа, рекомбинантной урат-оксидазы, ритуксимаба, ромуртида, сарграмостима, сизофурана, собузоксана, сонермина, стероидов, сурамина, тазонермина, тазаротена, тегафура, темопорфина, темозоломида, тенипозида, тетрахлордекаоксида, талидомида, тималфасина, альфа-тиротропина, топотекана, торемифена, трастузумаба, треосульфана, третиноина, трилостана, триметрексата, убенимекса, вальрубицина, вертепорфина, винкристина, винбластина, виндезина и винорелбина. В предпочтительном варианте осуществления схема лечения рака содержит применение ритуксимаба. В других предпочтительных вариантах осуществления схема лечения рака содержит применение мелфалана или преднизона или комбинации мелфалана и преднизона.
В некоторых вариантах осуществления схема лечения рака представляет собой комбинированную терапию. Комбинированная терапия может содержать лечение ингибитором протеосом и еще одну противораковую терапию или применение еще одного противоракового агента. В некоторых вариантах осуществления другой противораковый агент представляет собой моноклональное антитело, например ритуксимаб. В других вариантах осуществления другой противораковый агент представляет собой мелфалан, преднизон или комбинацию мелфалана и преднизона.
Благоприятным исходом может быть общая частота ответа, общий уровень выживаемости, общая частота полного ответа, продолжительность ответа, более продолжительное время до следующей терапии, продолжительность периода без лечения, положительный ответ на лечение, более продолжительное время до прогрессирования заболевания, более продолжительный период выживаемости и/или более продолжительная выживаемость без прогрессирования заболевания. Благоприятный исход может зависеть от дозы или не зависеть от дозы. Благоприятный исход может быть благоприятным по сравнению с отсутствием лечения или по сравнению с другой схемой или схемами лечения рака.
Термины «рак» или «опухоль» включают в себя любые формы новообразований в организме пациента, в том числе первоначальную опухоль и любые метастазы. Рак может быть гематологическим или принимать форму солидной опухоли. Гематологические формы рака включают в себя, например, миеломы (например, множественная миелома), лейкозы (например, макроглобулинемия Вальденстрема, острый миелобластный лейкоз, хронический лимфоцитарный лейкоз, гранулоцитарный лейкоз, моноцитарный лейкоз, лимфоцитарный лейкоз) и лимфомы (например, фолликулярная лимфома, лимфома из клеток мантии, диффузная В-крупноклеточная лимфома, лимфосаркома, плазмоцитома, ретикулосаркома, болезнь Ходжкина, неходжкинская лимфома или фолликулярная В-клеточная неходжкинская лимфома). Солидные опухоли могут возникать в различных органах и включают в себя такие формы рака, как рак головного мозга, рак кожи, рак легких, рак молочной железы, рак простаты, рак яичников, рак толстой кишки, рак почек и рак печени. Рак может быть в первичном месте, в форме метастазов, резистентным (то есть устойчивым по отношению к одной или более линиям терапии) и/или рецидивным. В некоторых вариантах осуществления рак представляет собой фолликулярную В-клеточную неходжкинскую лимфому или множественную миелому.
Если в организме пациента присутствует прогностический фактор, его присутствие, отсутствие или количество можно оценить путем взятия биологической пробы у пациента и определения того, содержит ли указанная биологическая проба прогностический фактор или в каком количестве указанная биологическая проба содержит прогностический фактор. Используемый в настоящем документе термин «биологическая проба» относится к образцу, содержащему или состоящему из тканей, клеток, биологических жидкостей и их изолятов, взятых у субъекта, а также тканей, клеток и жидкостей, присутствующих в организме субъекта. Примеры биологических проб включают в себя, например, мокроту, кровь, клетки крови (например, лейкоциты), амниотическую жидкость, плазму, сыворотку, сперму, слюну, костный мозг, ткань или пробы тонкоигольной биопсии, мочу, перитонеальную жидкость, плевральную жидкость и клеточные культуры. Биологические пробы также могут включать в себя срезы тканей, например, замороженные срезы, взятые для гистологического исследования. В некоторых вариантах осуществления биологическая проба может представлять собой или включать в себя клетки опухоли. Биологические пробы из гематологической опухоли могут включать в себя костный мозг и/или периферическую кровь.
Обнаружение прогностических факторов в биологической пробе можно проводить любым стандартным способом обнаружения такого рода прогностического фактора, например путем прямого измерения, иммуногистохимического анализа, иммуноблоттинга, иммунофлуоресценции, иммуноабсорбции, иммуноосаждения, белкового чипа, флуоресцентной гибридизации in situ, анализа FACS, гибридизации, гибридизации in situ, Нозерн-блоттинга, Саузерн-блоттинга, Вестерн-блоттинга, ИФА, радиоиммуноанализа, генного чипа, ПЦР, ОТ-ПЦР или цитогенетического анализа.
Если прогностический фактор основан на конкретном генотипе или полиморфизме, биологическую пробу можно анализировать генотипированием. Термин «генотип» относится к аллелям, присутствующим в ДНК субъекта или пациента, причем такой аллель может определяться конкретным(-и) нуклеотидом(-ами), присутствующим(-и) в последовательности нуклеиновой кислоты в конкретном(-ых) сайте(-ах). Генотипом часто оказывается(-ются) нуклеотид(-ы), присутствующие в одном полиморфном сайте, который варьируется в человеческой популяции. «Генотипированием» называют процесс определения генотипа человека с помощью биологического анализа. К современным методам такого анализа относятся ПЦР, секвенирование ДНК, зонды на основе антисмысловых олигонуклеотидов и гибридизация на микрочипах или гранулах ДНК.
«Однонуклеотидный полиморфизм» (SNP, произносится «снип») представляет собой вариацию последовательности ДНК, при которой наблюдаются отличия одного нуклеотида - A, T, C или G - в геноме (или иной общей последовательности) между представителями вида (или между парными хромосомами отдельного человека). Например, две последовательности фрагментов ДНК различных людей - AAGCCTA и AAGCTTA - содержат различие по одному нуклеотиду. В этом случае говорят, что существует два аллеля: C и T. Почти все распространенные SNP имеют всего два аллеля.
Для выявления присутствия или отсутствия по меньшей мере одной вариации генотипа используют взаимодействие последовательности нуклеиновой кислоты, соответствующей одному из генов, определенных в настоящем документе, или продукта такого гена, с зондом. Зонд способен различать конкретную форму гена или генетического продукта, или присутствие конкретной вариации или вариаций, например, за счет дифференциального связывания или гибридизации.
Если прогностическим фактором является присутствие или количество (в том числе уровень экспрессии) конкретного гена или белка, такое присутствие или количество (в том числе уровень экспрессии) можно определять иммуногистохимическим анализом биологической пробы.
В некоторых вариантах осуществления предложен набор для выявления пациентов, которые являются кандидатами на проведение схемы лечения рака, содержащий первый реагент для определения присутствия или количества одного из прогностических факторов настоящего изобретения в биологической пробе и второй реагент для определения присутствия или количества второго прогностического фактора настоящего изобретения в биологической пробе, а также инструкцию по применению прогностических факторов для выявления пациентов, которые являются кандидатами для проведения указанного лечения. В некоторых вариантах осуществления первый реагент определяет количество CD68, а второй реагент определяет полиморфизм PSMB1 (P11A) или полиморфизм PSMB5 (R24C). Реагенты могут представлять собой антитела (например, при тестировании CD68), или они могут представлять собой зонды или наборы зондов (например, при обнаружении полиморфизма генов).
В некоторых вариантах осуществления предложен способ лечения рака у пациента, содержащий: определение присутствия или количества первого прогностического фактора у пациента или в биологической пробе указанного пациента; и определение присутствия или количества второго прогностического фактора у указанного пациента или в биологической пробе указанного пациента; и выбор способа лечения в зависимости от вероятности ответа указанного пациента на указанное лечение.
Настоящее изобретение также предлагает варианты использования ингибиторов протеосом для лечения рака у пациента, где пациент характеризуется присутствием, отсутствием или количеством по меньшей мере одного прогностического фактора, коррелирующего с по меньшей мере одним положительным исходом в ответ на применение ингибитора протеосом.
Все цитируемые в настоящем документе публикации включены в него путем ссылки. Все технические и научные термины, используемые в настоящем документе, если не указано иное, имеют общепринятое значение, понятное любому специалисту, работающему в области, к которой относится данное изобретение.
ПРИМЕР 1
К неходжкинским лимфомам (NHL) относятся несколько отдельных злокачественных лимфоидных заболеваний, которые различаются по клиническим характеристикам, морфологическим проявлениям, иммунологическим и молекулярным фенотипам. Фолликулярная лимфома (FL), наиболее распространенная вялотекущая NHL, демонстрирует схожую вариабельность, при этом у некоторых пациентов заболевание развивается очень медленно, тогда как у других заболевание прогрессирует и приводит к смерти в течение всего 5 лет (Dave 2004). Проводилось рандомизированное открытое многоцентровое международное проспективное исследование с активным контролем по сопоставлению эффективности и безопасности комбинации бортезомиба и ритуксимаба (Vc-R) с монотерапией ритуксимабом у субъектов с рецидивом или резистентной фолликулярной В-клеточной NHL, ранее не получавших ритуксимаб или чувствительных к ритуксимабу.
Субъектов централизованно случайным образом распределили по группам лечения A (Vc-R) или B (ритуксимаб) в соотношении 1:1 с учетом следующих факторов стратификации:
- показатель Международного прогностического индекса для фолликулярных лимфом (FLIPI) (низкий [0 или 1 фактор], промежуточный [2 фактора], высокий [≥3 факторов]);
- предшествующая терапия ритуксимабом (да, нет);
- время после последней дозы противолимфомной терапии (≤1 года, >1 года);
- регион (Соединенные Штаты Америки/Канада, Европейский Союз, остальные страны).
Собирали пробы опухоли для анализа ДНК и белков, а также образцы крови для анализа ДНК.
Выбранными белками-кандидатами были NF-κB (RELA/p65), PSMA5, p27 и CD68. Активность перечисленных белков снижается при лечении бортезомибом (NF-κB (RELA/p65); PSMA5, p27), регулируется по каналу убиквитин-протеосома (p27) или ассоциируется с неблагоприятным прогнозом по лимфоме (CD68). Повышенные уровни экспрессии NF-κB (RELA/p65) ассоциировали с более продолжительным временем до прогрессирования заболевания (TTP) при лимфоме из клеток мантии (MCL) и при множественной миеломе (Goy 2010, Mulligan 2007 и Keats 2007). Более низкий уровень экспрессии PSMA5 связали с более продолжительным TTP при MCL (Goy 2010). Анализ выживаемости в исследовании MCL также показал, что более высокие уровни p27 коррелировали с более высокой общей выживаемостью (OS) (Goy 2010). CD68 также рассматривался ранее и, как недавно было показано, является прогностическим маркером для неблагоприятного исхода при лимфоме, а также ассоциируется с ответом на терапию ритуксимабом. Генами-кандидатами, выбранными для анализа соматических мутаций, были Bcl-2 и Notch-1. Рассматривали и других кандидатов, но их не включили в исследование, поскольку частота их известных мутаций при проявлениях лимфомы была менее 10%. Кроме того, из собранных проб выделяли лишь небольшие количества ДНК, поэтому анализ ограничили упомянутыми двумя кандидатами. Ген Bcl-2 имеет частоту мутаций 23% при В-клеточной лимфоме и 50% при фолликулярной лимфоме (Arif 2009), а частота мутаций гена Notch-1 составляет 24%. Bcl-2 представляет собой важный антиапоптозный белок с повышенным уровнем экспрессии при агрессивных лимфомах, и ранее проведенные исследования показывают, что бортезомиб преодолевает опосредованную Bcl-2 защиту (Fischer 2005, Yin 2005, Yeung 2006, Mitsiades 2002 и Wojcik 2002). Известно, что Notch-1 увеличивает время пребывания NF-κB (RELA/p65) в ядре (Shin 2006). Такое действие прямо противоположно бортезомибу, который не позволяет NF-κB достигать ядра, ингибируя протеосомное разрушение белков I-kappa-B, роль которых заключается в удержании NF-κB в цитоплазме. Опосредованное Notch-1 повышенное время пребывания NF-κB в ядре активирует транскрипцию регуляторов клеточного цикла, например, циклинов D1 и D2, что может способствовать повышенной регуляции генов, задействованных в иммунных и воспалительных процессах (Karin 2002). Было предположено, что мутации, обнаруженные в функциональных последовательностях этих двух генов, способствуют различиям в индивидуальных ответах на лечение бортезомибом.
Также включили гены-кандидаты мишеней для лекарственного средства, как для бортезомиба (PSMB1, 2, 5, 6, 8, 9), так и для ритуксимаба (FCGR2A, FCGR3A). Химическая структура бортезомиба обеспечивает его взаимодействие с субъединицами 1, 2 и 5 PSMB, и существуют подтвержденные свидетельства полиморфизма в таких субъединицах, а также в субъединицах 6, 7 и 8 PSMB. Полиморфизм в субъединицах может влиять на способность лекарственного средства к эффективному связыванию, или же может препятствовать автокаталитической трансформации пропоследовательностей, что может повлечь за собой вариабельность в уровнях протеосом и/или ответа на бортезомиб у разных пациентов. В случае ритуксимаба присутствие однонуклеотидных полиморфизмов (SNP), соответствующих фенотипической экспрессии валина (V) или фенилаланина (F) на аминокислоте 158 в FCGR3A, а также гистидина (H) или аргинина (A) на аминокислоте 131 в FCG2A, существенно влияет на аффинность IgG к рецептору Fcγ (Binstadt 2003, Wu 1997). Экспрессия высокоаффинного аллеля V в положении 158 приводит к более прочному связыванию FCG3A с IgG1 и IgG3, тогда как низкоаффинный аллель F ассоциируется с более слабым связыванием FCG3A с IgG. Аналогичным образом, высокоаффинный аллель H в положении 131 приводит к более высокой аффинности FCGR2A к IgG2, тогда как низкоаффинный аллель A коррелирует со снижением эффективности связывания. Корреляция таких низкоаффинных полиморфизмов ассоциировалась с худшим клиническим ответом и более низкой выживаемостью без прогрессии заболевания (PFS) после терапии ритуксимабом при исследованиях NHL (Cartron 2002). Поэтому был проведен анализ возможности ответа субъектов с такими полиморфизмами на лечение с использованием комбинированной терапии Vc-R, поскольку это может стать альтернативной терапией для пациентов с ограниченными вариантами лечения.
Цели этого исследования заключались в том, чтобы выявить популяции пациентов, которые с большей или меньшей вероятностью ответили бы на лечение Vc-R или на монотерапию ритуксимабом, для чего:
- проводили ассоциативный анализ уровней экспрессии белков CD68, NF-κB (RELA/p65), PSMA5 и p27 с выбранными конечными точками клинических исследований;
- проводили ассоциативный анализ соматических мутаций Notch-1 и Bcl-2 (отдельно и в комбинации) с выбранными конечными точками клинических исследований;
- проводили ассоциативный анализ полиморфизмов FCGR2A и FCGR3A (SNP) с выбранными конечными точками клинических исследований;
- полиморфизмов PSMB1, PSMB2, PSMB5, PSMB6, PSMB8 и PSMB9 (SNP) с выбранными конечными точками клинических исследований;
- проводили исследование комбинаций биомаркеров с выбранными конечными точками клинических исследований.
Поправки для множественных сравнений проводили с использованием уровня ложноположительных результатов (FDR) для парных сравнений и путем ускоренного отбора при сравнении комбинаций множества биомаркеров. С практической точки зрения FDR представляет собой ожидаемую долю ложноположительных результатов; например, если прогнозируется расхождение 1000 наблюдений, и FDR для этих наблюдений составляет 0,10, то ожидается, что 100 из этих наблюдений будут ложноположительными. Чрезмерно близкую подгонку контролировали путем перекрестной проверки и независимой внутренней проверки результатов анализа.
Гены с существенными вариациями включают в себя:
FCGR2A (H166R, Q62R, Q62X)
FCGR3A (V212F)
PSMB1 (P11A)
PSMB5 (R24C)
PSMB8 (G8R)
PSMB9 (R60H, V32I)
PSMA (положительный для окрашивания ядра и цитоплазмы)
CD68 (общий положительный, положительный для фолликулярных клеток, положительный для перифолликулярных клеток)
P27 (положительный для ядра, шкала интенсивности)
RELA/p65 (положительный для окрашивания ядра и цитоплазмы, шкала интенсивности).
Популяцию в соответствии с назначенным лечением (ITT) определяли как совокупность всех рандомизированных субъектов. Результаты для субъектов в этой популяции анализировали в соответствии со схемой лечения, для которой они были рандомизированы. Оценку биомаркеров в данной популяции проводили после подготовки данных по биомаркерам для выбранных конечных точек клинического исследования.
Уровни экспрессии белковых маркеров (CD68, NF-κB (P65), PSMA5, P27) определяли иммуногистохимическим анализом (IHC). Для анализов единичных маркеров использовали следующие точки отсечения по уровню экспрессии:
CD68:
% положительный фолликулярный (0-25, 26-50, 51-75, >75),
% положительный перифолликулярный (0-25, 26-50, 51-75, >75),
общий % положительный (0-25, 26-50, 51-75, >75)
NF-κB (p65):
% положительный цитоплазматический сигнал (отсечение <90%, >91%),
% положительный ядерный сигнал (0, <5%, >5%)
интенсивность ядерного окрашивания (<1+, >2+)
PSMA5:
% положительный цитоплазматический сигнал (0-20, 30-50, 60-70, 80-90)
% положительный ядерный сигнал (0-20, 30-50, 60-70, 80-90)
интенсивность цитоплазматического окрашивания (<2+, 3+)
положительный ядерный по сравнению со всеми остальными
P27:
% положительное ядерное окрашивание (0-20, 30-50, 60-70, 80-100)
интенсивность ядерного сигнала (<1+, >2+)
Точки отсечения для парных сравнений выбирали для уменьшения общего числа проводимых сравнений. Выбранные точки отсечения приведены в таблице 1:
| Таблица 1Точки отсечения для белковых маркеров, включенных в парные сравнения | |
| Белковый маркер | Точка отсечения |
| 20S (PSMA5) % ядерное окрашивание | ≤20 против >20 |
| 20S (PSMA5) % положительный цитоплазматический сигнал | ≤90 против >90 |
| Интенсивность цитоплазматического сигнала 20S | ≤2+ против >2 |
| CD68 общий положительный | ≤50 против >50 |
| CD68 положительный фолликулярный | ≤50 против >50 |
| CD68 положительный перифолликулярный | ≤50 против >50 |
| P27 % положительный ядерный | ≤70 против >70 |
| Интенсивность сигнала P27 | ≤1+ против >1 |
| P65 (NF-κB) % ядерное окрашивание | 0 против >0 |
| P65 (NF-κB) % положительный цитоплазматический сигнал | ≤90% против >90% |
| Интенсивность цитоплазматического сигнала P65(NF-κB) | ≤1+ против >1 |
Данные зародышевого SNP для субъединиц PSMB и генов FCGR2A и FCGR3A получали с помощью стандартных методик полимеразной цепной реакции (ПЦР). Обнаруженные в ходе этих анализов аллели приведены в таблице 2:
| Таблица 2Аллели субъединиц PSMB и генов FCGR2A и FCGR3A | |||||||
| FCGR2A | FCGR3A | PSMB1 | PSMB2 | PSMB5 | PSMB6 | PSMB8 | PSMB9 |
| H166R(такжеH131R) | D118N | A171S | E49X | L206M | A234D | G8R | G9E |
| P273L | D183G | I208N | G187V | R24C | P107A | R141C | R60H |
| Q62R | E63V | P11A | L159F | - | - | V182M | V32I |
| Q62X | H194Y | P193L | - | - | - | - | - |
| V217I | L102R | - | - | - | - | - | - |
| - | L281F | - | - | - | - | - | - |
| - | R270X | - | - | - | - | - | - |
| - | S231A | - | - | - | - | - | - |
| - | S72R | - | - | - | - | - | - |
| - | V142I | - | - | - | - | - | - |
| - | V212F (также V158F) | - | - | - | - | - | - |
Для каждой группы лечения в анализ включали перечисленные ниже конечные точки клинических исследований и проводили общее сравнение с ассоциированными с биомаркерами конечными точками: выживаемость без прогрессирования заболевания, определяемая как промежуток времени между датой рандомизации и датой прогрессирования заболевания (PD) или смерти, в зависимости от того, какой исход был зафиксирован первым в ITT-популяции; общая выживаемость; общая частота ответа (полный ответ [CR] + неподтвержденный CR [CRu] + частичный ответ [PR]); общая частота CR (CR + CRu); продолжительность ответа; время до следующей противолимфомной терапии; и перерыв между проведением терапии.
В анализ включали субъектов, которые соответствовали всем перечисленным ниже критериям: субъекты из ITT-популяции; субъекты с допускающими количественный анализ данными по биомаркеру, полученными с помощью иммуногистохимического анализа или ПЦР; и субъекты с клиническими данными для по меньшей мере одной из перечисленных выше конечных точек клинического исследования.
Первичный анализ биомаркеров был направлен на выявление дифференциально экспрессируемых белков, мутаций или генотипов, которые связывали с конечными точками клинического исследования. В анализ включали следующие коварианты: индекс FLIPI (низкий [0 или 1 фактор], промежуточный [2 фактора], высокий [≥3 факторов]); предшествующая терапия ритуксимабом (да, нет); время после последней дозы противолимфомной терапии (≤1 года, >1 года); регион (США/Канада, Европейский союз, остальной мир), возраст, пол, раса, стадия по классификации Анн Арбор (I, II, III, IV), количество проведенных ранее линий терапии (1, 2 и более) и высокая опухолевая нагрузка (да, нет).
Для ассоциативных анализов единичных маркеров и парных сравнений использовали логранговый критерий и модель пропорциональных рисков Кокса для оценок PFS, TTP и OS между группами лечения. Для оценки различий распределения между группами при анализе времени до наступления события использовали кривые Каплана-Мейера. Сравнение частоты ответа между группами лечения проводили с использованием точного критерия Фишера. Ассоциативные анализы единичных маркеров стратифицировали по ковариантам.
Для анализа при парном сравнении пары биомаркеров формировали комбинациями двух маркеров. Для оценки PFS, TTP и OS между группами лечения в подпопуляции, определяемых парами биомаркеров, использовали логранговый критерий. Для оценки различий распределения между группами при анализе времени до наступления события использовали кривые Каплана-Мейера. Сравнение частоты ответа между группами лечения проводили с использованием точного критерия Фишера. Способы анализа для моделей сравнения множества биомаркеров приведены в разделе 4.6.
Для каждого анализа следующим образом готовили сводную информацию по демографическим и базовым характерным переменным для популяции данного биомаркера. Рассчитывали описательные статистические характеристики (среднее, стандартное отклонение, медиана и интервал) для базовых демографических данных (в том числе: возраст (лет), возрастная категория (>65 лет и ≤65 лет), пол (мужской, женский), раса (европеоидная, монголоидная/тихоокеанская и негроидная/другая), индекс FLIPI (низкий [0 или 1 фактор], средний [2 фактора], высокий [≥3 факторов]); предшествующая терапия ритуксимабом (да, нет); время после последней дозы противолимфомной терапии (≤1 года, >1 года); стадия по Анн Арбор (I, II, III, IV), количество ранее проведенных линий терапии (1, 2 и более), высокая опухолевая нагрузка (да, нет) и регион (США/Канада, Европейский союз, остальной мир) и сравнивали их со сводными статистическими данными из наборов данных по клиническим испытаниям.
Для оценок PFS между группами лечения использовали стратифицированный логранговый критерий и модель пропорциональных рисков Кокса. Для оценки распределения общих PFS для каждой группы лечения в популяции биомаркера и в целом использовали способ Каплана-Мейера; со стратификацией по уровню экспрессии, SNP или мутации (или приведенным выше группам ковариантов). Отношение рисков и 95%-ный доверительный интервал рассчитывали на основе стратифицированной модели пропорциональных рисков Кокса, учитывая группу лечения как объясняющую переменную. Анализы проводили для всей популяции в целом и по г