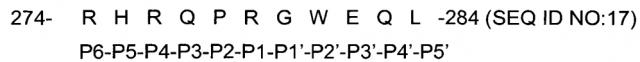Рекомбинантный иммунотоксин, нацеленный на мезотелин
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к усовершенствованному рекомбинантному иммунотоксину для клеток, экспрессирующих мезотелин. Заявленный иммунотоксин представляет собой слитый белок, включающий антитело к мезотелину и фрагмент экзотоксина Pseudomonas, который модифицирован так, чтобы снизить его иммуногенность и чувствительность к протеазам. Иммунотоксин может быть использован в способе лечения рака, сверхэкспрессирующего мезотелин. Изобретение обеспечивает повышенную цитотоксичность иммунотоксина в отношении клеток, которые экспрессируют мезотелин. 6 н. и 15 з.п. ф-лы, 9 ил., 4 табл., 2 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет предварительной заявки на патент США №61/483531, поданной 6 мая 2011 г., которая включена в настоящий документ посредством ссылки во всей полноте.
ЗАЯВЛЕНИЕ О ПРАВАХ НА ИЗОБРЕТЕНИЯ, СДЕЛАННОЕ В РАМКАХ НИОКР, ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА
НЕТ ДАННЫХ
ССЫЛКА НА ПРИЛОЖЕНИЕ «ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ», ТАБЛИЦУ ИЛИ СПИСОК КОМПЬЮТЕРНЫХ ПРОГРАММ, ПРЕДСТАВЛЕННЫЕ НА КОМПАКТ-ДИСКЕ
НЕТ ДАННЫХ
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Рекомбинантные иммунотоксины (RIT) - это искусственно созданные лечебные белки, в которых соединены фрагмент антитела и цитотоксический белок, полученный из бактериального или растительного источника. RIT созданы в качестве селективных агентов для целенаправленного уничтожения клеток без проявления множественной вторичной токсичности, характерной для химиотерапевтических стратегий. RIT для лечения раковых заболеваний могут быть сконструированы путем слияния вариабельного фрагмента (Fv) антител против опухолевых антигенов клеточной поверхности с фрагментом экзотоксина А Pseudomonas (РЕ). RIT с использованием 38-кДа фрагмента экзотоксина А Pseudomonas (PE38) имели определенный успех в клинических испытаниях, но имели также ограничения, которые включали плохое проникновение в твердые опухоли, высокую иммуногенность и неспецифическую токсичность (Kreitman RJ et al., Clin Cancer Res., 15(16):5274-9 (2009; Hassan R et al., Clin Cancer Res., 13(17):5144-9 (2007); Wayne AS et al., Clin Cancer Res., 16(6):1894-903 (2010); Kreitman RJ et al., J Clin Oncol., 27(18):2983-90 (2009); Sampson JH et al., Neuro Oncol., 10(3):320-9 (2008); Powell DJ Jr et al., J Immunol., 179(7):4919-28 (2007); Kreitman RJ, J Clin Oncol., 23(27):6719-29 (2005); Pal LH et al., Nat Med., 2(3):350-3 (1996)).
В стремлении улучшить результат лечения с использованием RIT важную роль для понимания строения этих белков играет знание пути токсического действия РЕ. RIT проникают в клетки путем рецептор-опосредованного эндоцитоза и транспортируются через эндолизосомальную систему в аппарат Гольджи, где они подвергаются обратному транспорту в эндоплазматический ретикулум (ER). Во время этого этапа токсин активируется за счет восстановления дисульфидной связи и расщепления протеазой фурином в определенном участке РЕ38, который отделяет Fv от фрагмента РЕ. Впоследствии активированный РЕ должен перемещаться в цитозоль, где он осуществляет АДФ-рибозилирование и инактивацию фактора элонгации 2, необходимого элемента трансляционного аппарата. Это останавливает синтез белка и в конечном итоге приводит к гибели клетки (обзор о пути токсического действия РЕ см. в 9). Предыдущие стратегии, направленные на улучшение цитотоксической активности RIT на основе РЕ, включали замену C-концевых остатков РЕ, REDLK (SEQ ID NO:15), на канонический сигнал возвращения в ER KDEL (SEQ ID NO:16) (Seetharam S et al., J Biol Chem., 266(26):17376-81 (1991); Du X, Но M, and Pastan I, J Immunother., 30(6):607-13 (2007); Rozemuller H. et al., Int J Cancer., 92(6):861-70 (2001); Kreitman RJ and Pastan I., Biochem J., 307 (Pt 1):29-37 (1995)). Известно, что это изменение повышает цитотоксичность РЕ, предположительно, за счет повышения эффективности ретроградного транспорта в ER из аппарата Гольджи. Эта стратегия эффективна, но, как правило, повышает также и неспецифическую токсичность RIT. Еще одна стратегия заключается в повышении эффективной интернализации комплекса RIT-рецептор, и увеличении тем самым количества токсина в клетке, за счет улучшения сродства между Fv и его мишенью (Salvatore G et al., Chn Cancer Res., 8(4):995-1002 (2002); Decker Т et al., Blood., 103(7):2718-26 (2004)).
Недавно был разработан протеазоустойчивый RIT, выдерживающий деградацию в эндолизосомальной системе, потенциальный барьер для эффективного лечения иммунотоксинами (Johannes L and Decaudin D, Gene Ther., 12(18):1360-8 (2005); Fitzgerald D. Why toxins Semin Cancer Biol., 7(2):87-95 (1996)). Этот «устойчивый к лизосомальной деградации» (LR) вариант RIT был получен путем удаления протеазочувствительных районов РЕ38 и направлением их на B-клеточный рецептор CD22 с использованием высокоаффинного Fv против CD22, полученного из RIT HA22 (Weldon JE, Blood., 113(16):3792-800 (2009)). Мутация LR практически не влияла на активность in vitro на клеточных линиях, но значительно понизила неспецифическую токсичность на мышах и резко повысила активность in vitro на клетках, полученных от пациента с хроническим лимфолейкозом (CLL). Кроме того, в варианте LR устранены две основные группы B-клеточных эпитопов у мышей (Onda M et al., J Immunol., 177(12):8822-34 (2006)) и участки процессинга антигена из РЕ38, что помогает уменьшить его иммуногенность у мышей (Hansen JK et al., J Immunother., 33(3):297-304 (2010)). Благодаря модульной природе RIT, вариант LR из РЕ может быть направлен на другие ассоциированные с опухолью антигены путем замены одного Fv на другой. Соответственно, предшествующий уровень техники, описывающий уменьшение доменов II и Ib РЕ, в общем показывает преимущества удаления протеазочувствительных и антигенных сайтов из молекулы. Уровень техники также демонстрирует фармакокинетические преимущества меньших RIT, что является следствием этих изменений.
Клинически значимым кандидатом-мишенью является ассоциированный с опухолью антиген мезотелин, который часто экспрессируется на высоком уровне при раковых заболеваниях, которые включают мезотелиомы и рак легких, яичников и поджелудочной железы. Соответственно, существует потребность в усовершенствованных RIT, которые специфически поражают раковые клетки, которые экспрессируют мезотелин на их поверхности. Данное изобретение обеспечивает эти и другие потребности, предоставляя RIT, фармацевтические композиции и способы лечения раковых опухолей, которые экспрессируют или сверхэкспрессируют мезотелин.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает усовершенствованный экзотоксин А Pseudomonas («РЕ») с уменьшенной иммуногенностью, улучшенной устойчивостью к лизосомальным протеазам и повышенной цитотоксичностью для клеток, экспрессирующих мезотелин. Структурно у усовершенствованного РЕ изобретения удален домен I РЕ, удалена большая часть домена II РЕ, и имеется функциональный домен III РЕ необязательно с замещением а) аминокислотных остатков домена III РЕ в позициях D406, R432, R467, R490, R513, Е548, K590 и/или Q592 на глицин, аланин или серин, и/или б) аминокислотных остатков домена III РЕ в позициях D403, R412, R427, Е431, R458, D461, R505, Е522, R538, R551, R576 и/или L597 на глицин, серин или аланин. Усовершенствование заключается во введении короткого и гибкого пептидного линкера («FL») от 3 до 8 аминокислот в длину, состоящего из остатков глицина и/или серина, введенного между сайтом расщепления фурином и функциональным доменом III РЕ улучшенного РЕ. Соответственно, короткий линкер состоит из остатков глицина и/или серина. В некоторых вариантах осуществления изобретения линкер представляет собой пептид формулы (Хаа1)n, где каждый Хаа1 независимо выбирают из глицина и серина, и n составляет от 3 до 8. Усовершенствованные молекулы РЕ изобретения сохраняют высокую цитотоксическую активность с удалением B-клеточных эпитопов. Неожиданно оказалось, что включение короткого гибкого линкера повышает цитотоксичность молекулы без существенного изменения расщепления молекулы фурином. Усовершенствованные молекулы РЕ проиллюстрированы частными вариантами осуществления изобретения, представленными здесь как (LR/FL/8X, SEQ ID NO:4) и LR/FL/8M (SEQ ID NO:5). Кроме того, существуют варианты осуществления, в которых молекулы РЕ имеют одну или более мутаций в их функциональном домене III, как показано в SEQ ID NO:4 или 5, по сравнению с функциональным доменом РЕ из SEQ ID NO:1. В других вариантах осуществления имеются дополнительные замены в одном или более остатках, соответствующих 609-613 из SEQ ID NO:1, которые, как предполагают, также функционируют для удержания в эндоплазматическом ретикулуме нативной последовательности. В других вариантах осуществления сайт расщепления фурином домена II РЕ модифицирован или заменен другим сайтом расщепления фурина.
В некоторых вариантах осуществления также в соответствии со всем вышеописанным РЕ содержит функциональный домен III, который имеет одну или более мутаций в функциональной области токсина РЕ из SEQ ID NO:2 (позиции с 12 до 230), или выбранных из следующей таблицы, которые удаляют один или несколько эпитопов домена III РЕ:
| Удаляемый эпитоп | Мутации |
| 2 | R467A |
| 4 | R432G, D406A |
| 5 | R490A |
| 6 | Е548А, R513A |
| 7 | K590S, Q592A |
| *Эпитопы описаны, например, в работе Onda, et al., Proc Natl Acad Sci USA. 2008 105(32):11311-6 и в WO 2007/016150. |
В близком аспекте изобретения предложены рекомбинантные иммунотоксины («RIT изобретения»), которые являются химерными молекулами, включающими (а) группу, направленную на мезотелин, конъюгированную или слившуюся с (б) модифицированным экзотоксином A Pseudomonas («РЕ»), как указано выше. В некоторых вариантах осуществления группа представляет собой антитело, выбранное из группы, состоящей из scFv, dsFv, Fab, однодоменного антитела и F(ab′)2, или полипептид, включающий CDR антитела. SS1 и MORab-009 являются предпочтительными направляющими группами. Кроме того, антитело к мезотелину может содержать вариабельную тяжелую цепь («VH») и вариабельную легкую цепь («VL»), причем каждая из цепей VH и VL содержит первую, вторую и третью области, определяющие комплементарность («CDR»), в которых первая CDR («CDR1»), вторая CDR («CDR2»), и третья CDR («CDR3») указанной тяжелой цепи соответственно имеют последовательность аминокислотных остатков, показанную для CDR1 (GYTMN, SEQ ID NO:51), CDR2 (LITPYNGASSYNQKFRG; SEQ ID NO:52), и CDR3 (GGYDGRGFDY; SEQ ID NO:53), и в которых CDR1, CDR2 и CDR3 указанной VL цепи соответственно имеют последовательность аминокислотных остатков, показанную для CDR1 (SASSSVSYMH; SEQ ID NO:54), CDR2 (DTSKLAS; SEQ ID NO:55), и CDR3 (QQWSGYPLT; SEQ ID NO:56). В некоторых вариантах осуществления CDR3 легкой цепи модифицирована и имеет последовательность QQWSKHPLT (SEQ ID NO:57), QQWSGHPLT (SEQ ID NO:58), QQWSAHPLT (SEQ ID NO:59), QQWSQIPLT (SEQ ID NO:60), QQWGFNPLT (SEQ ID NO:61), QQWGTNPLT (SEQ ID NO:62), QQWGSHPLT (SEQ ID NO:63), QQWGDFPLT (SEQ ID NO:64), QQWGDHPLT (SEQ ID NO:65), QQWSAHPLT (SEQ ID NO:66) или QQWSGYPTT (SEQ ID NO:67). В некоторых других вариантах осуществления антитело к мезотелину представляет собой scFv, dsFv, Fab или F(ab′)2. В некоторых других вариантах осуществления изобретения антитело к мезотелину для использования в RIT включает аминокислотную замену по меньшей мере одной аминокислоты в CDR, выбранной из группы, состоящей из VL CDR1, VL CDR2, VH CDR1 и VH CDR2, причем указанная аминокислота кодируется кодоном, который содержит нуклеотид, принадлежащий мотиву «горячей точки», выбранный из группы AGY или RGYW, где R представляет собой А или G, Y представляет собой С или Т, и W представляет собой А или Т.
В другом аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим
(а) RIT изобретения, как указано выше, и (б) фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к выделенным нуклеиновым кислотам, кодирующим модифицированный экзотоксин А Pseudomonas («РЕ»), FL или RIT, описанным выше. В некоторых вариантах осуществления нуклеиновая кислота далее кодирует все антитело, направленное на мезотелин, или его фрагмент (вариабельную легкую или тяжелую цепь или CDR).
Соответственно, первая группа вариантов осуществления изобретения относится к выделенным модифицированным экзотоксинам A Pseudomonas ("PE"s), содержащим непрерывную полипептидную последовательность со следующей формулой: FCS-FL-функциональный домен III РЕ или L1-FCS-FL-функциональный домен III РЕ, где L1 состоит из непрерывной последовательности пептида от 1 до 10 аминокислотных остатков в длину; FCS представляет собой сайт или последовательность расщепления фурином (например, RHRQPRGWEQL; SEQ ID NO:17), или другую последовательность, которая расщепляется фурином; FL представляет собой последовательность пептида гибкого линкера, содержащую от 3 до 8 аминокислотных остатков, независимо выбранных из глицина и серина; функциональный домен III РЕ включает остатки 395-613 из SEQ ID NO:1, необязательно содержащие (i) замещения в одном или более остатках, соответствующих 609-613 из SEQ ID NO:1, (ii) замещение глицина, аланина, валина, лейцина или изолейцина на аргинин в положении, соответствующем положению 490 в SEQ ID NO:1, (iii) замещение одного или более остатков, соответствующих остаткам SEQ ID NO:1, которые поддерживают иммуногенность эпитопа или субэпитопа домена III РЕ или (iv) комбинацию любого из (i) - (iii). В предпочтительных вариантах осуществления функциональный домен РЕ - это функциональный домен РЕ LR/FL/8X (SEQ ID NO:4) или LR/GGS/8M (SEQ ID NO:3).
В еще одной группе вариантов осуществления изобретения предложены химерные молекулы или RIT, включающие (а) направляющую группу или лиганд, который специфически связывается с мезотелином на поверхности клетки, конъюгированный или слившийся с (б) модифицированным экзотоксином А Pseudomonas (РЕ), как описано выше. В некоторых вариантах осуществления изобретения лиганд представляет собой антитело или его фрагмент, который сохраняет способность распознавать антиген. В предпочтительных вариантах осуществления антитела являются производными исходного антитела SS1. Предпочтительно, RIT является SS1-LR/GGS/8X, который имеет GGS FL, вставленный между FCS и функциональным доменом III. Эти RIT, соответственно, могут содержать вариабельную легкую цепь SS1 с SEQ ID NO:6 и последовательность вариабельной тяжелой цепи SS1 рекомбинантного иммунотоксина SEQ ID NO:8 или SEQ ID NO:9, где вариабельные легкая и тяжелая цепи SS1 образуют стабилизированное дисульфидными связями антитело.
В еще одной группе вариантов осуществления изобретения предложены терапевтические способы уничтожения клеток-мишеней или ингибирования роста клеток-мишеней, которые экспрессируют или сверхэкспрессируют мезотелин на поверхности клеток. Способы включают контактирование клеток с RIT изобретения. Мезотелин - это дифференцировочный антиген, присутствующий на поверхности клеток рака яичника, мезотелиом и некоторых других видов злокачественных новообразований человека. RIT согласно изобретению могут использоваться, например, in vitro или in vivo, чтобы подавить или замедлить рост рака яичников, желудка, клеток плоского эпителия, мезотелиом и других злокачественных клеток, экспрессирующих мезотелин. Предусмотрены способы лечения пациентов, имеющих эти состояния и нуждающихся в лечении с помощью RIT изобретения.
В еще одной группе вариантов осуществления изобретения предложены нуклеиновые кислоты, кодирующие мутировавшие РЕ и RIT, описанные выше.
В некоторых вариантах осуществления любого из вышеописанного гибкий линкер представляет собой GGS или GGSGGS (SEQ ID NO:18).
В других вариантах осуществления антитело выбрано из группы, состоящей из scFv, dsFv, Fab, однодоменного антитела и F(ab′)2. В некоторых других вариантах осуществления вышеописанного антитело представляет собой SS1 или модифицированное SS1 (scFv, dsFv, Fab, однодоменное антитело или F(ab′)2 антитела SS1 или фрагмент(ы), представляющий(ие) части CDR антитела SS1). В некоторых вариантах осуществления CDR антитела используют в качестве направляющей группы. В некоторых вариантах осуществления антитело является человеческим или гуманизированным. В некоторых вариантах осуществления изобретения модифицированный РЕ представляет собой LR/GGS/8M (SEQ ID NO:3) или LR/(Xaa1)n/8X (SEQ ID NO:4) или LR/(Xaa1)n/8M (SEQ ID NO:5). В некоторых других вариантах осуществления химерная молекула представляет собой SS1-LR/GGS/8X (SEQ ID NO:6 и 7) или SS1-LR/GGS/8M (SEQ ID NO:6 и 8), где их соответствующие направляющие группы включают VL и VH части антитела SS1.
Дополнительные варианты осуществления станут очевидными для специалистов и описаны в данном документе.
Соответственно, в некоторых вариантах осуществления изобретения предложена химерная молекула, содержащая фрагмент антитела к мезотелину, напрямую последовательно соединенный с первым пептидным линкером, содержащим от 3 до 8 аминокислот в длину, который непосредственно соединен в последовательности с сайтом расщепления полипептида фурином RHRQPRGWEQL (SEQ ID NO:17), который непосредственно соединен в последовательности со вторым пептидным линкером, содержащим от 3 до 6 аминокислот, выбранных из Gly и Ser, и который непосредственно соединен в последовательности с N-концевой аминокислотой функционального домена III экзотоксина A Pseudomonas. В некоторых последующих вариантах осуществления функциональный домен - это домен III LR или LR/8M, и фрагментом антитела является dsFv из SS1-LR. В некоторых вариантах осуществления первый пептидный линкер (L1) непосредственно соединен в последовательности с карбоксильным концом участка VH из dsFv. Также предложены фармацевтические композиции, содержащие химерные молекулы, а также их применение в способе лечения рака, который сверхэкспрессирует мезотелин, у субъекта, нуждающегося в этом. В последующих вариантах осуществления рак представляет собой аденокарциному легкого, рак яичника, мезотелиому или плоскоклеточный рак.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Рекомбинантные иммунотоксины. (А) Рекомбинантный иммунотоксин SS1P состоит из стабилизированных дисульфидными связями (ds) тяжелой (VH) и легкой (VL) полипептидных цепей вариабельного фрагмента (Fv) моноклонального антитела к мезотелину SS1, связанных с 38-кДа фрагментом экзотоксина A Pseudomonas (PE38) через короткий пептидный линкер (ASGG; SEQ ID NO:19) из тяжелой цепи. PE38 состоит из домена II, домена III и фрагмента домена Ib из нативного экзотоксина A Pseudomonas. Домен II включает гидрофильную петлю, ограниченную цистеинами, которые образуют дисульфидную связь, которая содержит сайт расщепления протеазой фурин (RHRQPRGWEQL; SEQ ID NO:17). (В) Вариант SS1P, устойчивый к лизосомальной деградации, SS1-LR, не имеет домена Ib и домена II РЕ, за исключением фрагмента из 11 остатков, содержащего сайт расщепления фурином из домена II. Созданы различные конструкции с мутациями (подчеркнуто) вокруг сайта расщепления фурином в SS1-LR (SEQ ID NO:20-24).
Фигура 2. Цитотоксичность SS1-LR на мезотелин-позитивных клеточных линиях. Клеточные линии L55, NCI-H322M, HAY, KB31, М30, А431/K5, OVCAR-8 и А1847 инкубировали с возрастающими концентрациями SS1P (незакрашенные кружки, сплошная линия) или SS1-LR (незакрашенные квадраты, пунктирная линия). Через 3 дня жизнеспособность клеток оценивали методом колориметрического анализа WST-8 и нормализовали между контрольными пробами, не обработанной и обработанной циклогексамидом. Показаны средние значения и стандартные ошибки для шести повторных измерений. SS1-LR содержит стабилизированную дисульфидными связями полипептидную цепь SS1 VL c SEQ ID NO:6 и полипептидную цепь SS1 VH-PE с SEQ ID NO:74.
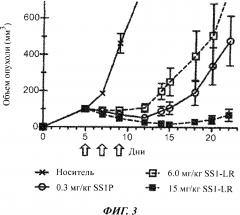
Фигура 3. Высокие дозы SS1-LR обладают сильной противоопухолевой активностью. Мышам, лишенным волосяного покрова (линии nude), с ксенотрансплантатами опухоли А431/K5 вводили внутривенно на 5, 7 и 9 сутки после имплантации буферный раствор для RIT (0,2% HSA в PBS; кресты, сплошная линия), 0,3 мг/кг SS1P (незакрашенные кружки, сплошная линия) или SS1-LR с дозой 6 мг/кг (незакрашенные квадраты, пунктирная линия) или 15 мг/кг (закрашенные квадраты, пунктирная линия). Стрелки указывают дни, когда проводилось лечение. Размер опухоли измеряли в течение 22 дней. Точки представляют средние размеры опухоли у всех мышей в группе обработки (n=6). Планки погрешностей показывают стандартное отклонение каждого среднего значения.
Фигура 4. Процессинг интернализированного иммунотоксина. Клетки А431/K5 инкубировали непрерывно с (А) SS1P или (В) SS1-LR, лизировали в различные моменты времени от 0 до 24 часов и анализировали методом невосстанавливающего электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинга с антителом к РЕ. Отмечены полосы, соответствующие полноразмерным, восстановленным и расщепленным фурином формам. (С) Интенсивность полосы, соответствующей форме, расщепленной фурином, относительно суммарной интенсивности всех полос в каждый момент времени показана для SS1P (незакрашенные кружки, сплошная линия) и SS1-LR (незакрашенные квадраты, пунктирная линия).
Фигура 5. Добавление гибкого линкера повышает цитотоксичность SS1-LR. Клеточные линии (А) KB31 и (В) NCI-H322M инкубировали с возрастающими концентрациями SS1P (незакрашенные кружки, сплошная линия), SS1-LR (незакрашенные квадраты, пунктирная линия), SS1-LR/GGS (незакрашенные ромбы, сплошная линия) или SS1-LR/GGS R279G (закрашенные шестиугольники, без линии). Через 3 дня жизнеспособность клеток оценивали методом колориметрического анализа WST-8 и нормализовали между контрольными пробами, не обработанной и обработанной циклогексамидом. Представлены средние значения и стандартные ошибки для шести повторных измерений.
Фигура 6. Цитотоксичность SS1-LR/GGS/8M на клетках пациентов. Клетки, полученные из плевральной жидкости или асцита пациентов с мезотелиомой, высевали с увеличивающимися концентрациями RIT SS1P (белая полоса) или SS1-LR/GGS/8M (серая полоса). После 4 дней клетки фиксировали и окрашивали кристаллическим фиолетовым, чтобы обнаружить интактные клетки. Полученное поглощение при 595 нм нормализовали относительно необработанной контрольной пробы. Представлены средние значения и стандартные ошибки для трех повторных измерений. Без звездочки = p>0,05; *=p<0,05; **=p<0,01; ***=p<0,001.
Фигура 7. Действие SS1-LR/GGS/8M in vivo. А) Противоопухолевая активность SS1-LR/GGS/8M. Мышам, лишенным волосяного покрова, с ксенотрансплантатом опухоли L55 внутривенно вводили на 7, 9 и 12 сутки после имплантации буферный раствор для RIT (0,2% HSA в D-PBS; кресты, сплошная линия), 0,4 мг/кг SS1P (незакрашенные кружки, сплошная линия), или SS1-LR/GGS/8M в дозе 0,4 мг/кг (незакрашенные квадраты, пунктирная линия) или 2,5 мг/кг (закрашенные квадраты, пунктирная линия). Стрелки указывают дни, когда проводилось лечение. Размер опухоли измеряли в течение 30 дней. Точки представляют средние размеры опухоли у всех мышей в группе обработки (n=7). Планки погрешностей указывают стандартное отклонение каждого среднего значения. В) Модель синдрома повышенной проницаемости капилляров на крысах. Крысам внутривенно вводили PBS, SS1P или SS1-LR/GGS/8M, наблюдали в течение 24 часов, а затем умерщвляли. Торакальную жидкость из эвтанизированных животных собирали и измеряли. Легкие нескольких крыс фиксировали, делали срезы и окрашивали гематоксилином и эозином. С) Показаны репрезентативные фотографии при 200-кратном увеличении. D) Фармакокинетика SS1-LR/GGS/8M. Мышам линии BalbC внутривенно вводили 10 мкг либо SS1P, либо SS1-LR/GGS/8M и брали кровь через определенные промежутки времени, от 2 до 60 минут после инъекции. Концентрацию иммунотоксина в сыворотке через различные промежутки времени определяли с использованием ELISA и аппроксимировали одноэкспоненциальной функцией распада. Рассчитывали соответствующий период полураспада (t1/2). Каждая точка представляет собой концентрацию иммунотоксина в сыворотке одной мыши, и концентрацию в каждый промежуток времени определяли по меньшей мере у двух различных мышей.
Фигура 8. Антигенность SS1-LR/GGS/8M для человека. Реакционную способность SS1P и SS1-LR/GGS/8M к существовавшим ранее антителам в сыворотке человека сравнивали, используя метод вытеснения, чтобы определить концентрацию, при которой два RIT уменьшали сигнал ELISA для выявления антител сыворотки на 50% (IC50). Здесь приведены относительные значения IC50 SS1P к SS1-LR/GGS/8M. Антигенность SS1-LR/GGS/8M резко понизилась по отношению к SS1P для всех сывороток.
Фигура 9. Заключение о цитотоксичности SS1-LR/GGS/8M для клеток пациентов. Зависимость относительной жизнеспособности от лечения. Клетки, полученные из плевральной жидкости или асцита у пациентов с мезотелиомой, высевали с увеличивающейся концентрацией SS1P (белая полоса) или SS1-LR/GGS/8M (серая полоса). Через 4 дня клетки фиксировали и окрашивали кристаллическим фиолетовым, чтобы обнаружить интактные клетки. Полученное поглощение при 595 нм нормализовали относительно необработанной контрольной пробы. Представлены средние значения и стандартные ошибки для трех повторных измерений. Звездочки указывают существенные различия p<0,01 (**) или p<0,001 (***).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложен менее токсичный и менее иммуногенный вариант RIT, направленных на мезотелин, на основе RIT SS1P, направленных на мезотелин, который создан на основе РЕ. Наша первоначальная оценка SS1-LR, произведенная на основе предыдущей работы с анти-CD22 RIT HA22-LR на основе РЕ (Weldon et al., Blood 113(6):3792-3800)(2009)), показала высоковариабельную активность в отношении экспрессирующих мезотелин клеточных линий in vitro. При исследовании ксенотрансплантатов опухоли А431/K5 на мышах SS1-LR (SEQ ID NO:6 и 7) был менее активен, чем SS1P, но SS1-LR мог быть введен в намного более высоких дозах для достижения значительной регрессии опухоли. При исследовании причин его высоковариабельной активности по отношению к SS1P мы изучали интернализацию и процессинг SS1-LR и обнаружили, что доля SS1-LR, расщепленного фурином, была гораздо ниже, чем у SS1P. Это позволило предположить, что пониженное расщепление фурином может ограничивать активность SS1-LR, и мы разработали и создали несколько мутантов, чтобы проверить эту гипотезу. Добавление короткого Gly-Gly-Ser линкера после сайта расщепления фурином повысило активность SS1-LR на клеточных линиях, но, на удивление, увеличенная цитотоксичность не соответствовала увеличенному расщеплению фурином. Настоящее изобретение относится к этому удивительному открытию значимости короткого гибкого линкера для цитотоксичность конструкции RIT, направленного на мезотелин, независимо от какого-либо влияния на расщепление РЕ фурином. В дальнейшей работе в SS1-LR/GGS были включены 8 точечных мутаций, на которых было показано уменьшение иммуногенности РЕ, а затем молекулу тестировали на первичных злокачественных клетках от пациентов с мезотелиомой. Конечная молекула, SS1-LR/GGS/8M (SEQ ID NO:6 и 8) демонстрировала цитотоксичность, аналогичную цитотоксичности SS1P. Кроме того, RIT в соответствии с изобретением могут обеспечить значительно сниженную неспецифическую токсичность (например, синдром повышенной проницаемости капилляров) у млекопитающих.
При использовании in vivo мышиной модели с ксенотрансплантатной опухолью A4311K5 наблюдали примерно 20-кратное различие в противоопухолевом эффекте между SS1-LR и SS1P. Это различие нельзя полностью отнести к цитотоксичности, поскольку данные in vitro указывают на 4-кратное снижение цитотоксичности на А431/K5 клетках. Видимо, остальная часть этой разницы связана с фармакокинетическими свойствами SS1-LR у мышей. Ранее нами было показано, что HA22-LR имеет почти в 2 раза более короткий период полураспада в сыворотке у мышей, чем НА22 (7,8 против 14,6 минут соответственно), и мы предположили, что разница связана с повышенной почечной фильтрации меньшей молекулы LR (Weldon JE, Blood., 113(16):3792-800 (2009)). Изучая площадь под кривой распада, мы обнаружили, что эта разница в полураспаде предполагает приблизительно 4-кратное различие в количестве доступного белка в течение одного часа. Таким образом, различие в активности in vivo можно отнести как к пониженной цитотоксичности, так и к более короткому периоду полураспада.
Хотя SS1-LR демонстрировал in vivo более низкую противоопухолевую активность, чем SS1P, его неспецифическая токсичность была также значительно снижена у мышей. Мы воспользовались этим свойством, чтобы резко увеличить дозу SS1-LR по сравнению с SS1P (в 50 раз) при анализе ксенотрансплантатной опухоли, что привело к значительному увеличению противоопухолевого эффекта. Предыдущие эксперименты показали, что LD50 для однократного внутривенного введения SS1P составляет 1,0 мг/кг для мышей линии Balb/C (Filpula D et al., Bioconjug Chem., 18(3):773-84 (2007)) и 0,75 мг/кг для мышей линии NIH Swiss (Onda M et al., Cancer Res., 61(13):5070-7 (2001)). При использовании графика дозирования QODx3, похожего на клинический график, мыши выносили максимальную дозу 0,3 мг/кг SS1P (неопубликованные наблюдения). SS1-LR, однако, вводили в режиме QODx3 мышам с ксенотрансплантатом опухоли А431/K5 в дозе 15 мг/кг без вредного воздействия. Ранее однократное внутривенное введение дозы HA22-LR 20 мг/кг не показало никакого токсичного эффекта у мышей (Weldon JE, Blood., 113(16):3792-800 (2009)), и мы вводили однократные дозы HA22-LR вплоть до 45 мг/кг мышам, не вызывая смерти (неопубликованные наблюдения). Хотя ни одна LR молекула не была испытана клинически, этот эффект означает, что LR вариант RIT может иметь пониженную токсичность у человека, что позволило бы избежать дозолимитирующей токсичности и вводить более высокие дозы.
Хотя SS1-LR была эффективна in vitro и in vivo, мы были обеспокоены пониженной в большинстве случаев активностью по сравнению с SS1P. Одним из возможных объяснений этого несоответствия является разница во внутриклеточном механизме интоксикации. LR вариант РЕ38 содержит обширные делеции в домене II и Ib РЕ, и эти делеции могли негативно отразиться на способности РЕ к перемещению в цитозоль. Интересно, что наши первоначальные эксперименты по обнаружению полноразмерного и процессированного РЕ в лизатах клеток, обработанных SS1P и SS1-LR, показали существенное различие в количестве обработанного фурином RIT. Большая часть от общего количества RIT в клетках, обработанных SS1P, была процессирована, но только небольшая часть от общего количества RIT была процессирована в обработанных SS1-LR клетках. Этот результат означал, что плохое расщепление фурином могло ограничивать активность SS1-LR, и мы намеревались улучшить этот этап токсического действия РЕ.
Наши усилия по повышению цитотоксичности SS1-LR за счет увеличения доступности сайта расщепления фурином привели к созданию более активного RIT, но мы не смогли продемонстрировать улучшенное расщепление фурином. Добавление короткого Gly-Gly-Ser линкера (SS1-LR/GGS, Фиг.1В), более длинного линкера (SS1-LR/GGSx2, Фиг.1В) или повторение сайта расщепления фурином в окружении коротких Gly-Gly-Ser линкеров (SS1-LR/2хФурин, Фиг.1В) привело к среднему повышению цитотоксичности. Ни у одной из этих молекул, однако, не повышалась доля расщепленного фурином SS1-LR в обработанных клетках А431/K5, а также не увеличивалась скорость расщепления фурином in vitro. Мы пришли к выводу, что добавление линкера должно повышать цитотоксичность через другой механизм, возможно, связанный с внутриклеточной миграцией молекулы в тестируемых клетках.
Эти эксперименты также показали абсолютную необходимость расщепления фурином для сохранения цитотоксичности SS1P. Точечная мутация в SS1-LR/GGS, которая заменяла аргинин, необходимый для расщепления, на глицин (SS1-LR/GGS R279G, Фиг.1В), приводила к получению белка, который не расщеплялся фурином. Такой RIT не проявлял никакой активности на обеих клеточных линиях - NCI-H322M и KB31. Необходимость расщепления фурином в пути интоксикации РЕ недавно была поставлена под сомнение (Morlon-Guyot J et al., Infect Immun., 77(7):3090-9 (2009)), но существует множество доказательств того, что фурин выполняет важную роль во время интоксикации (Ornatowski W et al., J Clin Invest, 117(11):3489-97 (2007); Shiryaev SA et al., J Biol Chem., 282(29):20847-53 (2007); Sarac MS et al., Infect Immun., 70(12):7136-9 (2002); Chiron MF, Fryling CM, and FitzGerald D, J Bid Chem., 272(50):31707-11 (1997); Gu M et al., Infect Immun., 64(2):524-7 (1996); Inocencio NM, Moehring JM, and Moehring TJ, J Biol Chem., 269(50):31831-5 (1994); Moehring JM et al., J Biol Chem., 268(4):2590-4 (1993)). В случае, представленном здесь, интоксикация РЕ нарушается при отсутствии сайта, пригодного для процессинга под действием фурина. Исследования по изучению связи между расщепления фурином и цитотоксичностью продолжаются.
Отдельное направление исследований в нашей лаборатории недавно привело к созданию варианта НА22, HA22-LR-8M, который имеет чрезвычайно низкую иммуногенность из-за ликвидации эпитопов В-клеток (Onda M et al., направлено для публикации в PNAS). HA22-LR-8M содержит те же делеции, что и LR вариант РЕ, но также включает восемь точечных мутаций в домене III РЕ. Эти мутации внесли в SS1P для создания SS1-LR/GGS/8M. Единственными различиями между HA22-LR-8M и SS1-LR/GGS/8M являются антитело Fv и линкер GGS после сайта расщепления фурином. Поскольку подавляющая часть иммунного ответа на RIT направлена на РЕ, SS1-LR/GGS/8M должен обладать аналогично сниженной иммуногенностью.
Цитотоксичность SS1-LR/GGS/8M сравнивали с SS1P на первичных злокачественных клетках от пациентов с мезотелиомой, и результаты показали, что цитотоксичность SS1-LR/GGS/8M была сравнима или лучше, чем SS1P. В дополнение к хорошей активности, SS1-LR/GGS/8M имеет потенциальные преимущества перед SS1P, которые включают пониженную неспецифическую токсичность и низкую иммуногенность. Эксперименты, описанные здесь, показывают, что SS1-LR/GGS/8M был бы превосходным кандидатом для применения в клинике из-за его низкой иммуногенности, низкой неспецифической токсичности и хорошей цитотоксичности.
Определения
Единицы, приставки и символы приведены в форме, принятой в Международной системе единиц (СИ). Числовые диапазоны включают числа, определяющие диапазон. Если не указано иное, нуклеиновые кислоты записаны слева направо в ориентации от 5′ к 3′; аминокислотные последовательности записаны слева направо от N-конца к С-концу. Заголовки, приведенные здесь, не ограничивают различные аспекты или варианты осуществления изобретения, которые необходимо воспринимать со ссылкой на описание в целом. Соответственно, термины, определенные непосредственно ниже, более полно определяются в соответствии с описанием в полном объеме.
Нативный экзотоксин A Pseudomonas («РЕ») является чрезвычайно активным мономерным белком (молекулярная масса 66 кДа), выделяемым синегнойной палочкой, который ингибирует синтез белков в эукариотических клетках. Нативная последовательность РЕ приведена в SEQ ID NO:1 патента США №5602095, включенного в данный документ посредством ссылки. Способ действия заключается в инактивации фактора элонгации 2 (EF-2) путем АДФ-рибозилирования. Экзотоксин состоит из трех структурных доменов, которые действуют совместно, проявляя цитотоксичность. Домен Ia (аминокислоты 1-252) опосредует связывание с клеткой. Домен II (аминокислоты 253-364) отвечает за транслокацию в цитозоль, и домен III (аминокислоты 400-613) опосредует АДФ-рибозилирование фактора элонгации 2. В исходной структуре РЕ домен III классифицировали как остатки 405-613, а не 400-613. Allured VS, Collier RJ, Carroll SF & McKay DB, Proc Natl Acad Sci USA 83, 1320-1324 (1986). Функция домена Ib (аминокислоты 365-399) остается неопределенной, хотя большая его часть, аминокислоты 365-380, могут быть удалены без потери цитотоксичности. См. Siegall, et al., J Biol Chem 264:14256-61 (1989). Многочисленные такие модификации известны в данной области техники и включают, без ограничения, удаление домена la, различные аминокислотные делеции в доменах Ib, II и III, единичные аминокислотные замены и добавление одной или более последовательностей к карбоксильному концу, таких как KDEL (SEQ ID NO:16) и REDL (SEQ ID NO:26). См. Siegall, et al., J. Biol. Chem. 264:14256-14261 (1989). Иммунотоксины данного изобретения способны к транслокации и рибозилированию EF-2 в клетке-мишени.
Мутации РЕ описаны в данном документе с указанием аминокислотного остатка, присутствующего в конкретном положении в 613-аминокислотной последовательности нативного РЕ (SEQ ID NO:1), с последующей аминокислотой, которой этот остаток был замещен в конкретной рассматриваемой мутации. Так, например, термин «R490A» указывает, что «R» (аргинин, стандартный однобуквенный код) в положении 490 в указанной молекуле замещен на «А» (аланин, стандартный однобуквенный код), a «K590Q» означает, что лизин, обычно присутствующий в положении 590, был замещен на глутамин. Стандартный однобуквенный код для распространенных аминокислот представлен ниже.
Термин «функциональный домен III РЕ» или «функциональный домен РЕ III» относится к остаткам 395-613 нативного РЕ (нативной последовательностью является SEQ ID NO:1). Хотя структурные границы домена III установлены как остатки 405-613, функциональный анализ показал, что домен III требует сегмент домена Ib для сохранения активности АДФ-рибозилирования (Hwang, J. et al., Cell, 48:129-136 (1987); Siegall, C.B. et al., J Biol Chem, 264:14256-14261 (1989)). Функциональный домен III РЕ, таким образом, определяют остатками 395-613 из РЕ (Kihara, A. and Pastan, I., Bioconjug Chem, 5:532-538 (1994)). В данном документе последовательность функционального домена III РЕ включает в себя необязательные модификации для снижения антигенности и необязательные альтернативные последовательности удержания в эндоплазматическом ретикулуме.
Концевые остатки домена III РЕ, REDLK (SEQ ID NO:15), могут меняться так, чтобы повысить цитотоксичность RIT, получающихся в соответствии с данным изобретением. Например, иммунотоксины, полученные с мутированным окончанием РЕ в виде последовательностей KDEL (SEQ ID NO:16), REEL (SEQ ID NO:27) или RDEL (SEQ ID NO:28), могут обладать гораздо более сильным цитотоксическим действием на клетки-мишени, чем иммунотоксины, полученные из РЕ38 с нативной концевой последовательностью. См. Kreitman and Pastan, Biochem J, 307(Pt 1):29-37 (1995). Повторы этих последовательностей также могут быть использованы в данных RIT. См., например, патенты США 5854044; 5821238 и 5602095, и международную публикацию WO 99/51643. В то время как РЕ, заканчивающиеся на KDEL (SEQ ID NO:16), полезны для исследований in vitro, они могут иметь большую неспецифическую токсичность у животных и являются менее предпочтительными дл