Композиция для синтеза кислородных соединений железа со степенями окисления (+4), (+5) и (+6), способ её получения и способ её применения
Иллюстрации
Показать всеИзобретение относится к области неорганической химии, а именно к методам синтеза композиционных материалов на основе соединений железа, содержащим его одновременно в различных степенях окисления: (0), (+2), (+3) и выше, и может быть использовано: в технологических решениях кондиционирования поверхностных и грунтовых вод бытового назначения; очистки и дезинфекции сточных вод; изготовления катодных материалов для химических источников электрического тока; ингибирования коррозии изделий из стали и сплавов, содержащих железо; в качестве окислительного реагента; катализатора в органическом синтезе; автономного источника теплоты, выделяющейся в результате образования материала. Композиция для синтеза кислородных соединений железа со степенями окисления (+4), (+5) и (+6) содержит металлическое железо в виде фракции размером от 1 до 20 мкм в количестве 40-80 мас.% и нитрат щелочного металла, термически обработана при температуре 240-350°С. Способ синтеза композиционных материалов - кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, включающий нагрев смеси, содержащей металлическое железо и нитрат калия, при котором в качестве реакционного материала используют указанную выше композицию, а нагрев осуществляют до температуры начала самоподдерживающейся реакции окисления. Способ получения растворов кислородных соединений железа (+4) и (+6), включающий их выщелачивание из твердой фазы, при котором в качестве твердой фазы используют композиционный материал, полученный по вышеуказанному способу, а выщелачивание осуществляют после увлажнения его водой. 3 н. и 5 з.п. ф-лы, 6 ил.
Реферат
1) Область техники, к которой относится изобретение
Изобретение относится к области неорганической химии, а именно к методам синтеза композиционных материалов на основе соединений железа, содержащим железо одновременно в различных степенях окисления: (0), (+2), (+3) и выше, и может быть использовано: в технологических решениях кондиционирования поверхностных и грунтовых вод бытового назначения; для очистки и дезинфекции сточных вод; изготовления катодных материалов для химических источников электрического тока; ингибирования коррозии изделий из стали и сплавов, содержащих железо; в качестве окислительного реагента; катализатора в органическом синтезе; автономного источника теплоты, выделяющейся в результате образования материала и проч. В частности, изобретение использует такие физико-химические свойства соединений железа в степенях окисления от (0) до (+3), как ферромагнитные, коагуляционные, флокуляционные и сорбционные, экзотермический характер взаимодействия с расплавами нитратов щелочных металлов, а также такие свойства соединений железа в степенях окисления выше чем (+3), как высокая реакционная способность, значительный окислительно-восстановительный потенциал, способность при контакте с водой генерировать в растворы феррат (+6) ионы посредством процессов диспропорционирования соединений железа (+4) и (+5). Способ применения в технологиях химических источников ЭДС, окислительном синтезе и катализе заключается в непосредственном применении продукта, получающегося из предложенной композиции для синтеза по предложенному способу синтеза; в технологиях водоочистки, защиты от коррозии - в использовании растворов, образующихся после выщелачивания водой продукта, получающегося из предложенной композиции для синтеза по предложенному способу синтеза и содержащих ионы феррата (+6) и золь гидроксида железа (+3). В технологиях автономных химических источников теплоты используется энергия экзотермической реакции, выделяющаяся при осуществлении предложенного способа синтеза. Способ получения композиции для синтеза использует свойства специально подготовленных смесей металлического железа определенного фракционного состава, его оксидов и нитратов щелочных металлов, компоненты которой способны вступать после кратковременного инициирования реакции в самоподдерживающееся окислительно-восстановительное взаимодействие посредством самораспространяющегося высокотемпературного синтеза.
2) Предшествующий уровень техники
Железо в своих соединениях может проявлять степени окисления от (0) до (+6). Известно, что в традиционных и наиболее распространенных соединениях железо имеет степени окисления (0), (+2) и (+3), которые, как правило, отличаются высокой термодинамической стабильностью в широком диапазоне условий. В большинстве железосодержащих минералов элемент находится в степенях окисления (+2) и (+3). Металлическое железо в степени окисления (0) широко применяется в качестве конструкционного материала. Соединения железа со степенями окисления выше (+3) обычно термодинамически неустойчивы или устойчивы только в определенных условиях (температура, рН, природа растворителя и пр.). Такие соединения проявляют сильные окислительные свойства. Наиболее хорошо изученными являются производные железа в степени окисления (+6), так как они более устойчивы, чем соединения (+4) и (+5). Области их существования ограничиваются низкими температурами и либо твердой фазой, либо сильнощелочными растворами. Препараты соединений железа (+6) часто загрязнены исходными веществами и продуктами деструкции, а чистые вещества чрезвычайно сложны в приготовлении. Соединения железа со степенями окисления (+4) и (+5) представлены буквально несколькими примерами. Они образуются и существуют, как правило, в очень специфичных условиях, и, судя по прогнозам, должны обладать более сильными окислительными свойствами, чем ферраты (+6).
По данным литературы, в последние десятилетия возрастает интерес к применению водных растворов ферратов (+6) для решения проблем улучшения качества питьевой воды. Определяющими аргументами использования соединений железа в высших состояниях окисления для водоочистки являются дезинфецирующие и окислительные свойства непосредственно ферратов (+6), а также флокуляционные и коагуляционные свойства образующегося при их разложении гидроксида железа (+3). Величины стандартных окислительно-восстановительных потенциалов редокс-пар FeO4 2- / Fe3+ (Eо = 1.93 В при pH = 0) и FeO4 2- / Fe(OH)3 (Eо = 1.24 В при pH = 7) указывают на то, что в кислой и нейтральной средах ферраты (+6) не уступают по окислительным свойствам традиционным окислителям (перманганатам, дихроматам, пероксиду водорода и проч.). Работы ряда современных исследователей подтвердили, что ферраты (+6) могут эффективно применяться не только для окисления неорганических и органических соединений, но и в целях уничтожения различных микроорганизмов, в том числе представляющих серьёзную угрозу здоровью и жизни человека. Таким образом, ферраты (+6) являются выгодной альтернативой общепринятым сегодня методам очистки воды (озонирование, хлорирование и проч.).
Сильные окислительные свойства ферратов (+6) щелочных и щелочноземельных металлов также предлагается использовать при изготовлении химических источников электрического тока [Licht S., Wang B., Ghosh S. Energetic Iron (VI) Chemistry: The Super-Iron Battery // Science. 1999. V.285. P.1039]. В таких источниках тока в качестве основного катодного материала используется феррат (+6) калия, лития или бария. За счёт того, что восстановление феррат (+6) иона является трехэлектронным процессом, химические источники электрического тока на основе ферратов обладают значительной внутренней энергией, имеют большую ЭДС, обладают меньшим внутренним сопротивлением и превосходят стандартные (с использованием MnO2) химические источники электрического тока той же массы по ёмкости на 47%. Конечным продуктом разложения ферратов в процессе разряда или утилизации таких батарей является более экологически безопасный гидроксид железа (+3).
Препятствием для широкого промышленного применения ферратов (+6) является сложность и высокая стоимость их получения и сохранения, существование только в присутствии избытка сильных и нестабильных окислителей (в твердой фазе) или в сильнощелочных растворах, что вызывает сомнение в эффективности именно ферратов при применении их в заявленных выше областях.
Наиболее близким прототипом предлагаемого изобретения по основному материалу могут служить ферраты (+4) и (+6), полученные следующим способом [Thompson J.A. // Патент США № 4.545.974 "Process for producing alkali metal ferrates utilizing hematite and magnetite". - 1984] из смеси тщательно измельчённых нитратов или нитритов щелочных металлов и оксидов Fe2O3, Fe3O4 при молярном соотношении 4:1 - 8:1 соответственно, которую нагревают до 800 - 1100°С на воздухе, в атмосфере аргона или азота от пяти минут до двух часов.
Недостатком этого процесса является, во-первых, значительное потребление энергии при создании высоких температур, необходимых для осуществления синтеза, что приводит к повышению себестоимости продукции и делает производство низкорентабельным. Во-вторых, значительный избыток нитрата является причиной загрязнения конечного продукта непрореагировавшими нитратами и нитритами, пероксидами и оксидами щелочных металлов.
Наиболее близким прототипом предлагаемого изобретения по способу получения можно считать способ получения продуктов, образующихся при получении ферратов (+6) щелочных металлов [Ферапонтов Ю.А., Ульянова М.А., Андреев В.П., Рылов Ю.Б. // Патент РФ (RU 2371392) "Способ получения феррата (VI) калия"] методом самораспространяющегося высокотемпературного синтеза, в котором в качестве окисляющего реагента используют KO2, а в качестве железосодержащего компонента - Fe2O3. К смеси также добавляют аморфный углерод и элементарное железо, служащие горючим. Перед началом синтеза все компоненты, кроме надпероксида, необходимо подвергнуть обезвоживанию. На первой стадии смешивают горючее и Fe2O3, после чего к ним добавляют окислитель. Инициируют начало реакции локальным разогревом шихты до температуры около 500°С в специальном реакторе.
Данный способ получения феррата (+6) калия обладает рядом существенных недостатков. Во-первых, он является многостадийным и сложным в практической реализации. Во-вторых, поскольку исходная смесь высокореакционноспособна, для предотвращения деструктивных процессов, способных привести к самовозгоранию смеси или взрыву, она требует соблюдения специальных мер предосторожности при хранении и обращении с ней. В-третьих, получаемый продукт сильно загрязнен перекисными соединениями щелочных металлов, которые выступают в качестве конкурирующих и сильно защелачивающих среду реагентов при практическом применении продукта реакции. И наконец, в-четвертых, он требует применения дорогостоящих реагентов - надпероксида калия.
Наиболее близким прототипом предлагаемого изобретения по способу применения в качестве источника водных растворов феррат (+6) ионов может служить способ получения феррата (+6) бария [Бильтц Г., Бильтц В. Упражнения по неорганической химии. - Одесса. - 1908. - С. 136-137], в котором смесь железных опилок и нитрата калия в массовом соотношении 1:2 нагревают в тугоплавкой пробирке на пламени горелки до температуры начала взаимодействия. Бурная реакция протекает с интенсивным выделением значительного количества тепла и сопровождается сильным разбрызгиванием расплава смеси и искр, а зачастую - и разрушением стеклянной посуды. Неконтролируемое выделение тепла требует особой осторожности в процессе синтеза. Чтобы извлечь продукты взаимодействия из пробирки в виде застывшего плава, её необходимо разбить и отделить осколки стекла. В раствор, полученный выщелачиванием охлажденного плава ледяной водой, после фильтрования добавляют хлорид бария. Вследствие протекания обменной реакции наблюдают выпадение фиолетово-красного осадка BaFeO4.
Недостатком данного способа являются неконтролируемые последствия бурной реакции: во-первых, это выбросы расплавов реагентов, раскаленных до красного каления продуктов реакции, во-вторых, разрушение и одноразовость реактора, а в-третьих, невозможность масштабирования методики. Все это характеризует описанный способ как технологически непродуманный
3) Сущность изобретения
Предлагаемое изобретение решает задачу по устранению указанных выше недостатков. Задача, решаемая данным изобретением, заключается в разработке новой композиции для синтеза кислородных соединений железа со степенями окисления (+4), (+5) и (+6), способа синтеза, позволяющего простым и экономически оправданным способом получать указанную выше композицию, содержащую соединения железа в высших степенях окисления, а также способа применения полученной выше композиции.
Техническим результатом предлагаемого изобретения является снижение потребления энергии, снижение нагрузки на экологическую систему, а также упрощение технологии получения композиции за счет получения по предлагаемому способу из доступных и безопасных реагентов с использованием простого оборудования безопасной и стабильной композиции для синтеза, обеспечивающей посредством указанного способа синтеза воспроизводимое предоставление соединений железа в степенях окисления выше, чем (+3), в необходимых технологических решениях.
Для решения поставленной задачи, а также для достижения заявленного технического результата предлагается композиция для синтеза кислородных соединений железа со степенями окисления (+4), (+5) и (+6), содержащая металлическое железо и нитрат щелочного металла. Отличительной особенностью предлагаемой композиции является то, что она содержит металлическое железо в виде фракции размером от 1 до 20 мкм в количестве 40-80% масс. и термически обработана при температуре 240 - 350°С.
Композиция может содержать в качестве нитрата щелочного металла нитрат калия и/или нитрат натрия.
Композиция может содержать в смеси до 60% масс. более крупных фракций железа и/или оксидов железа (+2) и/или (+3) и/или (+2, +3).
Композиция может быть термически обработана в течение не менее 1 минуты, но не более 180 минут.
Для решения поставленной задачи, а также для достижения заявленного технического результата предлагается способ синтеза композиционных материалов - кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, включающий нагрев смеси, содержащей нитрат калия. При этом в качестве реакционного материала используют указанную выше композицию, а нагрев осуществляют до температуры начала самоподдерживающейся реакции окисления.
Для решения поставленной задачи, а также для достижения заявленного технического результата предлагается способ получения растворов кислородных соединений железа (+4) и (+6), включающий их выщелачивание из твердой фазы. При этом в качестве твердой фазы используют указанный выше композиционный материал, а выщелачивание осуществляют после увлажнения его водой.
Указанный выше способ получения растворов кислородных соединений железа (+4) и (+6) может быть реализован таким образом, что увлажнение производят водой в соотношении 1 к 0.001-10 масс. долей для получения электролитов, содержащих ионы железа в степенях окисления выше (+3).
Указанный выше способ получения растворов кислородных соединений железа (+4) и (+6) может быть реализован таким образом, что увлажнение производят водой в соотношении 1 к 1-1000 масс. долей для получения растворов, применяемых для кондиционирования воды.
Поставленная в предлагаемом изобретении задача создания композиции для синтеза кислородных соединений железа со степенями окисления (+4), (+5) и (+6), содержащая металлическое железо и нитрат щелочного металла, решается таким образом, что, согласно п. 1 формулы изобретения, она содержит металлическое железо в виде фракции размером от 1 до 20 мкм в количестве 40-80% масс. и термически обработана при температуре 240-350°С.
Указанная композиция, согласно п. 2 формулы изобретения, может содержать в качестве нитрата щелочного металла нитрат калия и/или нитрат натрия.
Указанная композиция, согласно п. 3 формулы изобретения, может содержать в смеси до 60% масс. более крупных фракций железа и/или оксидов железа (+2) и/или (+3) и/или (+2, +3).
Указанная композиция, согласно п. 4 формулы изобретения, может быть термически обработана в течение не менее 1 минуты, но не более 180 минут.
Поставленная в предлагаемом изобретении задача создания способа синтеза композиционных материалов - кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, включающего нагрев смеси, содержащей нитрат калия, решается таким образом, что, согласно п. 5 формулы изобретения, в качестве реакционного материала используют композицию по п. 1, а нагрев осуществляют до температуры начала самоподдерживающейся реакции окисления.
Поставленная в предлагаемом изобретении задача создания способа получения растворов кислородных соединений железа (+4) и (+6), включающего их выщелачивание из твердой фазы, решается таким образом, что, согласно п. 6 формулы изобретения, в качестве твердой фазы используют композиционный материал, полученный по п. 5, а выщелачивание осуществляют после увлажнения его водой.
Поставленная в предлагаемом изобретении задача создания указанного выше способа получения растворов решается таким образом, что, согласно п. 7 формулы изобретения, увлажнение производят водой в соотношении 1 к 0.001-10 масс. долей для получения электролитов, содержащих ионы железа в степенях окисления выше (+3).
Поставленная в предлагаемом изобретении задача создания указанного выше способа получения растворов решается таким образом, что, согласно п. 8 формулы изобретения, увлажнение производят водой в соотношении 1 к 1-1000 масс. долей для получения растворов, применяемых для кондиционирования воды.
Поставленная в изобретении задача решается путем получения композиции для синтеза из специально подготовленной смеси реагентов, компоненты которой способны после инициирования реакции путем локального нагрева самостоятельно реагировать между собой по механизму самораспространяющегося высокотемпературного синтеза, сопровождающегося образованием композиционного материала, содержащего соединения железа в степенях окисления (0), (+2), (+3), и выше чем (+3). Для этой цели смешивают в определенных пропорциях металлическое железо заданного гранулометрического состава и нитрат щелочного металла. Смесь измельчают и нагревают выше температуры плавления нитрата щелочного металла. Охлаждённый продукт измельчают и при необходимости формуют в необходимое изделие, например, прессованием.
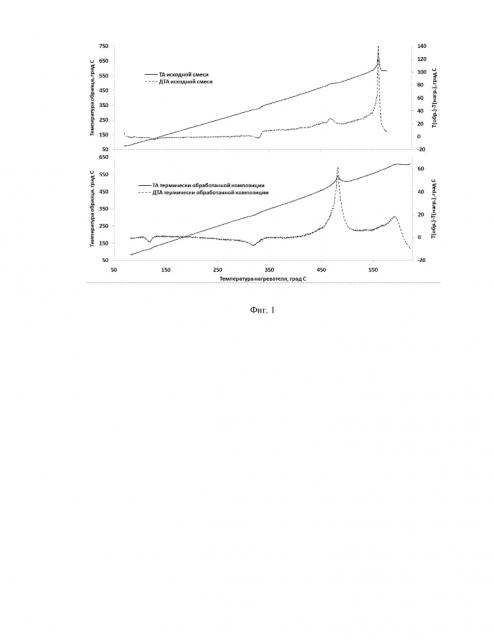
Нагрев смеси высокодисперсного железа и нитрата щелочного металла до температур выше температуры плавления последнего компонента способствует не только удалению возможных примесей воды из исходных реагентов, равномерному пропитывание всей реакционной массы расплавом, но и протеканию первичных реакций между реагентами, что было показано специальным исследованием с помощью термических методов анализа (см. Фиг.1). Это позволяет реализовать способ синтеза композиционных материалов кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа за счет контролируемой самоподдерживающейся реакции окисления.
Для получения указанной композиции для синтеза в качестве исходного сырья могут быть использованы высокодисперсное железо, отличающееся содержанием частиц металлического железа малого размера со сложной морфологией и с высокоразвитой поверхностью, а также нитраты натрия и/или калия. В качестве дополнительных компонентов, вводимых с целью улучшения некоторых физико-химических свойств (ферромагнитных, соотношения компонентов, плотности и пористости продукта синтеза и т.п.) или из экономических соображений, можно использовать "железо восстановленное", мелкодисперсные оксиды железа (+2), (+3), (+2, +3) и их смеси.
4) Раскрытие сущности изобретения
Изобретение относится к классу способов синтеза композиционных материалов широкого спектра действия на основе соединений железа, отличающихся тем, что одновременно содержат железо как в низких (от (0) до (+3)), так и в высоких степенях окисления (выше чем (+3)), что позволяет осуществлять различные технологические сценарии применения материала; для его получения используют недорогие, безопасные и широко производимые промышленностью реагенты, а также простой, безопасный и легко масштабируемый метод, не требующий дополнительных энергозатрат на месте применения.
К предмету предлагаемого изобретения относится как сама композиция для синтеза на основе высокодисперсного железа и нитратов щелочных металлов, способ синтеза с ее использованием путем самоподдерживающегося самораспространяющегося высокотемпературного синтеза композиционного материала, содержащего кислородные соединения железа (+2), (+3), (+4), (+5), (+6) и металлическое железо вместе с продуктами этого синтеза, содержащими соединения железа в степенях окисления от (0) до (+3) и выше, а также способ их использования для получения водных растворов соединений железа (+4) и (+6).
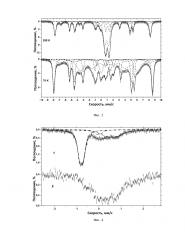
Предварительная обработка (путем нагревания до известной температуры) смеси высокодисперсного железа и нитрата щелочного металла в определенных соотношениях позволяет изменить механизм взаимодействия металлического железа с расплавом нитрата щелочного металла (см. Фиг. 1). В результате возможно осуществлять дальнейшее окислительно-восстановительное взаимодействие реагентов в легко контролируемых условиях самораспространяющегося высокотемпературного синтеза. Получаемый в ходе этого взаимодействия композиционный материал содержит соединения железа как в низких, так и в высоких степенях окисления (от (+4) до (+6)) (см. Фиг. 3). Это позволяет получать кислородные соединения железа в степенях окисления выше, чем (+3) из распространенных и широко производимых реагентов непосредственно на месте их предполагаемого применения, что способствует экономии средств на хранение и транспортировку материалов, содержащих термодинамически нестабильные соединения железа в высших степенях окисления. Наличие в получаемом после осуществления способа синтеза композиционном материале соединений железа в низких степенях окисления - (0), (+2) и (+3) позволяет использовать их ферромагнитные, коагуляционные, флокуляционные и сорбционные свойства в различных технологических решениях, а наличие в получаемом композиционном материале соединений в высоких степенях окисления (выше чем (+3)) позволяет использовать продукты реакции в качестве нового комбинированного окислителя с более высоким окислительно-восстановительным потенциалом, чем у обычных ферратов (+6), а значит, более эффективного и реакционноспособного, или в качестве генератора/источника феррат (+4) и (+6) ионов в водных и неводных растворах, образующихся, в основном, в результате процессов диспропорционирования соединений железа в степенях окисления (+4) и (+5) (см. Фиг. 4). Выделяющаяся в процессе использования описываемой композиции для синтеза теплота экзотермической реакции может быть дополнительно использована при изготовлении автономных химических источников теплоты, развивающих температуры вплоть до 800°С.
Достоинством предлагаемой композиции для синтеза является ее низкая стоимость, простота приготовления, легкая масштабируемость, безопасность при манипуляциях и контакте с водой или восстановителями, экологическая безопасность компонентов и продуктов деструкции, механическая прочность, позволяющая использовать ее в гранулированном виде или в любой другой требуемой по технологии использования форме.
Достоинством предлагаемого способа синтеза композиционного материала кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, является его низкая стоимость, простота и безопасность осуществления, энергетическая самодостаточность, получение продуктов синтеза в виде компактного композиционного материала, обладающего: естественной пористостью, (что делает доступным для других реагентов, например, воды, внутренний объем материала); ферромагнитными свойствами, (что позволяет контролировать положение материала в реакционных сосудах с помощью магнитного поля); образующего, после использования материала, экологически безопасные продукты деструкции, легко утилизируемые и вторично перерабатываемые по отработанным технологиям; содержащего соединения железа в степенях окисления (+2) и (+3) (что обеспечивает их коагуляционные, флокуляционные и сорбционные свойства); содержащего соединения железа в степенях окисления выше, чем (+3) (что позволяет использовать их высокую реакционную способность), с более высоким, чем у ферратов (+6) окислительно-восстановительным потенциалом; способным при контакте с водой посредством процессов диспропорционирования соединений железа (+4) и (+5) генерировать растворы феррат (+4) и (+6) ионов.
Областью нашего изобретения является композиция для синтеза, способ синтеза. Для получения указанного материала согласно способу, предложенному в настоящем изобретении, предлагается использовать в роли основного железосодержащего компонента высокодисперсное железо. В качестве окислителя в изобретении используются нитраты натрия и/или калия, которыми предварительно пропитывают (при температуре 240-350°С) вышеуказанное высокодисперсное железо с одновременным удалением из смеси следов воды и образованием первичных продуктов реакции, позволяющих провести собственно получение материала в контролируемом процессе самораспространяющегося высокотемпературного синтеза.
Отличительными особенностями предлагаемого изобретения является то, что композицию для синтеза по п. 1 получают из термически обработанной смеси высокодисперсного металлического железа и нитратов натрия и/или калия с возможными добавками более крупных фракций железа или оксидов железа (+2) и/или (+3) и/или (+2, +3), а способ синтеза по п. 5 осуществляют по механизму самораспространяющегося высокотемпературного синтеза, не требующего подвода энергии после иницииирования реакции. Полученный в результате синтеза композиционный материал ферромагнитен и, по п.6, при контакте с водой, в том числе, образует феррат (+4) и (+6) ионы.
Решение поставленной задачи достигается тем, что способ получения композиции для синтеза по п. 1 реализуют по пп. 1-4 путём предварительного нагрева на воздухе в течение 1-180 минут до температуры 240-350oС смеси тонкоизмельчённых высокодисперсного железа и нитрата натрия и/или калия, содержащей от 40 до 80% масс. железа, с возможными добавками до 60% масс. более крупных фракций железа и/или оксидов железа (+2), и/или (+3), и/или (+2, +3), с возможным измельчением охлажденного плава и формирования из него изделий методом прессования, а способ синтеза по п. 5 реализуют кратковременным локальным нагревом до температуры начала самоподдерживающейся реакции окисления.
Способ получения предлагаемой композиции для синтеза осуществляют следующим образом: высокодисперсное железо и нитрат щелочного металла смешивают в таком соотношении, чтобы содержание железа составляло от 40 до 80% масс. (при этом до 60% высокодисперсного железа может быть заменено мелкодисперсным "железом восстановленным" и/или оксидом железа (+2), и/или (+3), и/или (+2, +3)) и перетирают любым доступным способом (например, в фарфоровой ступке или смесителе) до получения однородной смеси, а затем нагревают на воздухе в течение 1-180 минут до температуры 240-350°С.
Полученная композиция для синтеза может быть непосредственно использована в качестве исходного реагента для получения композиционных материалов кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, однако, с целью достижения наилучшего результата, ее измельчают и прессуют с использованием пресс-форм (при давлениях от 20 до 200 кгс/см2) в изделие необходимой формы (например, в форме таблетки). Полученная композиция для синтеза стабильна и может храниться сколь угодно долго при умеренной влажности.
Способ синтеза композиционных материалов кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа осуществляют следующим образом: реакция инициируется локальным нагревом части изделия из композиции для синтеза до температуры 350оС и выше любым доступным методом (например, прямым огневым разогревом от факела газовой горелки, либо омическим разогревом от источника электрического тока). После инициации экзотермическая реакция окисления переходит в самоподдерживающий режим (самораспространяющийся высокотемпературный синтез) и протекает в виде линейно распространяющегося по изделию фронта реакции. Скорость распространения фронта реакции, в зависимости от состава, изменяется от 0.05 до 0.10 см/с. Наглядно это можно представить как перемещающуюся по изделию область, выделяющую тепловую и световую энергию и, возможно (в зависимости от состава), газообразные продукты реакции (и/или аэрозоль). Объем конечного продукта составляет от первоначального от 5 до 150%, в зависимости от состава композиции для синтеза. Полученный по окончании горения целевой продукт - композиционный материал кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, будучи охлаждённым до комнатной температуры, может самостоятельно использоваться по назначению, оговоренному ранее.
Если полученный композиционный материал поместить в сосуд, заполненный водой, можно наблюдать появление интенсивной фиолетовой окраски, что свидетельствует об образовании в растворе феррат (+6) ионов (см. Фиг. 5). Отделение раствора от других продуктов взаимодействия может быть легко осуществлено посредством магнитной сепарации, фильтрованием или центрифугированием. С течением времени раствор феррата (+6) обесцвечивается, при этом происходит выделение пузырьков газообразного кислорода и наблюдается выпадение на дно сосуда бурого осадка гидроксида железа (+3). Этот процесс упрощённо можно описать брутто-уравнением реакции:
4 K2FeO4 + 6 H2O = 4 FeO(OH)↓ + 8 KOH + 3 O2↑.
Полученные по описанной выше методике композиционные материалы были исследованы с использованием метода мессбауэровской спектроскопии (при комнатной температуре и при температуре жидкого азота), который позволил идентифицировать наличие в конечных продуктах синтеза кислородных соединений железа (+2), (+3), (+4), (+5), (+6) и металлического железа в различных соотношениях, в зависимости от состава композиции для синтеза (фиг. 3). Для определения концентрации феррат (+6) ионов в растворах применяли метод электронной спектроскопии поглощения (см. Фиг. 5). Концентрацию ионов железа (+3) в растворах определяли стандартным фенантролиновым методом.
5) Промышленная применимость
Предложенный способ синтеза композиционных материалов кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа не требует при своей реализации высоких температур и давления, следовательно, отсутствует необходимость использования какого-либо дополнительного оборудования, кроме вытяжных шкафов или боксов и реакционных емкостей специальной формы. Помимо простоты своего аппаратурного оформления, процесс может быть осуществлен в одну стадию, что является более экономичным решением по сравнению с известными аналогами. Благодаря наличию у продукта синтеза ферромагнитных свойств, он может быть легко удален из реакционных емкостей после использования или же отделен от других веществ и материалов путем магнитной сепарации. Указанные выше причины позволяют обеспечить промышленную применимость предлагаемого изобретения в необходимых объемах и количествах с учетом соблюдения мер безопасности при осуществлении способа синтеза.
6) Примеры выполнения, применения и реализации изобретения
Далее приводятся примеры получения композиции для синтеза, осуществления способа синтеза композиционных материалов кислородных соединений железа со степенями окисления (+2), (+3), (+4), (+5), (+6) и металлического железа, демонстрации их свойств и примеры практического применения, раскрывающие сущность предложенного изобретения. При этом возможности реализации получения композиции для синтеза, способа синтеза и практических применений не ограничиваются приведенными ниже примерами.
Пример 1. Смесь 3 г высокодисперсного железа и 1 г нитрата калия измельчили в ступке до однородного состава шихты, поместили в стальную лодочку и нагрели в атмосфере воздуха до 350°С. Навеску массой 0.68 г отделили от охлажденного плава и сожгли в тугоплавкой пробирке на пламени горелки. Остывший продукт в неизмельчённом виде поместили в стакан с 15 мл бидистиллированной воды, где наблюдали образование фиолетового раствора. Концентрация феррат-ионов в растворе составила 2.2·10-3 моль/л. Выход феррата (+6) как отношения количества полученного феррата к содержанию железа в исходной смеси составил 0.29%.
Пример 2. Тщательно смешали по 1 г высокодисперсного железа и предварительно растертого нитрата калия до однородного серого цвета исходной шихты. Смесь нагрели до 330°С, охладили, растерли в фарфоровой ступке и спрессовали в форме таблеток с d = 8 мм и высотой от 1 до 5 мм. Одну из них, массой 0.31 г, поместили на теплоизолирующую поверхность и инициировали реакцию окисления, нагревая край таблетки пламенем газовой горелки. Повторное взвешивание показало, что масса таблетки в результате реакции уменьшилась примерно на 21%. При выщелачивании её в 7.8 мл воды получили раствор с концентрацией феррат-ионов, равной 1.3·10-3 моль/л. Выход феррата (+6), как отношения количества полученного феррата к содержанию железа, составил 0.35%.
Пример 3. Таблетку, приготовленную по Примеру 2 и содержащую 4 массовые части высокодисперсного железа и одну массовую часть KNO3 марки "ЧДА", поместили между двумя стальными электродами, к которым через ЛАТР подавали постепенно повышающееся напряжение переменного тока. При напряжении, равном U = 100 В, была отмечена инициация реакции самораспространяющегося высокотемпературного синтеза. Обработка водой охлажденного продукта реакции привела к характерному интенсивному красно-фиолетовому окрашиванию, свидетельствующему об образовании раствора феррат-ионов.
Пример 4. Приготовили таблетку по Примеру 2. Ее загрузили в открытую с двух концов кварцевую трубку, а последнюю поместили в трубчатую печь. Нагревая печь со скоростью 5 град/мин, зафиксировали, что температура начала самовозгорания составила 357°С. К водному экстракту охлажденного продукта фиолетового цвета прилили 3%-ный раствор пероксида водорода. Вследствие протекания окислительно-восстановительной реакции между феррат (+6) ионами и пероксидом водорода наблюдалось интенсивное выделение из раствора кислорода и образование желто-коричневой взвеси гидроксида железа (+3) по реакции:
2 K2FeO4 + 3 H2O2 + 2 H2O = 2 Fe(OH)3↓ + 3 O2↑ + 4 KOH
Пример 5. Таблетку, приготовленную по Примеру 2 из высокодисперсного металлического железа и нитрата калия (содержание железа 66.7% масс.), подожгли с помощью факела бенгальского огня. Пирометром зафиксировали, что максимальное значение температуры, развиваемой в процессе горения (реакции окисления), составило 600°С. Охлажденную таблетку через увлажненный кусочек фильтровальной бумаги поместили над цинковой пластинкой. С помощью бытового электрического тестера и одинаковых стандартных медных щупов установили, что разность потенциалов между цинковой пластиной и верхней поверхностью сгоревшей таблетки составляет 1.9 В.
Пример 6. Поверх таблетки композиции для синтеза, приготовленной по Примеру 2 из смеси, содержащей 35% масс. высокодиспесного железа, 15% масс. восстановленного железа и 50% масс. нитрата калия, насыпали немного металлического магния. Металлический магний подожгли с помощью бытовой спички. Теплота, выделяющаяся вследствие экзотермической реакции сжигания магния, инициировала процесс горения таблетки. При обработке продукта синтеза бидистиллированной водой из расчета 25 мл на 1 г композиции получили раствор интенсивной фиолетовой окраски, с рН, равным 11.21. (Для определения pH использовали лабораторный рН-метр.) Определенная концентрация феррат (+6) ионов составила 1.7·10-3 моль/л, а выход феррата (+6) - 0.46%.
Пример 7. Из смеси содержащей 25% масс. высокодисперсного железа, 50% масс. оксида железа (+2) и 25% масс. нитрата калия по Примеру 2 подготовили таблетку композиции для синтеза. После инициирования реакции самораспространяющегося высокотемпературного синтеза, охлаждения образовавшегося композиционного материала и обработки его бидистиллированной водой из расчета 25 мл на 1 г исходной смеси, получили фиолетовый раствор, содержащий феррат (+6) ионы. Выход феррата составил 9.15·10-4 моль/л на 1 г общего железа.
Пример 8. Из смеси, содержащей 33% масс. высокодисперсного железа, 33% масс. оксида железа (+3) и 34% масс. нитрата калия по Примеру 2 подготовили таблетку композиции для синтеза. После инициирования реакции самораспространяющегося высокотемпературного синтеза, охлаждения образовавшегося композита и обработки бидистиллированной водой из расчета 25 мл на 1 г исходной смеси, получили фиолетовый раствор, содержащий феррат (+6) ионы. Выход феррата составил 9.46·10-4 моль/л на 1 г общего железа.
Пример 9. Смесь 3 г высокодисперсного железа, 1 г нитрата натрия и 1 г нитрата калия тщательно растерли до однородного цвета и нагревали при температуре 240°С в течение трех часов. Из охлажденного плава изготовили таблетку массой 0.53 г, инициировали локальным нагреванием начало взаимодействия компонентов и затем охладили на воздухе. Полученную композицию для синтеза поместили в сосуд, содержащий 13 мл воды, которая окрасилась феррат (+6) ионами в красно-фиолетовый цвет. Молярная концентрация феррат (+6) ионов составила 3.29·10-4 моль/л.
Пример 10. Из таблетированных композиций для синтеза, подготовленных по Примеру 2, с содержанием железа 50.0, 60.0, 66.7, 71.4, 77.8% масс. получили ком