Способ хирургического лечения роговичного синдрома при далекозашедшей стадии эндотелиально-эпителиальной дистрофии роговицы
Иллюстрации
Показать всеИзобретение относится к медицине, а точнее к офтальмологии, а именно к способам хирургического лечения эндотелиально-эпителиальной дистрофии (ЭЭД) роговицы, не поддавшихся консервативному лечению, сопровождающихся резко выраженным роговичным синдромом и угрожающих удалением глазного яблока. Производят надрез роговицы на глубину толщины стромы. Надрез выполняют перпендикулярно к поверхности роговицы в 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч. Расслаивают строму роговицы, формируют интрастромальный карман диаметром 6,5 мм, в который вводят дискообразный трансплантат из монолитного сплава никелида титана диаметром 6,0 мм, изогнутый по кривизне роговицы, с отверстием в центре диаметром 1,5 мм. На разрез роговицы накладывается непрерывный шов нитью 10/0. Способ позволяет добиться исчезновения отека роговицы и снятия роговичного синдрома. 3 ил., 2 пр.
Реферат
Изобретение относится к медицине, а точнее к офтальмологии, а именно к способам хирургического лечения эндотелиально-эпителиальной дистрофии (ЭЭД) роговицы, не поддавшихся консервативному лечению, сопровождающихся резко выраженным роговичным синдромом и угрожающих удалением глазного яблока.
Эндотелиально-эпителиальной дистрофии (ЭЭД) роговицы представляет собой серьезную медицинскую и социальную проблему. Буллезная кератопатия относится к прогрессирующим заболеваниям, в литературе не описано ни одного случая самопроизвольного излечения с хорошим исходом. Эта форма дистрофии роговицы является одним из наиболее распространенных роговичных заболеваний, требующих выполнения кератопластики. По материалам ФГБУ МНТК «Микрохирургия глаза» до 32,5% от всех пересадок роговицы проводятся по поводу ЭЭД роговицы.
Большинство пересадок роговицы при ЭЭД направлено на сохранение оперированного глаза и улучшение его функции.
Частота развития ЭЭД в хирургии катаракты, по данным литературы, колеблется в пределах от 3 до 11%. Эта патология может носить наследственный характер и наследуется по аутосомно-доминантному типу. Обычно ЭЭД развивается у больных на фоне снижения плотности эндотелиальных клеток после тяжелых глазных операций, увеита, иридоциклита, кератита, вторичной глаукомы, течения болезни не только снижает зрение, но и приводит к формированию булл в эпителии, при лопании которых появляется резкая боль, слезотечение, светобоязнь (роговичный синдром).
В тяжелых случаях болезни длительно существующая боль в глазу, светобоязнь и слезотечение заставляют пациента требовать удаления глазного яблока.
Эффективным хирургическим методом лечения являются различные виды кератопластики (послойная, интраламиллярная по М.М. Краснову капсулой хрусталика, задняя кератопластика).
Известен способ лечения эндотелиально-эпителиальной дистрофии роговицы, включающей анестезию, удаление эпителия роговой оболочки, за исключением каймы по периферии в 1-1,5 мм, разрез конъюнктивы и склеры концентрично лимбу в 1-2 мм от лимба с 8 до 4 часов, расслоение склеры и роговицы почти по всей площади на % ее глубины над десцеметовой оболочкой, помещением в интрастромальный карман капсулы хрусталика человека (биологическая полупроницаемая мембрана), взятой от удаленного внутрикапсулярно хрусталика по поводу катаракты (аутопластика роговицы с одномоментной экстракцией катаракты или аллопластика роговицы с использованием задней капсулы донорского хрусталика), с наложением узловых швов на разрез (М.М. Краснов, А.А. Каспаров, Н.Н. Пивоваров, П.И. Мусаев. «Интраламеллярная кератопластика с использованием капсулы хрусталика у больного буллезной кератопатией». «Вестник офтальмологии» №2, 1981 г., стр. 32-36. Патент №2744659/28-13 от 02. 04. 1979 г.).
Недостатком данного способа является отсутствие капсулы хрусталика (не выполняются операции интракапсулярной экстракции катаракты), непереносимость пересаженных биологических тканей, отторжение и болезнь трансплантата (развитие иммунологического конфликта в организме реципиента с донорской тканью) и трудности с пластическим материалом - кадаверных хрусталиков - в связи с нерешенностью юридических и правовых аспектов донорства в Российской Федерации, частое отсутствие эффекта снятия роговичного синдрома (Н.А. Пучковская, С.А. Якименко, В.М. Непомнящая «Ожоги глаз», издательство «Медицина», г. Москва, 2011 г., стр. 135-137).
Известно хирургическое лечение эпителиально-эндотелиальной дистрофии роговицы методом задней автоматизированной послойной кератопластики с использованием ультратонких трансплантатов - технология DMEK: пересадка десцеметовой оболочки с эндотелием, ультратонкий трансплантат (около 100 мкм) задних слоев роговицы, обладает хорошей адгезией, точно повторяет кривизну задней поверхности роговицы. Используется автоматизированный микрокератом, фемтосекундный лазер, модифицированные среды консервации, обладающие свойствами дегидратации ткани роговицы с целью стандартизации ее толщины перед проведением манипуляции. Через корнеосклеральный тоннельный разрез выполняют десцеметорексис диаметром 8-9 мм, шпателем отслаивают и удаляют десцеметову мембрану с пораженным эндотелием. Донорский трансплантат задних слоев роговицы толщиной 100-120 мкм послойно формируют с помощью микрокератома и вакуумного трепана. Полученный трансплантат вводят в переднюю камеру глаза реципиента в свернутом виде при помощи шпателя - глайда (Busin glide) и микропинцета, введенного в парацентез напротив тоннельного разреза. Переднюю камеру заполняют воздухом для фиксации и прижатия трансплантата к задним слоям роговицы реципиента. Выполняют контроль фильтрации и при возникновении фильтрации из передней камеры накладывают шов на тоннельный корнеосклеральный разрез. Трансплантат вводят в свернутом виде, что позволяет снизить травматизацию слоя эндотелиальных клеток.
Способ задней автоматизированной послойной кератопластики с использованием ультратонкого трансплантата осуществляют следующим образом: После выполнения анестезии и обработки операционного поля устанавливают блефаростат. Выполняют круговую разметку роговицы. С височной стороны в 1 мм от лимба отсепаровывают конъюнктиву и выполняют корнеосклеральный тоннельный разрез длинной 5 мм; переднюю камеру заполняют вискоэластичным препаратом; выполняют десцеметорексис диаметром 8-9 мм; затем десцеметову мембрану с пораженным эндотелием отслаивают и удаляют при помощи шпателя; производят вымывание вискоэластичного препарата из передней камеры глаза реципиента. Донорскую роговицу, консервированную в растворе для хранения роговицы, устанавливают в аппарат искусственной передней камеры (Moria ALTK). При помощи тонометра выполняют контроль внутрикамерного давления. Устанавливают апланационную насадку и измеряют диаметр будущего сформированного ложа. Затем производят пахиметрию роговицы в центральной зоне (OcuScan RxP, Alcon). Выполняют несколько послойных срезов роговицы, после каждого среза повторяют пахиметрию. Ориентируясь на данные пахиметрии и используя различные по величине головки микрокератома, достигают минимальной толщины остаточной стромы трансплантата, которая варьирует от 100 до 120 мкм. Затем при помощи вакуумного трепана выкраивают трансплантат задних слоев требуемого диаметра (8-9 мм). Полученный трансплантат вводят в переднюю камеру глаза реципиента в свернутом виде при помощи шпателя-глайда (Busin glide) и микропинцета, введенного в парацентез напротив тоннельного разреза. Переднюю камеру заполняют воздухом для фиксации и прижатия трансплантата к задним слоям роговицы реципиента. Выполняют контроль фильтрации и при возникновении фильтрации из передней камеры накладывают шов на тоннельный корнеосклеральный разрез. На конъюнктиву накладывают один узловой шов. Выполняют субконъюнктивальную инъекцию раствора антибиотика и глюкокортикоида. На глаз накладывают монокулярную повязку. (Малюгин Б.Э., Мороз З.И., Ковшун Е.В., Дроздов И.В. Способ задней послойной кератопластики. Патент РФ №2444341 (приоритет от 15.09.2010 г.).
Недостатки метода: сложное хирургическое вмешательство, сложная подготовка донорского лоскута, возможны микроперфорации донорского лоскута, потеря эндотелиальных клеток, что приводит к несостоятельности трансплантата.
Наиболее близким к заявляемому является способ, при котором осуществляется интрастромальная имплантация диска ушного аутохряща в толщу роговицы (Краснов М.М., Удинцов Б.Е. Ауто-алло-кератопластика (реконструктивная аутотрансплантация хряща, надкостницы и склеры как основы для кератопротезирования). // Вестник офтальмологии, 1975, №1, с. 35-39). Сущность способа заключается в высечении хрящевого диска из ушной раковины трепаном 10-12 мм. В роговице формируется широкий интраламеллярный карман для хрящевого диска. Если роговица сильно истончена, расслоение начинают в области лимба. Накладывают роговичный шов. Аллогенный хрящ является одним из наиболее хорошо зарекомендовавших себя материалов в хирургии орбиты - при переломах стенок орбиты, в качестве опорной культи при энуклеации.
Недостатком метода является отторжение или рассасывание хряща, в результате чего происходит снижение функционального и косметического эффекта. (Катаев М.Г. Лечение больных с отторжением гомохрящевого имплантата при анофтальме. // Пластическая хирургия орбиты и глазное протезирование. Сборник научных трудов - М., 1981. - С. 42-45).
Задача изобретения состоит в улучшении результатов лечения путем предотвращения отека эпителия с формированием булл, за счет использования трансплантата из нового материала - никелида титана, обеспечивающего непроницаемость глубоких слоев стромы роговицы.
Поставленная задача достигается способом хирургического лечения роговичного синдрома при далекозашедшей стадии эндотелиально-эпителиальной дистрофии роговицы, включающим надрез роговицы на глубину толщины стромы, формирование интрастромального кармана, помещение в карман трансплантата, наложение на разрез непрерывного шва. Надрез роговицы выполняют перпендикулярно к поверхности роговицы в 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч. Расслаивают строму роговицы, формируют интрастромальный карман диаметром 6,5 мм, в который вводят дискообразный трансплантат из монолитного сплава никелида титана диаметром 6,0 мм, изогнутый по кривизне роговицы, с отверстием в центре диаметром 1,5 мм. На разрез роговицы накладывается непрерывный шов нитью 10/0.
Новизна изобретения.
Расслаивают строму роговицы, формируют интрастромальный карман диаметром 6,5 мм. В который вводят дискообразный трансплантат из монолитного сплава никелида титана диаметром 6,0 мм, изогнутый по кривизне роговицы, с отверстием в центре диаметром 1,5 мм. На разрез накладывается непрерывный шов нитью 10/0.
Разрез роговицы в 2 мм от лимба позволяет сохранить краевую петлистую сеть сосудов, необходимую для питания роговицы. Отверстие в центре трансплантата сохраняет сообщение передних и задних слоев роговицы, необходимое для трофики роговицы и для возможного визуального результата операции.
Использование никелида титана в качестве трансплантата исключает непереносимость ткани роговицы к трансплантату, исключает болезнь трансплантата, обеспечивает непроницаемость глубоких слоев стромы роговицы и надежно защищает от проникновения камерной влаги в передние слои роговицы, исключает отек эпителия и формирование булл.
Использование диска из никелида титана способствует быстрому исчезновению отека и снятию роговичного синдрома (боль, светобоязнь, слезотечение), что позволяет сохранить глазное яблоко, улучшить работоспособность пациента, улучшить качество жизни.
Совокупность существенных признаков изобретения позволяет получить новый результат, заключающийся в исчезновении отека роговицы и снятии роговичного синдрома.
Монолитный сплав на основе никелида титана (ТН-10), проявляющий эффект памяти формы и сверхэластичности, не обладает аллергенными свойствами и характеризуется очень высокой степенью биосовместимости, как биохимической, так и биомеханической, может длительно функционировать в тканях организма в условиях знакопеременной нагрузки и деформации. Имплантированная в организм конструкция из такого сплава способна обеспечить гармоничное функционирование всей системы «ткань организма - имплантат», что обеспечивает высокую эффективность и состоятельность операции. («Медицинские материалы и имплантаты с памятью формы». Том 14. «Имплантаты с памятью формы в офтальмологии». Под редакцией В.Э. Гюнтера. г. Томск, 2012 г., стр. 6-31, 157-160).
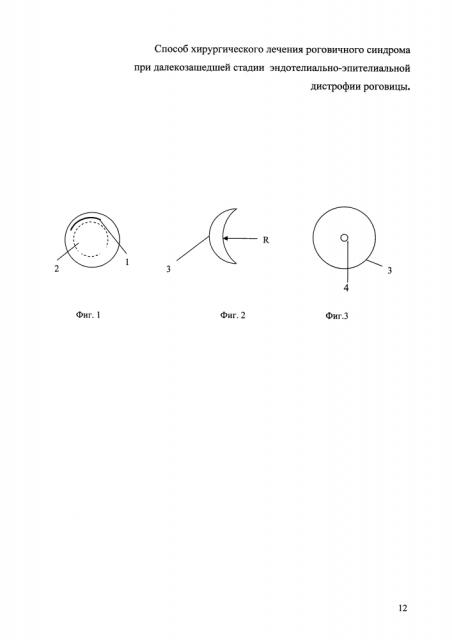
Изобретение поясняется Фиг. 1-3.
На Фиг. 1 - схема формирования кармана для диска.
На Фиг. 2 - вид диска сбоку.
На Фиг. 3 - вид диска спереди.
Способ хирургического лечения роговичного синдрома при далекозашедшей стадии эндотелиально-эпителиальной дистрофии роговицы осуществляется следующим образом:
Проводится акинезия 1% раствором лидокаина 8,0 мл и ретробульбарная анестезия 1% раствором лидокаина 2,0 мм.
В 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч выполняют перпендикулярный к поверхности надрез 1 роговицы на глубину толщины стромы. Осуществляется расслоение стромы с формированием интрастромального кармана 2 диаметром 6,5 мм (Фиг. 1). В карман 2 вставляется дискообразная пластинка трансплантат 3 диаметром 6,0 мм (Фиг. 3) из монолитного сплава никелида титана, изогнутая по радиусу R кривизны роговицы (Фиг. 2), с отверстием 4 в центре диаметром 1,5 мм (Фиг. 3). На разрез накладывается непрерывный шов нитью 10/0. В послеоперационном периоде продолжают инстилляции глазных капель - антибактериальных, кератопластических препаратов. Отек роговицы быстро рассасывается в течение 2-3 недель и исчезает роговичный синдром.
Клинический пример 1
Больной Р., 59 лет, страдает вторичной глаукомой более 10 лет, неоднократно оперирован. Добиться нормализации внутриглазного давления оперативным путем и гипотензивными средствами не удалось. Последние 3 года на фоне некомпенсированного внутриглазного давления появился отек эндотелия и стромы роговицы, буллезная кератопатия. Из-за глаукоматозной нейроретинопатии наступила полная атрофия зрительного нерва, глаз полностью ослеп. Беспокоят сильные режущие боли в правом глазу, слезотечение, светобоязнь. Стало трудно использовать зрячий левый глаз. Больной - профессор математики, заведующий кафедрой. Стало трудно выполнять свою работу. Просит удалить больной глаз. Состояние при поступлении в клинику:
Объективно: Правое глазное яблоко покрыто смешанной инъекцией, имеется отек конъюнктивы. Роговица молочно-белого цвета, эпителий резко отечен, множество эрозий, булл эпителия, выраженный отек стромы и эндотелия. Глубжележащие отделы глаза рассмотреть не удается. Рефлекса с глазного дна нет.
Левый глаз спокоен, здоров.
Выполнена операция правого глаза: Интрастромальная кератопластика пластинкой из монолитного сплава никелида титана по описанной выше методике: Проведена акинезия 1% раствором лидокаина 8,0 мл и ретробульбарная анестезия 1% раствором лидокаина 2,0 мм. В 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч выполнен перпендикулярный к поверхности надрез роговицы на глубину толщины стромы. Расслоена строма роговицы и сформирован карман диаметром 6,5 мм. В карман вставлена дискообразная пластинка из монолитного сплава никелида титана, изогнутая по кривизне роговицы, с отверстием в центре диаметром 1,5 мм. На разрез роговицы наложен непрерывный шов нитью 10/0. Операция прошла без осложнений. В послеоперационном периоде продолжалась комплексная терапия в инсталляциях кератопластических и антибактериальных препаратов. Через 2 недели воспалительный процесс в глазу купировался, исчезли боли, наступило полное восстановление переднего эпителия роговицы, а еще через неделю исчез отек стромы, ВГД справа снизилось до 28 мм рт.ст. В связи с исчезновением роговичного синдрома пациент смог выполнять полный объем работы, улучшилось качество жизни.
Клинический пример 2
Больная К., 83 лет, страдает пролиферативной диабетической ретинопатией обоих глаз, проведена панретинальная лазеркоагуляция сетчатки обоих глаз около 10 лет назад, оперированы осложненные катаракты обоих глаз около 4х лет назад. Последние 2 года появился отек эндотелия и стромы роговицы, буллезная кератопатия левого глаза. Беспокоят сильные режущие боли в левом глазу, слезотечение, светобоязнь, резко снизилось зрение слева. Стало трудно использовать зрячий правый глаз. Просит удалить больной глаз.
Состояние при поступлении в клинику:
Объективно: Смешанная инъекция левого глазного яблока. Слезотечение и светобоязнь выраженные. Роговица с выраженным отеком эпителия, множество эрозий, булл эпителия, выраженный отек стромы и эндотелия. Передняя камера средней глубины, влага прозрачная. Зрачок 3 мм, круглый, на свет не реагирует. Видна заднекамерная ИОЛ за радужкой. Рефлекса с глазного дна нет.
Правый глаз спокоен, безболезнен. На глазном дне - пролиферативная диабетическая ретинопатия.
Выполнена операция левого глаза: Интрастромальная кератопластика пластинкой из монолитного сплава никелида титана по описанной выше методике: Проведена акинезия 1% раствором лидокаина 8,0 мл и ретробульбарная анестезия 1% раствором лидокаина 2,0 мм. В 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч выполнен перпендикулярный к поверхности надрез роговицы на глубину толщины стромы. Расслоена строма роговицы и сформирован карман диаметром 6,5 мм. В карман вставлена дискообразная пластинка из монолитного сплава никелида титана, изогнутая по кривизне роговицы, с отверстием в центре диаметром 1,5 мм. На разрез роговицы наложен непрерывный шов нитью 10/0. Операция прошла без осложнений. В послеоперационном периоде продолжалась комплексная терапия в инстилляциях кератопластических и антибактериальных препаратов. Через 2 дня исчезли боли в глазу, в течение 10 дней наступило полное восстановление переднего эпителия роговицы, значительно уменьшился отек стромы и эндотелия роговицы, повысилась острота зрения оперированного глаза до 0,01, ВГД слева 21 мм рт.ст. В связи с исчезновением роговичного синдрома улучшилось качество жизни пациента.
Предложенный способ хирургического лечения роговичного синдрома при далекозашедшей стадии ЭЭД позволил полностью снять признаки роговичного синдрома, повысить остроту зрения оперированного глаза и улучшить качество жизни пациентов.
Способ хирургического лечения роговичного синдрома при далекозашедшей стадии эндотелиально-эпителиальной дистрофии роговицы, включающий надрез роговицы на глубину толщины стромы, формирование интрастромального кармана, помещение в карман трансплантата, наложение на разрез непрерывного шва, отличающийся тем, что надрез роговицы выполняют перпендикулярно к поверхности роговицы в 2 мм от лимба в соответствии с часовым циферблатом с 10 ч до 1 ч, расслаивают строму роговицы, формируют интрастромальный карман диаметром 6,5 мм, в который вводят дискообразный трансплантат из монолитного сплава никелида титана диаметром 6,0 мм, изогнутый по кривизне роговицы, с отверстием в центре диаметром 1,5 мм, на разрез накладывается непрерывный шов нитью 10/0.