Человеческие антитела к онкостатину м и способы их применения
Иллюстрации
Показать всеГруппа изобретений раскрывает группу антител и их антигенсвязывающих фрагментов, специфично связывающихся с человеческим онкостатином М (ОМ), а также фармацевтические композиции, содержащие указанные антитела и антигенсвязывающие фрагменты, предназначенные для лечения или профилактики ОМ-ассоциированных состояний, таких как остеоартрит и идиопатический легочный фиброз. Антитела и антигенсвязывающие фрагменты согласно группе изобретений блокируют сигнальные рецепторы gp130 и, соответственно, оказывают используемое в клинике цитотоксическое или иммуномодуляторное действие на клетки, которые экспрессируют gp130. 8 н. и 14 з.п. ф-лы, 10 ил., 13 табл., 13 пр.
Реферат
ОБЛАСТЬ ПРИМЕНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к человеческому антителу, способному нейтрализовать биологическую активность, вызванную онкостатином М, путем связывания с мембранными рецепторами, и способам его использования.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Онкостатин M (ОМ) является мультифункциональным членом семейства цитокинов ИЛ-6 с массой 28 кДа, которые секретируются моноцитами, макрофагами, нейтрофилами и активированными Т-лимфоцитами (Tanaka & Miyajima, Rev Physiol Biochem Pharmacol 149: 39-53, 2003). Протеолитическое расщепление в области карбоксильного конца секретированного ОМ приводит к формированию полностью активной формы ОМ, которая составляет 209 аминокислотных остатков в длину и содержит два N-связанных участка гликозилирования. ОМ относится к семейству цитокинов ИЛ-6, которое включает ИЛ-6, ИЛ-11, фактор, ингибирующий лейкемию (LIF), кардиотрофин-1, цилиарный нейтротрофический фактор (CNTF) и кардиотрофин-подобный цитокин (CLC), которые содержат общую рецепторную субъединицу - белок gp130. У людей ОМ проявляет сигнальную активность посредством рецепторных гетеродимеров, содержащих gp130 и субъединицу LIFRα или gp130 и субъединицу β OSMR. В отличие от других цитокинов семейства ИЛ-6, ОМ непосредственно связывается с gp130 при отсутствии какого-либо дополнительного мембраносвязанного корецептора (Gearing et al., Science 255: 1434-1437, 1992). После того, как ОМ связался с gp130, в образовании высокоафинного сигнального комплекса принимают участие OSMRβ или LIFRα (Mosley et al., J Biol Chem 271: 32635-32643, 1996). Активация другого рецептора приводит к передаче сигнала по пути JAK/STAT (Auguste et al., J Biol Chem 272: 15760-15764, 1997).
ОМ главным образом вырабатывается клетками, вырабатываемыми иммунной системой, и, в связи с широкой распространенностью сигнальных рецепторов, он связан с разнообразными проявлениями биологической активности, включающей регуляцию клеточного роста, развитие нервной системы и регуляцию состава внеклеточного матрикса.
Как следует из названия, онкостатин М связан с процессами онкогенеза. Кроме того, ОМ также принимает участие в ранних стадиях каскадов реакций, происходящих при воспалительных и гипертрофических процессах, приводящих к таким вредоносным состояниям, как легочный фиброз. Таким образом, существует необходимость в получении человеческих антител, специфичных к человеческому ОМ, которые были бы способны к блокированию сигнальных рецепторов (сигнальных рецепторов gp130), и антитела, которые блокируют эти сигналы, могут оказывать используемое в клинике цитотоксическое или иммуномодуляторное действие на клетки, которые экспрессируют gp130.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает ОМ-связывающие моноклональные антитела, способные блокировать активность, связанную с одним или более видом биологической активности, связанной с действием ОМ и ОМ-связывающего рецептора на клетки, ткани или органы в организме пациента. Представлены аминокислотные последовательности примерных ОМ-связывающих моноклональных антител, которые закодированы при помощи нуклеиновых кислот для их экспрессии в клетках организма. Одни или более моноклональные ОМ-антитела настоящего изобретения распознают эпитоп на поверхности ОМ, соединение которого с антителом изобретения предотвращает его взаимодействие с рецепторными компонентами сигнального комплекса gp130 и LIFRα или gp130 и OSMRβ, тем самым предотвращая лигатирование лиганда, вызванное сигнальной и регулирующей последующие звенья сигнальных каскадов биологической активностью.
Одним из аспектов изобретения является выделенное антитело, взаимодействующее с человеческим ОМ-белком и имеющим антиген-связывающую активность моноклонального антитела, содержащего антиген-связывающий домен, содержащий аминокислотные последовательности, которые указаны в SEQ ID NO: 13-18 по отдельности или в определенных положениях FR1-CDR1-FR2-CDR2-FR3, как указано в SEQ ID NO: 1-3, CDR3, как представлено в SEQ ID NO: 27-29 и 47; или антиген-связывающий домен, содержащий аминокислотную последовательность, указанную в SEQ ID NO: 23-26 по отдельности или в определенных положениях, как указано в SEQ ID NO: 5-8 или их варианты, и CDR3, как представлено в SEQ ID NO: 19-22. В конкретном варианте осуществления человеческое ОМ-связывающее антитело содержит вариабельный домен, выбранный из SEQ ID NO: 49-55.
В другом варианте осуществления изобретения связывающие домены моноклонального антитела используются как непроцессированные структуры IgG, имеющие константные домены, полученные из константных доменов человеческого IgG, или их специфические варианты, и используются как терапевтические молекулы в фармацевтических препаратах для предотвращения связывания ОМ с клетками, экспрессирующими рецепторные компоненты для ОМ. В другом варианте осуществления связывающие домены сконфигурированы как фрагменты антитела, которые используются как терапевтические молекулы, способные предотвращать связывание ОМ с клетками, экспрессирующими рецепторные компоненты для ОМ. В одном аспекте изобретения обеспечивается фармацевтически приемлемый состав, система или набор для доставки, а также способ лечения состояний, связанных с онкостатином М, содержащие один или более домен для связывания ОМ настоящего изобретения, которое не ограничивается 13-28, 30-46 и вариантами, которые представлены в SEQ ID NO: 29 и 47 .
КРАТКОЕ ОПИСАНИЕ НЕКОТОРЫХ ВИДОВ НА ФИГУРАХ
Фигура 1 изображает зародышевые последовательности генов, используемые для построения библиотек Fab-фрагментов, обнаруживаемых на белке оболочки pIX, причем каждый из гипервариабельных участков доменов содержит мозаичный FR1-CDR1-FR2-CDR2-FR3 в соответствии с SEQ ID NO: 1-3 (1=IGHV1-69, 2=IGHV3-23 и 3=IGHV5-51), что сопровождается вариабельной длиной, мозаичным участком H-CDR3 и J-участком (FR4, SEQ ID NO: 4); и каждый из низковариабельных участков доменов содержит мозаичный FR1-CDR1-FR2-CDR2-FR3 в соответствии с SEQ ID NO: 5-8 (5=IGKV1-39 (O12), 6=IGKV3-11 (L6), 7 - IGKV3-20 (A27) и 8=IGKV4-1 (B3)), а также CDR3 в соответствии с SEQ ID NO: 9, который сопровождается J-участком (FR4, SEQ ID NO: 10).
Фигура 2A является графиком зависимости дозы от эффекта рекомбинантного онкостатина человека и яванского макака, который был получен из клеточной линии СНО, для подавления пролиферации клеток A375-S2, которое измерялось при помощи включения 5-бромдезоксиуридина и нормализации до контроля только в присутствии несущей среды.
Фигура 2B является графиком, изображающим способность антитела M71, содержащего вариабельные домены L180 (SEQ ID NO: 53) и H17 (SEQ ID NO: 54), для уменьшения супрессии пролиферации ОМ A375-S2, когда ОМ присутствует в концентрации 2 нг/мл.
Фигура 3 является столбчатой диаграммой, изображающей эффект M64, M71, M55 и M69 в концентрации 20 мкг/мл для увеличения поглощения35SO4, которое является мерой увеличения синтеза протеогликанов, который превышает свой нормальный уровень при отсутствии антител и когда антитела неспецифического изотипа использовались в качестве контроля в ко-культивировании человеческих хондроцитов в гранулах альгината и человеческих макрофагах, которые способны секретировать ОМ.
Фигура 4A является графиком зависимости дозы от эффекта человеческого ОМ, стимулирующего pSTAT3 в клетках неходжкинской лимфомы, когда найденная EC50 составляет около 1 нг/мл.
Фигура 4B является графиком, изображающим способность антитела M71 нейтрализовать сигнал pSTAT3 в присутствии 2 нг/мл ОМ.
Фигуры 5A и B являются диаграммами рассеяния, которые изображают количество IP-10 (A) и MCP-1 (B), обнаруживаемого в сыворотке отдельных мышей после введения ОМ при наличии или отсутствии предварительного введения указанных концентраций антитела M71.
Фигуры 6A и B являются графиками, изображающими сывороточные концентрации у яванских макак через некоторое время после внутривенного (A) или подкожного (B) введения 3 мг/кг M71 или Fc-варианта M71.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Все публикации, упоминаемые в данном описании, включая патенты и патентные заявки, но не ограничиваясь ими, включенные путем ссылок, являются частью настоящего документа, как если бы они были изложены непосредственно в настоящем документе.
Сокращения
BSA= Бычий сывороточный альбумин; CDR = Гипервариабельный участок; Cyno = Яванский макак (Macaca fascicularis); ДН= Диабетическая нефропатия; ECD = Внеклеточный домен; FR = Каркасный участок; H = Тяжелая цепь; РА-ИЗЛ= Интерстициальное заболевание легких при ревматоидном артрите; L = Легкая цепь; Ig = Иммуноглобулин; Mab = Моноклональные антитела; ОМ= Онкостатин М; OA = Остеоартрит; PBS = физиологический раствор с фосфатным буфером; РА= Ревматоидный артрит; VL = Вариабельный участок легкой цепи; VH = Вариабельный участок тяжелой цепи,
Определения
Используемый в настоящем документе термин "антитело” включает целые антитела, любые антиген-связывающие фрагменты или одну из их цепей. Таким образом, антитело включает любую белковую или пептидсодержащую молекулу, которая содержит, по меньшей мере, часть молекулы иммуноглобулина, без ограничений включающую в себя, по меньшей мере, один гипервариабельный участок (CDR) тяжелой или легкой цепей или их лиганд-связывающую часть, вариабельный участок тяжелой или легкой цепей, константный участок тяжелой или легкой цепей, каркасный участок (FR) или любую их часть, или, по меньшей мере, одну часть связывающего белка, который может быть включен в антитело настоящего изобретения. Термин «антитело» дополнительно охватывает антитела, их расщепленные фрагменты, специфические части и варианты, включающие миметики антител или содержащие части антител, которые схожи по структуре и/или функции с антителом или его специфическим фрагментом или частью, включая одноцепочечные или однодоменные антитела и их фрагменты. Функциональные фрагменты включают антиген-связывающие фрагменты к предопределенной мишени. Примеры связывающих фрагментов охвачены термином "антиген-связывающая часть" антитела, которая включает (i) Fab-фрагмент, моновалентный фрагмент, содержащий домены VL, VH, CL и CH; (ii) F(ab')2-фрагмент, который является двухвалентным фрагментом, содержащим два Fab-фрагмента, которые связаны дисульфидным мостиком в области шарнира; (iii) Fd-фрагмент, состоящий из доменов VH и CH; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела, (v) dAb-фрагмент (Ward et al., (1989) Nature 341:544-546), который состоит из домена VH; и (vi) выделенный гипервариабельный участок (CDR). Более того, хотя два домена VL и VH Fv-фрагмента кодируются разными генами, они могут быть объединены способами рекомбинации при помощи синтетического линкера, который позволяет сделать из них одну белковую цепь, в которой участки VL и VH соединяются для образования моновалентных молекул (известных как одноцепочечные Fv (scFv); см, например, Bird et al. (I 988) Science 242:423-426, and Huston et al. (1988) Proc. Natl. Acad Sci. USA 85:5879-5883). Такие одноцепочечные антитела также охватываются термином "антиген-связывающая часть" антитела. Эти фрагменты антитела получаются при помощи стандартных способов, известных специалистам в данной области техники, и пригодность фрагментов проверяется таким же образом, как и пригодность интактных антител. Напротив, для анализа антиген-связывающей способности могут использоваться библиотеки конструкций scFv, после чего при помощи стандартных способов они могут сплайсироваться с другой ДНК, которая кодирует зародышевые последовательности генов человека. Одним из примеров такой библиотеки является “HuCAL: Комбинаторная библиотека антител человека” (Knappik, A. et al. J Mol Biol (2000) 296(1):57-86).
Термин “CDR” относится к участку, который определяет комплементарность, или гипервариабельному участку аминокислотных остатков антитела, который участвует или отвечает за связывание с антигеном. Гипервариабельные участки, или CDR, антитела человека подтипа IgG содержат аминокислотные остатки из остатков 24-34 (L-CDR1), 50-56 (L-CDR2) и 89-97 (L-CDR3) в легкой цепи вариабельного домена, и 31-35 (H-CDR1), 50-65 (H-CDR2) и 95-102 (H-CDR3) в тяжелой цепи вариабельного домена, как описано у Kabat et al. (1991 Sequences of Proteins of Immunological Interest, пятая редакция Службы общественного здравоохранения, Национальные институты здравоохранения, Бетесда, Мэриленд), и/или эти остатки из гипервариабельной петли (т.е. остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в легкой цепи вариабельного домена и 26-32 (H1), 53-55 (H2) или текущем обозначении H2 по Хотии 52-57, и 96-101 (H3) в тяжелой цепи вариабельного домена, как описано у Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987). Хотия и Леск относят HV с консервативной структурой к «каноническим структурам». Каркасный участок или остатки FR1-4a являются остатками этого вариабельного домена, которые отличаются от гипервариабельных участков, тем самым ограничивая их. Система нумерации по Хотии и Леску учитывает различия в нумерации остатков в петле, указывая протяженность конкретных остатков, обозначенных условными знаками в виде маленьких букв, например, 30a, 30b, 30c и т.д. В последнее время была разработана и широко распространена международная система нумерации - международная информационная система ImMunoGeneTics information system® (IMGT) (LaFranc, et al. 2005. Nucl Acids Res. 33:D593-D597).
Здесь CDR упоминаются как с учетом их аминокислотной последовательности, так и расположения в легкой и тяжелой цепи при помощи последовательной нумерации. Поскольку «расположение» CDR в структуре вариабельного домена иммуноглобулина консервативно у различных видов и присутствует там в виде структур, называемых петлями, использование систем нумерации, которые упорядочивают вариабельные домены в соответствии с особенностями структуры, CDR и остатки каркасного участка быстро определяются. Эта информация используется для замены и трансплантации остатков CDR из иммуноглобулинов одного вида в акцепторный каркасный участок, который обычно находится в человеческом антителе.
Термин «созревание» применяется к направленным изменениям в вариабельном участке антитела с целью изменения свойств полипептида. Как известно в данной области техники и описывается в настоящем документе, большое количество последовательностей, расположенных в V-участке, могут влиять на распознавание антигена. В природе антитела достигают высокой аффинности и специфичности при помощи прогрессивного процесса соматических мутаций. Этот процесс может имитироваться in vitro для обеспечения параллельного отбора и селективной изменчивости, при которых поддерживается целостность последовательности каждой цепи антитела таким образом, что они соответствуют антителам определенных видов, в данном случае - человека, а также усиление аффинности или биофизических параметров, таких как растворимость или стойкость к окислению. Процесс создания направленных изменений, или «созревание», обычно проводится на уровне кодирующей последовательности и обеспечивается посредством создания подбиблиотек для выбора усиленного свойства.
В настоящем документе термин «ОМ» относится к полипептиду онкостатину М или полинуклеотиду, содержащему последовательность, которая кодирует полипептид онкоститин М. Человеческий ОМ является продуктом человеческого гена osm (Ген 5008).
Термин «эпитоп» обозначает область связывания белка, которая способна к специфическому связыванию с антителом. Эпитопы обычно состоят из химически активных групп на поверхности молекул, таких как аминокислоты или боковые цепи сахаров, и обычно имеют специфические трехмерные структурные характеристики, как и определенные характеристики заряда. Конформационные и неконформационные эпитопы различаются тем, что в присутствии денатурирующих растворителей теряется связывание с первыми, но не теряется связывание со вторыми.
В настоящем документе KD обозначает константу диссоциации, более конкретно - KD антитела к предопределенному антигену, и является мерой аффинности антитела к конкретной мишени. Высокоаффинные антитела к предопределенному антигену имеют KD 10-8 M или менее, более предпочтительно - 10-9 M или менее, и наиболее предпочтительно - 10-10 M или менее. Обратной для KD является константа ассоциации KA. Используемые в настоящем документе термины "kdis", "k2" или “kd” предназначены для обозначения скорости диссоциации во время определенного взаимодействия антитела с антигеном. "KD" является отношением скорости диссоциации (k2), также называемой (koff), к скорости ассоциации (k1), или (kon). Таким образом, KD равна k2/k1 или koff/kon, и выражается в виде молярной концентрации (M). Из этого следует, что чем меньше KD, тем сильнее связывание. Таким образом, KD 10-6 M (или 1 мкмоль/л) указывает на слабое связывание в сравнении с 10-9 M (или 1нмоль/л).
Термины «моноклональное антитело» или «композиция моноклональных антител» в данном документе относятся к получению молекул антител с одной молекулярной композицией. Композиция моноклональных антител имеет одинаковую специфичность связывания и аффинность к определенному эпитопу. Этот термин также включает «рекомбинантное антитело» и «рекомбинантное моноклональное антитело» в качестве антител, которые были получены, экспрессированы, созданы или выделены рекомбинантными способами, в которых (a) антитела, выделенные из клеток животных или гибридом, получаются при помощи слияния клеток животных, секретирующих антитела, и сливающихся клеток, (b) антитела, выделенные из клеток организма, трансформируются для экспрессирования антител, образуя, например, трансфектому, (c) антитела, выделенные из комбинаторной библиотеки рекомбинантных антител человека или других видов, и (d) антитела, полученные, экспрессированные, созданные или выделенные другими способами, которые включают сплайсинг последовательностей гена иммуноглобулина с другими последовательностями ДНК. В настоящем документе термин «выделенное антитело» предназначен для обозначения антитела, которое по существу не содержит других антител, которые имеют другую антигенную специфичность. Выделенное антитело, которое специфично связывается с эпитопом, изоформой или вариантом человеческого ОМ, тем не менее, может быть способно к перекрестной реактивности с другими родственными антигенами, например, других видов (например, ОМ гомологичных видов). Кроме того, выделенное антитело может быть практически свободным от постороннего клеточного материала и (или) химических веществ. В одном варианте осуществления комбинация «выделенных» моноклональных антител, имеющих различную специфичность, имеет четко определенный состав.
В настоящем документе словосочетания «специфическое связывание», «иммуноспецифическое связывание» и «связывается иммуноспецифично» относятся к связыванию антитела с предопределенным антигеном. Как правило, связывание антитела характеризуется константой диссоциации (KD) 10-7 M или менее. Связывание с предопределенным антигеном происходит при KD, в два раза меньшей, чем KD связывания с неспецифичным антигеном (например, BSA, казеин, или любой другой полипептид), отличным от предопределенного антигена. Фразы «антитело распознало антиген» и «антитело специфично к антигену» в настоящем документе взаимозаменяемы с термином «антитело, которое специфически связывается с антигеном». В настоящем документе «высокоспецифическое» связывание означает, что относительная KD антитела при связывании с эпитопом, который является его специфической мишенью, по меньшей мере в 10 раз меньше, чем KD при связывании этого антитела с другими лигандами.
В настоящем документе «тип» относится к классу антитела (например, IgA, IgE, IgM или IgG), который кодируется генами константного участка тяжелой цепи. Некоторые классы антител дополнительно охватывают подклассы, или «изотипы», которые также кодируются константными участками тяжелой цепи (например, IgG1, IgG2, IgG3 и IgG4). Антитела могут быть дополнительно соединены с олигосахаридами, связанными с белком при помощи специфических остатков в доменах константного участка, что дополнительно усиливает биологические функции антитела. Например, у человека изотипы антител IgG1, IgG3 и в меньшей степени IgG2 проявляют такие же эффекторные функции, как и мышиные антитела IgG2a.
Под «эффекторными» функциями или «положительным эффектором» подразумевается, что антитело содержит домены, которые отличаются от доменов для специфического связывания антигена и способны взаимодействовать с рецепторами или другими компонентами крови, такими как комплемент, что приводит, например, к рекрутингу макрофагов и событиям, приводящим к разрушению клеток, связанных с антиген-связывающими доменами антитела. Антитела имеют некоторые эффекторные функции, обусловленные связыванием с эффекторными молекулами. Например, связывание C1-компонента комплемента с антителом активирует систему комплемента. Активация комплемента важна для опсонизации и лизиса клеточных патогенов. Активация комплемента стимулирует воспалительный ответ и может также участвовать в аутоиммунной гиперчувствительности. Кроме того, антитела связываются с клетками при помощи Fc-участка, который содержит Fc рецепторный участок на Fc-участке антитела, связывающегося с Fc-рецептором (FcR) на клетке. Существует множество Fc-рецепторов, которые специфичны для различных классов антител, включая IgG (гамма-рецепторы), IgE (эта-рецепторы), IgA (альфа-рецепторы) и IgM (мю-рецепторы). Связывание антитела с Fc-рецепторами на поверхностях клеток запускает множество важных и разнообразных биологических ответов, включающих захват и разрушение покрытых антителами частиц, выведение иммунных комплексов, лизис покрытых антителами клеток-мишеней при помощи клеток-киллеров (называемый опосредованной антителами клеточной цитотоксичностью, или ADCC), высвобождение медиаторов воспаления, плацентарный перенос и контроль за продукцией иммуноглобулинов.
Термин «полипептид» означает молекулу, которая содержит аминокислотные остатки, связанные пептидной связью с образованием полипептида. Небольшие полипептиды, состоящие из менее чем 50 аминокислот, могут быть отнесены к «пептидам». Полипептиды могут быть также названы «белками».
ОБЩЕЕ ОПИСАНИЕ
Настоящее изобретение предусматривает выделенные Mab, способные к связыванию и нейтрализации биологической активности ОМ-белков и продуктов расщепления. В частности, ОМ-связывающие mAb настоящего изобретения способны блокировать связывание ОМ с gp130 или предотвращать рекрутинг LIFRa или OSMRb, вызванный связыванием ОМ с gp130. В ином случае, ОМ-связывающее mAb настоящего изобретения способно блокировать вызванное ОМ сигнальное действие рецептора gp130.
Сообщалось, что фосфорилирование STAT3 приводит к гиперпродукции коллагена фибробластами в различных патологических условиях (Lim et al. Oncogene 23(39): 5416-25, 2006; Huang et al. J Cell Biochem 81(1): 102-13, 2001). Эти свойства показывают возможное терапевтическое значение этих антител при РА, OA и при фиброзах, таких как идиопатический легочный фиброз (ИЛФ) и диабетическая нефропатия (ДН).
Продукт человеческого гена ОМ, ОМ (образец NCBI № NP_065391) является препрополипептидом с длиной 252 аминокислот (SEQ ID NO: 11), имеет сигнальный пептид длиной 25 аминокислот и участок протеолитического расщепления между остатками 234 и 235. Он является секретируемым белком, имеющим пять остатков цистеина, которые образуют две внутренние дисульфидные связи между остатками аминокислот 31-152 и 74-192 (Kallestad JC, et al. J Biol Chem. 1991 May 15; 266 (14):8940-5). Имеются два возможных N-связанных участка гликозилирования у остатков 100 и 217, и при продукции в эукариотических клетках данный белок гликозилируется. Человеческий ОМ содержит свободную сульфгидрильную группу у остатка 105.
Последовательность белка ОМ макак отсутствует в открытом доступе, хотя существует автоматически-вычисленная запись 1867 пар нуклеотидных оснований мРНК (NCBI № XM_001110148), полученная из аннотированной геномной последовательности (NW_001095169). Для получения последовательности ОМ макак РНК была выделена из мононуклеарных клеток периферической крови макак, и затем ген был амплифицирован из кДНК при помощи ПЦР в реальном времени и секвенирован. Предсказанная трансляция клонированной последовательности (SEQ ID NO: 12) была на 99,6% идентичной предсказанной последовательности Macaca mullata (резус), на 92% идентичной последовательности белка ОМ человека, и на 41% идентичной последовательности белка ОМ мыши, как было описано заявителем в одной из заявок, находящихся одновременно на рассмотрении патентного ведомства США (Сер. № 12/648430).
Более того, настоящее изобретение направлено на идентификацию полученных у человека ОМ-связывающих Mab, способных ингибировать последующие звенья сигнальных каскадов биологической активности, приводящей к появлению сигналов при связывании ОМ с gp130, и где Mab обнаруживают способность к;
восстановлению пролиферации клеток в присутствии ОМ, ингибированию вызванной ОМ деградации хондроцитов во внутрисуставном матриксе тканевого эксплантата,
эффективной нейтрализации ОМ-зависимого фосфорилирования STAT3 в фибробластах легких человека и предотвращению ОМ-индуцированного высвобождения цитокинов.
1. Состав антитела настоящего изобретения
ОМ-нейтрализующее антитело настоящего изобретения является антителом, которое подавляет, блокирует или противодействует по меньшей мере одному виду активности ОМ или связыванию ОМ с рецептором in vitro, in situ и/или in vivo, и не способствует, не стимулирует, не индуцирует или не увеличивает активность ОМ или его связывание с лигандом, а также не является антителом, которое при своем связывании имитирует эффекты последующих звеньев сигнальных каскадов, вызванных ОМ-обусловленным лигатированием ОМ-рецепторов, в частности взаимодействие gp130 с ОМ, заключающееся в передаче сигнала в клетке организма. Подходящее ОМ-нейтрализующее антитело, определенная часть или вариант могут также в необязательном порядке влиять, по меньшей мере, на один вид активности или функцию ОМ, которые неограниченно включают; синтез РНК, ДНК или белка; высвобождение белка; активацию, пролиферацию или дифференцировку клетки; секрецию антитела; передачу сигналов рецептором ОМ; расщепление ОМ; связывание ОМ, индукцию, синтез или секрецию ОМ или gp130.
Настоящее изобретение основывается на открытии противочеловеческих моноклональных антител к ОМ, способных подавлять сигнальное действие gp130 после связывания с ОМ или ОМ-индуцированного рекрутинга LIFR. Для связывания ОМ были выбраны связывающие домены антитела в виде Fab-библиотеки, которые отображаются в виде частиц нитевидного фага, связанных с оболочечным белком pIX (см. WO29085462A1 и дальнейшее описание ниже). Для распознавания этих Fab-фрагментов был использован сравнительный анализ при помощи gp130 таким образом, чтобы при их связывании с ОМ происходило предотвращение связывания ОМ с gp130. В ином случае, Fab-фрагменты должны были предотвращать рекрутинг LIFR, вызванный связыванием gp130 с ОМ. Клеточный анализ (A375, клетки меланомы человека) был использован для идентификации некоторых подходящих антител, способных к ингибированию gp130-обусловленной активации pSTAT3 в ОМ-экспрессирующих клетках организма.
ОМ-связывающие антитела, описанные в настоящем документе, распознают, по меньшей мере, две различных области в активной форме человеческого белка ОМ, что указывает на дополнительное открытие множественных участков ОМ, которые подходят для направленного воздействия антител или других соединений со схожими блокирующими функциями. Таким образом, экспрессия и очистка связывающих доменов антител в настоящем документе сводится к аминокислотной последовательности, которая является инструментом, который может обеспечить возможность выбора новых молекул, проявляющих ОМ-нейтрализующую активность.
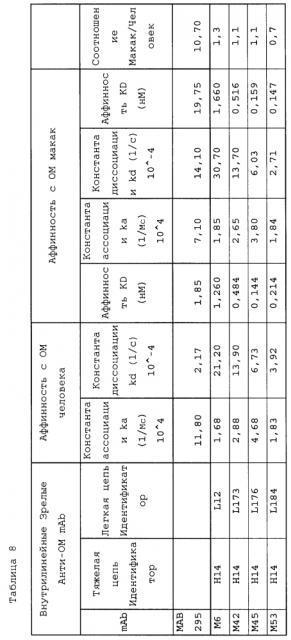
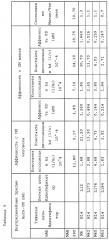
В одном варианте осуществления противочеловеческое ОМ-антитело содержит связывающий участок, имеющий вариабельный участок легкой цепи (VL) или вариабельный участок тяжелой цепи (VH), который содержит аминокислотную последовательность, показанную в SEQ ID NO: 49-55, и это антитело или его связывающая часть иммуноспецифически связывает ОМ. В другом варианте осуществления настоящего изобретения, который содержит тяжелую цепь, содержащую в свой антиген-связывающей части SEQ ID NO: 54 или 55, антитело связывается с белком ОМ и, помимо этого, имеет специфические функциональные свойства антитела изобретения, такие как:
1. связывание человеческий ОМ с KD менее 100 пмоль/л
2. связывание ОМ макак с KD менее 500 пмоль/л
3. способность восстанавливать пролиферацию клеток A375-S2 в присутствии 2 нг/мл человеческого ОМ на 90% от уровня, который наблюдается при отсутствии ОМ,
4. способность восстанавливать пролиферацию клеток A375-S2 в присутствии 2 нг/мл ОМ макак на 90% от уровня, который наблюдается при отсутствии ОМ,
5. ингибирование ОМ-индуцированной деградации хондроцитов во внутрисуставном матриксе тканевых эксплантатов,
6. эффективная нейтрализация ОМ-зависимого фосфорилирования STAT3 в фибробластах легких нормального человека (NHLF), или
7. блокирование высвобождения цитокинов после системной проверки иммунности к ОМ у мышей.
В другом аспекте настоящего изобретения структурные особенности антител, проявляющих некоторые или все виды вышеперечисленной биологической активности, в частности, Mab, обозначенных как связывающие домены M55 и M71, используются для создания родственных по структуре человеческих анти-ОМ антител, которые сохраняют, по меньшей мере, одно функциональное свойство антител настоящего изобретения, такое как связывание с ОМ. Более конкретно, один или более участок CDR в M55 и M71 (такой как специфические остатки в SEQ ID NO: 1 и 8) может быть рекомбинирован с известными каркасными участками человека и такими CDR, как SEQ ID NO: 13-28, 30-46, для создания дополнительных рекомбинантных генно-инженерных человеческих анти-ОМ антител настоящего изобретения.
В одном варианте осуществления антитела настоящего изобретения имеют последовательности, включающие FR1, 2 и/или 3; IGVH1-69 (SEQ ID NO: 1) или IGVH5-51 (SEQ ID NO: 3), причем один или более остаток CDR выбирается из группы, включающей SEQ ID NO: 13-22, которые находятся в CDR, расположенном в SEQ ID NO: 1 или 3, причем способность антитела к связыванию ОМ сохраняется (например, за счет консервативных замен). Таким образом, в другом варианте осуществления, генно-инженерное антитело может содержать один или более CDR, который, например, может быть на 90%, 95%, 98% или 99,5% идентичным CDR, перечисленным в SEQ ID NO: 13-22, или вариантам L-CDR3, приведенным в SEQ ID NO: 29 или 47.
В дополнение к простому связыванию с ОМ, генно-инженерные антитела, такие как описанные выше антитела, могут быть выбраны с точки зрения сохранения функциональных свойств антител настоящего изобретения, таких как способность подавлять связывание белка ОМ или его продуктов расщепления с GP130-положительными клетками, и это связывание может привести к подавлению пролиферации GP130-положительных клеток in vivo.
Человеческие моноклональные антитела настоящего изобретения могут быть исследованы на связывание с ОМ, например, при помощи стандартного твердофазного иммуноферментного анализа.
2. Синтез ОМ-нейтрализующих антител
ОМ-нейтрализующие антитела, демонстрирующие желаемый спектр биологической активности, примерами чего являются антитела M5, M6, M9, M10, M42, M45, M53, M54, M55, M62, M63, M65, M66, M67, M68, M69, M71 и M83, содержащие последовательности тяжелой цепи и легкой цепи, которые указаны в библиотеке каркасных участков SEQ ID NO: 1, 3, 8, а также имеющие CDR с SEQ ID NO: 13-28, 30-46, могут быть синтезированы различными способами.
В другом варианте осуществления эпитоп, связываемый антителами настоящего изобретения и содержащий всего лишь пять из всех остатков 51-227 с SEQ ID NO: 11, или нуклеиновая кислота, кодирующая данную последовательность, могут использоваться для иммунизации испытуемого для продуцирования антител настоящего изобретения непосредственно в организме с целью лечения, профилактики или облегчения течения заболевания или симптомов заболевания, которые связаны с продукцией ОМ.
В одном варианте осуществления и в качестве примера в настоящем документе человеческое антитело выбирается из библиотеки фагов, где эти фаги содержат гены человеческого иммуноглобулина, и библиотека экспрессирует связывающие домены антитела, например, в виде одноцепочечных антител (scFv), Fab-фрагментов или некоторых других конструкций, содержащих парные и непарные вариабельные участки антител (Vaughan et lo al. Nature Biotechnology 14:309-314 (1996): Sheets et al. PITAS (USA) 95:6157-6162 (1998)); Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al. J. Mol. Biol., 222:581 (1991)). Человеческие моноклональные антитела настоящего изобретения могут также получаться при помощи способов фагового дисплея для скрининга библиотек генов человеческих иммуноглобулинов. В данной области техники признаны данные способы фагового дисплея для изоляции человеческих антител. См., например: Патенты США № 5223409; 5403484; и 5571698 Ладнер и соавт.; Патенты США № 5427908 и 5580717 Довер и соавт.; Патенты США № 5969108 и 6172197 МкКафферти и соавт.; и Патенты США № 5885793; 6521404; 6544731; 6555313; 6582915 и 6593081 Гриффитс и соавт.
Клоны фагов выбираются и идентифицируются при помощи многоэтапной процедуры, которая известна как биопэннинг. Биопэннинг осуществляют посредством инкубирования фага, мишенью которого являются варианты белковых лигандов (библиотеки генов фагового дисплея), удаления несвязанного фага при помощи промывания, и специфического элюирования связанного фага. Элюированный фаг необязательно может амплифицироваться перед прохождениями дополнительных циклов связывания и необязательной амплификации, которые пополняют пул специфических последовательностей в пользу клонов этих фагов, которые несут фрагменты антител, демонстрирующих наилучшее связывание с мишенью. После нескольких циклов характеризуются отдельные клоны фагов, и пептидные последовательности, отображенные при помощи клонов, предопределяются посредством секвенирования соответствующей ДНК вириона фага.
Библиотека Fab-фрагментов фага-pIX
В конкретном варианте осуществления способа фагового дисплея синтетические Fab-библиотеки отображаются на фаговом оболочечном белке pIX, описанном Shi et al. J Mol Biol 397:385-396, 2010; а также в международной заявке WO29085462A1 и патенте США Сер. № 12/546850, что будет подробно рассматриваться далее, и используются для выбора связующего вещества из иммунного репертуара последовательностей человеческого IgG, которые получены из зародышевых генов человека. Библиотеки сконструированы из четырех доменов VL и трех доменов VH, кодирующихся известными зародышевыми последовательностями IGV и IGJ, выбранными на основании частоты, с которой эти последовательности обнаруживаются в человеческих антителах, выделенных из естественных источников. По номенклатуре IMGT VH является IGHV1-69 (SEQ ID NO: 1), IGHV3-23 (SEQ ID NO: 2) или IGHV5-51 (SEQ ID NO: 3). Разнообразие конструкций VH приводит к образованию тяжелых цепей с последовательностью вариабельной длины в участке CDR3, многообразие положений которых ограничивается H-CDR1 и H-CDR2, длина которых остается постоянной. Каркасный участок четыре (H-FR4) остается постоянным у всех представителей библиотеки (SEQ ID NO: 4).
VH169, IGHV1-69*01 Длина=98, CDR1=31-35, CDR2=50-66
QVQLVQSGAE VKKPGSSVKV SCKASGGTFS SYX1ISWVRQA PGQGLEWMGX2 IX3X4X5X6GTANY AQKFQGRVTI TADESTSTAY MELSSLRSED TAVYYCAR (SEQ ID NO: 1)
Причем в 169 библиотеке X1 является A или G, X2 является G или W, X3 может быть I или S,X4 может быть P или A, X5 может быть I или Y, и X6 может быть F или N.
VH323, IGHV3-23*01 Длина=98, CDR1=31-35, CDR2=50-66
EVQLLESGGG LVQPGGSLRL SCAASGFTFS X1YX2MX3WVRQA PGKGLEWVSX4 IX5X6X7GX8STYY ADSVKGRFTI SRDNSKNTLY LQMNSLRAED TAVYYCAK (SEQ ID NO: 2)
Причем в 323 библиотеке X1 может быть S, D, N или T; X2 может быть A, G или W; X3 может быть S или H; X4 может быть V, A, N или G; X5 может быть S, N, K или W; X6 может быть Y, S, G или Q; X7 может быть S или D; и X8 может быть S или G.
VH551, IGHV5-51*03 Длина=98, CDR1=31-35, CDR2=50-66
EVQLVQSGAE VKKPGESLKI SCKGSGYSFT X1YWIX2WVRQM PGKGLEWMGX3 IX4PX5DSX6TRY SPSFQGQVTI SADKSISTAY LQWSSLKASD TAMYYCAR (SEQ ID NO: 3)
Причем в 551 библиотеке X1 может быть S, N или T; X2 может быть S или G; X3 может быть I или R; X4 может быть D или Y; X5 может быть G или S; X6 может быть D или Y.
Участки FR4 или JH, содержащие 11 остатков, WGQGTLVTVSS (SEQ ID NO: 4), были присоединены к вышеупомянутым последовательностям для образования целого вариабельного участка тяжелой цепи.
Положения H-CDR1 и H-CDR2, которые были использованы в качестве мишени для разнообразия, были предопределены 1) разнообразием в зародышевых генах; и 2) частотой, с которой они обнаруживаются с антигеном в комплексах антитело-антиген с известной структурой (Almagro J Mol Recognit.17:132-143, 2004). Разнообразие аминокислот в выбранных положениях предоп