Гипогликемическое средство пептидной структуры, ингибирующее дипептидилпептидазу-4
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается пептида H-Trp-Arg-Glu-(D-Arg)9-OH, обладающего свойством ингибировать дипептидилпептидазу-4. Группа изобретений также касается средства для лечения сахарного диабета второго типа, содержащего в качестве действующего вещества указанный пептид. Группа изобретений обеспечивает расширение спектра биологически активных веществ, применяемых для лечения гипергликемии, путем создания соединения, обладающего свойством ингибирования дипептидилпептидазы-4. 3 н. и 1 з.п. ф-лы, 3 пр., 4 табл.
Реферат
Изобретение относится к медицине и ветеринарии, в частности к гипогликемическим лекарственным препаратам, применяемым для лечения сахарного диабета 2 типа.
Большая распространенность сахарного диабета (СД), а также ежегодный рост заболеваемости во всем мире носит характер эпидемии, несмотря на значительные успехи фармакологии в области создания гипогликемизирующих средств. В РФ на январь 2013 г. зафиксировано 3,779 млн больных СД. Из них больше половины - это люди трудоспособного возраста. При этом реальное число больных СД в России может быть в 3-4 раза больше (Дедов И.И., Шестакова М.В., Александров А.А. и др., 2013).
Пропорционально росту заболеваемости диабетом соответственно растет число его осложнений, которые могут иметь тяжелые последствия. Почти пятая часть пациентов с СД (17,63%) имеет проблемы со зрением. Слепота наступает в 25 раз чаще у лиц с диабетом (Липатов Д.В., Александрова В.К., Атарщиков Д.С. и др. Эпидемиология и регистр диабетической ретинопатии в Российской Федерации. // Сахарный диабет. - 2014. - №1. - С.: 4-7). Диабетическая нефропатия является ведущей причиной терминальной почечной недостаточности и занимает 20-44% всех диализных мест. Наличие СД 2 типа (СД2) повышает вероятность развития инсульта в 2-6 раз. Сосудистая патология головного мозга на фоне инсулинорезистентности и гипергликемии при СД2 являются одной из основных причин развития диабетической нейропатии.
По приблизительным подсчетам, мировые затраты на борьбу с СД достигли 471 млрд долларов США (Дедов И.И. Инновационные технологии в лечении и профилактике сахарного диабета и его осложнений. // Сахарный диабет. - 2013. - №3. - С. 4-10). Имеющиеся гипогликемизирующие средства и фармакотерапевтические стратегии не в полной мере решают проблемы лечения СД2 и его осложнений. Поэтому актуальность поиска новых мишеней и терапевтических стратегий лечения и профилактики СД не вызывает сомнений.
Широко применяющиеся на сегодняшний день группы гипогликемизирующих препаратов не всегда эффективны, их применение сопряжено со многими нежелательными эффектами: гипогликемия (инсулины, производные сульфонилмочевины, меглитиниды, миметики амилина и др.); повышение массы тела (инсулины, производные сульфонилмочевины, меглитиниды); желудочно-кишечные расстройства (бигуаниды, ингибиторы альфа-глюкозидазы, агонисты рецептора ГПП-1, миметики амилина (прамлинтид), секвестранты желчных кислот (колесевелам), агонисты дофаминовых рецепторов D2); другие метаболические нарушения - лактат-ацидоз и В12-дефицитная анемия (бигуаниды), триглицеридемия (секвестранты желчных кислот), задержка жидкости, отеки (тиазолидиндионы) и многое другое (Тюренков И.Н., Куркин Д.В., Болотова Е.В. и др. (2015). Десять новых мишеней для разработки лекарственных средств для лечения СД2 и метаболического синдрома. Сахарный диабет, 18(1), 101-109).
По мере прогрессирования заболевания врачи вынуждены прибегать к комбинированной терапии СД, что повышает риск возникновения побочных эффектов. Все перечисленное делает актуальным поиск новых сахароснижающих препаратов как среди известных групп ЛС, так и среди препаратов с новым механизмом действия и новыми точками приложения (Дедов И.И., 2013).
Более полувека назад было замечено, что пероральная нагрузка глюкозой приводит к более выраженному повышению инсулина в плазме крови, чем при внутривенном введении. Позже было установлено, что это обусловлено действием инкретинов на β-клетки, при котором инкретины повышают глюкозостимулированную секрецию инсулина, а само явление получило название «инкретиновый эффект». К инкретинам относятся гастроинтестинальные гормоны: глюкагон-подобный пептид-1 (ГПП 1-1, GLP-1) и глюкозозависимый инсулинотропный пептид (ГИП, GIP), секретируемые соответственно L- и К-клетками кишечника. Инкретины обладают множеством физиологических эффектов, оказывая разнообразное действие на обмен углеводов, включая глюкозозависимую стимуляцию секреции инсулина (при концентрации глюкозы в плазме крови выше, чем 6,1 мМоль/л), глюкозозависимое подавление секреции глюкагона, снижение аппетита и скорости опорожнения желудка, уменьшение количества секретируемого желудочного сока (Спасов А.А., Самохина М.П., Буланов А.Е., Инкретины (физиология, патология, фармакология). Вопросы биологической, медицинской и фармацевтической химии. 2009. (4), 3-7).
Отмечено, что у пациентов с СД2 снижается в первую очередь концентрация ГПП-1 при сохранении биологической активности этого инкретина, тогда как уровни ГИП остаются в пределах нормы, но снижается его физиологическая эффективность (Романцова Т.И., 2009; Патогенетическое обоснование и эффективность применения вилдаглиптина у больных сахарным диабетом 2 типа. Ожирение и метаболизм, (3), 16-26; Галстян Г.Р. (2006). Физиологическая роль инкретинов: перспективы лечения больных сахарным диабетом 2 типа. Сахарный диабет, (4), 14-18). По этим причинам система инкретинов привлекла пристальное внимание ученых в последнее десятилетие.
Инкретины имеют короткий период полужизни в организме (для ГПП-1 он составляет 1-2 мин, для ГИП 5-7 мин), поскольку они быстро разрушаются ферментом дипептидилпептидазой-4 (ДПП-4). Поэтому для воздействия на систему инкретинов и в конечном счете коррекции обмена углеводов могут быть использованы два фармакологических подхода. Первый из них реализуется путем увеличения времени жизни собственных инкретинов путем блокады фермента ДПП-4. К таким препаратам относят глиптины: ситаглиптин, вилдаглиптин, саксаглиптин (ЕА 201101231 A1, 30.09.2010). Второй подход реализован путем введения инкретиномиметиков (аналогов ГПП-1) в организм человека, устойчивых к инактивирующему действию ДПП-4. Препараты данной группы вводятся подкожно (Дедов И.И. (2013). Инновационные технологии в лечении и профилактике сахарного диабета и его осложнений. Сахарный диабет, (3), 4-10).
Глиптины приводят более чем к 90% ингибированию фермента (Fukuda-Tsuru S., Anabuki J., Abe Y. Et al. (2012). A novel, potent, and long-lasting dipeptidyl peptidase-4 inhibitor, teneligliptin, improves postprandial hyperglycemia and dyslipidemia after single and repeated administrations. European journal of pharmacology, 696(1), 194-202) и, как следствие, значительно снижают образование метаболита ГПП-1 (9-36)амида, за счет которого потенцируется действие основного гормона ГПП-1 (7-36)амида. Таким образом, терапия основанная на инкретинах, является перспективным способом лечения СД2. Применение препаратов пептидной структуры позволяет достичь неполного ингибирования фермента ДПП-4, что позволяет увеличить время жизни нативного ГПП-1 и его активного метаболита, тем самым обеспечив устойчивый терапевтический эффект.
Включение в состав пептида олигоаргининового вектора позволяет увеличить проницаемость пептида через гематоэнцефалический барьер головного мозга (Wang С. et al. Synthesis and antinociceptive effects of endomorphin-1 analogs with C-terminal linked by oligoarginine //Peptides. - 2011. - T. 32. - №.2. - C. 293-299), и тем самым увеличить уровень ГПП-1 в гипоталамусе. Увеличение уровня ГПП-1 в гипоталамусе ведет к изменению пищевого поведения - вызывает снижение количества потребляемой пищи и, как следствие, снижение массы тела (Tang-Christensen M. et al. Central administration of GLP-1-(7-36) amide inhibits food and water intake in rats //American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. - 1996. - T. 271. - №. 4. - C. R848-R856).
С учетом сказанного, задачей настоящего изобретения является создание антигипергликемического средства для орального применения, реализующего свое биологическое действие за счет неполного ингибирования ДПП-4.
Технический результат, обеспечиваемый изобретением, заключается в расширении спектра биологически активных веществ, применяемых для лечения гипергликемии, путем создания соединения, обладающего свойством ингибирования дипептидилпептидазы-4 (ДПП-4).
Предметом заявки является пептид H-Trp-Arg-Glu-(D-Arg)9-OH, обладающий свойством ингибировать дипептидилпептидазу-4.
Предметом заявки также является средство для лечения сахарного диабета второго типа, содержащее в качестве действующего вещества пептид H-Trp-Arg-Glu-(D-Arg)9-OH и/или его гидраты, сольваты или соли.
Предметом заявки также является лекарственный препарат для лечения сахарного диабета второго типа, содержащий вышеуказанное средство. В частности, такой препарат может быть выполнен в виде лекарственной формы, пригодной для перорального введения, такой как таблетки или капсулы, раствор для внутримышечного или инфузионного введения.
Фармакологические свойства и способ получения заявленного пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в литературе не описаны.
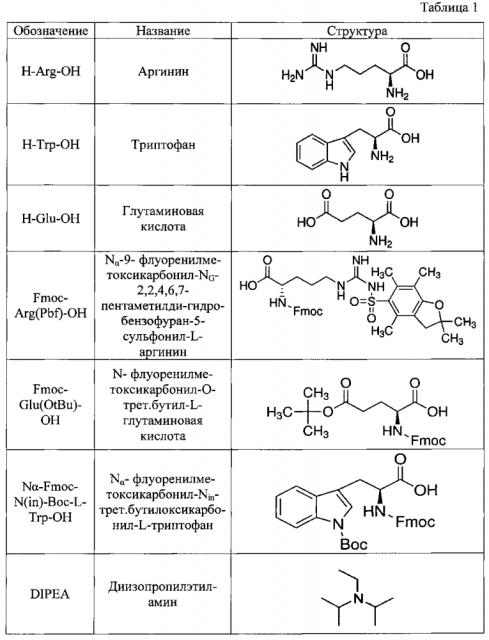
Синтез пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH осуществляли по нижеследующей методике. Список использованных сокращений представлен в таблице 1.
Синтез H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH
В реакторе для твердофазного синтеза суспендировали 2.0 г 2-хлортритильной смолы (емкость 1.5 ммоль/г) в 15 мл DCM, выдерживали в течение 5 мин, смолу отфильтровывали, промывали 2×10 мл DCM. К смоле добавляли раствор 0.45 г (3.3 ммоль) Fmoc-D-Arg-OH·HCl, и 2 мл (12 ммоль) DIPEA в 10 мл DCM, перемешивали в течение 60 мин при комнатной температуре. Смолу отфильтровывали, промывали 2×10 мл DCM, обрабатывали 2×10 мл смеси ОСМ/метанол/DIPEA (17:2:1) в течение 10 мин, промывали 2×10 мл DCM и 3×10 мл DMF. В реактор загружали 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 2.60 г (6.0 ммоль) Fmoc-D-Arg-OH· HCl, 0.98 г (7.2 ммоль) HOBt и 1.12 мл (7.2 ммоль) DIC в 10 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 2.60 г (6.0 ммоль) Fmoc-D-Arg-OH ·HCl, 0.98 г (7.2 ммоль) HOBt и 1.12 мл (7.2 ммоль) DIC в 10 мл DMF, перемешивали в течение 4 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 3.46 г (8.0 ммоль) Fmoc-D-Arg-OH ·HCl, 1.35 г (10.0 ммоль) HOBt и 1.56 мл (10.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 3 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 3.46 г (8.0 ммоль) Fmoc-D-Arg-OH ·HCl, 1.35 г (10.0 ммоль) HOBt и 1.56 мл (10.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 4 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 3.46 г (8.0 ммоль) Fmoc-D-Arg-OH ·HCl, 1.35 г (10.0 ммоль) HOBt и 1.56 мл (10.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 10 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 4.33 г (10.0 ммоль) Fmoc-D-Arg-OH ·HCl, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 12 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 4.33 г (10.0 ммоль) Fmoc-D-Arg-OH· HCl, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 12 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 4.33 г (10.0 ммоль) Fmoc-D-Arg-OH· HCl, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 12 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 4.25 г (10.0 ммоль) Fmoc-Glu(OtBu)-OH, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 12 час при комнатной температуре. Смолу отфильтровывали, промывали 6×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×10 мл DMF, добавляли 10 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×10 мл DMF.
В реактор загружали охлажденный (4°С) раствор 6.50 г (10.0 ммоль) Fmoc-Arg(Pbf)-OH, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×30 мл DMF.
В реактор загружали охлажденный (4°С) раствор 5.80 г (10.0 ммоль) Nα-Fmoc-N(in)-Boc-L-Trp-OH, 1.62 г (12.0 ммоль) HOBt и 1.88 мл (12.0 ммоль) DIC в 10 мл DMF, перемешивали в течение 2 час при комнатной температуре. Смолу отфильтровывали, промывали 6×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, перемешивали в течение 5 мин, отфильтровывали, промывали 3×30 мл DMF, добавляли 30 мл 20% раствора диэтиламина в DMF, выдерживали в течение 20 мин, отфильтровывали, промывали 5×30 мл DMF, 4×20 мл DCM, сушили, добавляли 50 мл смеси TFA/TIS/H2O (97:1:1), выдерживали в течение 30 мин при комнатной температуре, отфильтровывали, промывали 3×20 мл трифторуксусной кислотой, объединенные фильтраты упаривали до объема ~20 мл, к остатку добавляли 60 мл сухого эфира. Выпавший осадок отфильтровывали, промывали на фильтре эфиром, сушили. Полученный продукт растворяли в 50 мл воды, раствор замораживали и лиофилизовали. Лиофилизат растворяли в 40 мл воды и наносили на обращеннофазную колонку Waters X-Bridge С18, 10мкм, 127Å, 50×250 мм. Элюирование проводили при скорости потока элюента 50 мл/мин. Фаза А: 0,1% TFA/H2O, В: ацетонитрил. Градиент: 0%(В)-70%(В) за 70 минут. Фракции, содержащие основной продукт, объединяли, упаривали до объема ~50 мл, замораживали и лиофилизовали. Получено 3.8 г (45%) продукта с чистотой (ВЭЖХ) 97.6%. Масс спектр: вычислено для C76H139N43O15 МН+ 2808.46, получено МН+ 2808.56. Аминокислотный анализ: аргинин 10.0 (10), глутаминовая кислота 0.95 (1), триптофан 0.95 (1).
Нижеследующие примеры фармакологических исследований подтверждают возможность применения заявленного пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в качестве средства с антигипергликемичеекой активностью, обусловленной неполным ингибированием ДПП-4.
Пример 1. Изучение ингибирующего влияния пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH на активность фермента ДПП-4 in vitro
Ингибирующее действие (ИД) пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH определяли по скорости ферментации субстрата глицил-L-пролин п-нитрбанилид (Gly-L-Pro-p-nitroanilide) дипептидилпептидазой 4, определяемой спектрофотометрически по продукту реакции (р-нитроанилин) при 405 нм (Lin Lu I., Tsai K.-C., Chiang Y.-K. Et al. (2008). A three-dimensional pharmacophore model for dipeptidyl peptidase IV inhibitors. European Journal of Medicinal Chemistry, 43(8), 1603-1611). В качестве положительного контроля использовали ситаглиптин.
Аналитическую часть исследования проводили в 96-луночных планшетах. В ряды лунок вносили 20 мкл плазмы крови крыс или раствора фермента (0,025 МЕ/мл) и 40 мкл рабочего буферного раствора (0,1 М Трис-буферный раствор рН 8.0). Затем во все лунки добавляли 40 мкл раствора субстрата для начала реакции, после чего планшет инкубировали 30 мин при 37°С. В течение этого времени измеряли оптическую плотность реакционной смеси при 405 нм каждые 5 минут.
После инкубации строили зависимость изменения оптической плотности при 405 нм от времени ферментной реакции D=f(t, мин) для каждого образца.
Определяли линейную область изменения оптической плотности, строили линейное уравнение у=а×х+b с коэффициентом регрессии не менее 0,99. Для дальнейших расчетов использовали значение тангенса угла наклона линейной зависимости (tgα, равное значению коэффициента «а»).
Усредняли полученные значения tgα для параллельных опытов.
Рассчитывали % ингибирующей активности по формуле:
где tgα, контроль - тангенс угла наклона линейной зависимости, полученной для положительного контроля (100% активности фермента); tgα, проба - тангенс угла наклона линейной зависимости, полученной для испытуемых проб (пробы с испытуемым пептидом и специфическим ингибитором).
По результатам анализа серии растворов исследуемых веществ с различными концентрациями, для которых значения ИА (%) находятся в диапазоне от 10 до 90%, строили зависимость ИА от концентрации вещества (мг/мл). По уравнению регрессии полученной зависимости определяли IC50 - концентрацию исследуемого вещества (нмоль/мл), вызывающую 50% ингибирование активности ДПП-4.
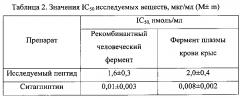
Рассчитанные значения IC50 исследуемых веществ в отношении коммерчески доступного ДПП-4 и ДПП-4 плазмы крови крыс представлены в таблице 2.
Ингибирующее действие ситаглиптина для плазмы крови крыс составляет 0,008±0,002 нмоль/мл. Полученные результаты согласуются с литературными данными, что подтверждает адекватность выбранной методики (Wang Α., Dorso С., Kopcho L. et al. (2012). Potency, selectivity and prolonged binding of saxagliptin to DPP4: maintenance of DPP4 inhibition by saxagliptin in vitro and ex vivo when compared to a rapidly-dissociating DPP4 inhibitor. BMC pharmacology, 12(1), 2).
По результатам исследования IC50 пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH для плазмы крови крыс составила 2,0±0,4 нмоль/мл, для рекомбинантного человеческого фермента 1,6±0,3 нмоль/мл. Таким образом, у пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH было показано специфическое ингибирующее действие в отношении ДПП-4.
Пример 2. Изучение ингибирующего влияния пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH на активность фермента ДПП-4 in vivo
Ингибирующее влияние пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в отношении ДПП-4 проводили при его однократном внутрижелудочном введении аутбредным крысам-самцам. В качестве положительного контроля использовали ситаглиптин. Ситаглиптин вводили в дозе 10 и 0,1 мг/кг, исследуемый пептид - в дозах 0.1, 1 и 10 мг/кг.
Кровь у животных для определения активности ДПП-4 забирали из хвостовой вены (в объеме 0,5 мл) до, через 1, 6 и 24 часа после однократного внутрижелудочного введения исследуемых веществ.
Аналитическую часть исследования проводили аналогично примеру 1.
Для определения активности ДПП-4 и ингибирующего действия препаратов строили зависимость изменения оптической плотности при 405 нм от времени ферментной реакции ΔD (опт.ед) для каждого образца плазмы (ΔD=Dконечная-D0). Скорость реакции определяли как соотношение ΔD/t, где t - время реакции, мин = 30. Усредняли полученные значения для параллельных опытов.
Ингибирующее действие рассчитывали по формуле (1):
где νк - скорость ферментативной реакции, полученной до введения исследуемых веществ (100% активности фермента);
ν - скорость ферментативной реакции, полученной после введения исследуемых веществ.
Активность фермента
Расчет активности фермента ДПП-4 в плазме крови мышей в нмоль/мин/мл (мМЕ/мл) рассчитывали по формуле:
где tga - тангенс угла наклона линейной зависимости, полученной при анализе образцов плазмы; аСО - значение коэффициента «а», полученного при построении калибровочной зависимости для раствора СО п-нитроанилина; 0,88 - поправочный коэффициент; 0,1 - объем реакционной смеси в ячейке планшета, мл; Vпл - объем плазмы, использованный для эксперимента, мл.
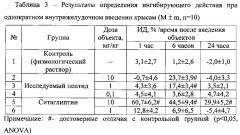
Результаты определения представлены в таблице 3.
Как видно из таблицы 3, ингибирующая активность физиологического раствора на всех временных точках (1, 6 и 24 часа) была практически равна нулю.
Введение ситаглиптина привело к 60%-ному ингибированию через 1 час, 44% через 6 часов и 30%-ному через 24 часа после введения. Полученные данные согласуются с литературными (Wang A. et al. 2012). Таким образом, метод, выбранный нами для определения ингибирующей активности ДПП-4, является адекватным.
Применение пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в дозе 0,1 мг/кг не выявило достоверного влияния на активность ДПП-4 на все временные точки (1, 6 и 24 часа после введения). Внутрижелудочное введение пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в дозе 1 и 10 мг/кг привело к ингибированию активности ДПП-4 на 17% и 24% соответственно, через 6 часов после введения.
Таким образом, однократное внутрижелудочное введение пептида Н-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH привело к неполному ингибированию ДПП-4 в живом организме.
Пример 3. Влияние пептида H-Trg-Arg-Glu-(D-Arg)9-OH*8CF3COOH на уровень глюкозы крови животных в условиях экспериментального СД2.
Экспериментальный сахарный диабет второго типа моделировали половозрелым мышам-самцам согласно методическим рекомендациям (Руководство по проведению доклинических исследований лекарственных средств. Часть первая. М.: Гриф и К, 2012. 944 с.) однократной инъекцией стрептозотоцина (60 мг/кг внутрибрюшинно) с предварительным, за 15 минут, введением никотинамида в дозе 210 мг/кг.
Тестируемый пептид вводили внутрижелудочно в дозах 0,2, 2 и 20 мг/кг. В качестве позитивного контроля использовали ситаглиптин в дозе 2 и 20 мг/кг. Исследуемые вещества вводили внутрижелудочно, начиная с 10-го дня после индукции патологии в течение 14-ти дней.
Уровень глюкозы крови определяли с использованием глюкометра OneTouch Horizjn фирмы «Lifescan», США. Кровь для анализа брали из хвостовой вены мышей. Определение проводили до индукции, на 10-й, 15-й и 24-й дни после.
Результаты определения представлены в таблице 4.
Из данных таблицы 4 видно, что однократное введение стрептозотоцина вызвало развитие гипергликемии, о чем свидетельствует статистически значимое увеличение концентрации глюкозы в периферической крови на 10-й день эксперимента по отношению к интактной группе животных.
Применение препарата ситаглиптина в дозе 20 мг/кг в течение двух недель привело к снижению уровня глюкозы крови, что говорит об адекватности моделируемой патологии. Применение пептида H-Trp-Arg-Glu-(D-Arg)9-OH*8CF3COOH в дозе 2 и 20 мг/кг привело к достоверному снижению уровня глюкозы крови (19-26% соответственно) по сравнению с контрольными животными.
1. Пептид H-Trp-Arg-Glu-(D-Arg)9-OH, обладающий свойством ингибировать дипептидилпептидазу-4.
2. Средство для лечения сахарного диабета второго типа, содержащее в качестве действующего вещества пептид H-Trp-Arg-Glu-(D-Arg)9-OH и/или его гидраты, сольваты или соли.
3. Лекарственный препарат для лечения сахарного диабета второго типа, содержащий средство по п. 2.
4. Лекарственный препарат по п. 3, отличающийся тем, что выполнен в виде лекарственной формы, пригодной для перорального введения, такой как таблетки или капсулы, раствор для внутримышечного или инфузионного введения.