Вещества, включающие керамические частицы для доставки биомолекул
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описано состоящее из частиц вещество, содержащее: частицы керамической матрицы, несущие функциональную группу, способную стимулировать проникновение частиц в клетки; и биомолекулу, находящуюся в порах частиц, где указанная биомолекула может высвобождаться из частиц при растворении керамической матрицы. Вещество обеспечивает хорошую пенетрацию активного вещества в клетки-мишени. 3 н. и 53 з.п. ф-лы, 22 ил.
Реферат
Область, к которой относится изобретение
Настоящее изобретение относится к веществам, содержащим керамические частицы для доставки биомолекул, и к способам получения таких веществ. Более конкретно, настоящее изобретение относится к состоящим из частиц веществам, которые включают частицы керамической матрицы, несущие функциональную группу и имеющие высвобождаемые биомолекулы, присутствующие в порах этих частиц.
Предшествующий уровень техники
Применение киРНК-терапии и генотерапии представляет собой главное перспективное направление в медицине. Оно открывает большие возможности для лечения ряда заболеваний, которые в настоящее время не поддаются лечению, таких как кистозный фиброз, некоторые виды рака и иммунные заболевания, такие как диабет типа 1, рассеянный склероз и т.п. Однако, для осуществления эффективной киРНК-терапии, киРНК, перед ее доставкой на участок действия, должна быть защищена от ферментативного расщепления in vivo.
В настоящее время, киРНК-терапия требует больших расходов. Такая дорогостоящая терапия применяется, главным образом, в наиболее развитых странах. По оценкам специалистов, общие затраты на генотерапию составляют >5 миллиардов долларов США.
Основными задачами при разработке киРНК-терапии для применения в медицине являются:
- защита активного вещества от ферментативного разложения;
- обеспечение доставки активного вещества в клетки-мишени (обеспечение хорошей пенетрации);
- высвобождение активного вещества из инкапсулирующего вещества в цитоплазму (эндосомное высвобождение);
- обеспечение возможности осуществления нокаута генов («отключения» экспрессии генов) (предпочтительно, с эффективностью активного вещества в нМ-концентрациях); и
- достижение низкой токсичности (широкое терапевтическое окно).
КиРНК представляют собой гидрофобные молекулы с высоким отрицательным зарядом, имеющие средние размеры (приблизительно массу 14 кДа, диаметр 3 нм, длину 10 нм). Они являются химически и биологически неустойчивыми, если только они не были модифицированы для повышения стабильности. Для достижения клинического эффекта, киРНК должны обладать способностью проходить через клеточную мембрану и локализоваться в цитоплазме популяции клеток-мишеней.
В последнее время были проведены исследования вирусных векторов на их способность к доставке РНК или ДНК. Однако, такое применение вирусных векторов связано с риском возникновения иммунологических реакций и с трудностями практического осуществления такой доставки. Были также исследованы различные не-вирусные векторы (например, липидные комплексы, катионные полимерные комплексы, липосомы, дендримеры, полимерные наночастицы). В этих исследованиях специалисты столкнулись с рядом проблем, включая трудности, связанные с применением киРНК, а именно, взаимодействия между киРНК и вектором, и чувствительность киРНК к разложению in vivo. В частности, были разработаны различные системы адсорбции ДНК или РНК на поверхности наночастиц. Однако, недостатками таких систем является то, что адсорбированная биомолекула подвергается ферментативной атаке еще до ее доставки на участок действия, что тем самым снижает эффективность лечения.
Хотя вышеописанное обсуждение относится, главным образом, к киРНК и ДНК, однако, обсуждаемые здесь проблемы не ограничиваются только применением киРНК и ДНК. Они могут относиться к биомолекулам широкого ряда, включая, например, пептиды, белки и т.п., которые могли бы быть доставлены вовнутрь клеток. Таким образом, решение указанных проблем может открыть более широкие перспективы. Поэтому, применение настоящего изобретения не должно ограничиваться только киРНК.
Настоящее изобретение позволяет, в основном, успешно решить обсуждаемые проблемы или устранить по меньшей мере один или несколько из вышуказанных недостатков, что, по меньшей мере частично, удовлетворяет описанным выше требованиям.
Описание сущности изобретения
В соответствии с одним из своих аспектов, настоящее изобретение относится к состоящему из частиц веществу, содержащему:
частицы керамической матрицы, несущей функциональную группу, способную стимулировать проникновение частиц в клетки; и
биомолекулу, находящуюся в порах частиц, где указанная биомолекула может высвобождаться из частиц при растворении керамической матрицы.
Используемый здесь термин «биомолекула, находящаяся в порах частиц» входит в объем настоящего изобретения и означает, что керамическая матрица, которая эффективно образует твердые пористые частицы, содержит биомолекулы, диспергированные по всей керамической матрице или находящиеся в порах такой матрицы. При этом не рассматриваются случаи, в которых биомолекула присоединена к внешней поверхности частиц или связана с этой поверхностью.
Вообще говоря, в других возможных относительно экстремальных условиях, биомолекула, в основном, не высвобождается из частиц посредством выщелачивания, в случае, если не происходит растворение керамической матрицы. В этой связи, используемый здесь термин «биомолекула, которая, по существу, не высвобождается посредством выщелачивания в отсутствие растворения» входит в понятие термина «выщелачивание» в предполагаемых условиях хранения и применения вещества, состоящего из частиц. При этом, предпочтительно, чтобы функциональная группа взаимодействовала с биомолекулой и, по существу, предотвращала такое выщелачивание.
Предпочтительно, чтобы функциональная группа была равномерно распределена по всем частицам.
В соответствии с одним из вариантов изобретения, керамическая матрица, несущая функциональную группу, включает матрицу, имеющую функциональную группу двуокиси кремния. Однако, могут быть использованы различные оксиды металлов, включая смешанные оксиды металлов, например, оксид титана, оксид алюминия, двуокись циркония, оксид железа, оксид церия, оксид цинка и т.п. Функциональная группа может быть введена посредством титаноорганического или алюмоорганического соединения или силанорганического соединения, которое конденсируется с соединением-предшественником других металлов, образующих титан-кремнийорганическое соединение или алюмо-кремний-органическое соединение. Другие варианты осуществления изобретения будут очевидны из обсуждения получения указанных частиц, приведенного ниже.
Функциональная группа керамической матрицы может содержать любую группу, которая эффективно стимулирует проникновение частиц в клетки. Так, например, такая группа может включать аминогруппу. В предпочтительном варианте изобретения, функциональная группа включает аминоалкиламиногруппу, первичную алкиламиногруппу, вторичную алкиламиногруппу, третичную алкиламиногруппу, алкилимидазольную группу, алкиламидную группу или алкиламинокислотную группу. Другие варианты осуществления изобретения будут очевидны из обсуждения получения указанных частиц, приведенного ниже.
Настоящее изобретение относится к состоящему из частиц веществу, содержащему биомолекулу. В этом контексте, термин «биомолекула» может означать вещество, имеющее биологическое происхождение или биологическую природу и обладающее биологической активностью. В объем этого термина входит вещество, содержащее одну или несколько молекул, включая смесь различных молекул. Такой биомолекулой может быть макромолекула. Макромолекула может иметь молекулярную массу приблизительно от 1 до 1000 кДа или более, или приблизительно 1-100, 1-50, 1-20, 1-10, 5-1000, 10-1000, 100-1000, 500-1000, 5-100, 5-50, 5-20 или 10 - 20 кДа, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 кДа. В некоторых случаях, такая макромолекула может иметь молекулярную массу менее чем 1 кДа или более чем 1000 кДа. Она может иметь диаметр приблизительно 0,5-20 нм, или приблизительно 1-20, 2-20, 5-20, 10-20, 0,5-10, 0,5-5, 0,5-2, 0,5-1, 1-10, 2-10, 1-5, 5-10 или 10-20 нм, например, приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 нм.
Выбор биомолекулы может зависеть от конкретного применения. Для сохранения биомолекулы в частицах и/или на частицах, ей может быть сообщен отрицательный заряд. Это позволяет биомолекуле связываться с функциональной группой на керамической матрице, например, с протонированными аминогруппами в керамической матрице с функциональной аминогруппой. Альтернативно или дополнительно, биомолекула может иметь другую функциональную группу, которая позволяет ей связываться с функциональными группами керамической матрицы. Альтернативно или дополнительно, биомолекула может быть достаточно крупной (то есть, она может иметь достаточно большую молекулярную массу или достаточно большой молекулярный объем), в результате чего она может физически захватываться частицами. При этом она может иметь достаточно большой размер, в результате чего она будет неспособна проходить через поры частиц.
В некоторых вариантах изобретения, такой биомолекулой может быть нуклеиновая кислота, такая как РНК, например, киРНК (короткая интерферирующая РНК), миРНК (микроРНК), или рибозим, ASODN (антисмысловой нуклеотид или антисмысловая РНК), молекула ДНК, аптамер, белок, включая полипептиды, пептиды, гликопротеины, липопротеины, иммуноглобулины (например, антитела и фрагменты антител), углевод, липид или смесь или аддукт любой из двух или более перечисленных здесь молекул. В одном конкретном варианте изобретения, такой биомолекулой является киРНК. Эта биомолекула может быть использована для профилактики или лечения заболевания, расстройства или патологического состояния.
В некоторых вариантах изобретения, предпочтительно, чтобы агент для обработки поверхности связывался с поверхностью частиц. В предпочтительном варианте изобретения, полиэтиленгликолевые (ПЭГ) цепи связываются с поверхностью частиц. Альтернативно или дополнительно, нацеливающая группа может быть связана с поверхностью частиц для облегчения нацеливания частиц на используемую мишень, например, на опухоль, на конкретный орган или на другую мишень. В некоторых вариантах изобретения, ПЭГ-цепи, имеющие нацеливающие группы на своих дистальных концах, могут быть связаны с частицами.
В некоторых вариантах изобретения, может оказаться предпочтительным, чтобы частицы состоящего из частиц вещества имели средний размер приблизительно 0,1-1 микрон. Однако, они могут иметь средний размер приблизительно 0,1-10 микрон, или приблизительно 0,1-5, 0,1-2, 0,1-1, 0,1-0,5, 0,2-10, 0,5-10, 1-10, 2-10, 5-10, 0,2-2, 0,2-1, 0,2-0,5, 0,5-2 или 0,5-1 микрон, например, приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9 или 10 микрон.
В некоторых вариантах изобретения, может оказаться предпочтительным, чтобы средний размер частиц составлял менее чем приблизительно 0,1 микрон. Так, например, он может составлять приблизительно 20-100 нм (0,1 микрон), или приблизительно 20-50 нм, или приблизительно 50-100 нм, например, приблизительно 20, 30, 40, 50, 60, 70, 80 или 90 нм.
Следует отметить, что частицы, имеющие размер приблизительно выше 1-2 микрон, могут оказаться неподходящими для внутриклеточной доставки. Однако, следует принять во внимание, что они могут быть использованы для доставки более крупных белков в какой-либо участок организма. В соответствии с этим, частицы размером до нескольких микрон могут быть интернализованы, в частности, специализированными фагоцитарными клетками.
Частицы могут быть, в основном, монодисперсными либо они могут быть до некоторой степени агрегированными и иметь второй максимум на кривой распределения частиц по размерам. Кривая может иметь нормальное распределение, гауссово распределение или какое-либо другое распределение частиц. Частицы могут иметь широкое, среднее или узкое распределение по размерам. Частицы могут иметь сферическую или почти сферическую форму, либо они могут иметь яйцевидную форму, форму сжатого сфероида или форму многогранника (имеющего, например, от 8 и приблизительно до 60 сторон), либо они могут иметь какую-либо другую форму. Эти частицы могут иметь неправильную форму.
Частицы могут иметь средний размер пор (то есть, размер пор <100 нм). Они могут быть микропористыми (то есть, иметь размер пор <1,7 нм). При этом предпочтительно, чтобы средний размер пор частиц составлял приблизительно 1-50 нм. Так, например, средний размер пор может составлять приблизительно 1-20, 1-10, 5-50, 10-50, 20-50, 5-20, 5-10 или 10-20 нм, например, приблизительно 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 нм.
По своей структуре, поры могут быть связаны друг с другом либо они могут иметь пустоты, соединенные друг с другом относительно небольшими связывающими каналами. Размер пор может быть достаточно малым, настолько, чтобы он, в основном, предотвращал высвобождение биомолекулы из пор посредством диффузии. Альтернативно, если размер пор позволяет биомолекуле высвобождаться из поры, то такая биомолекула может удерживаться путем ее притяжения функциональными группами, присутствующими на поверхности пор. Функциональные группы могут быть идентичны группам, которые стимулируют проникновение частиц в клетки, либо они могут отличаться от этих групп.
Нагрузка биомолекул в частицах может составлять приблизительно 1-20% масс., например, приблизительно 1-10, 1-5, 1-2, 2-20, 5-20, 10-20, 2-10, 2-5 или 5-10%, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20%, хотя, в некоторых случаях, такая нагрузка может составлять менее чем 1% или более чем 20%.
Используемая биомолекула преимущественно высвобождается при растворении частиц в условиях, которые, в основном, не способствуют разложению биомолекулы. Так, например, такая биомолекула может высвобождаться при растворении частиц в биологической среде, которая, в основном, не способствует разложению биомолекулы. Альтернативно, такая биомолекула может высвобождаться при ее разведении в жидкости, способствующей высвобождению.
Вообще говоря, биомолекула может высвобождаться (например, в основном, полностью высвобождаться) за период времени приблизительно от 0,5 до 50 часов. Так, например, такой период времени может составлять приблизительно 0,5-20, 0,5-10, 0,5-5, 0,5-2, 1-50, 5-50, 10-50, 1-20, 1-10, 2-10 или 5-10 часов, например, приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 часов. Поскольку скорость растворения может зависеть от размера частиц, то такая скорость может быть скорректирована путем регуляции размера частиц, как обсуждается в нижеследующем описании.
Наиболее предпочтительно, чтобы биомолекула была защищена от разложения до ее высвобождения из частиц в том случае, если такие частицы подвергаются воздействию разлагающего агента, например фермента, который может разлагать биомолекулу, если она незащищена. То есть, биомолекулу защищают от разложения с использованием керамической матрицы.
В некоторых вариантах изобретения рассматривается полимер или комплекс-образующий агент, который может находиться в порах частиц вместе с биомолекулой, что облегчает их эндосомное высвобождение. Обычно, полимер может представлять собой полиэтиленамин, полилизин, полигистидин или любое вещество, обладающее эффектом протонной губки.
Образование микрочастиц (>100 нм)
В некоторых вариантах изобретения может оказаться предпочтительным, чтобы образующиеся частицы имели размер в микродиапазоне. То есть, в данном описании, средний размер частиц составляет более чем 100 нм.
В соответствии с другим своим аспектом, настоящее изобретение относится к способу получения частиц, содержащих биомолекулу, диспергированную в порах этих частиц, где указанный способ включает:
a) объединение:
гидрофобной фазы, содержащей гидрофобную жидкость, первый керамический предшественник и поверхностно-активное вещество; и
гидрофильной фазы, содержащей гидрофильную жидкость, второй керамический предшественник и биомолекулу;
с образованием эмульсии, содержащей капельки гидрофильной фазы, диспергированной в гидрофобной фазе; и
b) перемешивание эмульсии по мере формирования частиц внутри капелек;
где первый керамический предшественник содержит функциональную группу, способную стимулировать проникновение частиц в клетки.
Используемый здесь термин «перемешивание» охватывает любой способ перемешивания, включая, но не ограничиваясь ими, размешивание, встряхивание, вихревое перемешивание, обработку ультразвуком, фрагментирование и т.п., и любую их комбинацию.
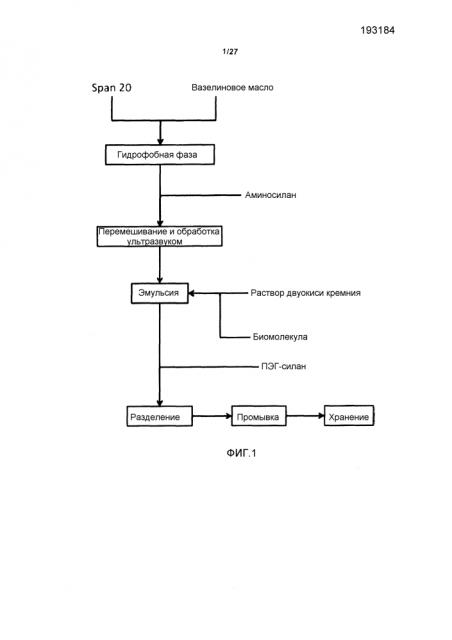
При изготовлении частиц, эмульсия образуется при объединении гидрофобной фазы с гидрофильной фазой. Такая эмульсия может представлять собой эмульсию типа «вода в масле» (w/o), в которой гидрофобная фаза представляет собой непрерывную фазу, а гидрофильная фаза представляет собой дисперсную или дискретную фазу.
Гидрофобной фазой может быть олеофильная фаза или липофильная фаза. Гидрофобная фаза может быть получена путем объединения поверхностно-активного вещества с гидрофобной жидкостью и добавления первого керамического предшественника с образованием гидрофобной фазы, либо она может быть получена путем объединения всех трех компонентов, либо она может быть получена путем объединения первого керамического предшественника с гидрофобной жидкостью или с поверхностно-активным веществом с последующим добавлением другого компонента. Эти стадии, предпочтительно, проводят перед объединением гидрофобной и гидрофильной фаз. Каждая стадия объединения может включать перемешивание компонентов, которые были предварительно объединены. Такое перемешивание может включать размешивание, встряхивание, вихревое перемешивание, обработку ультразвуком или их комбинацию. Такое перемешивание компонентов может быть достаточным для образования раствора. Таким образом, гидрофобная фаза может представлять собой раствор первого керамического предшественника и поверхностно-активного вещества в гидрофобной жидкости.
Гидрофобная фаза содержит 3 компонента:
Гидрофобную жидкость, которая может представлять собой, например, растительное масло, вазелиновое масло, минеральное масло или какую-либо другую подходящую гидрофобную жидкость. Гидрофобная жидкость может содержать смесь гидрофобных компонентов, например, смесь растительных масел или смесь растительного масла и вазелинового масла. Такая жидкость имеет, в основном, умеренную вязкость, например, приблизительно 0,5 - приблизительно 1500 мПа·с, или приблизительно 0,5-1000, 0,5-500, 0,5-250, 0,5-100, 0,5-50, 0,5-20, 0,5-0, 0,5-5, 0,5-1, 1-500, 10-1500, 100-1500, 250-1500, 500-1500, 1000-1500, 10-1000, 10-200, 200-1000 или 200-500 мПа·с, например, приблизительно 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400 или 1500 мПа·с, или, в· некоторых случаях, более чем 1500 мПа·с. Вязкость гидрофобной жидкости может быть использована для регуляции размера частиц, полученных этим способом. Таким образом, более вязкая гидрофобная жидкость, в основном, создает более вязкую гидрофобную фазу, что, в свою очередь, обычно приводит к уменьшению размера частиц.
Поверхностно-активное вещество, которое может представлять собой подходящее поверхностно-активное вещество для сохранения эмульсии «вода в масле». Такое поверхностно-активное вещество может растворяться в гидрофобной жидкости или смешиваться с этой жидкостью. Таким поверхностно-активным веществом может быть неионное поверхностно-активное вещество или анионное поверхностно-активное вещество, либо цвиттерионное поверхностно-активное вещество. Такое поверхностно-активное вещество может иметь ГЛБ, составляющий приблизительно от 8 до 16, или приблизительно 8-12, 10-16 или 8-10, например, приблизительно 8, 9, 10, 11, 12, 13, 14, 15 или 16. Подходящими поверхностно-активными веществами являются Span® 20 (монолаурат сорбитана), Aerosol® OT (бис(2-этилгексил)сульфосукцинат натрия), смеси Span® 20/Tween® 80 и смеси Span® 20/Brij® 35. При использовании смешанных поверхностно-активных веществ обычно получают в высокой степени тонкодисперсную эмульсию, но конечный размер частиц обычно остается неизменным.
Первый керамический предшественник, который представляет собой компонент, включающий функциональную группу, способную стимулировать проникновение полученных частиц в клетки. В некоторых вариантах изобретения, функциональная группа первого керамического предшественника обладает способностью химически взаимодействовать, например электростатически взаимодействовать с биомолекулой.
Этот компонент может иметь, например, функциональную аминогруппу. Альтернативно, могут быть использованы и другие положительно заряженные группы или группы, которые могут сообщать положительный заряд. Может быть использовано соединение, имеющее по меньшей мере одну аминогруппу на молекулу и способное превращаться в керамическую матрицу, имеющую функциональную аминогруппу. Это соединение может растворяться в гидрофобной жидкости или в смеси (необязательно в растворе) поверхностно-активного вещества в гидрофобной жидкости.
Подходящими керамическими предшественниками являются силаны, имеющие функциональную амингруппу, в частности алкоксисиланы, имеющие функциональную аминогруппу. Алкоксигруппами таких силанов могут быть, например, C1-C6-алкоксигруппы (которые могут быть разветвленными, если они имеют 3 атома углерода или более), а обычно C1-C4-алкоксигруппы например метокси-, этокси-, пропокси-, изопропокси- или бутоксигруппы. В некоторых случаях могут быть использованы и другие гидролизуемые группы, например ацетокси, кетоксимо, энолокси и т.п. Керамический предшественник с функциональной аминогруппой может иметь более чем одну аминогруппу на молекулу, например, 2, 3, 4 или 5 аминогрупп на молекулу. Авторами настоящего изобретения было обнаружено, что керамические предшественники, имеющие диамино- и триаминогруппу, обычно образуют частицы, которые более эффективно связываются с подходящими биомолекулами, чем соответствующие керамические предшественники, имеющие моно-аминогруппу. Каждая аминогруппа независимо может представлять собой первичную, вторичную или третичную аминогруппу. В предпочтительных предшественниках, аминогруппы разделены линкерными группами, обычно короткими алкиленовыми цепями, такими как этиленовая (-CH2CH2-), пропиленовая (-CH2CH2CH2-) или бутиленовая (-CH2CH2CH2CH2-) цепи. Авторы настоящего изобретения считают, что бутиленовая группа является особенно предпочтительной, поскольку она присутствует в природных полиамин-полинуклеотидных лигандах, таких как путресцин (N-4-N), спермидин (N-3-N-4-N) и спермин (N-3-N-4-N-3-N). При этом могут быть использованы различные комбинации, включающие пентилен и гексилен, однако группы, которые очень отличаются друг от друга по своей биогенной конфигурации, могут быть токсичными. В частности, авторы настоящего изобретения считают, что этиленовые спейсеры создают некоторое расстояние между аминогруппами, которые находятся достаточно близко от зарядов в киРНК и присутствуют в коммерчески доступных продуктах, что делает этот спейсер подходящим для применения в случае, если биомолекулой является киРНК. Такими подходящими предшественниками являются 3-(2-аминоэтиламино)пропилтриметоксисилан, 3-[2-(2-аминоэтиламино)этиламино]пропилтриметоксисилан, 3-(2- аминоэтиламино)пропилтриэтоксисилан или 3-[2-(2- аминоэтиламино)этиламино]пропилтриэтоксисилан и смеси любых двух или более таких соединений. Другими соединениями, которые могут быть использованы в качестве первого керамического предшественника, являются: триалкоксисилан, содержащий пропилкарбамид; алкоксисиланы с функциональным изоцианатом; алкоксисиланы с функциональной карбоксильной группой; алкоксисиланы с функциональной меркаптогруппой (например, меркаптопропилтриалкоксисиланы), катионные пептиды или углеводы или липиды, присоединенные к алкоксисиланам и т.п. Могут быть также использованы смеси любых двух или более этих предшественников или любых других подходящих первых керамических предшественников.
В некоторых случаях, первым керамическим предшественником может быть смесь. Таким предшественником может быть смесь силановых керамических предшественников. Указанные предшественники могут дополнительно содержать один или более не-силановых керамических предшественников, например предшественник на основе двуокиси циркония, предшественник на основе оксида алюминия или предшественник на основе оксида титана. Такими предшественниками могут быть, например, алкоксиды циркония, алкоксиды алюминия и алкоксиды титана соответственно.
Обычно отношение поверхностно-активного вещества к гидрофобной жидкости составляет приблизительно 5-25% масс./об. (то есть, приблизительно от 5 до 25 г поверхностно-активного вещества на 100 мл гидрофобной жидкости) или приблизительно 5-20, 5-15, 10-25, 15-25 или 10-20%, например приблизительно 5, 10, 15, 20 или 25%.
Обычно отношение первого керамического предшественника к гидрофобной жидкости составляет приблизительно 10-1000 м.д. по объему, или приблизительно 10-500, 10-200, 10-100, 10-50, 20-1000, 50-1000, 100-1000, 200-1000, 500-1000, 20-500, 50-500, 50-200, 200-500 или 50-200 м.д., например, приблизительно 10, 20, 304, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900 или 1000 м.д.
Гидрофильной фазой может быть липофобная фаза. Такой фазой может быть водная фаза. Гидрофильная фаза содержит три компонента:
Гидрофильную жидкость, которая может быть липофобной. Такая жидкость обычно содержит воду, например, она может представлять собой воду, включая чистую воду, или водный раствор. Такая жидкость может также содержать растворенные соли.
Второй керамический предшественник, который может представлять собой водорастворимый силикат, в частности метасиликат. Такой предшественник сам по себе может быть силикатом (например, образующимся в результате гидролиза тетраалкилсиликата, такого как тетраметилортосиликат или тетраэтилортосиликат) либо он может представлять собой молекулу формулы RSi(OR')xOHySiz, где x+y+z=3 (называемую здесь алкилсиликатом, полученным, например, путем гидролиза алкилтриалкоксисилана, например, метилтриметоксисилана или этилтриметоксисилана). В случае алкилсиликата, алкильная группа R должна быть достаточно небольшой или в достаточной степени гидрофильной, то есть, чтобы она сообщала второму керамическому предшественнику растворимость в воде. Следует отметить, что это может быть достигнуто, например, путем введения небольших групп R, таких как метил или этил, или более крупных групп R, имеющих гидрофильные или полярные заместители, такие как гидроксил, нитро, сульфат и т.п.
Вторым керамическим предшественником может быть, например, жидкое стекло. Жидкое стекло представляет собой олигомерное или полимерное силикатное вещество, имеющее эмпирическую формулу приблизительно Na2SiO3 и способное подвергаться гидратации в различной степени, обычно в водном растворе. Жидкое стекло может иметь содержание твердых веществ приблизительно 1-20% или приблизительно 1-10, 1-5, 1-2, 2-20, 5-20, 10-20, 2-10, 2-5 или 5-10%, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20%. Такое жидкое стекло может иметь приблизительно 25-30% двуокиси кремния и приблизительно 1 - приблизительно 20% гидроксида натрия в воде. Оно может быть разведено в воде в отношении приблизительно 1:2 - приблизительно 1:10, или приблизительно 1:2-1:5, 1:5-1:10 или 1:3-1:8, например, приблизительно 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 или 1:10.
Вторым керамическим предшественником может быть также алкоксид титана (например, этоксид, н-пропоксид и изопропоксид, н-бутоксид, втор-бутоксид и трет-бутоксид), или алкоксид алюминия, или алкоксид циркония, или модифицированный алкоксид металла (например, модифицированный ацетилацетоном или уксусной кислотой). Этот предшественник может также представлять собой смешанный алкоксид металла. Он может также представлять собой соль другого металла, такую как соль магния, соль циркония или соль алюминия, которые образуют силикат магния, алюмо-силикат и т.п. Он может также представлять собой предварительно гидролизованный алкоксид кремния.
Второй керамический предшественник может содержать керамический коллоид, например коллоидную двуокись кремния. Керамический коллоид может иметь частицы диаметром менее 50 нм или приблизительно менее 40, 30, 20 или 10 нм, или приблизительно 5-50 нм, или приблизительно 5-20, 5-10, 10-50, 20-50 или 10-20 нм. Такой керамический коллоид может иметь диаметр частиц (обычно средний диаметр частиц, и, необязательно, максимальный диаметр частиц), составляющий приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 45 или 50 нм.
В некоторых случаях, второй керамический предшественник может содержать комбинацию из двух или более вышеуказанных вариантов, например он может содержать смесь водного раствора силиката и коллоидной двуокиси кремния.
Биомолекула представляет собой различные варианты биомолекул, описанных выше. Как указывалось выше, такая биомолекула может быть отрицательно заряженной, либо она может быть нейтральной. Такая биомолекула может иметь отрицательный заряд, достаточный для ее присоединения к функциональной группе частиц и, необязательно, для ее связывания с такой функциональной группой (происходящей от первого керамического предшественника). Указанная биомолекула может представлять собой или содержать РНК, например, киРНК (короткую интерферирующую РНК), миРНК (микроРНК), ASODN (антисмысловой нуклеотид или антисмысловую РНК), аптамер, ДНК, белок, гликопротеин, полипептид, углевод или смесь или аддукт любой из двух или более из перечисленных здесь молекул.
Кроме того, полимер или комплекс-образующий агент могут быть добавлены так, чтобы они осаждались в порах частиц вместе с биомолекулой для облегчения ее эндосомного высвобождения. Обычно, полимер может представлять собой полиэтиленамин, полилизин, полигистидин или любое вещество, обладающее эффектом протонной губки.
Гидрофильная фаза может быть кислотной. Она может иметь рН ниже pKa первого керамического предшественника (или его кислоты, если таким керамическим предшественником является основание, например, керамический предшественник с функциональной аминогруппой). Гидрофильная фаза может иметь рН менее чем приблизительно 10,5, или менее чем приблизительно 10, 9, 8, 7, 6, 5,5, 5, 4,5 или 4, или в пределах приблизительно 3-10,5, 5-10,5, 7-10,5, 9-10,5, 7-10, 9-4, 7-4, 9-7, 5-7, 3-6 или приблизительно 3-5, 3-4, 4-6, 4-5 или 3,5-4,5, например, приблизительно 3, 3,5, 4, 4,5, 5, 5,5 или 6.
Обычно при получении гидрофильной фазы, гидрофильную жидкость и второй керамический предшественник объединяют, причем второй керамический предшественник растворяют, но необязательно, в гидрофильной жидкости. Такой способ может включать последующее доведение pH первого керамического предшественника до значения ниже pKa, например, до pH менее чем приблизительно 10,5, или до кислотного pH, например, до pH менее чем приблизительно 7, или менее чем приблизительно 5, или менее чем приблизительно 4, и добавление биомолекулы с образованием гидрофильной фазы. Так, например, если вторым керамическим предшественником является жидкое стекло или коллоидная двуокись кремния, то в этом случае обычно образуется основный раствор. Поэтому, такой способ может включать подкисление указанного раствора.
Обычно подкисление осуществляют путем обработки раствора катионообменной смолой, где указанная смола, перед такой обработкой, присутствует в кислотной (протонированной) форме. Обработка может включать объединение смолы и раствора, размешивание, но необязательно, полученной смеси, а затем отделение смолы от подкисленного раствора (например, путем фильтрации, декантирования, центрифугирования и т.п.) либо она может включать пропускание раствора через слой смолы. Отношение смолы ко второму керамическому предшественнику может быть скорректировано так, чтобы достигался нужный рН (как описано выше). Альтернативно, второй керамический предшественник может быть подкислен путем добавления подкисляющего агента (например, кислоты) или подходящего буфера.
Обычно биомолекулу добавляют к подкисленному раствору непосредственно перед объединением гидрофильной фазы и гидрофобной фазы. Такая биомолекула может быть добавлена непосредственно перед объединением этих фаз. Она может быть добавлена приблизительно менее чем за 2 минуты до объединения фаз, или приблизительно менее чем за 1 минуту, или приблизительно менее чем за 50, 40, 30, 20, 15 или 10 секунд, например, приблизительно за 5, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90, 100, 110 или 120 секунд до объединения фаз. Это снижает вероятность вступления биомолекулы в нежелательные химические реакции. Биомолекула может присутствовать в гидрофильной фазе в количестве, достаточном для достижения ее желательной загрузки в конечные частицы. Типичная концентрация биомолекулы в гидрофильной фазе составляет приблизительно 1-10 мг/мл, или приблизительно 1-5, 5-10 или 2-8, например, приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 мг/мл. Биомолекула может быть добавлена к объединенной гидрофильной жидкости/второму керамическому предшественнику в форме раствора. Растворитель для этого раствора должен смешиваться с гидрофильной жидкостью и, в основном, он должен быть таким же, как гидрофильная жидкость. Биомолекула может быть добавлена в виде водного раствора.
При получении эмульсии, гидрофобную и гидрофильную фазы объединяют при перемешивании, но необязательно. Перемешивание может включать одну или несколько процедур смешивания, встряхивания, вихревого перемешивания и обработки ультразвуком. Эффективным способом приготовления эмульсии является получение гидрофобной фазы, описанной выше, и одновременное перемешивание и обработка ультразвуком при добавлении гидрофильной фазы. Затем получают гидрофильную фазу путем объединения биомолекулы со вторым керамическим предшественником, объединенным с гидрофильной жидкостью (например, с подкисленным водным раствором жидкого стекла), а затем полученную гидрофильную фазу добавляют, как можно быстрее, к обработанной ультразвуком и к перемешанной гидрофобной фазе, продолжая обработку ультразвуком. Обработка ультразвуком может быть продолжена в течение непродолжительного периода времени после добавления, например, приблизительно в течение 10-120 секунд, или приблизительно 10-60, 10-30, 20-120, 60-120, 20-60 или 20-40 секунд, например, приблизительно 10, 20, 30, 40, 50, 60, 90 или 120 секунд. Обработку ультразвуком обычно прекращают через соответствующий период времени в целях предотвращения перегревания эмульсии. Такое перегревание может, например, негативно влиять на биомолекулу. Обработка ультразвуком может быть осуществлена при мощности приблизительно 200-2000 Вт, или приблизительно 200-1000, 200-500, 500-2000, 1000-2000, 500-1000 или 600-800 Вт, например, приблизительно 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1200, 1400, 1600, 1800 или 2000 Вт.
Отношение гидрофобной фазы к гидрофильной фазе может составлять приблизительно 10-50 (то есть, приблизительно 10:1-50:1) или приблизительно 10-40, 10-30, 10-20, 20-50, 30-50, 40-50, 20-40 или 25-25, например, приблизительно 10, 15, 20, 25, 30, 35, 40, 45 или 50.
При этом может оказаться достаточным, чтобы молярное отношение первого керамического предшественника ко второму керамическому предшественнику составляло приблизительно 0,2-20 моль%, или приблизительно 0,5-20, 1-20, 2-20, 5-20, 10-20, 0,2-10, 0,2-5, 0,2-2, 0,2-1, 1-10, 1-5 или 5-10, например, приблизительно 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 моль%. В случае, если первый керамический предшественник представляет собой или содержит силан с функциональной аминогруппой, то отношение первого керамического предшественника ко второму керамическому предшественнику может варьироваться в целях изменения заряда на частицах. Таким образом, если количество первого керамического предшественника является небольшим (например, приблизительно 1 моль% по отношению ко второму керамическому предшественнику), то такие частицы являются почти нейтральными, а при большем количестве (приблизительно 10 моль%), они являются положительно заряженными. Если силан с функциональной аминогруппой не добавляли (или добавляли в очень небольших количествах, например, приблизительно менее чем 0,5 моль%), то частицы могут быть отрицательно заряженными.
В эмульсии, полученной как описано выше, капельки гидрофильной фазы могут иметь средний диаметр приблизительно 0,1-10 микрон, или приблизительно 0,1-5, 0,1-2, 0,1-1, 0,1-0,5, 0,2-10, 0,5-10, 1-10, 2-10, 5-10, 0,2-2, 0,2-1 , 0,2-0,5, 0,5-2 или 0,5-1 микрон, например, приблизительно 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9 или 10 микрон. Средняя величина диаметра может быть среднечисленно