Пептиды neil3 и включающие их вакцины
Иллюстрации
Показать всеНастоящее изобретение относится к области иммунологии. Предложен выделенный пептид, обладающий способностью индуцировать цитотоксические Т-лимфоциты (CTL) против белка NEIL3 в присутствии антигенпредставляющей клетки (АРС), несущей HLA-A*0201 и/или HLA-A*0206. Также описаны: выделенный полинуклеотид, кодирующий пептид по изобретению, и вектор для экспрессии указанного пептида в клетке-хозяине. Кроме того, рассмотрено применение пептида, АРС и экзосомы по изобретению в качестве активного ингредиента в изготовлении фармацевтической композиции для лечения или предотвращения опухоли; композиция для индукции CTL и фармацевтическая композиция для лечения или профилактики злокачественных опухолей, экспрессирующих NEIL3, и/или предотвращения их послеоперационного рецидива. Представлены АРС и экзосома, обладающие способностью индуцировать CTL, способы индукции АРС и CTL, а также способ индукции иммунного ответа против злокачественной опухоли, экспрессирующей NEIL3 у субъекта. Данное изобретение может найти дальнейшее применение в терапии заболеваний, характеризующихся повышенной экспрессией NEIL3. 11 н. и 3 з.п. ф-лы, 9 ил., 4 табл.
Реферат
Область техники
По настоящей заявке испрашивается приоритет Предварительной заявки США № 61/210512, поданной 18 марта 2009 г., полное содержание которой приведено в настоящем документе в качестве ссылки.
Настоящее изобретение относится к области биологической науки, более конкретно - к области терапии злокачественных опухолей. В частности, настоящее изобретение относится к новым пептидам, являющимся чрезвычайно эффективными в качестве противораковых вакцин и лекарственных средств для лечения и предотвращения опухолей.
Предпосылки изобретения
Показано, что CD8-положительные CTL узнают пептиды-эпитопы, происходящие из опухолеассоциированных антигенов (TAA), на молекуле главного комплекса гистосовместимости (MHC) класса I, и затем уничтожают клетки опухолей. Со времени открытия семейства антигенов меланомы (MAGE) как первого примера TAA множество других TAA открыто иммунологическими способами (NPL 1/Boon T, Int J Cancer 1993 May 8, 54(2):177-80; NPL 2/Boon T & van der Bruggen P, J Exp. Med. 1996 Mar 1, 183(3):725-9), и некоторые из TAA в настоящее время находятся в процессе клинической разработки в качестве иммунотерапевтических мишеней.
Идентификация новых TAA, индуцирующих сильные и специфические противоопухолевые иммунные ответы, обеспечивает дальнейшее развитие клинического применения способа пептидной вакцинации при различных типах злокачественных опухолей (NPL 3/Harris C.C, J Natl. Cancer Inst 1996 Oct 16, 88(20):1442-55; NPL 4/Butterfield L.H. et al., Cancer Res 1999 Jul 1, 59(13): 3134-42; NPL 5/Vissers J.L. et al., Cancer Res 1999 Nov 1, 59(21):5554-9; NPL 6/van der Burg S.H. et al., J Immunol. 1996 May 1, 156(9):3308-14; NPL 7/Tanaka F. et al., Cancer Res 1997 Oct 15, 57(20):4465-8; NPL 8/Fujie T. et al., Int J Cancer 1999 Jan 18, 80(2):169-72; NPL 9/Kikuchi M. et al., Int J Cancer 1999 May 5, 81(3):459-66; NPL 10/Oiso M. et al., Int J Cancer 1999 May 5, 81(3):387-94). До настоящего времени опубликовано несколько клинических исследований с использованием этих пептидов, происходящих из опухолеассоциированных антигенов. К сожалению, только низкую частоту объективных ответов можно наблюдать в этих исследованиях противораковых вакцин до настоящего времени (NPL 11/Belli F et al., J Clin. Oncol. 2002 Oct 15, 20(20):4169-80; NPL 12/Coulie PG et al., Immunol. Rev 2002 Oct, 188:33-42; NPL 13/Rosenberg SA et al., Nat. Med. 2004 Sep, 10(9):909-15).
Преимущественные в качестве мишени для иммунотерапии TAA являются необходимыми для пролиферации и выживаемости клеток злокачественных опухолей, поскольку применение таких TAA может минимизировать хорошо описанный риск ускользания от иммунного ответа клеток злокачественных опухолей, связанного с делецией, мутацией или понижающей регуляцией TAA в качестве последствия терапевтически направляемого иммунного отбора.
С другой стороны, подобный эндонуклеазе Nei VIII белок 3 (NEIL3) выделили в качестве члена, принадлежащего к классу ДНК-гликозилаз, гомологичных семейству бактериальных Fpg/Nei (NPL 14/Bandaru et al., DNA Repair (Amst). 2002 Jul 17; 1(7):517-29). Эти гликозилазы инициируют первую стадию в эксцизионной репарации оснований посредством расщепления оснований, поврежденных реакционноспособными видами кислорода, и введения разрыва цепи ДНК посредством ассоциированной лиазной реакции. NEIL3, по-видимому, играет роль в механизме репарации ДНК, однако его связь с канцерогенезом не выяснена.
Список ссылок
Непатентная литература
[NPL 1] Boon T, Int J Cancer 1993 May 8, 54(2):177-80
[NPL 2] Boon T. & van der Bruggen P, J Exp. Med. 1996 Mar 1, 183(3):725-9
[NPL 3] Harris C.C, J Natl. Cancer Inst 1996 Oct 16, 88(20):1442-55
[NPL 4] Butterfield L.H et al., Cancer Res 1999 Jul 1, 59(13):3134-42
[NPL 5] Vissers J.L. et al., Cancer Res 1999 Nov 1, 59(21):5554-9
[NPL 6] van der Burg S.H. et al., J Immunol. 1996 May 1, 156(9):3308-14
[NPL 7] Tanaka F. et al., Cancer Res 1997 Oct 15, 57(20):4465-8
[NPL 8] Fujie T. et al., Int J Cancer 1999 Jan 18, 80(2):169-72
[NPL 9] Kikuchi M. et al., Int J Cancer 1999 May 5, 81(3):459-66
[NPL 10] Oiso M. et al., Int J Cancer 1999 May 5, 81(3):387-94
[NPL 11] Belli F. et al., J Clin. Oncol. 2002 Oct 15, 20(20):4169-80
[NPL 12] Coulie P.G. et al., Immunol. Rev 2002 Oct, 188:33-42
[NPL 13] Rosenberg S.A. et al., Nat Med 2004 Sep, 10(9):909-15
[NPL 14] Bandaru et al., DNA Repair (Amst). 2002 Jul 17; 1(7):517-29
Краткое изложение сущности изобретения
Настоящее изобретение основано, по меньшей мере, частично на открытии применимых мишеней для иммунотерапии. Поскольку TAA в основном узнаются иммунной системой как «свое», и, таким образом, часто не обладают иммуногенностью, открытие подходящих мишеней обладает чрезвычайной важностью. Как указано выше, NEIL3 (SEQ ID NO:45, кодируемый геном с инвентарным № в GenBank NM_018248 (например, SEQ ID NO:44)) идентифицирован как обладающий повышающей регуляцией в злокачественных опухолях, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, немелкоклеточный рак легкого (NSCLC), остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, мелкоклеточный рак легкого (SCLC), опухоль мягких тканей, острый миелоидный лейкоз (AML) и хронический миелоидный лейкоз (CML). Таким образом, NEIL3 является кандидатом на мишень для иммунотерапии злокачественных опухолей/опухолей.
Настоящее изобретение основано, по меньшей мере, частично на идентификации специфических пептидов-эпитопов продуктов генов NEIL3, обладающих способностью индуцировать CTL, специфические для NEIL3. Как подробно обсуждают ниже, мононуклеарные клетки периферической крови (PBMC), полученные от здорового донора, стимулировали с использованием связывания HLA-A*2402 или HLA-A*0201 с пептидами-кандидатами, происходящими из NEIL3. Получены линии CTL со специфической цитотоксичностью против положительных по HLA-A24 или HLA-A2 клеток-мишеней, сенсибилизированных каждым из пептидов-кандидатов. Эти результаты показывают, что эти пептиды представляют собой рестриктированные по HLA-A24 или HLA-A2 пептиды-эпитопы, которые могут индуцировать сильные и специфические иммунные ответы против клеток, экспрессирующих NEIL3. Кроме того, они показывают, что NEIL3 является сильно иммуногенным, и его эпитопы представляют собой эффективные мишени для иммунотерапии злокачественных опухолей/опухолей.
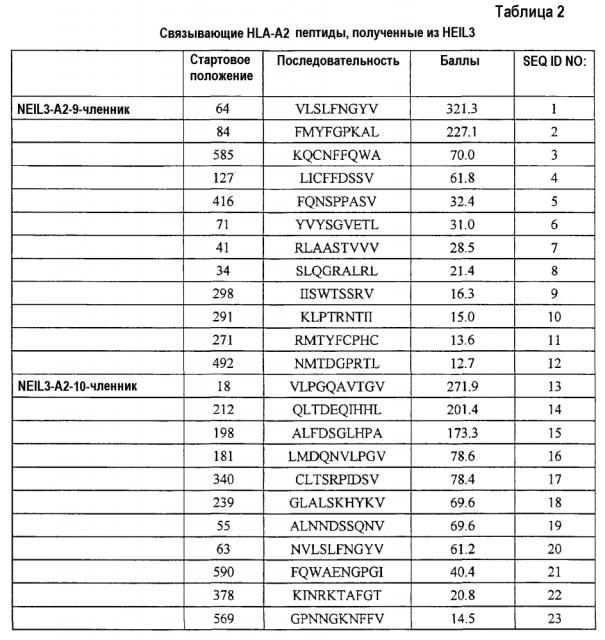
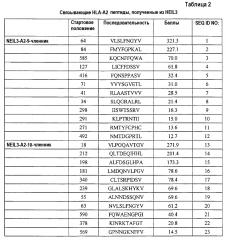
Соответственно, настоящее изобретение относится к выделенным пептидам, связывающимся с антигеном HLA, состоящим из NEIL3 (SEQ ID NO:45) или его иммунологически активных фрагментов. Ожидают, что эти пептиды обладают способностью индуцировать CTL, и их можно использовать для индукции CTL ex vivo или для введения субъекту для индукции иммунных ответов против злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, эндометриоз, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, SCLC и AML. Предпочтительно, эти пептиды представляют собой нонапептид или декапептид и, более предпочтительно, состоят из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:1-43. В частности, для пептидов, состоящих из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, показали сильную способность индуцировать CTL.
Пептиды по настоящему изобретению включают в себя пептиды, в которых одна, две или более аминокислот заменены, делетированы или добавлены, при условии, что модифицированные пептиды сохраняют исходную способность индуцировать CTL.
Кроме того, настоящее изобретение относится к выделенным полинуклеотидам, кодирующим любые пептиды по настоящему изобретению. Эти полинуклеотиды можно использовать для индукции или получения APC со способностью индуцировать CTL или с возможностью введения субъекту для индукции иммунных ответов против злокачественных опухолей, также как настоящие пептиды.
При введении субъекту настоящие пептиды являются представленными на поверхности APC и затем индуцируют CTL, нацеленные на соответствующие пептиды. Таким образом, один из аспектов настоящего изобретения относится также к композициям или веществам, включающим любые пептиды или полинуклеотиды по настоящему изобретению, для индукции CTL. Более того, композиции или вещества, включающие любые пептиды или полинуклеотиды, можно использовать для лечения и/или профилактики злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML, и/или предотвращения их послеоперационного рецидива. Таким образом, настоящее изобретение также относится к фармацевтическим композициям или веществам для лечения и/или профилактики злокачественных опухолей, и/или предотвращения их послеоперационного рецидива, включающим любые пептиды или полинуклеотиды по настоящему изобретению. Настоящие фармацевтические композиции или вещества могут включать APC или экзосомы, представляющие любой из настоящих пептидов, вместо/помимо настоящих пептидов или полинуклеотидов в качестве активных ингредиентов.
Пептиды или полинуклеотиды по настоящему изобретению могут индуцировать APC, представляющие на своей поверхности комплекс антигена HLA и настоящего пептида, например, посредством приведения APC, полученных от субъекта, в контакт с пептидом или введения полинуклеотида, кодирующего пептид по настоящему изобретению, в APC. Такие APC обладают сильной способностью индуцировать CTL против пептидов-мишеней и находят применение в иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к способам индукции APC со способностью индуцировать CTL и к APC, полученным этими способами.
Настоящее изобретение также относится к способу индукции CTL, включающему в себя стадию совместного культивирования CD8-положительных клеток с APC или экзосомами, представляющими пептид по настоящему изобретению на своей поверхности, или стадию введения гена, включающего полинуклеотид, кодирующий полипептид субъединицы T-клеточного рецептора (TCR), связывающей настоящий пептид. CTL, полученные этими способами, могут находить применение для лечения и/или профилактики злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML. Таким образом, настоящее изобретение относится к CTL, полученным настоящими способами.
Более того, настоящее изобретение относится к способам индукции иммунного ответа против злокачественных опухолей, где способы включают в себя стадию введения композиций или веществ, включая полипептиды NEIL3 или их иммунологически активные фрагменты, полинуклеотиды, кодирующие полипептиды NEIL3, экзосомы или APC, представляющие полипептиды NEIL3.
Настоящее изобретение также относится к способу диагностики злокачественной опухоли, включая, в качестве неограничивающих примеров, злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Настоящее изобретение можно применять для любых заболеваний, связанных со сверхэкспрессией NEIL3, таких как злокачественная опухоль, где примеры злокачественных опухолей включают в себя злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Краткое описание фигур
[Фиг.1] На фиг.1 изображены фотографии, изображающие результаты анализа ELISPOT IFN-гамма для CTL, индуцированных с помощью пептидов, происходящих из NEIL3. Для CTL в лунке номер №8, стимулированных с помощью NEIL3-A2-9-585 (SEQ ID NO:3) (a), №2 - с помощью NEIL3-A2-9-127 (SEQ ID NO:4) (b), №4 и 5 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (c), №3 - с помощью NEIL3-A2-9-71 (SEQ ID NO:6) (d), №1 - с помощью NEIL3-A2-9-271 (SEQ ID NO:11) (e), №3 - с помощью NEIL3-A2-10-198 (SEQ ID NO:15) (f), №1 - с помощью NEIL3-A2-10-340 (SEQ ID NO:17) (g), №2 и 3 - с помощью NEIL3-A2-10-590 (SEQ ID NO:21) (h), №6 - с помощью NEIL3-A2-10-378 (SEQ ID NO:22) (i) и №9, 10, 12 и 13 - с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (j), показали сильную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих фигурах показывает, что клетки из соответствующей лунки размножали для получения линий CTL. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.2-1] На фиг.2-1 изображены линейные графики, показывающие продукцию IFN-гамма для линий CTL, стимулированных с помощью NEIL3-A2-585 (SEQ ID NO:3) (a), NEIL3-A2-9-127 (SEQ ID NO:4) (b), NEIL3-A2-9-416 (SEQ ID NO:5) (c)(d) и NEIL3-A2-9-71 (SEQ ID NO:6) (e), детектированную посредством анализа ELISA IFN-гамма. Они показывают, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» указывает на продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» указывает на продукцию IFN-гамма против клеток-мишеней не сенсибилизированных никакими пептидами.
[Фиг.2-2] На фиг.2-2 изображены линейные графики, показывающие продукцию IFN-гамма линий CTL, стимулированных с помощью NEIL3-A2-9-271 (SEQ ID NO:11) (f), NEIL3-A2-10-198 (SEQ ID NO:15) (g), NEIL3-A2-10-590 (SEQ ID NO:21) (h)(i) и NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (j)(k), детектированную посредством анализа ELISA IFN-гамма. Показано, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.3] На фиг.3 показана продукция IFN-гамма клонов CTL, полученных предельным разведением из линий CTL, стимулированных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (e) (для HLA-A0206). Показано, что для клонов CTL, полученных стимуляцией с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (e) (для HLA-A0206), показали сильную продукцию IFN-гамма по сравнению с контролем. На фигуре «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b), NEIL3-A2-10-198 (SEQ ID NO:15) (c), NEIL3-A2-10-590 (SEQ ID NO:21) (d) и NEIL3-A2-9-416 (SEQ ID NO:5) (для HLA-A0206) (e), и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.4-1] На фиг.4 показаны линейные графики, показывающие специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*0201 или HLA-A*0206. Клетки COS7, трансфицированные геном HLA-A*0201, HLA-A*0206 или полноразмерного NEIL3, получали в качестве контроля. Для клонов CTL, полученных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (a), NEIL3-A2-9-71 (SEQ ID NO:6) (b) и NEIL3-A2-10-198 (SEQ ID NO:15) (c), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*0201 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA (треугольники), либо NEIL3 (круги).
[Фиг.4-2] На фиг.4 изображены линейные графики, показывающие специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*0201 или HLA-A*0206. Клетки COS7, трансфицированные геном HLA-A*0201, HLA-A*0206 или полноразмерного NEIL3, получали в качестве контроля. Для клонов CTL, полученных с помощью NEIL3-A2-9-416 (SEQ ID NO:5) (d) (для HLA-A0206), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*0206 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA (треугольники), либо NEIL3 (круги).
[Фиг.5] На фиг.5 показаны фотографии, показывающие экспрессию NEIL3 при раке печени. На части A показана экспрессия NEIL3 в тканях при клиническом раке печени, оцененная полуколичественной RT-PCR. На части B показана экспрессия NEIL3 в линиях клеток HCC, оцененная полуколичественной RT-PCR.
[Фиг.6] На фиг.6 изображены фотографии, изображающие результаты анализа ELISPOT IFN-гамма для CTL, индуцированных с помощью пептидов, происходящих из NEIL3. Для CTL в лунке номер №7, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), №6 - с помощью NEIL3-A24-9-362 (SEQ ID NO:33) (b), №2 и №8 - с помощью NEIL3-A24-10-320 (SEQ ID NO:35) (c), №8 - с помощью NEIL3-A24-10-544 (SEQ ID NO:41) (d), №1 и №4 - с помощью NEIL3-A24-10-87 (SEQ ID NO:43) (e), показали сильную продукцию IFN-гамма по сравнению с контролем, соответственно. Квадрат на лунке на этих фигурах показывает, что клетки из соответствующей лунки размножали для получения линии CTL. В отличие от этого, в качестве типичного случая отрицательных данных, не показана специфическая продукция IFN-гамма из CTL, стимулированных с помощью NEIL3-A24-9-364 (SEQ ID NO:25) (f), против активированных пептидом клеток-мишеней. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.7] На фиг.7 изображены линейные графики, показывающие продукцию IFN-гамма для линий CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), NEIL3-A24-9-362 (SEQ ID NO:33) (b), NEIL3-A24-10-320 (SEQ ID NO:35) (c), NEIL3-A24-10-544 (SEQ ID NO:41) (d) и NEIL3-A24-10-87 (SEQ ID NO:43) (e), детектированную посредством анализа ELISA IFN-гамма. Показано, что для линий CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигурах «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.8] На фиг.8 изображены линейные графики, показывающие продукцию IFN-гамма для клонов CTL, полученных предельным разведением из линий CTL, стимулированных с помощью NEIL3-A24-9-545 (SEQ ID NO:24) (a), NEIL3-A24-10-320 (SEQ ID NO:35) (b) и NEIL3-A24-10-544 (SEQ ID NO:41) (c). Они показывают, что для клонов CTL, полученных стимуляцией с помощью каждого пептида, показали сильную продукцию IFN-гамма по сравнению с контролем. На фигуре «+» обозначает продукцию IFN-гамма против клеток-мишеней, сенсибилизированных соответствующим пептидом, и «-» обозначает продукцию IFN-гамма против клеток-мишеней, не сенсибилизированных никакими пептидами.
[Фиг.9] На фиг.9 изображен линейный график, показывающий специфическую активность CTL против клеток-мишеней с экзогенной экспрессией NEIL3 и HLA-A*2402. Клетки COS7, трансфицированные геном HLA-A*2402 или полноразмерного NEIL3, получали в качестве контрольных. Для клона CTL, полученного с помощью NEIL3-A24-9-545 (SEQ ID NO:24), показана специфическая активность CTL против клеток COS7, трансфицированных как NEIL3, так и HLA-A*2402 (черные ромбы). С другой стороны, не детектировали значительной специфической активности CTL против клеток-мишеней, экспрессирующих либо HLA-A*2402 (треугольники), либо NEIL3 (круги).
Описание вариантов осуществления
Хотя любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, можно использовать для практического осуществления или тестирования вариантов осуществления настоящего изобретения, в настоящее время описаны предпочтительные способы, устройства и материалы. Однако, до описания настоящих материалов и способов, следует понимать, что настоящее изобретение не является ограниченным конкретными размерами, формами, измерениями, материалами, способами, протоколами и т.д., описанными в настоящем документе, поскольку их можно менять, в соответствии с общепринятыми экспериментами и/или оптимизацией. Понятно также, что терминология, применяемая в описании, предназначена только для описания конкретных версий или вариантов осуществления и не предназначена для ограничения объема настоящего изобретения, который ограничен только прилагаемой формулой изобретения.
I. Определения
Варианты слов в единственном числе, как применяют в настоящем документе, означают «по меньшей мере один», если конкретно не указано иначе.
Термины «полипептид», «пептид» и «белок» используют в настоящем документе взаимозаменяемо, и они относятся к полимеру из остатков аминокислот. Термины применяют к аминокислотным полимерам, в которых один или более остаток(остатков) аминокислот могут представлять собой модифицированный остаток(остатки), или неприродный остаток(остатки), такой как искусственный химический миметик(и) соответствующей природной аминокислоты(аминокислот), также как к природным аминокислотным полимерам.
Термин «аминокислота», как применяют в настоящем документе, относится к природным и синтетическим аминокислотам, также как к аналогам аминокислот и миметикам аминокислот с функцией, сходной с функцией природных аминокислот. Аминокислота может представлять собой L-аминокислоту или D-аминокислоту. Природными аминокислотами являются аминокислоты, кодируемые генетическим кодом, также как аминокислоты, модифицированные после трансляции в клетках (например, гидроксипролин, гамма-карбоксиглутамат и O-фосфосерин). Словосочетание «аналог аминокислоты» относится к соединениям, обладающим такой же основной химической структурой (альфа-углеродный атом, связанный с водородом, карбокси-группой, аминогруппой и R-группой), как природная аминокислота, но обладающим одной или более модифицированной R группой(группами) или модифицированными остовами (например, гомосерин, норлейцин, метионин, сульфоксид, метионин-метил-сульфоний). Словосочетание «миметик аминокислоты» относится к химическим соединениям, обладающим различными структурами, но сходными функциями с главными аминокислотами.
Аминокислоты можно обозначать в настоящем документе их общеизвестными трехбуквенными символами или буквенными символами, рекомендованными Комиссией по Биохимической номенклатуре IUPAC-IUB.
Термины «ген», «полинуклеотиды», «нуклеотиды» и «нуклеиновые кислоты» используют взаимозаменяемо в настоящем документе и, если конкретно не указано иначе, они являются сходными с аминокислотами, обозначаемыми их общепринятыми однобуквенными кодами.
Если не определено иначе, термин «злокачественная опухоль» относится к злокачественным опухолям со сверхэкспрессией гена NEIL3, неограничивающие примеры которых включают в себя злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, холангиоцеллюлярную карциному, злокачественную опухоль ободочной и прямой кишки, эндометриоз, злокачественную опухоль пищевода, злокачественную опухоль печени, NSCLC, остеосаркому, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, карциному почки, SCLC, опухоль мягких тканей, AML и CML.
Если не определено иначе, термины «цитотоксический T-лимфоцит», «цитотоксическая T-клетка» и «CTL» используют взаимозаменяемо в настоящем документе, и если конкретно не указано иначе, они относятся к подгруппе T-лимфоцитов, способных узнавать не свои клетки (например, клетки опухолей/злокачественных опухолей, инфицированные вирусом клетки) и индуцировать гибель таких клеток.
Если не определено иначе, термин «HLA-A24» относится к типу HLA-A24, содержащему подтипы, такие как HLA-A*2402.
Если не определено иначе, термин «HLA-A2», как применяют в настоящем документе, относится к репрезентативным подтипам, таким как HLA-A*0201 и HLA-A*0206.
Если не определено иначе, термин «набор», как применяют в настоящем документе, используют для обозначения комбинации реагентов и других материалов. В настоящем документе предусмотрено, что набор может включать в себя микромассив, чип, маркер и т.д. Не предусмотрено, что термин «набор» является ограниченным конкретной комбинацией реагентов и/или материалов.
Если не определено иначе, все технические и научные термины, применяемые в настоящем документе, обладают таким же значением, какое является общепринятым для специалиста в области, к которой относится настоящее изобретение.
II. Пептиды
Чтобы показать, что пептиды, происходящие из NEIL3, функционируют как антиген, узнаваемый CTL, пептиды, происходящие из NEIL3 (SEQ ID NO:45), анализировали, чтобы определить, являются ли они антигенными эпитопами, рестриктированными по HLA-A24 или A2, которые являются часто встречающимися аллелями HLA (Date Y et al., Tissue Antigens 47:93-101, 1996; Kondo A. et al., J Immunol. 155:4307-12, 1995; Kubo R.T. et al., J Immunol. 152:3913-24, 1994).
Кандидатов на связывающие HLA-A2 пептиды, происходящие из NEIL3, идентифицировали с использованием информации об аффинности их связывания с HLA-A2. Пептиды-кандидаты представляют собой пептиды, выбранные из группы, состоящей из SEQ ID NO:1-23.
Более того, после стимуляции T-клеток in vitro дендритными клетками (DC), сенсибилизированными (нагруженными) этими пептидами, CTL успешно получали с использованием каждого из следующих пептидов;
NEIL3-A2-9-585 (SEQ ID NO:3),
NEIL3-A2-9-127 (SEQ ID NO:4),
NEIL3-A2-9-416 (SEQ ID NO:5),
NEIL3-A2-9-71 (SEQ ID NO:6),
NEIL3-A2-9-271 (SEQ ID NO:11),
NEIL3-A2-10-198 (SEQ ID NO:15),
NEIL3-A2-10-340 (SEQ ID NO:17),
NEIL3-A2-10-590 (SEQ ID NO:21) и
NEIL3-A2-10-378 (SEQ ID NO:22).
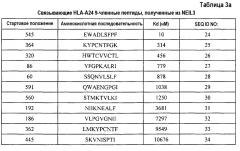
Кандидатов на связывающие HLA-A24 пептиды, происходящие из NEIL3, идентифицировали на основании аффинности их связывания с HLA-A24. Пептиды-кандидаты представляют собой пептиды, выбранные из группы, состоящей из SEQ ID NO:24-43.
Более того, после стимуляции T-клеток in vitro дендритными клетками (DC), сенсибилизированными (нагруженными) этими пептидами, CTL успешно получали с использованием каждого из следующих пептидов;
NEIL3-A24-9-545 (SEQ ID NO:24),
NEIL3-A24-9-362 (SEQ ID NO:33),
NEIL3-A24-10-320 (SEQ ID NO:35),
NEIL3-A24-10-544 (SEQ ID NO:41) и
NEIL3-A24-10-87 (SEQ ID NO:43).
Для этих полученных CTL показали сильную специфическую активность CTL против клеток-мишеней, сенсибилизированных соответствующим пептидами. Эти результаты показывают, что NEIL3 является антигеном, узнаваемым CTL, и что тестированные пептиды представляют собой пептиды-эпитопы из NEIL3, рестриктированные по HLA-A24 или HLA-A2.
Поскольку ген NEIL3 сверхэкспрессирован в клетках злокачественных опухолей, таких как злокачественная опухоль мочевого пузыря, злокачественная опухоль молочной железы, злокачественная опухоль шейки матки, холангиоцеллюлярная карцинома, злокачественная опухоль ободочной и прямой кишки, эндометриоз, злокачественная опухоль пищевода, злокачественная опухоль печени, NSCLC, остеосаркома, злокачественная опухоль поджелудочной железы, злокачественная опухоль предстательной железы, карцинома почки, SCLC, опухоль мягких тканей, AML и CML, и не экспрессирован в большинстве нормальных органов, он является хорошей мишенью для иммунотерапии злокачественных опухолей. Таким образом, настоящее изобретение относится к нонапептидам (пептидам, состоящим из девяти аминокислотных остатков) и декапептидам (пептидам, состоящим из десяти аминокислотных остатков) из узнаваемых CTL эпитопов из NEIL3. Альтернативно, настоящее изобретение относится к выделенным пептидам, которые связывают антигены HLA и индуцируют цитотоксические T лимфоциты (CTL), где пептид состоит из аминокислотной последовательности из SEQ ID NO:45 или представляет собой ее иммунологически активный фрагмент. Более конкретно, в некоторых вариантах осуществления, настоящее изобретение относится к пептидам, состоящим из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43.
Как правило, программное обеспечение, доступное в настоящее время, например, в Интернет, такое как описанное в Parker K.C. et al., J Immunol. 1994 Jan 1, 152(1):163-75 и Nielsen M. et al., Protein Sci 2003; 12:1007-17, можно использовать для расчета аффинностей связывания между различными пептидами и антигенами HLA in silico. Аффинность связывания с антигенами HLA можно измерять, как описано, например, в Parker K.C. et al., J Immunol. 1994 Jan 1, 152(1):163-75, Kuzushima K. et al., Blood 2001, 98(6):1872-81, Larsen M.V. et al. BMC Bioinformatics. 2007 Oct 31; 8:424, Buus S. et al. Tissue Antigens., 62:378-84, 2003, Nielsen M. et al., Protein Sci 2003; 12:1007-17 и Nielsen M. et al. PLoS ONE 2007; 2: e796, которые обобщены, например, в Lafuente E.M. et al., Current Pharmaceutical Design, 2009, 15, 3209-3220. Способы определения аффинности связывания описаны, например, в Journal of Immunological Methods, 1995, 185:181-190; Protein Science, 2000, 9:1838-1846. Таким образом, можно выбирать фрагменты, происходящие из NEIL3, обладающие высокой аффинностью связывания с антигенами HLA, с использованием такого программного обеспечения. Таким образом, настоящее изобретение относится к пептидам, состоящим из любых фрагментов, происходящих из NEIL3, которые можно определить как связывающиеся с антигенами HLA посредством таких известных программ. Более того, такие пептиды могут включать в себя пептид, состоящий из полноразмерного NEIL3.
Пептиды по настоящему изобретению могут быть фланкированы дополнительными аминокислотными остатками, при условии, что пептиды сохраняют свою способность индуцировать CTL. Дополнительные аминокислотные остатки могут состоять из любых видов аминокислот, при условии, что они не нарушают способность исходного пептида индуцировать CTL. Таким образом, настоящее изобретение относится к пептидам с аффинностью связывания с антигенами HLA, включая пептиды, происходящие из NEIL3. Такие пептиды составляют, например, менее приблизительно 40 аминокислот, часто менее приблизительно 20 аминокислот, обычно менее приблизительно 15 аминокислот.
В основном, известно, что модификации одной или нескольких аминокислот в пептиде не влияют на функцию пептида, или, в некоторых случаях, усиливают желаемую функцию исходного белка. Фактически, известно, что модифицированные пептиды (т.е. пептиды, состоящие из аминокислотной последовательности, модифицированной посредством замены, делеции или добавления одного, двух или более аминокислотных остатков к исходной контрольной последовательности) сохраняют биологическую активность исходного пептида (Mark et al., Proc. Natl. Acad. Sci USA 1984, 81:5662-6; Zoller and Smith, Nucleic Acids Res 1982, 10: 6487-500; Dalbadie-McFarland et al., Proc. Natl. Acad Sci USA 1982, 79:6409-13). Таким образом, в одном из вариантов осуществления настоящего изобретения, пептид, обладающий способностью индуцировать CTL по настоящему изобретению, может состоять из пептида, состоящего из аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21, 22, 24, 33, 35, 41 и 43, где одна, две или даже более аминокислот добавлены, делетированы и/или заменены.
Специалисту в данной области понятно, что отдельные добавления, делеции или замены в аминокислотной последовательности, изменяющие отдельную аминокислоту или небольшой процент аминокислот, приводят к сохранению исходных свойств боковых цепей аминокислот; их, таким образом, обозначают как «консервативная замена» или «консервативная модификация», где изменение белка приводит к белку со сходными функциями. Таблицы консервативных замен, предоставляющие функционально сходные аминокислоты, хорошо известны в данной области. Примеры свойств боковых цепей аминокислот представляют собой гидрофобные аминокислоты (A, I, L, M, F, P, W, Y, V), гидрофильные аминокислоты (R, D, N, C, E, Q, G, H, K, S, T) и боковые цепи, обладающие следующими общими функциональными группами или характеристиками: алифатическая боковая цепь (G, A, V, L, I, P); содержащая гидроксильную группу боковая цепь (S, T, Y); содержащая атом серы боковая цепь (C, M); содержащая карбоновую кислоту и амид боковая цепь (D, N, E, Q); содержащая основание боковая цепь (R, K, H); и содержащая ароматическую группу боковая цепь (H, F, Y, W). Кроме того, каждая из следующих восьми групп содержит аминокислоты, представляющие собой консервативные замены друг для друга:
1) Аланин (A), Глицин (G);
2) Аспарагиновая кислота (D), Глутаминовая кислота (E);
3) Аспарагин (N), Глутамин (Q);
4) Аргинин (R), Лизин (K);
5) Изолейцин (I), Лейцин (L), Метионин (M), Валин (V);
6) Фенилаланин (F), Тирозин (Y), Триптофан (W);
7) Серин (S), Треонин (T); и
8) Цистеин (C), Метионин (M) (см., например, Creighton, Proteins 1984).
Такие пептиды с консервативной модификацией также рассматривают как пептиды по настоящему изобретению. Однако пептиды по настоящему изобретению не являются ограниченными ими и могут включать в себя неконсервативные модификации, при условии, что пептид сохраняет способность индуцировать CTL. Более того, модифицированные пептиды не исключают способные индуцировать CTL пептиды из полиморфных вариантов, межвидовых гомологов и аллелей NEIL3.
Для сохранения необходимой способности индуцировать CTL можно модифицировать (добавлять или заменять) небольшое число (например, 1, 2 или более) или небольшой процент аминокислот. В настоящем документе термин «несколько» означает 5 или менее аминокислот, например, 3 или менее. Процент подлежащих модификации аминокислот может составлять 20% или менее, например, 15% или менее, например, 10% или 1-5%.
Более того, в пептидах можно заменять или добавлять такие аминокислотные остатки, чтобы достигать более высокой аффинности связывания. При применении в иммунотерапии злокачественных опухолей, настоящие пептиды представлены на поверхности клетки или экзосомы в форме комплекса с антигеном HLA. В дополнение к пептидам, экспонированным естественным образом, поскольку закономерности последовательностей пептидов, экспонируемых посредством связывания с антигенами HLA, уже известны (J Immunol. 1994, 152:3913; Immunogenetics 1995, 41:178; J Immunol. 1994, 155:4307), модификации на основании этих закономерностей можно вводить в иммуногенные пептиды по настоящему изобретению.
Например, пептиды, для которых показана высокая аффинность связывания HLA-A2, обладающие второй аминокислотой с N-конца, замененной на лейцин или метионин, и пептиды, с аминокислотой на C-конце, замененной на валин или лейцин, также можно преимущественно использовать. Таким образом, пептиды, обладающие аминокислотными последовательностями, выбранными из группы, состоящей из SEQ ID NO:3, 4, 5, 6, 11, 15, 17, 21 и 22, где вторая аминокислота с N-конца аминокислотной последовательности из SEQ ID NO заменена на лейцин или метионин, и/или пептиды, где C-конец аминокислотной последовательности из SEQ ID NO заменен на валин или лейцин, относятся к настоящему изобретению.
С другой стороны, пептиды, обладающие высокой аффинностью связывания HLA-A24, обладают второй аминокислотой с N-конца, замененной на фенилаланин, тирозин, метионин или триптофан, и аминокислотой на C-конце, замененной на фенилаланин, лейцин, изолейцин, триптофан или метионин. Таким образом, пептиды, обладающие аминокислотными последовательностями из SEQ ID NO:24, 33, 35, 41 и 43, где вторая аминокислота с N-конца заменена на фенилаланин, тирозин, метионин или триптофан, и/или где C-конец заменен на фенилаланин, лейцин, изолейцин, триптофан или метионин, относятся к настоящему изобретению.
Замены можно вводить не только в концевые аминокислоты, но также в положение потенциального узнавания пептидов T-клеточным рецептором (TCR). В нескольких исследованиях показали, что пептид с аминокислотными заменами может обладать эквивалентной или лучшей функцией, чем исходный, например, CAP1, p53 (264-272), Her-2/neu (369-377) или gp100 (209-217) (Zaremba et al. Cancer Res. 57, 4570-4577, 1997, T. K. Hoffmann et al. J Immunol. (2002) Feb 1;168(3):1338-47, S. O. Dionne et al. Cancer Immunol immunother. (2003) 52:199-206 и S. O. Dionne et al. Cancer Immunology, Immunotherapy (2004) 53, 307-314).
Более того, одну, две или более аминокислот можно также добавлять к N и/или C-концу настоящих пептидов. Такие модифицированные пептиды с высокой аффинностью связывания антигенов HLA и сохраненной способностью индуцировать CTL также включены в настоящее изобретение.
Однако, когда пептидная последовательность является идентичной части аминокислотной последовательности эндогенного или экзогенного белка, обладающего отличной функцией, могут быть индуцированы побочные эффекты, такие как аутоиммунные нарушения или аллергические симптомы против конкретных веществ. Таким образом, можно проводить поиски гомологии с использованием до