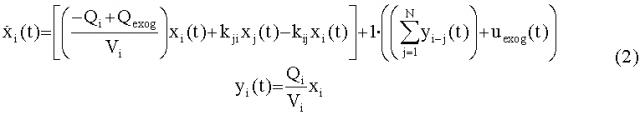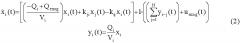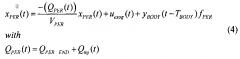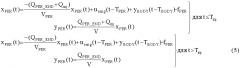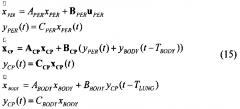Моделирование распространения фармацевтического препарата и генерирование параметров для инъекционных протоколов
Иллюстрации
Показать всеГруппа изобретений относится к медицине и может быть использована для моделирования распространения контрастного вещества у пациента. Для этого используют физиологически обоснованную фармакокинетическую модель, содержащую один нелинейный период насыщения в периферическом венозном компартменте. При этом экзогенное введение контрастного вещества определяется нелинейной функцией ввода uexog(t)≡=Cinj(t)·Qinj(t), где Cinj(t) является концентрацией средства усиления контрастности как функция от времени и Qinj(t) является скоростью потока введения контрастного вещества как функция от времени, при этом Qinj(t) является константой, равной заданной предельной скорости потока введения при скоростях потока введения, являющихся равными или больше, чем заданная предельная скорость потока введения. Также предложена система для моделирования распространения контрастного вещества. Группа изобретений позволяет устранить нежелательные побочные эффекты, связанные с избыточным введением контрастного вещества пациенту. 2 н. и 17 з.п. ф-лы, 17 табл., 47 ил.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
[1] Эта заявка претендует на приоритет предварительной заявки США серийный №61/358400, поданной 24 июня 2010 года, а также содержит предмет, который может быть в связи с тем, что раскрыто и/или заявлено в заявке на патент США №11/575846, поданной 22 марта 2007 года, заявке на патент США №11/691748, поданной 27 марта 2007, заявке на патент США №11/576060, поданной 27 марта 2007 года, в настоящее время предоставленных в качестве патента США №7925330, заявки на патент США №12/519040, поданной 12 июня 2009 года, заявки на патент США №12/519213, поданной 15 июня 2009 года, и заявки на патент США №12/669292, поданной 15 января 2010 года, раскрытия которых включены в настоящий документ с помощью ссылки и сделаны его частью.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[2] Следующая информация предоставляется, чтобы помочь читателю понять технологию, описанную ниже, и некоторые внешние условия, в которых такая технология может быть использована. Термины, используемые в настоящем документе, не предназначены для ограничения какой-либо конкретной узкой интерпретации, если четко не указано иное в данном документе. Ссылки, изложенные в настоящем документе, могут способствовать пониманию технологии или ее предпосылок. Раскрытия всех ссылок, приведенных в настоящем документе, включены с помощью ссылки.
[3] Введение контрастного вещества (с помощью, например, механизированного инъектора) для радиологических исследований, как правило, начинается с заполнения клиницистом пустого одноразового шприца определенным объемом фармацевтического контрастного агента. В других процедурах используется шприц, предварительно заполненный контрастным агентом. Затем клиницист определяет объемный расход и объем контраста, который нужно ввести пациенту для создания возможности диагностической визуализации. Инъекция физиологического раствора, имеющего объем и скорость потока, определенные оператором, часто следует завведением контрастного агента в вены или артерии. Ряд доступных в настоящее время инъектров позволяет оператору программировать множество отдельных фаз объемных скоростей потока и объемов для доставки. Например, инъекторы SPECTRIS SOLARIS® и STELLANT® доступны от Medrad Inc., Индианола, штат Пенсильвания, предусматривают ввод вплоть до шести отдельных пар или фаз объемной скорости потока и объема для доставки пациенту (например, для контраста и/или физиологического раствора). Такие инъекторы и протоколы управления инъекторами для применения с ними раскрыты, например, в патенте США №6643537 и опубликованной публикации заявки на патент США №2004-0064041, раскрытие которых включено в настоящий документ с помощью ссылки. Значения или параметры в пределах областей для таких фаз, как правило, вводятся вручную оператором для каждого типа процедуры и для каждого пациента, подвергающегося процедуре инъекции/визуализации. Альтернативно, ранее введенные вручную значения объема и скорости потока могут быть сохранены и позднее вызваны из памяти компьютера. Однако метод, которым такие параметры бывают определены для конкретной процедуры для конкретного пациента, продолжает подвергаться развитию.
[4] В связи с этим были признаны различия в требованиях дозирования контраста для различных пациентов во время визуализации и других процедур. Например, патент США №5840026, раскрытие которого включено в настоящий документ с помощью ссылки, раскрывает устройства и способы для настройки инъекции пациенту с использованием конкретных данных пациента, полученных перед или во время инъекции. Хотя различия в требованиях дозирования для медицинских процедур визуализации на основе различий пациентов были признаны, обычные медицинские процедуры визуализации продолжают применять заданные дозы или стандартные протоколы доставки для инъекции контрастного вещества во время медицинских процедур визуализации. Учитывая возросшую скорость сканирования последних доступных КТ сканеров, включая MDCT (или MSCT) сканеры, однофазные инъекции доминируют над двухфазными или другими многофазными инъекциями в регионах мира, где используются такие быстрые сканеры. Хотя использование стандартных, фиксированных или заданных протоколов (однофазных, двухфазных или многофазных) для доставки упрощает процедуру, предоставление одинакового количества контрастного вещества различным пациентам по одинаковому протоколу может давать очень разные результаты контраста и качества изображения. Кроме того, с внедрением новейших MDCT сканеров открытый вопрос клинической практики и КТ литературы, используются ли стандартные протоколы контрастирования с однослойными спиральными сканерами, будет хорошо переводиться на процедуры с использованием MDCT машин.
[5] Несколько исследований попытались произвести количественный анализ процесса инъекции во время КТ ангиографии (КТА) для улучшения и прогнозирования артериального усиления. Например, Вае и его коллеги разработали фармакокинетические (ФК) модели поведения контраста и решили связанную систему дифференциальных уравнений с целью обнаружения задающей функции, которая вызывает наиболее равномерное артериальное усиление. К.Т.Вае, J.P.Heiken, J.А.Brink, "Aortic and hepatic contrast medium enhancement at CT. Part I. Prediction with a computer model," Radiology, vol. 207, pp.647-55 (1998); К.Т.Bae, "Peak contrast enhancement in CT and MR angiography: when does it occur and why? Pharmacokinetic study in a porcine model," Radiology, vol. 227, pp.809-16 (2003); К.T.Bae et al., "Multiphasic Injection Method for Uniform Prolonged Vascular Enhancement at CT Angiography: Pharmacokinetic Analysis and Experimental Porcine Method," Radiology, vol. 216, pp.872-880 (2000); патент США №№5583902, 5687208, 6055985, 6470889 и 6635030, раскрытия которых включены в настоящий документ с помощью ссылки. Решение обратной задачи набора дифференциальных уравнений упрощенной компартментальной модели, изложенной Вае et al., показывает, что экспоненциальное снижение скорости потока контрастного вещества может приводить к оптимальному/постоянному усилению в процедуре КТ визуализации. Однако профили инъекций, рассчитанные с помощью решения обратной задачи ФК модели, являются профилями, с трудом реализуемыми большинством автоматических КТ инъекторов без существенной модификации.
[6] В моделях Вае не рассматривается осуществление ФК моделей в контроллерной структуре. Например, при преобразовании системы дифференциальных уравнений в представление в пространстве состояний ранг полученной матрицы состояния меньше порядка системы из-за числа свободных параметров в составе системы. Этот недостаток ранга проявляется как сингулярность при попытке инвертирования матрицы и является проблематичным для цифрового представления системы для прогнозирования и управления. Кроме того, модели Вае прямо не учитывают транспортные задержки контрастного вещества, но моделируют транспортную задержку с помощью введения множественных последовательных суб-компартментов по всей сердечно-легочной модели. Множественные суб-компартменты обеспечивают задержку распространения в воспроизведенном выходе, поскольку новая фаза ответа системы отличается (аддитивна) из-за дополнительных компартментов. Введение множественных компартментов несколько произвольно, хотя и основано на физическом понимании сосудистой системы. Например, компартмент легких разделен на 30 суб-компартментов из-за дисперсии болюса контраста и задержки по сердечно-легочной системе.
[7] Wada and Ward, "The hybrid model: a new pharmacokinetic model for computer-controlled infusion pumps", IEEE Trans. Biomed Eng, vol. 41(2), pp.134-142, 1994, раскрытие которых включено в настоящий документ с помощью ссылки, получили 3-компартментную фармакокинетическую модель, подобную подходу, принятому Вае, и использовали эту модель в схеме управления в попытке регулировать концентрацию анестетика в плазме (нагрузка отчуждения). Они пытались моделировать эффект рециркуляции агента через кровоток, а также смоделировали это с помощью транспортной задержки в их воспроизведениях. Они были способны генерировать воспроизведение с ошибками прогноза до 5%.
[8] Wada and Ward "Open loop control of multiple drug effects in anesthesia", IEEE Trans. Biomed Eng, vol. 42(7), pp.666-677, 1995, раскрытие которых включено в настоящий документ с помощью ссылки, также применяли их фармакокинетическую (ФК) модель для управления множественными эффектами анестезирующих средств. Их схема управления требует анестезиолога для установки допустимых уровней побочных эффектов (выраженных как концентрация в плазме).
[9] В другом подходе Fleischmann и коллеги рассматривали сердечно-сосудистую физиологию и контрастную кинетику в качестве «черного ящика» и определяли ее импульсную характеристику с помощью форсирования системы коротким болюсом контраста (аппроксимируя единичный импульс). В этом методе выполняют преобразование Фурье импульсной характеристики и манипулируют этой оценкой передаточной функции для определения оценки более оптимальной траектории инъекции, чем практиковалась ранее. D.Fleischmann и К.Hittmair, "Mathematical analysis of arterial enhancement and optimization of bolus geometry for CT angiography using the discrete Fourier transform," J Comput Assist Tomogr, vol. 23, pp.474-84 (1999), раскрытие которого включено в настоящий документ с помощью ссылки.
[10] Однофазное введение контрастного агента (как правило, от 100 до 150 мл контраста при одной скорости потока) приводит к неоднородному повышению кривой, например, D.Fleischmann и К.Hittmair, supra; и К.Т.Вае, "Peak contrast enhancement in CT and MR angiography: when does it occur and why? Pharmacokinetic study in a porcine model," Radiology, vol. 227, pp.809-16 (2003), раскрытия которых включены в настоящий документ с помощью ссылки. Fleischmann и Hittmair таким образом представили схему, которая пыталась адаптировать введение контрастного агента в двухфазной инъекции, приспособленной к индивидуальному пациенту, с намерением оптимизации визуализации аорты. Основная трудность с управлением представления КТ контрастного агента, это то, что гиперосмолярный препарат диффундирует быстрее из центрального кровяного компартмента. Кроме того, контраст смешивается и разбавляется кровью, которая не содержит контраст.
[11] Fleischmann предписал, чтобы небольшая болюсная инъекция, пробная болюсная инъекция контрастного агента (16 мл контраста при 4 мл/с) вводилась до диагностического сканирования. Сканирование динамического усиления выполняли по интересующему сосуду. Полученные обработанные данные сканирования (пробного сканирования) интерпретировали как импульсную характеристку системы пациент/контрастное вещество. Fleischmann получал преобразование Фурье передаточной функции пациента путем деления преобразования Фурье пробного сканирования на преобразование Фурье пробной инъекции. Предполагая, что система была инвариантной во времени линейной (LTI) системой, и что желаемый выходной сигнал временной области известен (плоское диагностическое сканирование на заранее определенном уровне усиления), Fleischmann получал входной временной сигнал путем деления частотной области представлений желаемого выхода на таковую из передаточной функции пациента. Поскольку способ Fleischmann et al. вычисляет входные сигналы, которые не реализуемы в действительности как результат ограничений инъекционной системы (например, ограничения скорости потока), необходимо обрезать и аппроксимировать рассчитанный непрерывный временной сигнал.
[12] В дополнение к проблемам управления существующими инъекторными системами многим подобным системам не хватает удобства и гибкости в способе, которым действуют эти инъекторные системы. В связи с этим, сложность медицинских инъекционных процедур и лихорадочный темп во всех аспектах отрасли здравоохранения стимулируют время и навыки оператора.
[13] Во многих современных методах количественного анализа клиническая практичность уменьшает шансы принятия для регулярного применения. Доступные в настоящее время физиологические модели могут требовать оценки многих физиологических параметров априори (например, сердечный выброс, объемы крови органа и крупных сосудов, факторы проницаемости). Кроме того, модели могут быть недостаточно хорошо ориентированы для адаптации по отношению к каждому пациенту на основе пробного болюсного усиления из-за определенных математических ограничений.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
[14] В одном аспекте способ моделирования распространения контрастного вещества (который включает агент контрастного усиления для применения в процедуре визуализации), введенного пациенту с использованием физиологически обоснованной фармакокинетической модели, включает: включение в физиологически обоснованную фармакокинетическую модель по меньшей мере одного нелинейного периода насыщения в периферическом венозном компартменте, или по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент.Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для моделирования, прогнозирования или оценки кривой времени усиления для одной или нескольких зон интереса пациента. В ряде вариантов осуществления физиологически обоснованная фармакокинетическая модель является дискретизируемой.
[15] По меньшей мере одна конфигурируемая транспортная задержка может, например, быть конфигурируемой, по меньшей мере, частично на основе по меньшей мере одной конкретной переменной пациента (например, рост, возраст, вес, пол и т.д.).
[16] Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для моделирования распространения контрастного вещества после того, как инъекция контрастного вещества прекратилась. Модель может, например, прогнозировать, оценивать или моделировать объемную скорость потока крови и ее эффект на распространение контрастного вещества. Физиологически обоснованная фармакокинетическая модель может, например, прогнозировать, оценивать или моделировать эффект распространения контрастного вещества после инъекции жидкости, не содержащей агент контрастного усиления, после инъекции контрастного вещества. Жидкость, не содержащая агент контрастного усиления, может, например, включать физиологический раствор (например, как в случае промывки физиологическим раствором после инъекции контрастного вещества).
[17] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен из данных от множества лиц. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной переменной для конкретного пациента. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента, полученной при инъекции контрастного вещества. Кривые времени усиления для более чем одной зоны интереса могут быть использованы в определении одного или нескольких параметров модели.
[18] Способ может дополнительно включать понижение порядка физиологически обоснованной фармакокинетической модели. В ряде вариантов осуществления модели с понижением порядка по меньшей мере один параметр определяется по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента. Кривые времени усиления для более чем одной зоны интереса могут быть использованы в определении одного или нескольких параметров модели.
[19] Физиологически обоснованная фармакокинетическая модель может, например, быть включена в систему, содержащую инъекторную систему и систему визуализации. Модель может, например, быть использована в генерировании по меньшей мере одного параметра для инъекционной процедуры.
[20] В ряде вариантов осуществления способ может дополнительно включать использование физиологически обоснованной фармакокинетической модели для оценки кривой времени усиления для пациента и для определения по меньшей мере одного параметра инъекционной процедуры по меньшей мере частично по расчетной кривой времени усиления. Способ может дополнительно включать использование кривой времени усиления во время диагностической инъекции контрастного вещества (например, в методологии болюсного контрастирования) для корректировки модели (например, в методологии управления с прогнозирующими моделями) и, например, для изменения по меньшей мере одного параметра инъекционной процедуры.
[21] В другом аспекте способ моделирования распространения контрастного вещества, введенного пациенту с использованием физиологически обоснованной фармакокинетической модели включает: моделирование объемной скорости потока крови и ее эффекта на распространение контрастного вещества после того, как инъекция контрастного вещества прекращается. Физиологически обоснованная фармакокинетическая модель может, например, прогнозировать, оценивать или моделировать эффект распространения контрастного вещества после инъекции жидкости, не содержащей агент контрастного усиления, после инъекции контрастного вещества. Жидкость, не содержащая агент контрастного усиления, может, например, включать физиологический раствор. Физиологически обоснованная фармакокинетическая модель может, например, быть дискретизируемой.
[22] Физиологически обоснованная фармакокинетическая модель может, например, быть адаптирована для прогнозирования, оценки или моделирования кривой времени усиления для одной или нескольких зон интереса пациента.
[23] Физиологически обоснованная фармакокинетическая модель может, например, включать по меньшей мере один нелинейный период насыщения в периферическом венозном компартменте, или по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент.По меньшей мере одна конфигурируемая транспортная задержка может, например, быть конфигурируемой по меньшей мере частично на основе по меньшей мере одной конкретной переменной пациента.
[24] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе данных от множества лиц. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной конкретной переменной пациента. По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента, полученной при инъекции контрастного вещества.
[25] Способ может дополнительно включать понижение порядка физиологически обоснованной фармакокинетической модели (например, устранение или объединение одного или нескольких параметров, компартментов и/или подсистем). В ряде вариантов осуществления по меньшей мере один параметр для такой физиологически обоснованной фармакокинетической модели с понижением порядка определяется по меньшей мере частично на основе по меньшей мере одной кривой времени усиления пациента.
[26] Физиологически обоснованная фармакокинетическая модель может, например, быть включена в систему, содержащую инъекторную систему и систему визуализации (которая может быть отдельной, частично интегрированной или полностью интегрированной). Модель может, например, быть использована в генерировании по меньшей мере одного параметра для инъекционной процедуры.
[27] В ряде вариантов осуществления физиологически обоснованная фармакокинетическая модель используется для оценки кривой времени усиления для пациента и для определения по меньшей мере одного параметра инъекционной процедуры по расчетной кривой времени усиления.
[28] В ряде вариантов осуществления способ дополнительно включает использование кривой времени усиления во время диагностической инъекции контрастного вещества для корректировки модели и для изменения по меньшей мере одного параметра инъекционной процедуры.
[29] Любая из моделей, описанных в данном документе, может, например, быть включена в систему (например, включая по меньшей мере один процессор и по меньшей мере одну систему памяти в связи с по меньшей мере одним процессором) как программное обеспечение, техническое обеспечение или их комбинация.
[30] В другом аспекте система включает систему генерирования параметров для определения по меньшей мере одного параметра для инъекционной процедуры (например, параметр инъекционного протокола или параметр системы визуализации), система генератора параметров включает физиологически обоснованную фармакокинетическую модель для моделирования распространения контрастного вещества, введенного пациенту, включая по меньшей мере один нелинейный период насыщения в периферическом венозном компартменте, по меньшей мере один конфигурируемый период транспортной задержки через по меньшей мере один компартмент, или адаптацию для моделирования объемной скорости потока крови и ее эффекта на распространение контрастного вещества после того, как инъекция контрастного вещества прекращается. Физиологически обоснованная фармакокинетическая модель может, например, быть дискретизируемой.
[31] По меньшей мере один параметр для физиологически обоснованной фармакокинетической модели может, например, быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента. Как и во всех моделях настоящего документа, один или несколько параметров (включая все параметры) может быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента.
[32] Порядок физиологически обоснованной фармакокинетической модели может, например, быть понижен. По меньшей мере один параметр для такой модели с понижением порядка может, например, быть определен по меньшей мере частично из по меньшей мере одной кривой времени усиления пациента.
[33] Система может дополнительно включать непараметрическую модель для оценки, моделирования или прогнозирования распространения контрастного вещества, введенного пациенту. Непараметрическая модель может, например, быть основана по меньшей мере частично на по меньшей мере одной кривой времени усиления для зоны интереса пациента. Непараметрическая модель может, например, быть основана по меньшей мере частично на усеченном деконволюционном методе разложения по сингулярным числам матрицы (tSVD).
[34] По меньшей мере один параметр может, например, быть определен с использованием способа оптимизации на основе физиологически обоснованной фармакокинетической модели. Способ оптимизации может, например, быть ограниченным способом оптимизации.
[35] По меньшей мере один параметр может, например, быть определен с использованием способа оптимизации на основе по меньшей мере одной физиологически обоснованной фармакокинетической модели или непараметрической модели.
[36] Модели, способы и системы, описанные в данном документе, могут, например, быть использованы в связи с различными контрастными веществами для применения в ряде процедур радиологической визуализации. Кроме того, модели, способы и системы, описанные в данном документе, могут также быть использованы в связи с фармацевтическими препаратами, которые не являются контрастными веществами.
[37] Преимущества, предоставляемые различными вариантами осуществления, включают, но не ограничиваясь: более плотное усиление для последующей обработки изображений, сниженную загрузку контраста или жидкости для некоторых пациентов, увеличенную дозу контраста для достижения достаточного контраста изображения при необходимости, сниженную вероятность кровоизлияния, сниженные артефакты изображения, сниженное число повторных съемок, все срезы, содержащие оптимальный контраст изображения, увеличенную согласованность между сканированиями, наблюдающими прогрессирование заболевания или лечение во времени, и факультативно, более быстрое время визуализации.
[38] Технология, описанная в настоящем документе, наряду с ее атрибутами и сопутствующими преимуществами лучше всего будет оценена и понята в силу следующего подробного описания, данного в сочетании с прилагаемыми изображениями.
КРАТКОЕ ОПИСАНИЕ ИЗОБРАЖЕНИЙ
[39] Фигура 1А иллюстрирует вариант осуществления модельной структуры новой фармакокинетической модели (иногда называемой в данном документе как гибридная модель), описывающей распространение фармацевтического препарата, такого как контрастное вещество.
[40] Фигура 1В иллюстрирует вариант осуществления инъекционной системы.
[41] Фигура 1С иллюстрирует вариант осуществления настройки экрана управления для параметров пациента, параметров сканирования и параметров инъекционного протокола.
[42] Фигура 2 иллюстрирует вариант осуществления полно-интеграторного вида физиологически обоснованной фармакокинетической модели, в которой толстые линии в секции "CP" отмечают векторные величины, и матричные значения в которой определяются в уравнениях с 18 по 26, изложенных ниже.
[43] Фигура 3 иллюстрирует воспроизведенные контрастные усиления для нормального субъекта.
[44] Фигура 4 иллюстрирует воспроизведенные пиковые усиления аорты и моменты времени для пикового усиления аорты, построенные как функции от сердечного выброса в гибридной модели.
[45] Фигура 5 иллюстрирует воспроизведенные результаты, демонстрирующие способность модели воспроизводить эффект инъекций промывки физиологическим раствором.
[46] Фигура 6А и 6В иллюстрирует сравнение данных, сообщенных Bae et al., с выходом гибридной модели, (а) Фигура 6а в Bae et al. от группы пациентов с использованием инъекции 5 мл/с (b) прогнозируемый выход новой модели в брюшной аорте с использованием такого же протокола контрастирования и демографических данных пациентов, как и для данных эмпирического исследования.
[47] Фигура 7 иллюстрирует профиль контрастного усиления одного субъекта (1-го субъекта), полученный из нисходящей части дуги аорты. Планки погрешностей показывают стандартное отклонение контрастного усиления в каждом расположении измерения.
[48] Фигура 8 иллюстрирует данные клинической визуализации одного субъекта (11-го субъекта), воспроизведение прогноза гибридной модели и прогнозы модели Вае.
[49] Фигура 9А и 9В иллюстрирует прогнозы модели по сравнению с клиническими данными для (а) субъекта 6 (b) субъекта 8. Субъект 6 был 47-летней женщиной весом 110 фунтов, тогда как пациент 8 был 53-летним мужчиной весом 246 фунтов.
[50] Фигуры с 10А по 10С иллюстрируют ящичковые диаграммы с усами суммарных результатов для (a) RMSE (b) PDME и (с) EDI.
[51] Фигуры с 11А по 11С иллюстрируют диаграммы рассеяния воспроизведенных испытаний (х-=модель Вае, о--=гибридная модель) - (a) RMSE (b) PDME (с) EDI.
[52] Фигура 12 иллюстрирует осевое КТ изображение, полученное при процедуре пробного болюсного сканирования.
[53] Фигура 13 иллюстрирует кривую времени усиления, генерированную от пациента после анализа пробного болюсного сканирования, являющегося результатом пробной болюсной инъекции контраста (набор данных из фигуры 12).
[54] Фигура 14 иллюстрирует вариант осуществления уменьшенной структуры гибридной модели, использованной для оценивания параметров с данными пробного болюсного сканирования. Пунктирные линии представляют модельные подсистемы, объединенные для идентификации модели.
[55] Фигура 15 иллюстрирует вариант осуществления переформулированной модельной структуры правых отделов сердца и периферических компартментов (He1) для применения в оценке параметров. Элементы массовой скорости потока, QPER и QCO транспортируют контраст из периферического компартмента один к два и от периферического компартмента два в правые отделы сердца.
[56] Фигура 16 иллюстрирует вариант осуществления переформулированной модельной структуры левых отделов сердца и компартмента легких (Не2) для применения в оценивании параметров. Сердечный выброс (QCO) транспортирует болюс контраста из компартмента легких в компартмент левых отделов сердца.
[57] Фигура 17 иллюстрирует блок-схему варианта осуществления дискретной модели, использованной для определения параметров с оценкой максимального правдоподобия.
[58] Фигура 18 иллюстрирует контурные графические отображения функции стоимости Jlh для пар параметров для подсистемы He2D.
[59] Фигура 19 иллюстрирует контурные графические отображения, показывающие проекцию функции стоимости Jrh как функции от пар параметров.
[60] Фигура 20 иллюстрирует воспроизведение гибридной модели для диагностической инъекции с использованием данных субъекта 6 и расчетной кривой усиления с использованием методологии MLE. Задержка сканирования и значения продолжительности сканирования также были получены из набора клинических данных для субъекта 6.
[61] Фигуры с 21А по 21С иллюстрируют результаты воспроизведения гибридной модели, установленные с использованием Оценки Максимального Правдоподобия (MLE). а) Среднеквадратичная Ошибка от 20 пациентов воспроизведена с помощью гибридной модели и прогнозированного усиления Ь) Прогнозированная Разница Максимального Усиления (PDME) между данными воспроизведения гибридной модели и расчетным ответом с) Результаты Индекса Разницы Усиления (EDI). Пунктирные линии представляют среднее значение для каждого набора данных.
[62] Фигуры 22А и 22В иллюстрируют результаты воспроизведения с использованием методологии MLE по данным гибридной модели. Каждая полоса представляет среднее по всем 20 субъектам при оценке генерированных параметров данных болюсов с различной длиной хронометража. Планки погрешностей показывают одно стандартное отклонение от среднего, а) Среднеквадратичная Ошибка (RMSE) между воспроизведенными и прогнозированными усилениями b) Процентная Разница Максимального Усиления (PDME) между воспроизведением и данными прогнозированного усиления.
[63] Фигуры 23А и 23В иллюстрируют результаты, демонстрирующие влияние пробного болюса уменьшенной длины на определение и вклад шумов в оценочную характеристику a) RMSE между выходами воспроизведения гибридной модели и прогнозами оценки для данных пробного болюса, заканчивающегося в 25 и 35 секунд b) PDME между выходами воспроизведения гибридной модели и прогнозами оценки для данных пробного болюса, усеченного в 25 и 35 секунд.
[64] Фигуры с 24А по 24С иллюстрируют исходные параметры производительности методологии MLE с использованием набора клинических данных. Пунктирные горизонтальные линии показывают среднее значение.
[65] Фигуры 25А и В иллюстрируют результаты прогноза MLE с использованием клинических данных для (а) субъекта 6 и (b) субъекта 8. Планки погрешностей показывают плюс/минус одно стандартное отклонение от среднего, как измерено в аорте при специфическом расположении оси z.
[66] Фигуры с 26А по 26С иллюстрируют ящичковые диаграммы с усами для результатов прогнозированных усилений с использованием гибридной модели (Hybrid) и методологии MLE (MLE) для прогноза контрастного усиления в наборе клинических данных (a) RMSE (b) PDME (с) EDI.
[67] Фигура 27 иллюстрирует решение для импульсной характеристика, hsys, с использованием данных субъекта 7 и деления матриц (решение методом наименьших квадратов).
[68] Фигура 28 иллюстрирует расчетную импульсную характеристику для данных субъекта 7 с использованием способа tSVD.
[69] Фигуры с 29А по 29С иллюстрируют исходные параметры производительности для tSVD оценки усиления в левых отделах сердца с использованием данных гибридной модели. Горизонтальная пунктирная синяя линия представляет среднее (а) Среднеквадратичная Ошибка (b) Процентная Разница Максимального Усиления (с) Индекс Разницы Усиления.
[70] Фигуры 30А и 30В иллюстрируют результаты воспроизведения гибридной модели по сравнению с характеристикой методологий оценки MLE и tSVD, как длины векторов пробных болюсов в диапазоне от 20 до 40 секунд. Во всех воспроизведениях не было никакого дополнительного шума в данных пробных болюсов (a) RMSE результаты (b) PDME результаты.
[71] Фигура 31 иллюстрирует результаты воспроизведения для пробных болюсов длиной 35 секунд, но при добавлении AWGN (sigma) к данным пробных болюсов, варьировавшим от 0 до 20 HU. Каждая точка данных является средним от 20 субъектов, воспроизведенных с использованием гибридной модели.
[72] Фигуры с 32А по 32С иллюстрируют результаты двух методологий оценки, MLE и tSVD, с использованием набора клинических данных векторов пробных болюсов и диагностических данных усиления (a) RMSE (b) PDME (с) EDI.
[73] Фигуры с 33А по 33С иллюстрируют ящичковые диаграммы с усами, сравнивающие два метода оценки с использованием набора клинических данных в качестве основы для сравнения, (a) RMSE (b) PDME (с) EDI.
[74] Фигура 34 иллюстрирует пробный болюс для одного субъекта (субъект 15) в наборе клинических данных. Кривая, отмеченная "х", является ТЕС легочной артерии, а кривая, помеченная кругами, является ТЕС восходящей части дуги аорты.
[75] Фигура 35 иллюстрирует изображение желаемого результата генерирования индивидуального протокола. Сплошная изогнутая линия является профилем контрастного усиления, рассчитанным с помощью гибридной ФК модели, вертикальные линии представляют окно получения КТ сканирования, а пунктирные горизонтальные линии представляют желаемые уровни усиления.
[76] Фигуры с 36А по 36D иллюстрируют 3D графики поверхности предполагаемой функции стоимости с использованием данных воспроизведения и различных характеристик процедуры (а) Функция стоимости для субъекта 6 с 250 HU цели и 2 секундами продолжительности сканирования (b) Функция стоимости для субъекта 6 с 250 HU цели и 8 секундами продолжительности сканирования (с) Функция стоимости для субъекта 6 с 350 HU цели и 2 секундами продолжительности сканирования (d) Функция стоимости для субъекта 6 с 350 HU цели и 8 секундами продолжительности сканирования.
[77] Фигуры с 37А по 37D иллюстрируют 2D контурные графики функции стоимости для воспроизведенных данных субъекта 6 и предполагаемой функции стоимости. Крест показывает истинный минимум каждой проекции, (а) Функция стоимости для субъекта 6 с 250 HU цели и 2 секундами продолжительности сканирования (b) Функция стоимости для субъекта 6 с 250 HU цели и 8 секундами продолжительности сканирования (с) Функция стоимости для субъекта 6 с 350 HU цели и 2 секундами продолжительности сканирования (d) Функция стоимости для субъекта 6 с 350 HU цели и 8 секундами продолжительности сканирования.
[78] Фигура 38 иллюстрирует образец ответа пробного болюса, измеренного у субъекта в нисходящей части дуги аорты.
[79] Фигуры с 39А по 39D иллюстрируют рассчитанные инъекционные протоколы с использованием деконволюционного способа Фурье, описанного в [9], Ts=2 с/изображение. Общий объем контраста инъекции перечислен на каждой подфигуре. (А) Необработанный протокол. Поскольку допускается отрицательная скорость потока инъекции, общий объем контраста ниже, чем B-D. (В) Неотрицательный протокол (С) Неотрицательный протокол фиксируют при 7 мл/с и команды инъекции при времени >34 с удаляют (D) Тот же протокол, что и С, но образцы через 32 секунды удаляют.
[80] Фигуры с 40А по 40D иллюстрируют прогнозируемые (синие) и желаемые (зеленые) уровни усиления, генерированные с помощью инъекционных протоколов, представленных в (А) Идеальный профиль усиления с использованием необработанного протокола (В) Усиление, генерированное с помощью неотрицательного инъекционного протокола (С) Усиление, когда неотрицательная инъекция фиксируется на 7 мл/с и инъекция не допускается через 34 секунды (D) Профиль усиления, как в С, но с образцами, игнорируемыми через 32 секунды.
[81] Фигура 41 иллюстрирует сравнительный результат между желательным профилем усиления (сплошная линия) и прогнозируемым усилением с использованием алгоритма генерирования протокола в Таблице 18 (пунктирная линия). Объем контраста 115 мл и скорость потока 4,1 мл/с рассчитывали с помощью алгоритма для генерирования профиля усиления, показанного в фигуре. Желательная продолжительность сканирования составила 30 секунд.
[82] Фигура 42 иллюстрирует вариант осуществления экспериментов по проверке генерирования протоколов.
[83] Фигура 43 иллюстрирует результат воспроизведения гибридной модели с использованием данных инъекционного протокола субъекта 8, рассчитанного с помощью способа, представленного в этом разделе. Субъект 8 из набора клинических данных использовался для параметризации гибридной модели. "Точка-тире" ТЕС (с пиками при ~130 HU) является кривой усиления