Полиморфы дейтерированной омега-дифенилмочевины или ее солей
Иллюстрации
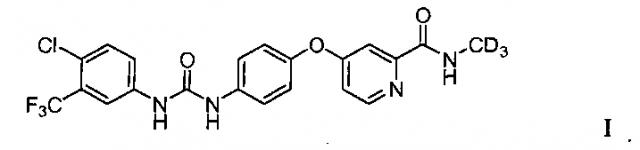
Показать всеИзобретение относится к полиморфным формам дейтерированной омега-дифенилмочевины или ее солей, в частности, полиморфные формы 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1',1',1'-тридейтерио-метил)пиколинамида формулы (I)
или его соли. Полиморфные формы подходят для получения фармацевтической композиции, применяемой для ингибирования фосфокиназы (такой как raf киназа). 9 н. и 7 з.п. ф-лы, 6 табл., 21 ил., 10 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области медицины, в частности к полиморфным формам дейтерированной омега-дифенилмочевины или ее солей и более конкретно к полиморфным формам 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида или его солей.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Структура 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида представлена формулой I.
Соединение формулы I, имеющее молекулярную формулу C21H13D3ClF3N4O3 и молекулярную массу 467,84, представляет собой белый или беловатый кристаллический порошок без запаха и вкуса. Этот порошок хорошо растворим в диметилсульфоксиде или диметилформамиде, слаборастворим в метаноле, малорастворим в ацетоне, безводном этаноле и ледяной уксусной кислоте и практически нерастворим в воде.
Соединение формулы I принадлежит к соединениям, ингибирующим raf киназу, и подходит для получения лекарственных средств для лечения рака и других родственных заболеваний. Различные кристаллические формы лекарственного средства могут влиять на его растворение, всасывание in vivo, воздействуя посредством этого на его клинический терапевтический эффект и в определенной степени на безопасность. В частности, для некоторых малорастворимых твердых или полутвердых пероральных препаратов влияние кристаллических форм очень велико. До сих пор не было проведено никаких исследований по полиморфным формам соединения I, и полиморфные формы соединения I еще не разработаны.
Таким образом, необходима разработка полиморфных форм соединения I.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Цель настоящего изобретения состоит в разработке полиморфных форм соединения I или его фармацевтически приемлемых солей или сольватов.
В первом аспекте предложены полиморфная форма соединения I или его фармацевтически приемлемых солей или сольватов,
В другом воплощении изобретения фармацевтически приемлемая соль представляет собой п-толуолсульфонат.
В другом воплощении изобретения в п-толуолсульфонате соединения I молярное отношение соединения I и п-толуолсульфоновой кислоты равно 1:1 или 2:1.
В другом воплощении изобретения сольват представляет собой метанольный или этанольный сольват п-толуолсульфоната соединения I.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму I п-толуолсульфоната 1/1 соединения I (1:1), где полиморфная форма I имеет от 1 до 3 характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 13,182±0,2°, 21,472±0,2° и 22,833±0,2°.
В другом воплощении изобретения полиморфная форма I дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 4,397±0,2°, 16,636±0,2°, 17,821±0,2°, 20,407±0,2° и 20,782±0,2°.
В другом воплощении изобретения полиморфная форма I имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 1а.
В другом воплощении изобретения полиморфная форма I имеет максимальный пик при 231,5-237,7°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма I имеет график дифференциальной сканирующей калориметрии, представленный на фиг. 1b.
В другом воплощении изобретения в полиморфной форме I молярное отношение соединения I и п-толуолсульфоновой кислоты равно 1:1.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму II метанольного сольвата п-толуолсульфоната 1/1 соединения I (1:1:1), где полиморфная форма II имеет от 1 до 3 характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 21,014±0,2°, 18,333±0,2° и 25,301±0,2°.
В другом воплощении изобретения полиморфная форма II дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 8,405±0,2°, 15,906±0,2°, 19,477±0,2°и24,744±0,2°.
В другом воплощении изобретения полиморфная форма II имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 2а.
В другом воплощении изобретения полиморфная форма II имеет максимальные пики при 193,5-197,0°С и 228,6-236,4°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма II метанольного сольвата имеет график дифференциальной сканирующей калориметрии, представленный на фиг. 2b.
В другом воплощении изобретения в полиморфной форме II молярное отношение соединения I, п-толуолсульфоновой кислоты и метанола равно 1:1:1.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму III п-толуолсульфоната 1/1 соединения I (1:1), где полиморфная форма III имеет 1 или 2 характеристических пика на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 19,858±0,2°и25,896±0,2°.
В другом воплощении изобретения полиморфная форма III дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 17,726±0,2°, 19,325±0,2° и 21,575±0,2°.
В другом воплощении изобретения, полиморфная форма III имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 3а.
В другом воплощении изобретения полиморфная форма III имеет максимальные пики при 193,8-197,2°С и 231,3-236,9°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма III имеет график дифференциальной сканирующей калориметрии, представленный на фиг. 3b.
В другом воплощении изобретения в полиморфной форме III молярное отношение соединения I к п-толуолсульфоновой кислоте равно 1:1.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму IV этанольного сольвата п-толуолсульфоната 1/1 соединения I (1:1:1), где полиморфная форма IV имеет 1 или 2 характеристических пика на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 20,961±0,2° и 18,277±0,2°.
В другом воплощении изобретения полиморфная форма IV дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 9,273±0,2°, 15,812±0,2°, 24,674±0,2°, 25,246±0,2° и 27,552±0,2°.
В другом воплощении изобретения полиморфная форма IV имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 4а.
В другом воплощении изобретения полиморфная форма IV имеет максимальные пики при 190,8-192,5°С и 230,0-237,4°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма IV имеет график дифференциальной сканирующей калориметрии, представленный на фиг. 4b.
В другом воплощении изобретения в полиморфной форме IV молярное отношение соединения I, п-толуолсульфоновой кислоты и этанола равно 1:1:1.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму V п-толуолсульфоната 1/2 соединения I (2:1), где полиморфная форма V имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 13,423±0,2°, 13,974±0,2°, 20,467±0,2°, 20,705±0,2°, 24,929±0,2° и 27,101±0,2°.
В другом воплощении изобретения полиморфная форма V дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 17,192±0,2°, 19,778±0,2°, 22,799±0,2°, 23,590±0,2° и 27,416±0,2°.
В другом воплощении изобретения полиморфная форма V имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 5а.
В другом воплощении изобретения полиморфная форма V имеет максимальный пик при 130-142,3°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма V имеет график дифференциальной сканирующей калориметрии, представленный на фиг. 5b.
В другом воплощении изобретения в полиморфной форме V молярное отношение соединения I к п-толуолсульфоновой кислоте равно 2:1.
В другом воплощении изобретения полиморфная форма представляет собой полиморфную форму VI соединения I, где полиморфная форма VI имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 23,818±0,2°, 24,236±0,2°, 26,382±0,2°, 26,817±0,2°, 24,929±0,2° и 27,101±0,2°.
В другом воплощении изобретения полиморфная форма VI дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 11.327±0.2°, 17.997±0.2°, 18,528±0,2° и 21,669±0,2°.
В другом воплощении изобретения полиморфная форма VI имеет характеристические пики на порошковой рентгеновской дифрактограмме, по существу представленной на фиг. 6а.
В другом воплощении изобретения полиморфная форма VI имеет максимальный пик при 211,5-213,6°С на графике дифференциальной сканирующей калориметрии.
В другом воплощении изобретения полиморфная форма VI имеет график дифференциальной сканирующей калориметрии, по существу представленный на фиг. 6b.
Во втором аспекте предложено применение полиморфных форм первого аспекта настоящего изобретения для получения фармацевтической композиции дли ингибирования фосфокиназы (такой, как raf киназа).
В другом воплощении изобретения фармацевтическую композицию применяют для лечения или предупреждения рака.
В третьем аспекте предложена фармацевтическая композиция, содержащая:
(a) полиморфную форму первого аспекта настоящего изобретения; и
(b) фармацевтически приемлемый носитель.
В четвертом аспекте предложен способ получения полиморфных форм первого аспекта настоящего изобретения, включающий следующие стадии: образование соли соединения I с кислотой и кристаллизация ее в инертном растворителе или перекристаллизация соединения I или его фармацевтически приемлемых солей или сольватов в инертном растворителе с получением полиморфной формы первого аспекта настоящего изобретения.
В другом воплощении изобретения кислота представляет собой п-толуолсульфоновую кислоту.
В другом воплощении изобретения способ получения полиморфной формы I включает следующую стадию: перекристаллизация соединения I с п-толуолсульфоновой кислотой в инертном растворителе с получением полиморфной формы I по настоящему изобретению.
В другом воплощении изобретения способ получения полиморфной формы II включает следующую стадию: перекристаллизация полиморфной формы I, полученной на вышеуказанной стадии, в метаноле, в результате чего получают полиморфную форму II по настоящему изобретению.
В другом воплощении изобретения способ получения полиморфной формы III включает следующую стадию: высушивание полиморфной формы II, полученной на вышеуказанной стадии, в течение периода времени с получением полиморфной формы III по настоящему изобретению.
В другом воплощении изобретения способ получения полиморфной формы IV включает следующую стадию: перекристаллизация полиморфной формы I, полученной на вышеуказанной стадии, в этаноле с получением полиморфной формы IV по настоящему изобретению.
В другом воплощении изобретения способ получения полиморфной формы V включает следующую стадию: высушивание полиморфной формы I, полученной на вышеуказанной стадии, в течение периода времени с получением полиморфной формы V по настоящему изобретению.
Понятно, что в настоящем изобретении любые из технических признаков, конкретно раскрытых выше и ниже (таких как в Примерах), можно комбинировать друг с другом, в результате чего составляют новые или предпочтительные технические решения, каждое из которых не описано избыточно в данном изобретении.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1а представлена порошковая рентгеновская дифрактограмма полиморфной формы I Примера 1.
На фиг. 1b представлен график дифференциальной сканирующей калориметрии полиморфной формы I Примера 1.
На фиг. 1с представлен спектр 1Н ЯМР полиморфной формы I Примера 1.
На фиг. 2а представлена порошковая рентгеновская дифрактограмма полиморфной формы II Примера 2.
На фиг. 2b представлен график дифференциальной сканирующей калориметрии полиморфной формы II Примера 2.
На фиг. 2с представлен спектр 1Н ЯМР полиморфной формы II Примера 2.
На фиг. 3а представлена порошковая рентгеновская дифрактограмма полиморфной формы III Примера 3.
На фиг. 3d представлен график дифференциальной сканирующей калориметрии полиморфной формы III Примера 3.
На фиг. 3с представлен спектр 1Н ЯМР полиморфной формы III Примера 3.
На фиг. 4а представлена порошковая рентгеновская дифрактограмма полиморфной формы IV Примера 4.
На фиг. 4b представлен график дифференциальной сканирующей калориметрии полиморфной формы IV Примера 4.
На фиг. 4с представлен спектр 1Н ЯМР полиморфной формы IV Примера 4.
На фиг. 5а представлена порошковая рентгеновская дифрактограмма полиморфной формы V Примера 5.
На фиг. 5b представлен график дифференциальной сканирующей калориметрии полиморфной формы V Примера 5.
На фиг. 5с представлен спектр 1Н ЯМР полиморфной формы V Примера 5.
На фиг. 6а представлена порошковая рентгеновская дифрактограмма полиморфной формы VI Примера 6.
На фиг. 6b представлен график дифференциальной сканирующей калориметрии полиморфной формы VI Примера 6.
На фиг. 6с представлен спектр 1Н ЯМР полиморфной формы VI Примера 6.
На фиг. 7а представлена порошковая рентгеновская дифрактограмма аморфной формы п-толуолсульфоната соединения I.
На фиг. 7b представлен график дифференциальной сканирующей калориметрии аморфной формы п-толуолсульфоната соединения I.
На фиг. 7с представлен спектр 1Н ЯМР аморфной формы п-толуолсульфоната соединения I.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
После интенсивных исследований в течение длительного периода авторы изобретения неожиданно обнаружили различные полиморфные формы соединения I или его фармацевтически приемлемых солей или его сольватов, обладающие высокой степенью чистоты, высокой стабильностью, и подходящие для получения фармацевтических композиций, ингибирующих фосфокиназу (такую, как raf киназа). Поэтому они обладают большей пользой при лечении заболеваний, таких как рак. Кроме того, полиморфные формы по настоящему изобретению не склонны к флотации в процессе получения (такому как субупаковка) лекарственного средства, их легко собирать, поэтому легко избежать утечки, и это помогает при защите здоровья работников. Основываясь на этом открытии, авторы выполнили настоящее изобретение.
Как используют в данном описании, "соединение формулы I (или соединение I)" относится к 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамиду, представленному формулой I.
п-толуолсульфонат 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пикол инамида
п-толуолсульфонат 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида по настоящему изобретению включает различные формы п-толуолсульфоната соединения I.
Предпочтительно он представляет собой п-толуолсульфонат 1/1 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида, который относится к соли, где отношение соединения I и п-толуолсульфоновой кислоты равно 1:1; или п-толуолсульфонат 1/2 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида, который относится к соли, где отношение соединения I и п-толуолсульфоновой кислоты равно 2:1.
Полиморфная форма
Твердое вещество существует либо в аморфной форме, либо в кристаллической форме. В случае кристаллической формы молекулы ориентированы в сайтах решетки в трехмерной (3D) кристаллической решетки. При кристаллизации соединения из раствора или суспензии оно может иметь различные кристаллические фазы, которые имеют различные структурные организации и/или конформации молекул, называемые "полиморфизмом". Различные полиморфные формы данного вещества могут отличаться друг от друга одним или более физических свойств, таких как растворимость и скорость растворения, истинное значение удельной массы, кристаллическая форма, режим накопления, текучесть и/или стабильность твердого состояния и т.д.
Кристаллизация
Кристаллизация в промышленном масштабе может быть достигнута путем работы с раствором, таким образом, чтобы превысить предел растворимости представляющего интерес соединения. Это может быть выполнено разнообразными способами, например путем растворения соединения при относительно высокой температуре, а затем охлаждения этого раствора ниже предела насыщения, либо уменьшения объема жидкости путем кипячения, атмосферного выпаривания, вакуумной сушки или некоторых других способов, либо снижения растворимости представляющего интерес соединения путем добавления осадителя или растворителя, в котором соединение имеет низкую растворимость, или смеси таких растворителей. Альтернативным способом является снижение растворимости путем регулирования значения рН. Подробное описание кристаллизации см. в кн. Crystallization, Third Edition, J W Mullens, Butterworth-Heineman Ltd., 1993, ISBN 0750611294.
Если желательно, чтобы образование соли и ее кристаллизация происходили одновременно и растворимость соли была ниже, чем растворимость исходного вещества, в реакционной среде, соль можно кристаллизовать непосредственно путем добавления соответствующей кислоты или основания. Подобным образом, в среде, в которой растворимость желаемой конечной формы ниже, чем растворимость реагента, конечный продукт может кристаллизоваться непосредственно при завершении реакции синтеза.
Оптимизация кристаллизации может включать добавление желаемого кристалла в качестве затравочного кристалла в среду кристаллизации. Кроме того, при множестве способов кристаллизации используют комбинацию описанных выше стратегий. Один из путей включает следующие стадии: растворение представляющего интерес соединения в растворителе, затем добавление осадителя в подходящем объеме в контролируемом режиме, чтобы создать систему чуть ниже уровня насыщения. В этот момент можно добавить желаемый затравочный кристалл (поддерживают целостность затравки), затем кристаллизация достигается путем охлаждения системы.
Как используют в данном описании, термин "комнатная температура" в целом относится к температуре от 4 до 30°С, предпочтительно 20±5°С.
Полиморфная форма по настоящему изобретению
Как используют в данном описании, термин "полиморфные формы по настоящему изобретению" включает полиморфные формы соединения I или его фармацевтически приемлемых солей (таких как п-толуолсульфонат) или его сольватов и дополнительно включает полиморфные формы некоторых п-толуолсульфонатов или их сольватов.
Предпочтительные полиморфные формы по настоящему изобретению включают, но не ограничены ими:
полиморфная форма VI соединения I;
полиморфная форма I или полиморфная форма III п-толуолсульфоната 1/1 соединения I;
полиморфная форма II метанольного сольвата п-толуолсульфоната 1/1 соединения I или полиморфная форма IV этанольного сольвата п-толуолсульфоната 1/1 соединения I; где в полиморфной форме II молярное отношение соединения I, п-толуолсульфоновой кислоты и метанола равно 1:1:1; и в полиморфной форме IV молярное отношение соединения I, п-толуолсульфоновой кислоты и этанола равно 1:1:1; и
полиморфная форма V п-толуолсульфоната 1/2 соединения I.
Идентификация и свойства полиморфной формы
После получения полиморфных форм п-толуолсульфоната соединения I их свойства исследуют, используя различные способы и приборы.
Порошковая рентгеновская дифракция
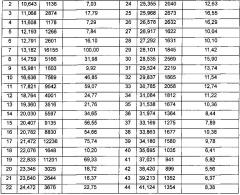
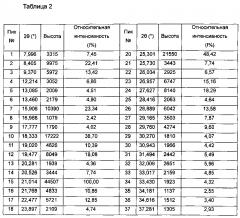
Способ определения кристаллической формы с помощью порошковой рентгеновской дифракции известен в данной области техники. Например, дифрактограмму получают, используя излучение меди на порошковом рентгеновском дифрактометре Rigaku D/max 2550VB/PC при скорости сканирования 2° в минуту.
Полиморфные формы п-толуолсульфоната соединения I имеют определенную кристаллическую форму и определенные характеристические пики на порошковой рентгеновской дифрактограмме. Предпочтительные воплощения изобретения включают:
(1) полиморфная форма I
Полиморфная форма I имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 13,182±0,2°, 21,472±0,2° и 22,833±0,2°. В другом воплощении, полиморфная форма I дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 4,397±0,2°, 16,636±0,2°, 17,821±0,2°, 20,407±0,2° и 20,782±0,2°. В другом воплощении изобретения полиморфная форма I имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 1а.
(2) полиморфная форма II
Полиморфная форма II имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 21,014±0,2°, 18,333±0,2° и 25,301±0,2°. В другом воплощении изобретения полиморфная форма II дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 8,405±0,2°, 15,906±0,2°, 19,477±0,2° и 24,744±0,2°. В другом воплощении изобретения, полиморфная форма II имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 2а.
(3) полиморфная форма III
Полиморфная форма III имеет 1 или 2 характеристических пика на порошковой рентгеновской дифрактограмме, выбранные из группы, состоящей из 19,858±0,2° и 25,896±0,2°. В другом воплощении изобретения полиморфная форма III дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 17,726±0,2°, 19,325±0,2° и 21,575±0,2°. В другом воплощении изобретения полиморфная форма III имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 3а.
(4) полиморфная форма IV
Полиморфная форма IV имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 20,961±0,2° и 18,277±0,2°. В другом воплощении изобретения полиморфная форма IV дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 9,273±0,2°, 15,812±0,2°, 24,674±0,2°, 25,246±0,2° и 27,552±0,2°. В другом воплощении изобретения полиморфная форма IV имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 4а.
(5) полиморфная форма V
Полиморфная форма V имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 13,423±0,2°, 13,974±0,2°, 20,467±0,2°, 20,705±0,2°, 24,929±0,2° и 27,101±0,2°. В другом воплощении изобретения полиморфная форма V дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 17,192±0,2°, 19,778±0,2°, 22,799±0,2°, 23,590±0,2° и 27,416±0,2°. В другом воплощении изобретения полиморфная форма V имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 5а.
(6) полиморфная форма VI
Полиморфная форма VI имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 23,818±0,2°, 24,236±0,2°, 26,382±0,2°, 26,817±0,2°, 24,929±0,2° и 27,101±0,2°. В другом воплощении изобретения полиморфная форма VI дополнительно имеет один или более характеристических пиков на порошковой рентгеновской дифрактограмме, выбранных из группы, состоящей из 11,327±0,2°, 17,997±0,2°, 18,528±0,2° и 21,669±0,2°. В другом воплощении изобретения, полиморфная форма VI имеет характеристические пики на порошковой рентгеновской дифрактограмме, представленной на фиг. 6а.
Дифференциальная сканирующая калориметрия
Дифференциальная сканирующая калориметрия (ДСК) относится к термоаналитическому методу, при котором измеряют разность в количестве энергии, требующемся для повышения температуры образца и стандарта, в зависимости от температуры. Положение, форма и число пиков на графике ДСК соответствуют свойствам вещества, поэтому их можно использовать для идентификации вещества качественным методом. Как правило, данный способ применяют для определения температуры фазового перехода, температуры стеклования, калориметрии реакции и других параметров вещества.
Способ ДСК известен в данной области техники. Например, можно использовать дифференциальный сканирующий калориметр NETZSCH DSC 204 F1 при скорости нагревания 10 градусов в минуту от 25°С до 250°С с получением графика ДСК кристаллической формы.
Полиморфные формы п-толуолсульфоната соединения I имеют определенные характеристические пики на графике дифференциальной сканирующей калориметрии (ДСК). Предпочтительно они представлены следующим образом:
(1) полиморфная форма I
Полиморфная форма I имеет максимальный пик при 231,5-237,7°С на графике ДСК. В другом воплощении изобретения полиморфная форма I имеет график ДСК, по существу представленный на фиг. 1b.
(2) полиморфная форма II
Полиморфная форма II имеет максимальные пики при 193,5-197,0°С и 228,6-236,4°С на графике ДСК. В другом воплощении изобретения полиморфная форма II имеет график ДСК, представленный на фиг. 2b.
(3) полиморфная форма III
Полиморфная форма III имеет максимальные пики при 193,8-197,2°С и 231,3-236,9°С на графике ДСК. В другом воплощении изобретения полиморфная форма III имеет график ДСК, представленный на фиг. 3b.
(4) полиморфная форма IV
Полиморфная форма IV имеет максимальные пики при 190,8-192,5°С и 230,0-237,4°С на графике ДСК. В другом воплощении изобретения полиморфная форма IV имеет график ДСК, представленный на фиг. 4b.
(5) полиморфная форма V
Полиморфная форма V имеет максимальный пик от при 130-142,3°С на графике ДСК. В другом воплощении изобретения полиморфная форма V имеет график ДСК, представленный на фиг. 5b.
(6) полиморфная форма VI
Полиморфная форма VI имеет максимальный пик при 211,5-213,6°С на графике ДСК. В другом воплощении изобретения полиморфная форма VI имеет график ДСК, представленный на фиг. 6b.
Ядерный магнитный резонанс (ЯМР) можно дополнительно использовать для вспомогательного определения кристаллической структуры. Способы и приборы для этого определения известны в данной области техники, например, можно использовать прибор Bruker Avance III plus - 400 МГц.
Активные ингредиенты
Как используют в данном описании, термин "активные ингредиенты" или "активное соединение" относится к полиморфным формам по настоящему изобретению, то есть к полиморфным формам соединения I или его фармацевтически приемлемых солей (таких как п-толуолсульфонат) или его сольватов.
Фармацевтическая композиция и ее введение
Полиморфные формы по настоящему изобретению обладают выраженной активностью ингибирования фосфокиназ, таких как raf киназы. Следовательно, полиморфные формы по настоящему изобретению и фармацевтическую композицию, содержащую полиморфные формы по настоящему изобретению в качестве основного активного ингредиента, можно применять для лечения, предупреждения и облегчения заболеваний, опосредованных фосфокиназами (например, raf киназой). На основании предшествующего уровня техники соединения по изобретению могут лечить следующие заболевания: рак, сердечно-сосудистые заболевания, ожирение, диабет и т.д.
Фармацевтическая композиция по изобретению содержит полиморфную форму по настоящему изобретению в безопасном и эффективном диапазоне дозы и фармацевтически приемлемые эксципиенты или носители, где термин "безопасная и эффективная доза" относится к количеству соединений (или полиморфных форм), достаточному для улучшения состояния пациента без каких-либо серьезных побочных эффектов. Как правило, фармацевтическая композиция содержит от 1 до 2000 мг полиморфной формы по изобретению на дозу, предпочтительно от 10 до 200 мг полиморфной формы по изобретению на дозу. Предпочтительно "на дозу" означает одну капсулу или таблетку.
"Фармацевтически приемлемый носитель" означает один или более совместимых твердых или жидких наполнителей или веществ в виде геля, подходящих для людей, который должен иметь достаточную чистоту и достаточно низкую токсичность. "Совместимость" в данном описании означает, что компоненты композиций можно смешивать с соединениями по изобретению или друг с другом, и они не должны значительно снижать эффективность соединений. Несколько примеров фармацевтически приемлемых носителей включает целлюлозу и ее производные (такие как натриевая соль карбоксиметилцеллюлозы, натриевая соль этилцеллюлозы, ацетат целлюлозы и т.д.), желатин, тальк, твердые смазывающие вещества (такие как стеариновая кислота, стеарат магния), сульфат кальция, растительные масла (такие как соевое масло, кунжутное масло, арахисовое масло, оливковое масло и т.д.), полиолы (такие как пропиленгликоль, глицерин, маннит, сорбит и т.д.), эмульгаторы (такие как Твин®), увлажняющий агент (такой как додецилсульфат натрия), красящие вещества, корригенты, стабилизаторы, антиоксиданты, консерванты, апирогенную воду и т.д.
Конкретных ограничений по введению полиморфных форм или фармацевтических композиций по настоящему изобретению нет, и репрезентативный путь введения включает (но не ограничен ими) следующие пути: пероральный, интратуморальный, ректальный, парентеральный (внутривенный, внутримышечный или подкожный), а также местное введения.
Твердые дозируемые формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В этих твердых дозируемых формах активные ингредиенты смешаны по меньшей мере с одним традиционным инертным эксципиентом (или носителем), таким как цитрат натрия или СаНРO4, либо смешаны с любым из следующих ингредиентов: (а) наполнителей или средств обеспечения совместимости, например с крахмалом, лактозой, сахарозой, глюкозой, маннитом и кремниевой кислотой; (b) связующих веществ, например с гидроксиметилцеллюлозой, альгинатами, желатином, поливинилпирролидоном, сахарозой и аравийской камедью; (с) увлажнителя, такого как глицерин; (d) разрыхлителей, таких как агар, карбонат кальция, картофельный крахмал или тапиоковый крахмал, альгиновая кислота, некоторые композитные силикаты и карбонат натрия; (е) средств, замедляющих растворение, таких как парафин; (f) ускорителей всасывания, например соединений четвертичного аммония; (g) увлажняющих агентов, таких как цетиловый спирт и глицерилмоностеарат; (h) адсорбентов, например каолина; и (i) смазывающих веществ, таких как тальк, стеаринкальций, стеарат магния, твердый полиэтиленгликоль, лаурилсульфат натрия или их смеси. В капсулах, таблетках и пилюлях дозируемые формы могут также содержать буферные агенты.
Твердые дозируемые формы, такие как таблетки, пилюли, покрытые сахаром, капсулы, пилюли и гранулы, можно готовить при использовании материалов покрытия и оболочки, таких как энтеросолюбильные покрытия и любые другие материалы, известные в данной области техники. Эти материалы могут содержать светонепроницаемое вещество. Высвобождение активных соединений или соединений в композициях может происходить в замедленном режиме в определенном участке пищеварительного тракта. Примеры инкапсулирующих компонентов включают полимеры и воски. При необходимости активные соединения и один или более описанных выше эксципиентов могут образовать микрокапсулы.
Жидкие дозируемые формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы или настойки. В дополнение к активным ингредиентам жидкие дозируемые формы могут содержать любые традиционные инертные разбавители, известные в данной области техники, такие как вода или другие растворители, солюбилизаторы и эмульгаторы, например этанол, изопропанол, этилкарбонат, этилацетат, пропиленгликоль, 1,3-бутандиол, диметилформамид, а также масло, в частности, хлопковое масло, арахисовое масло, масло зародышей пшеницы, оливковое масло, касторовое масло, либо их комбинацию.
Помимо этих инертных разбавителей, композиция может также содержать добавки, такие как увлажняющие агенты, эмульгаторы и суспендирующие агенты, подсластители, корригенты и ароматическое вещество.
В дополнение к активным ингредиентам суспензия может содержать суспендирующий агент, например этоксилированный изооктандиол, полиоксиэтиленсорбит и сорбитановые сложные эфиры, микрокристаллическая целлюлоза, метанол алюминий и агар, либо их комбинацию.
Композиции для парентеральной инъекции могут содержать физиологически приемлемые стерильные водные или безводные растворы, дисперсии, суспензии или эмульсии, а также стерильные порошки, которые можно восстанавливать до стерильных инъекционных растворов или дисперсий. Подходящие водные и неводные носители, разбавители, растворители или эксципиенты включают воду, этанол, полиолы и их любые подходящие смеси.
Дозируемые формы для местного введения соединений по изобретению включают мази, порошки, пластыри, аэрозоли и ингаляционные препараты. Активные ингредиенты смешивают с физиологически приемлемыми носителями и любыми консервантами, буферами при необходимости с пропеллентом в стерильных условиях.
Полиморфные формы по настоящему изобретению можно вводить отдельно или в комбинации с любыми другими фармацевтически приемлемыми соединениями.
При применении фармацевтических композиций безопасное и эффективное количество полиморфной формы по настоящему изобретению вводят млекопитающему (такому как человек), нуждающемуся в этом, где доза введения представляет собой фармацевтически эффективную дозу. Для человека массой 60 кг суточная доза обычно составляет от 1 до 2000 мг, предпочтительно от 20 до 500 мг. Конечно, конкретная доза должна также зависеть от различных факторов, таких как путь введения, состояние здоровья пациента, которые находятся в пределах компетенции опытного врача.
Основными преимуществами настоящего изобретения являются следующие:
1. Предложена серия новых полиморфных форм 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида или его солей, либо сольватов, включающая полиморфные формы I-VI;
2. Предложено применение различных полиморфных форм при получении фармацевтической композиции, полезной для ингибирования фосфокиназы (такой как raf киназа).
Настоящее изобретение дополнительно проиллюстрировано ниже со ссылкой на конкретные примеры. Понятно, что эти примеры предназначены только для иллюстрации изобретения, но не для ограничения объема изобретения. Экспериментальные способы, для которых в приведенных ниже примерах не раскрыты конкретные условия, как правило, выполняют в стандартных условиях или согласно инструкциям изготовителя. Если не указано иное, части и проценты вычисляют по массе.
Пример 1: Полиморфная форма I п-толуолсульфоната 1/1 4-(4-{3-[4-хлор-3-(трифторметил)фенил)-уреидо]-фенокси}-2-(N-1′,1′,1′-тридейтерио-метил)пиколинамида
50 г метил-4-хлор-2-пиколината растворяли в 250 мл тетрагидрофурана в трехгорлой колбе, затем добавляли соответственно 31 г дейтерированного метиламина гидрохлорида и 80 г безводного карбоната калия. После перемешивания смеси при 25°С в течение 20 часов добавляли 250 мл воды и 100 мл метил-трет-бутилового эфира. Смесь перемешивали и разделяли и водную фазу экстрагировали 100 мл метил-трет-бутилового эфира. Органические фазы объединяли и высушивали и растворитель удаляли при пониженном давлении с получением 48 г бледно-желтой жидкости.
Бледно-желтую жидкость растворяли в 50 мл диметилсульфоксида, затем добавляли 30 г 4-аминофенола и добавляли порциями 31 г трет-бутилата калия. Смесь нагревали до 80°С и перемешивали в течение 4 часов. Добавляли по каплям 100 мл соляной кислоты, затем смесь фильтровали и фильтрационный осадок суспендировали в 150 мл ацетона. Суспензию перемешивали при 25°С в течение 16 часов и фильтровали. Фильтрационный осадок растворяли в