Средства и способы диагностики и лечения рассеянного склероза
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к применению пептида, состоящего из по меньшей мере 8 последовательных аминокислотных остатков последовательности, представленной в SEQ ID NO:3, для диагностики рассеянного склероза, что может быть использовано в медицине. Диагностируют рассеянный склероз или предрасположенность к рассеянному склерозу у пациента по присутствию антитела против KIR4.1 в образце пациента. Изобретение позволяет получить альтернативные средства и способы диагностики и/или лечения рассеянного склероза. 5 н. и 4 з.п. ф-лы, 8 ил., 1 табл., 6 пр.
Реферат
Настоящее изобретение относится к пептиду, содержащему или состоящему из по меньшей мере 8 последовательных аминокислотных остатков из последовательности, представленной в SEQ ID NO:3, при условии, что указанный пептид не состоит из последовательности, представленной в SEQ ID NO:3, или из соответствующего пептидомиметика, где указанный пептид или пептидомиметик связывается с антителом против KIR4.1, содержащимся в образце от пациента с рассеянным склерозом или предрасположенного к развитию рассеянного склероза, где предпочтительно (i), указанные по меньшей мере 8 последовательных аминокислотных остатков представляют собой подпоследовательность внеклеточного домена KIR4.1, состоящего из последовательности, представленной в SEQ ID NO:1 или 2; или (ii) указанный пептид содержит или состоит из последовательноти SEQ ID NO:1 или 2. Настоящее изобретение также относится к способу диагностики рассеянного склероза или предрасположенности к рассеянному склерозу у пациента, включающему определение присутствия антитела против KIR4.1 в образце, полученном от указанного пациента, где присутствие антитела против KIR4.1 в указанном образце указывает на наличие рассеянного склероза или предрасположенности к рассеянному склерозу.
В настоящем описании приведены ссылки на ряд документов, включающих патентные заявки и инструкции производителей. Содержание этих документов не рассматривается, как относящееся к патентоспособности настоящего изобретения, и они включены в настоящее описание посредством ссылки во всей их полноте. Более конкретно, все цитируемые документы включены посредством ссылки в той же мере, как если бы каждый отдельный документ был указан конкретно и отдельно как включенный в данное описание посредством ссылки.
Рассеянный склероз (РС) является наиболее распространенным хроническим воспалительным заболеванием центральной нервной системы (ЦНС), приводящим к инвалидности большинство больных, страдающих этой патологией (1). Этиология РС не выявлена, но эпидемиологические данные свидетельствуют о сложной взаимосвязи генетических и экологических факторов (2-4). Неясный патогенетический механизм, клиническая гетерогенность и непредсказуемость исхода у конкретного больного усугубляют сложность заболевания (5).
Принятая в настоящее время рабочая гипотеза патогенеза РС предполагает центральную роль аутореактивных Т-клеток (6). Вместе с тем, гистопатологические исследования выявили подгруппу больных РС, у которых в значительной степени выражены депонирование иммуноглобулинов и активация комплемента при острых демиелинизирующих поражениях (7, 8). Такие больные особенно хорошо реагируют на терапевтический плазмаферез (9). Кроме того, В-клеточное истощение посредством терапевтических моноклональных антител оказывает глубокое влияние на воспалительное действие при РС (10). Все эти данные поддерживают утверждение, что по меньшей мере в подгруппе больных РС наблюдается существенный вклад В-клеток и антител в развитие и прогрессирование заболевания (11, 12). Притом, что приведенные доказательства являются косвенными, не было установлено прямых доказательств присутствия клинически значимых антител при РС, в связи с тем, что остаются нераскрытыми конкретные молекулярные мишени для гуморального ответа при РС.
Можно представить техническую задачу изобретения, как получение альтернативных или улучшенных средств и способов диагностики и/или лечения рассеянного склероза.
В первом аспекте настоящее изобретение относится к пептиду, содержащему или состоящему из по меньшей мере 8 последовательных аминокислотных остатков из последовательности, представленной в SEQ ID NO:3, при условии, что указанный пептид не состоит из последовательности, представленной в SEQ ID NO:3, или из соответствующего пептидомиметика, где указанный пептид или пептидомиметик связывается с антителом против KIR4.1, содержащимся в образце от пациента с рассеянным склерозом или предрасположенного к рассеянному склерозу, где предпочтительно (i) указанные по меньшей мере 8 последовательных аминокислотных остатков представляют собой подпоследовательность внеклеточного домена KIR4.1, и указанный внеклеточный домен состоит из последовательности, представленной в SEQ ID NO:1 или 2; или (ii) указанный пептид содержит или состоит из последовательности SEQ ID NO:1 или 2. Соответственно, предпочтительными также являются пептидомиметики, соответствующие пептидам согласно вариантам (i) и (ii). Также предпочтительно, указанный пептид не содержит последовательность SEQ ID NO:3.
"KIR4.1" является сокращенным обозначением специфичного направленного внутрь калиевого канала. Предпочтительно, указанный KIR4.1 имеет человеческое происхождение. Последовательность человеческого KIR4.1 представлена в SEQ ID NO:3. Термины "последовательность человеческого белка KIR4.1" и "последовательность SEQ ID NO:3" использованы в изобретении для описания одного и того же объекта.
Данное антитело против KIR4.1 также называется "аутоантителом" согласно настоящему изобретению. Аутоантитело представляет собой встречающееся в природе антитело и предпочтительно является антителом IgG. В частности, аутоантитело представляет собой антитело против KIR4.1, выявляемое у больных РС и у пациентов, имеющих предрасположенность к развитию РС, и его следует отличать от других антител против KIR4.1, которые не встречаются у указанных больных или пациентов, а также от других антител, которые могут быть использованы в терапевтических целях, как описано ниже в настоящем описании. Последние указанные типы антител против KIR4.1 не встречается в природе и не являются показателями заболевания. Аутоантитело предпочтительно связывается с внеклеточным доменом KIR4.1, где указанный внеклеточный домен состоит из последовательности, представленной в SEQ ID NO:1 или 2. Предпочтительно, указанное аутоантитело связывается с внеклеточным доменом, состоящим из последовательности, представленной в SEQ ID NO:1.
Предпочтительные подпоследовательности последовательностей SEQ ID NO:1 и 2 представляют собой последовательности SEQ ID NO:4 и 5, соответственно. Предполагается, что последовательности SEQ ID NO:4 и 5 являются полностью внеклеточными. Таким образом, также является предпочтительным, что указанный пептид содержит или состоит из последовательноти SEQ ID NO:4 или 5. Кроме того, намеренно предусмотрен пептидомиметик, соответствующий последнему указанному пептиду.
Предпочтительными являются пептиды, имеющие последовательности, содержащие или состоящие из одной из любых последовательностей SEQ ID NO:1, 2, 4 или 5, но вместе с тем, предусмотрено наличие других пептидных последовательностей, причем указанные пептидные последовательности могут только частично перекрываться или совсем не перекрываться с любой из последовательностей SEQ ID NO:1, 2, 4 и 5. Для дополнительного разъяснения и, как известно в данной области техники, Т-клетки и В-клетки могут иметь различные предпочтительные эпитопы в пределах данного антигена.
Термин "пептид" относится к поликонденсации аминокислот. Предпочтительно, указанные аминокислоты выбирают из 20 природных аминокислот. Длина пептида согласно изобретению составляет по меньшей мере 8 аминокислотных остатков. Предпочтительный верхний предел длины указанного пептида составляет 100, 50, 40, 30, 25, 20, 15, 14, 13, 12, 11, 10 или 9 аминокислотных остатков, и, в самом широком смысле, верхний предел длины отсутствует, и, соответственно, в изобретение включены полипептиды любой длины. Предпочтительно, чтобы длина указанного пептида выбиралась таким образом, чтобы быть уникальной. Как подробно описано ниже, предпочтительно выбирают такую длину, чтобы пептид был способен связываться с молекулой главного комплекса гистосовместимости (МНС). В частности, известно, что молекулы МНС I обычно задают определенные ограничения для размера пептидов, способных связываться с этими молекулами. Таким образом, предпочтительные значения длины и диапазоны длины составляют от 8 до 12, от 8 до 10, и наиболее предпочтительно, 9 аминокислот. Молекулы MHC II, с другой стороны, обычно способны связываться с пептидами большей длины, и соответственно, не задают ограничений для верхнего предела длины пептида согласно изобретению.
Термин "пептидомиметики" общеизвестен в данной области техники. Этот термин относится к производным пептидов, и ниже приведено определение указанных производных в отношении их структуры. "Соответствующий пептидомиметик" представляет собой пептидомиметик, который связывается с указанными антителами. Такое связывание может быть достигнуто путем сохранения структурных характеристик каждой аминокислоты, составляющей пептид, производным которого является этот пептидомиметик, например, где исходный пептид также связывается с указанным антителом. В предпочтительном варианте осуществления каждая из боковых цепей по меньшей мере 8 последовательных аминокислотных остатков остается в указанном соответствующем пептидомиметике в модифицированном или в немодифированном виде. Модификации боковой цепи включают замену одного или нескольких атомов водорода атомами галогена, предпочтительно атомами фтора. Дополнительно, предпочтительные модификации боковой цепи включают циклизацию. Независимо от этого, одну или более пептидных связей основной цепи можно независимо заменять функциональными группами, которые являются изостерическими или, другими словами, имитируют эту пептидную связь. Предпочтительно, что пептидную связь -CO-NH- можно заменить любым из следующего: -NH-CO-, -CH-(OH)-CH2-, -CO-CH2-, -CH2-NH-, -CH2-О-, -CH2-CH2-, -CH=CH-, -CO-N(CH3)- и ΡО2-Χ-, где Х предпочтительно выбирают из NH, О и СН2. Так, например, в соответствующем пептидомиметике все пептидные связи исходного пептида можно заменить ретро-инверсо связями (-H-CO-).
Следует понимать, что пептидомиметикам по изобретению присущи по существу неизмененные функциональные свойства исходного пептида. В частности, соответствующий пептидомиметик связывается с антителом против KIR4.1, содержащимся в образце больного рассеянным склерозом. Оценку таких связей можно проводить без дополнительных усилий с помощью средств и способов, описанных в изобретении.
Следует понимать, что первый аспект настоящего изобретения относится, с одной стороны, к пептиду и ,с другой стороны, к пептидомиметику. Дискламация вычеркивает из определения пептида аминокислотную последовательность, состоящую из последовательности, представленной в SEQ ID NO:3. Другими словами, первый аспект относится: (а) к пептиду, содержащему или состоящему из по меньшей мере 8 последовательных аминокислотных остатков в последовательности, представленной в SEQ ID NO:3, при условии, что указанный пептид не состоит из последовательности, представленной в SEQ ID NO:3, или (b) к соответствующему пептидомиметику, где указанный пептид или пептидомиметик связывается с антителом против KIR4.1, содержащимся в образце от пациента с рассеянным склерозом или предрасположенного к развитию рассеянного склероза, где предпочтительно, (i) указанные по меньшей мере 8 последовательных аминокислотных остатков представляют собой подпоследовательность внеклеточного домена KIR4.1, где указанный внеклеточный домен состоит из последовательности, представленной в SEQ ID NO:1 или 2; или (ii) указанный пептид содержит или состоит из последовательности SEQ ID NO:1 или 2.
Пептид или пептидомиметик по изобретению связываются с антителом против KIR4.1, где указанное антитело против KIR4.1 содержится в образце от больного рассеянным склерозом (РС) или в образце от пациента с предрасположенностью к развитию РС. Как дополнительно подробно описано ниже, настоящее изобретение предоставляет различные средства и способы выявления наличия у больного РС аутоантител против KIR4.1, а также для выделения таких антител у больного РС. В число указанных средств включены средства, которые в настоящем изобретении в целом называются "рецепторами". Способы выделения антител согласно изобретению включают стадию приведения в контакт указанных рецепторов с образцом, полученным от пациента, где образец предположительно содержит антитела против KIR4.1. С помощью использования таких полученных от больного РС антител против KIR4.1 специалист в данной области может без дополнительных усилий определить, способен или не способен к связыванию с антителом пептид, содержащий или состоящий из по меньшей мере 8 последовательных аминокислотных остатков из KIR4.1 или соответствующего пептидомиметика. Предпочтительный способ, который может использовать специалист в данной области, представляет собой анализ ELISA. В таком анализе указанный пептид или пептидомиметик согласно основному варианту осуществления является иммобилизованным на носителе, создается возможность связывания аутоантитела от больного РС или от пациента, имеющего предрасположенность к РС, с пептидом или пептидомиметиком, и указанное связывание выявляют с помощью вторичного антитела, которое, в свою очередь, является ферментно-связанным. Указанное вторичное антитело, может, например, представлять собой антитело, способное к связыванию с Fc-фрагментами, и, соответственно, оно будет связываться с Fc-участком аутоантитела.
В связи с вышеизложенным, настоящее изобретение также относится к антителу против KIR4.1, которое можно получать от больного рассеянным склерозом или от пациента, имеющего предрасположенность к развитию РС. Определение такого аутоантитела приведено выше.
Как описано более подробно в прилагаемых примерах, в KIR4.1 присутствуют по меньшей мере два внеклеточных домена. Эти два внеклеточных домена также называются большим и малым внеклеточными доменами. Антитело против KIR4.1, являющееся показателем рассеянного склероза, предпочтительно связывается с большим внеклеточным доменом, малым внеклеточным доменом или с двумя указанными внеклеточными доменами. Последовательности большого и малого внеклеточного домена KIR4.1, соответственно, представлены в SEQ ID NO:1 и 2. Строго внеклеточные части показаны в SEQ ID NO:4 и 5, соответственно.
Термин "рассеянный склероз" относится к воспалительным заболеваниям нервной системы; см. также цитируемую литературу, приведенную в разделе предыдущего уровня выше. Так или иначе, пациент или больной рассеянным склерозом может выявляться способом диагностики согласно изобретению, который предоставляется во втором аспекте изобретения и описан ниже. Альтернативно или в дополнение, диагноз рассеянного склероза можно устанавливать на основе подтвержденных клинических симптомов, и указанные клинические симптомы известны специалистам в данной области. Клинические симптомы рассеянного склероза включают нарушения зрения, головокружение, сенсорные дисфункции, слабость, нарушение координации, потерю равновесия, утомляемость, боль, нейрокогнитивные расстройства, расстройства психического здоровья, дисфункцию мочевого пузыря, дисфункцию кишечника, сексуальную дисфункцию, температурную чувствительность.
При том, что обнаружение аутоантител против KIR4.1 в образце, взятом у больного или у пациента, указывает на рассеянный склероз или предрасположенность к рассеянному склерозу, следует понимать, что рассеянный склероз или предрасположенность к нему необязательно характеризуются наличием указанных антител у указанного пациента или больного, или во взятом у них образце.
Таким образом, присутствие аутоантител против KIR4.1 определяет подгруппу людей с предрасположенностью к развитию РС, и указанная подгруппа отличается наличием указанных аутоантител. Аналогично, в изобретении описана подгруппа больных РС, где указанная подгруппа отличается наличием указанных аутоантител. Другими словами, присутствие аутоантител означает вторичный показатель в рамках показателей диагноза рассеянного склероза. Предполагается, что больные с выявленным вторичным показателем РС реагируют на лечение иным образом, по сравнению с больными РС, которые не являются носителями указанных аутоантител. Также ожидается, что профиль риска у пациентов - носителей указанных аутоантител, будет отличаться от профиля риска у пациентов, которые не имеют указанных аутоантител. Как следствие, можно выбирать разные способы терапевтического лечения, а также разные способы профилактического лечения в зависимости наличия или отсутствия аутоантител у больного РС, и наличия или отсутствия указанных аутоантител у пациента с риском развития РС, соответственно.
Термин "подпоследовательность" означает участок смежных аминокислотных остатков, взятых из более длинной последовательности. Другими словами, если указанная более длинная последовательность состоит из n остатков, максимальная длина подпоследовательности составляет (n-1) остатков.
Настоящее изобретение также относится к нуклеиновой кислоте, кодирующей описанный выше пептид согласно изобретению. Нуклеиновая кислота может представлять собой ДНК, например, кДНК или геномную ДНК, или РНК. Кроме того, в изобретении предоставляется вектор, содержащий указанную нуклеиновую кислоту. Кроме того, настоящее изобретение относится к клетке-хозяину, содержащей нуклеиновую кислоту и/или вектор согласно изобретению. Клетка-хозяин может быть любого происхождения, и предпочтительно существует in vitro, например, в выделенном виде или в культуре. Следует отметить, что в распоряжении квалифицированного специалиста имеются линии человеческих эмбриональных стволовых клеток, но вместе с тем, является предпочтительным получение клеток-хозяев без использования или уничтожения человеческих эмбрионов. Также предпочтительно, чтобы клетки-хозяева не были клетками человеческого происхождения, если они представляют собой эмбриональные клетки или эмбриональные стволовые клетки.
Во втором аспекте настоящее изобретение относится к способу диагностики рассеянного склероза или предрасположенности к рассеянному склерозу у пациента, включающему определение присутствия антител против KIR4.1 в образце, полученном от указанного пациента, где присутствие антител против KIR4.1 в указанном образце свидетельствует о рассеянном склерозе или предрасположенности к рассеянному склерозу.
Данный способ дает возможность диагностировать рассеянный склероз, или способ предназначен для диагностики предрасположенности к рассеянному склерозу, при условии, что диагноз рассеянного склероза не является очевидным для указанного пациента. Термин "предрасположенность" имеет принятое в данной области значение и предпочтительно означает вероятность развития заболевания. В частности, указанная вероятность превышает этот показатель у нормального пациента из контрольной группы. Указанную вероятность у нормального пациента из контрольной группы можно представить в виде средней вероятности развития РС в случайной выборке из популяции.
Подходящие агенты для определения указанного присутствия антител против KIR4.1 описаны ниже, в частности, в качестве активных агентов, относящихся к раскрываемым диагностическим композициям и диагностическим применениям.
Предпочтительную группу людей для проведения тестирования на указанную предрасположенность к РС представляют люди с семейным анамнезом РС.
Авторы настоящего изобретения были первыми, кто идентифицировал молекулярную мишень ранее предполагаемого аутоиммунного ответа при РС. Следует отметить, что целью общепринятых стратегий выявления антител при РС в основном является серологический скрининг на иммуноглобулины к предварительно выбранным возможным молекулам-мишеням на основе их функционального отношения к природе миелина и энцефалитогенного потенциала на животных моделях (13). Также проводился скрининг экспрессии E.coli, фагового дисплея и пептидных библиотек для выявления линейных мишеней РС-специфичных аутоантител (14-17). До настоящего времени ни одна из стратегий не выявила каких-либо потенциальных мишеней, которые могли бы быть или специфичными, или прогностическими для рассеянного склероза (18, 19).
Авторы настоящего изобретения обнаружили высокие титры антител против KIR4.1 в сыворотке пациентов в 50,8% случаях в двух независимых когортах. Таким образом, средства и способы, описанные в данном описании, дают возможность диагностировать РС или предрасположенность к РС примерно в половине случаев РС или среди пациентов из группы риска развития заболевания, соответственно. В частности, способы по изобретению дают возможность проводить раннюю диагностику РС или предрасположенности к РС, или подтверждать неустановленный диагноз. Тест на антитела может давать возможность неинвазивной диагностики клинически изолированного синдрома (КИС) или РС (например, без забора и анализа спинномозговой жидкости) и проводить более раннюю диагностику РС, КИС или предрасположенности к РС, чем это было возможно с помощью диагностических процедур, известных в данной области. "КИС" означает "клинически изолированный синдром" и будет рассмотрен ниже. Общеизвестно, что лечение РС бывает наиболее эффективным при максимально раннем начале лечения в ходе болезни. Таким образом, ранняя диагностика дает возможность осуществлять раннее лечение больных с КИС, РС или с риском развития этих заболеваний. У некоторых людей из группы риска лечение может даже предотвращать (дальнейшее) развитие заболевания.
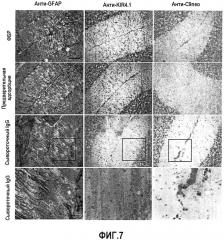
Как показано в прилагаемых примерах, аутоантитела могут истощать экспрессию KIR4.1 глиальными клетками с помощью антитело-зависимой клеточно-опосредованной цитотоксичности (ADCC) или активации комплемента (фиг.6). Дополнительно, антитела могут нарушать функционирование калиевого канала в результате функциональных последствий в отношении буферизации ионов и нейромедиаторов гомеостаза (20, 21, 22). Это может приводить к поражению тканей или нарушению ремиелинизации.
В предпочтительном варианте осуществления способов согласно изобретению и в случае присутствия антител против KIR4.1 в указанном образце (i) наличие по меньшей мере одного клинического симптома рассеянного склероза у указанного пациента указывает на рассеянный склероз; и (ii) отсутствие каких-либо клинических симптомов рассеянного склероза является показателем указанной предрасположенности к рассеянному склерозу.
Как указано выше, способы согласно изобретению предназначены для диагностики рассеянного склероза, а также для диагностики предрасположенности к РС. Представленный предпочтительный вариант осуществления предусматривает дополнительную информацию, получаемую в отношении указанного пациента, при этом указанная дополнительная информация способствует проведению дифференциальной диагностики заболевания и диагностики предрасположенности к заболеванию. В частности, указанная дополнительная информация содержит или состоит из по меньшей мере одного клинического симптома рассеянного склероза. Рассеянный склероз является хорошо изученным заболеванием с установленными клиническими симптомами. Специалистам хорошо известны клинические симптомы, характерные для рассеянного склероза или свидетельствующие о его наличии (см. ниже), и они могут определить наличие или отсутствие РС без лишних усилий.
Согласно представленному предпочтительному варианту осуществления, отсутствие каких-либо клинических симптомов рассеянного склероза, наблюдаемое одновременно вместе с присутствием антител против KIR4.1, является показателем предрасположенности к рассеянному склерозу. Другими словами, в случаях неэффективности существующих способов диагностики и прогнозирования настоящее изобретение дает возможность выявлять пациентов, у которых в определенный момент в будущем возникнет повышенный риск развития рассеянного склероза.
С другой стороны, у пациентов с выявленным по меньшей мере одним клиническим симптомом рассеянного склероза определение антител против KIR4.1 дополнительно подтверждает диагноз рассеянного склероза. В тех случаях, когда клинические параметры сами по себе не позволяют установить четкий диагноз, настоящее изобретение способствует проведению диагностики и обоснованию указанного диагноза. В частности, это относится к ранним формам рассеянного склероза. В данной области общеизвестно, что ранняя диагностика рассеянного склероза является весьма желательной, поскольку обычно ранние стадии в более высокой степени подходят для лечения.
Согласно другому предпочтительному варианту осуществления указанный клинический симптом представляет собой по меньшей мере один симптом, выбранный из следующих: нарушения зрения, головокружения, сенсорных дисфункций, слабости, нарушения координации, потери равновесия, утомляемости, боли, нейрокогнитивных расстройств, расстройств психического здоровья, дисфункции мочевого пузыря, дисфункции кишечника, сексуальной дисфункции, температурной чувствительности, наличия маркера (маркеров) воспаления в спинномозговой жидкости (СМЖ), наличия поражений головного мозга и/или спинного мозга. Приведенные поражения можно визуализировать с помощью МРТ. Обычно такие поражения возникают в перивентрикулярной, юкстакортикальной и/или субтенториальной области мозга. Маркеры воспаления, показательные для РС, хорошо известны в данной области и предпочтительно их выбирают из плеоцитоза (аномально увеличенного количества клеток в СМЖ, при том, что типичные значения повышенного количества клеток составляют от 5 до 50 клеток/мкл или выше), синтеза интратекального иммуноглобулина IgG и появления полос в олигоклональном IgG в спинномозговой жидкости.
Согласно другому предпочтительному варианту осуществления указанный пациент имеет клинически изолированный синдром (КИС) или по меньшей мере один клинический симптом КИС. В данной области КИС обычно считается ранней стадией рассеянного склероза, при этом характерные для него клинические характеристики еще не полностью установлены. Информацию о КИС, см., например, в публикации Thrower, Neurology 68, S12-S15 (2007). Преимущество средств и способов согласно настоящему изобретению состоит в том, что они дают возможность собрать дополнительные доказательства для пациентов с КИС.
Согласно другому предпочтительному варианту осуществления указанное антитело против KIR4.1, т.е. антитело против KIR4.1, которое можно выявлять у больных с РС, а также у пациентов из группы риска развития РС, связывается с KIR4.1 (SEQ ID NO:3) или с внеклеточным доменом KIR4.1, состоящим из последовательности, представленной в любой из SEQ ID NO:1, 2, 4 или 5. Структура KIR4.1 дополнительно описана в прилагаемых примерах. В частности, KIR4.1 содержит (по меньшей мере) два внеклеточных домена, которые предположительно разделены одним трансмембранным сегментом, см. фиг.4c. Эти два внеклеточных домена в данном описании также называются большим внеклеточным доменом и малым внеклеточным доменом и представлены в SEQ ID NO:1 и 2. Остальные области показаны на фиг.4с в виде SEQ ID NO:4 и 5, соответственно.
Еще в одном предпочтительном варианте осуществления обнаружение антител против KIR4.1 в указанном образце осуществляется с помощью способа, выбранного из группы, состоящей из твердофазного иммуноферментного анализа ELISA, иммунопреципитации, вестерн-блоттинга, иммунофлюоресценции, иммуногистохимического анализа, проточной цитометрии, металлоиммуноанализа (например, GLORIA), анализа флуоресцентного резонансного переноса энергии (FRET) и масс-спектрометрии. Эти способы хорошо известны и доступны специалисту в данной области. Например, с помощью анализа ELISA можно использовать связывание антитела с указанным антителом против KIR4.1. Аналогичные соображения применимы к анализам иммунопреципитации, вестерн-блоттингу, иммунофлюоресценции и иммуногистохимии. Как отмечалось выше, специалист в данной области может выделить и определить свойства антитела против KIR4.1 без лишних усилий, если это предусмотрено теорией настоящего изобретения. Для такого определения свойств предпочтительно используется масс-спектрометрия. Масс-спектрометрию можно использовать после определения свойств для определения наличия или отсутствия антител против KIR4.1 в любом конкретном образце. Можно использовать FRET-анализ, например, в контексте анализа связывания, при этом указанный анализ связывания предпочтительно проводят с использованием рецепторов, и определение указанного рецептора приведено ниже. Можно выполнять FRET-анализ таким образом, что детектируемый перенос между донором и акцептором FRET-пары происходит только в случае, если рецептор и антитело против KIR4.1 находятся в непосредственной специфичной близости, и эта непосредственная специфичная близость указывает на присутствие антитела против KIR4.1.
В других предпочтительных вариантах присутствие указанного антитела против KIR4.1 определяют с помощью (а) приведения в контакт образца с рецептором, связанным с указанным антителом против KIR4.1, и (b) обнаружения образования комплекса рецептор-антитело против KIR4.1, где указанный рецептор предпочтительно выбирают из группы, состоящей из пептида или пептидомиметика согласно изобретению, белка KIR4.1 (SEQ ID NO:3) и связывания антитела с указанным антителом против KIR4.1. Как описано ниже, специалисту в данной области доступны средства и способы получения антител против конкретного антигена (включая антитела).
В отличие от предыдущего предпочтительного варианта, предусматривающего разные схемы считывания, представленный предпочтительный вариант осуществления содержит специальные способы обнаружения антитела против KIR4.1, и указанные специальные способы отличаются в структурном отношении. Соответственно, эти предпочтительные варианты осуществления, а также любые другие варианты осуществления, описанные в данном описании, можно комбинировать, если не указано иное, с любой из указанных комбинаций, которая является объектом дополнительных предпочтительных вариантов осуществления согласно настоящему изобретению. В предпочтительном анализе проводят экспрессию белка KIR4.1 в клетках, указанные клетки инкубируют с сывороткой, и определяют связывание аутоантител с белком KIR4.1 с помощью анализов проточной цитометрии и иммуногистохимии с использованием вторичного антитела. Как указано выше, указанное вторичное антитело предпочтительно связывается с указанным аутоантителом, например, посредством связывания с его участком Fc. Дополнительные предпочтительные анализы описаны в прилагаемых примерах.
Предпочтительными вариантами указанных рецепторов являются пептид или пептидомиметик согласно изобретению и антитело, связанное с указанным антителом против KIR4.1. В любом случае, более предпочтительно, указанный рецептор является специфичным для указанного антитела против KIR4.1. Специфичность можно определить в сравнительных или конкурентных анализах, в которых с одной стороны выявляют связывание с рецептором указанного антитела против KIR4.1 других белков, связывающих белков или антител. Предпочтительно, что константа связывания (Kd) рецептора для аутоантитела ниже по меньшей мере на порядок величины, предпочтительно по меньшей мере ниже на два, три, четыре, пять или шесть порядков величины, чем для других исследуемых белков. "Порядок величины" находится в пределах одного порядка.
Терапевтические или диагностические антитела, описанные в данном описании, могут быть моноклональными или поликлональными антителами. Кроме того, в частности, в контексте диагностических и терапевтических антител, описанных в данном описании, термин "антитело" также включает одноцепочечные антитела или их фрагменты, которые специфично связываются со своими соответствующими мишенями, а также биспецифичные антитела, синтетические антитела, фрагменты антител, такие как Fab, F(ab2)′, фрагменты Fv и ScFv и тому подобное, а также их химически модифицированные производные.
Моноклональные антитела могут быть получены, например, с помощью методик, исходно описанных Kohler and Milstein, Nature 256 (1975), 495, и Galfre, Meth. Enzymol. 73 (1981), 3, и эти методики содержат слияние клеток миеломы мышей с клетками селезенки, полученными от иммунизированных млекопитающих, с модификациями, разработанными в данной области техники. Кроме того, можно получать антитела или их фрагменты к вышеуказанным пептидам с использованием способов, описанных, например, Harlow and Lane "Antibodies, A Laboratory Manual", CSH Press, Cold Spring Harbor, 1988. Если производные указанных антител получают технологией фагового дисплея, можно применять поверхностный плазмонный резонанс, используемый в системе BIAcore, для повышения эффективности фаговых антител, которые связываются с эпитопом пептида или полипептида согласно изобретению (Schier, Human Antibodies Hybridomas 7 (1996), 97-105; Malmborg, J. Immunol. Methods 183 (1995), 7-13). Получение химерных антител описано, например, в WO 89/09622. Еще одним источником антител, используемых согласно настоящему изобретению, являются так называемые ксеногенные антитела. Общий принцип получения ксеногенных антител, например, человеческих антител у мышей, описан, например, в патентах WO 91/10741, WO 94/02602, WO 96/34096 и WO 96/33735. Используемые согласно изобретению антитела или их соответствующая иммуноглобулиновая цепь(и) можно модифицировать с помощью общепринятых способов, известных в данной области, например, с помощью аминокислотной делеции(й), инсерции(й), замещения(й), добавления(й) и/или рекомбинации(й), и/или любой другой модификации(й), известных в данной области, применяя их по отдельности или в комбинации. Способы внедрения таких модификаций в последовательность ДНК, лежащие в основе аминокислотной последовательности цепи иммуноглобулина, хорошо известны специалистам в данной области техники, см., например, Sambrook, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, Нью-Йорк, 1989 год.
Термин "моноклональное" или "поликлональное антитело" (см. Harlow and Lane (1988), loc. cit.) также относится к производным указанных антител, которые сохраняют или по существу сохраняют свою специфичность связывания. Особенно предпочтительные варианты осуществления этих производных указаны ниже в настоящем описании, при этом существуют другие предпочтительные производные таких антител, представляющие собой химерные антитела, содержащие, например, мышиную или крысиную вариабельную область и человеческую константную область.
Термин "scFv-фрагмент" (одноцепочечный Fv фрагмент) общеизвестен в данной области и является предпочтительным благодаря своему небольшому размеру и возможности рекомбинантного получения таких фрагментов.
В особенно предпочтительном варианте осуществления способа согласно изобретению указанное антитело или его антитело-связывающий фрагмент является человеческим антителом или гуманизированным антителом, или их производным. Согласно настоящему изобретению, термин "гуманизированное антитело" означает антитело не человеческого происхождения, в котором по меньшей мере одна область, определяющая комплементарность (CDR) в вариабельных областях, таких как CDR3, и, предпочтительно, все шесть областей CDR были заменены областями CDR из антител человеческого происхождения, имеющими желаемую специфичность. Необязательно, что не человеческая константная область(и) антитела заменяется/была заменена на константную область(и) человеческого антитела. Способы получения гуманизированных антител описаны, например, в патентах EP-A1 0239400 и WO 90/07861.
В другом предпочтительном варианте осуществления указанный образец выбирают из крови, сыворотки, плазмы, лимфатических узлов, СМЖ, слезной жидкости, мочи, мокроты и биоптата мозга.
В третьем аспекте настоящее изобретение относится к рецептору, описанному выше, для применения в лечении рассеянного склероза или в диагностике рассеянного склероза, или предрасположенности к РС. Для этих медицинских целей предназначен рецептор, определение которого приведено выше, а также полностью белок KIR4.1 (то есть белок, состоящий из последовательности, представленной в SEQ ID NO:3). Введение этих агентов служит для уменьшения числа циркулирующих антител против KIR4.1. Как более подробно описано ниже, эти агенты можно не только вводить больному, страдающему РС, или пациенту с наличием или подозрением на предрасположенность к РС, но также можно использовать в способах ex vivo, где указанные способы ex vivo обеспечивают удаление аутоантител из организма больного РС или, более конкретно, из биологической жидкости указанного больного или пациента с риском развития РС.
Терм