Керамический материал для интерконнекторов топливных элементов и способ его получения
Иллюстрации
Показать всеИзобретение относится к твердооксидным топливным элементам (ТОТЭ), а именно к керамическому материалу. Керамический материал для интерконнекторов топливных элементов представляет собой твердый раствор на основе оксида индия с легирующей добавкой при следующем соотношении компонентов, мол. %: оксид индия - 92-98 мол. %, легирующая добавка - 2-8 мол. %. Синтез керамического материала для интерконнекторов топливных элементов по п. 1 осуществляют методом совместного осаждения гидроксидов, при этом в качестве исходных реагентов выбирают соли In(NO3)3·5H2O, ZrO(NO3)2·2H2O, HfOCl2·6H2O, из которых приготавливают разбавленные водные растворы, после чего осаждение проводят гидроксидом аммония при интенсивном перемешивании с введением в раствор аммиака поверхностно-активного вещества, а образовавшиеся гелеобразные осадки отделяют от маточного раствора фильтрованием и подсушивают при 100°C, после чего осуществляют прокаливание полученных порошков при 300°C до их кристаллизации в кубической структуре In2O3, затем полученные компакты из синтезированных порошков прессуют под давлением 150 МПа и спекают на воздухе при температуре 1400°C в течение 2 ч со скоростью нагрева 350-400°C/ч. Полученная заявленным способом керамика на основе In2O3 обладает более высокой удельной электропроводностью по сравнению с «хромит-лантановыми» композициями и может быть рекомендована для создания интерконнекторов твердооксидных топливных элементов, работающих в области как средних, так и высоких температур, что является техническим результатом изобретения. 2 н. и 2 з.п. ф-лы, 8 ил., 1 табл.
Реферат
Проблема генерирования электроэнергии с помощью твердооксидных топливных элементов (ТОТЭ) относится к числу наиболее важных задач современного материаловедения, решение которой позволит увеличить КПД существующих тепловых электростанций более чем вдвое. ТОТЭ представляют собой совокупность электрохимических ячеек, эффективно преобразующих химическую энергию взаимодействия водорода с кислородом в электрическую при минимальном воздействии на окружающую среду. В настоящее время ТОТЭ, в основном, выполняются на основе трубчатых или планарных топливных ячеек, планарные ТОТЭ более просты в изготовлении, поэтому предпочтение отдается именно им. Основные элементы батареи планарного ТОТЭ - электролит, анод, катод и интерконнектор [1,2]. Каждый элемент служит определенным целям и должен удовлетворять определенным требованиям. В настоящее время большое внимание уделяется разработке материалов для электролитов и электродов ТОТЭ, а в качестве интерконнекторов (межэлементных соединений), как правило, используют металлические пластины для среднетемпературных топливных элементов (600-800°C) и хромиты РЗЭ для высокотемпературных топливных элементов (800-1000°C) [2,3]. Интерконнекторы выполняют две основные задачи: обеспечение электрического контакта между двумя соседними элементами ТОТЭ и создание барьера, препятствующего смешиванию топлива и кислорода.
Материалы для интерконнекторов должны иметь следующие свойства: высокую проводимость электронного типа (σ≥1 См·см-1), низкий термический коэффициент линейного расширения (ТКЛР) в области температур 20-1000°C, близкий к ТКЛР циркониевой керамики (ZrO2 - 8 мол. % Y2O3), химическую и фазовую стабильность в восстановительных и окислительных средах в диапазоне температур 20-1000°C, термическую устойчивость до 1000°C. В некоторых высокотемпературных ТОТЭ с твердым электролитом на основе ZrO2 используют интерконнекторы, изготовленные из жаростойких сплавов на основе Ni-Cr и Co-Ni-Cr. Данные сплавы обладают высокой проводимостью и хорошей термостойкостью в кислородсодержащих средах, однако они имеют достаточно высокие значения ТКЛР (16-20·10-6 К-1), существенно превышающие ТКЛР циркониевой керамики (8-12·10-6 К-1) [3]. Такое большое различие в тепловом расширении сплавов и керамики может приводить к высоким внутренним напряжениям при нагреве металлокерамических соединений и их разрушению.
Альтернативным материалом для интерконнекторов является хромит лантана, допированный ионами стронция или кальция. Например, лантан-кальциевый хромит La0.7Ca0.3CrO3-δ (ТКЛР=9.5-10.5·10-6 К-1) в широком диапазоне давлений кислорода в интервале температур 850-1000°C остается химически устойчивым, а его удельная электропроводность варьируется от 1 до 50 См·см-1, что удовлетворяет предъявляемым к интерконнектору требованиям [4, 5]. Традиционной технологией получения порошков на основе хромита лантана является твердофазный синтез, однако этот метод имеет ряд существенных недостатков: высокая температура синтеза (1400-1500°C), недостаточная фазовая гомогенность конечного продукта, низкая активность порошка к спеканию и, следовательно, высокая температура спекания (≥ 1500°C). Для интенсификации процесса спекания в синтезированные порошки La0.7Ca0.3CrO3-δ вводят металлы с переменной степенью окисления (Co, Ni, Cu), что позволяет получать более плотную керамику и повысить величину электропроводности.
Задачей изобретения является создание оксидной керамики для интерконнекторов на основе оксида индия и способа ее получения с целью обеспечения высокого качества и продолжительного срока службы ТОТЭ.
Оксид индия является полупроводником n-типа, удельная электропроводность которого ≥20 См·см-1, КЛТР In2O3 изменяется от 9 до 11 в интервале температур 20-1000°C. Поэтому керамику на основе In2O3 целесообразно рассматривать в качестве материала для интерконнекторов высокотемпературных ТОТЭ, поскольку она позволит создать полноценный электрический контакт между отдельными блоками топливного элемента.
Сущность первого независимого объекта изобретения заключается в следующей совокупности существенных признаков.
Керамический материал для интерконнекторов топливных элементов, характеризующийся тем, что он представляет собой твердый раствор на основе оксида индия с легирующей добавкой при следующем соотношении компонентов, мол. %:
| оксид индия | 92-98 |
| легирующая добавка | 2-8 |
Кроме того, первый независимый объект изобретения характеризуется наличием ряда дополнительных факультативных признаков, а именно:
- в качестве легирующей добавки использован ZrO2;
- в качестве легирующей добавки использован HfO2.
Сущность второго независимого объекта изобретения заключается в следующей совокупности существенных признаков.
Синтез вышеописанного керамического материала для интерконнекторов топливных элементов осуществляют методом совместного осаждения гидроксидов, при этом в качестве исходных реагентов выбирают соли In(NO3)3·5H2O, ZrO(NO3)2·2H2O, HfOCl2·6H2O, из которых приготавливают разбавленные водные растворы, после чего осаждение проводят гидроксидом аммония при интенсивном перемешивании с введением в раствор аммиака поверхностно-активного вещества, а образовавшиеся гелеобразные осадки отделяют от маточного раствора фильтрованием и подсушивают при 100°C, после чего осуществляют прокаливание полученных порошков при 300°С до их кристаллизации в кубической структуре In2O3, затем полученные компакты из синтезированных порошков прессуют под давлением 150 МПа и спекают на воздухе при температуре 1400°C в течение 2 ч со скоростью нагрева 350-400°C/ч.
Кроме того, второй независимый объект изобретения характеризуется наличием ряда дополнительных факультативных признаков, а именно:
- в качестве поверхностно-активного вещества используют 1%-ный раствор поливинилового спирта (ПВС).
Технический результат, достигаемый при использовании заявленной совокупности существенных признаков заявленных решений, заключается в следующем. Керамический материал состава (In2O3)0.92(ZrO2)0.08 обладает более высокой удельной электропроводностью (>100 См·см-1) в интервале температур 20-1300°C, при этом парциальное давление кислорода, соответствующее различным средам (воздух, аргон, кислород), кардинально не влияет на зависимость lgσ-1/T, что делает этот материал более перспективным электропроводящим материалом для топливных элементов. Легирующие добавки диоксидов циркония и гафния, образуя твердые растворы с оксидом индия, в результате гетеровалентного замещения улучшают спекание керамики и повышают удельную электропроводность твердых растворов, не нарушая их однофазность. В области температур 20-800°C для твердых растворов на основе оксида индия характерна практически квазиметаллическая проводимость, а при более высоких температурах на G влияет процесс восстановления In2O3, приводящий к образованию дополнительных носителей заряда (электронов), и зависимость lgσ-1/T имеет полупроводниковых характер.
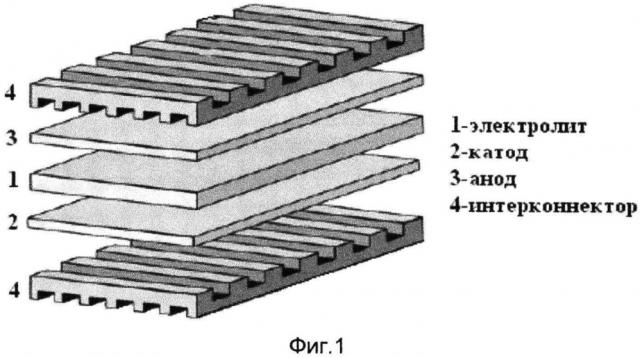
Сущность изобретения поясняется чертежами, где на фиг. 1 представлена условная схема ячейки топливного элемента, на фиг. 2 - четырехэлектродная схема измерения удельной электропроводности твердых растворов на основе оксида индия, на фиг. 3 - влияние поливинилового спирта на степень агломерации осадков на основе оксида индия в системах In2O3-ZrO2 и In2O3-HfO2, на фиг. 4 - формирование кристаллической структуры твердых растворов на основе In2O3, где а - 300°C, б - 800°C, в - 1400°C, - твердый раствор на основе In2O3, на фиг. 5 - микроструктура твердого раствора (In2O3)0.92(ZrO2)0.08 (1400°C), на фиг. 6 - температурные зависимости удельной электропроводности чистого оксида индия и твердых растворов на его основе, где 1 - In2O3, 2 - (In2O3)0.98(HfO2)0.02, 3 - (In2O3)0.96(ZrO2)0.04, 4 - (In2O3)0.92(ZrO2)0.08., на фиг. 7 - влияние газовой среды на удельную электропроводность твердого раствора (In2O3)0.92(ZrO2)0.08., где 1 - воздух, 2 - аргон, 3 - кислород, на фиг. 8 - температурная зависимость удельной электропроводности керамики на основе хромита лантана на воздухе, где 1 - La0.6Sr0.4CrO3, 2 - La0.5Ca0.5CrO3, 3 - La0.75Ca0.25CrO3, 4 - La0.8Ca0.2Cr0.8Ni0.2O3.
Заявленный керамический материал получали следующим образом.
Синтез нанокристаллических порошков на основе In2O3 осуществляли методом совместного осаждения гидроксидов, который позволяет обеспечить высокую степень гомогенности смешиваемых компонентов, что способствует интенсификации химических процессов и дает возможность снизить температуру спекания керамики [6-8], а также не требует дорогих реактивов и сложного химического оборудования. Количество легирующих добавок ZrO2 и HfO2, вводимых в оксид индия, выбрано с учетом получения однофазных твердых растворов на основе In2O3 [9,10]. Синтезированы твердые растворы следующих составов: (In2O3)0.92(ZrO2)0.08, (In2O3)0.96(ZrO2)0.04 и (In2O3)0.98(HfO2)0.02, которые были исследованы следующими методами:
1. Рентгенофазовый анализ (РФА) порошков и спеченных компактов был выполнен на дифрактометре ДРОН-3 (CuKα-излучение). Средний размер кристаллитов (d) рассчитывали из уширения дифракционных максимумов по формуле Дебая-Шерера: d=0.9 λ/β·cosθ (λ - длина волны CuKα, β - полуширина дифракционного пика) [11].
2. Термическая обработка порошков и спекание компактов (силитовая печь с SiC-нагревателями).
3. Электронно-микроскопическое исследование керамики (электронный микроскоп ЭМ-125).
4. Измерения открытой пористости образцов определяли методом гидростатического взвешивания в дистиллированной воде в соответствии с ГОСТом 473.4-81.
5. Измерения электрического сопротивления спеченных образцов (R, ом) проведены по четырехэлектородной схеме на постоянном токе, фиг. 2, интервале температур 25-1300°C на воздухе (PO2=2·104 Па), в аргоне (PO2=1 Па) и кислороде (PO2=105 Па). Контактные электроды наносили путем вжигания платиновой пасты на торцевые поверхности образцов. Величина тока, подаваемого на образец, составляла 50-100 мА в зависимости от сопротивления образца. Измерения падения напряжения осуществляли на участке между двумя зондами, что позволило избежать поляризационных эффектов и влияния сопротивления контактов и подводящих ток проводников на прохождение тока через образец. Удельную электропроводность керамики вычисляли по формуле: , где S - площадь торцевой поверхности образца, см2, l - расстояние между зондами, см.
В качестве исходных реагентов использованы соли: In(NO3)3·5H2O «хч», ZrO(NO3)2·2H2O «чда», HfOCl2·6H2O «чда», из которых были приготовлены разбавленные водные растворы (~0.1 М). Осаждение проводили гидроксидом аммония (~1 М). В работах [7, 8] определено, что гидроксиды индия, циркония и гафния осаждаются в следующих интервалах pH - 3.0-4.3, 1.5-2.0 и 1.8-2.3 соответственно.
Растворы солей приливали к NH4OH со скоростью 10 мл/мин при интенсивном перемешивании многолопастной стеклянной мешалкой образующихся осадков. Для снижения степени агломерации совместно осажденных гидроксидов в раствор аммиака вводили поверхностно-активное вещество - 1%-ный раствор поливинилового спирта (ПВС). В момент осаждения гидроксидов образование агломератов начинается уже на первой стадии процесса за счет возникновения мостиковых связей в водной среде. ПВС благодаря углеводородным радикалам, которые обладают поверхностной активностью и адсорбируется на поверхности осаждаемых частиц, способствует созданию вокруг частиц осадка защитного слоя, что препятствует процессу агломерации частиц и тормозит их рост [12]. Использование ПВС позволило повысить дисперсность осадка за счет снижения степени его агломерированности, фиг. 3а, б.
Гелеобразные осадки отделяли от маточного раствора фильтрованием, промывали дистиллированной водой для удаления нитрата аммония и подсушивали при 100°С. Прокаливание полученных порошков при 300°C, по данным РФА, приводит к разложению гидроксидов и их кристаллизации в кубической структуре In2O3 со средним размером кристаллитов 8-10 нм, фиг. 4а. Дальнейшее повышение температуры (800 и 1400°C) способствует совершенствованию кристаллической структуры твердых растворов In2O3, фиг. 4б, в, а средний размер кристаллитов возрастает до 75-90 нм в зависимости от состава. Наличие на диффрактограммах рефлексов, соответствующих только оксиду индия, свидетельствует об однофазности синтезированных порошков. Согласно правилу Гольдшмидта [13] в образцах составов (In2O3)0.92(ZrO2)0.08, (In2O3)0.96(ZrO2)0.04 и (In2O3)0.98(HfO2)0.02 образуются твердые растворы замещения, поскольку разница в ионных радиусах замещающих друг друга ионов не превышает 15% .
Из порошков, термообработанных при 800°C, прессовали компакты под давлением 150 МПа, которые затем спекали на воздухе при температуре 1400°C в течение 2 ч, скорость нагрева составляла ~350-400°С/ч. Достаточно большая скорость нагрева была выбрана в связи с тем, чтобы уменьшить скорость роста кристаллитов. После обжига спеченные компакты закаливали на воздухе для достижения более высокой плотности. Пористость и средний размер кристаллитов спеченных образцов приведены в таблице 1.
Из таблицы 1 следует, что легирующие добавки (ZrO2 и HfO2), вводимые в оксид индия, активизируют процесс спекания порошков и это позволяет получать более плотную керамику. Для исследования микроструктуры был выбран наиболее плотный образец твердого раствора (In2O3)0.92(ZrO2)0.08, фиг. 5. Микроструктура данного образца характеризуется хорошо сформированными кристаллитами с гладкой поверхностью и размером < 100 нм, собранными в плотную упаковку.
На фиг. 6 представлены температурные зависимости удельной электропроводности чистого индия и твердых растворов в интервале 20-1300°C. Рост удельной электропроводности твердых растворов на основе In2O3 по сравнению с чистым оксидом индия в интервале температур 20-800°C обусловлен образованием твердых растворов в результате гетеровалентного замещения индия цирконием (гафнием) в кристаллической решетке In2O3, при этом происходит частичное изменение валентного состояния индия до +1 [15]. Это способствует появлению дополнительных электронов проводимости в твердых растворах, а следовательно, и росту проводимости n-типа. Данный процесс может быть описан с помощью уравнений (1) (обозначения Крегера-Винка [16]):
где и - атомы индия, расположенные в узлах кристаллической решетки оксида, - атомы циркония (гафния), замещающие атомы индия в кристаллической решетке, - атомы кислорода в узлах кристаллической решетки, - электроны.
В интервале температур 20-800°C удельная электропроводность исследованных твердых растворов незначительно зависит от температуры, что, по-видимому, является следствием специфического зонного строения оксида индия [17]. На величину σ влияет количество легирующей добавки (ZrO2, HfO2), которая, вероятно, и определяет концентрацию дополнительных носителей заряда. В таблице для сравнения приведены значения σ всех исследованных твердых растворов при 20 и 1000°C.
При температуре выше 800°C на удельную электропроводность твердых растворов In2O3 влияет процесс восстановления оксида индия. По данным термогравиметрии и масс-спектроскопии для In2O3 [18] наблюдается потеря кислорода:
что приводит к возникновению нестехиометрии (кислородных вакансий - ) в кристаллической решетке In2O3:
Образование дополнительных носителей заряда способствует росту удельной электропроводности более чем на 0.5 порядка величины. При понижении температуры степень восстановления твердых растворов In2O3 уменьшается (процесс обратимый) и, соответственно, снижаются значения удельной электропроводности, о чем свидетельствует практически полное совпадение кривых нагревания и охлаждения.
Для изучения влияния парциального давления кислорода на величину удельной электропроводности выбран образец наиболее проводящего твердого раствора - (In2O3)0.92(ZrO2)0.08, фиг. 7. Измерения σ были проведены в трех средах: воздух, аргон, кислород. При нагревании в атмосфере аргона значения удельной электропроводности твердого раствора возрастают за счет его активного восстановления и значения σ достигают 700-800 См·см-1 в интервале температур 20-800°C и 1500-1600 См·см-1 в интервале температур 800-1000°C. Измерения в атмосфере кислорода уменьшают величину удельной электропроводности (In2O3)0.92(ZrO2)0.08 за счет смещения равновесия в уравнениях (2, 3) в сторону стехиометрического оксида индия, но при этом значения σ остаются достаточно высокими 65-100 См·см-1 в диапазоне температур 20-1000°C.
На фиг. 8 для сравнения приведены температурные зависимости удельной электропроводности керамических композиций на основе хромит лантана (LaCrO3) по литературным данным [4]. Керамические материалы на основе LaCrO3 являются проводниками p-типа, в которых процесс переноса заряда осуществляется по механизму перескока электронов.
В окислительной среде замещение низковалентным ионом (Ca2+, Sr2+) лантана или хрома в LaCrO3 приводит к взаимно компенсирующему переходу Cr3+ в Cr4+, что способствует повышению электронной проводимости материала:
за счет возникновения дополнительных носителей заряда дырки (p+) по уравнению:
С уменьшением парциального давления кислорода среды, например, в атмосфере аргона величина удельной электропроводности падает, что характерно для полупроводников p-типа. Данное явление связано с образованием вакансий в подрешетке кислорода в результате восстановления согласно реакции:
что приводит к уменьшению количества источников носителей заряда (Cr4+).
В ТОТЭ хромит лантана подвергается воздействию двух сред: топлива - с одной стороны и кислорода - с другой, в результате чего образуется градиент проводимости через данный материал. Проводимость соединений хромита лантана в водороде ниже на три порядка, чем в воздухе. Однако общая проводимость стабилизированного хромита лантана все же достаточна для его использования в конструкции топливного устройства.
Разработана эффективная и простая технология синтеза однофазных нанокристаллических порошков твердых растворов на основе оксида индия и подобраны оптимальные условия для их консолидации. Изучены температурные зависимости удельной электропроводности твердых растворов (In2O3)0.92(ZrO2)0.08, (In2O3)0.96(ZrO2)0.04 и (In2O3)0.98(HfO2)0.02 в интервале температур 20-1200°C и установлено, что легирующие добавки диоксидов циркония и гафния, образуя твердые растворы с оксидом индия в результате гетеровалентного замещения, улучшают спекание керамики и повышают удельную электропроводность твердых растворов, не нарушая их однофазность. В области температур 20-800°C для твердых растворов на основе оксида индия характерна практически квазиметаллическая проводимость, а при более высоких температурах на σ влияет процесс восстановления In2O3, приводящий к образованию дополнительных носителей заряда (электронов), и зависимость lgσ-1/T имеет полупроводниковый характер.
Выявлено, что твердый раствор (In2O3)0.92(ZrO2)0.08 обладает более высокой удельной электропроводностью (> 100 См·см-1) в интервале температур 20-1300°C и парциальное давление кислорода, соответствующее различным средам (воздух, аргон, кислород), кардинально не влияет на зависимость lgσ-1/T и является более перспективным электропроводящим материалом.
Проведенные исследования позволяют констатировать, что полученная заявленным способом керамика на основе In2O3 обладает более высокой удельной электропроводностью по сравнению с «хромит-лантановыми» композициями и может быть рекомендована для создания интерконнекторов твердооксидных топливных элементов, работающих в области как средних, так и высоких температур.
Литература
1. Петров А.Н. Формирование целевых свойств перспективных материалов. Теория и приложение. ИОНЦ «Нанотехнологии и перспективные материалы». Учебное пособие, Екатеринбург, 2008, 118 с.
2. Липилин А.С.ТОТЭ и энергосистемы на их основе: состояние и перспективы. Электрохимическая энергетика, 2007, т. 7, №2, с. 61-72.
3. Иванов В.В., Липилин А.С., Спирин А.В. и др. Формирование многослойных структур твердооксидного топливного элемента. Международный научный журнал «Альтернативная энергетика и экология», 2007, т. 46, №2, с. 75-88.
4. Пальгуев С.Ф., Гильдерман В.К., Земцов В.И. Высокотемпературные оксидные электронные проводники для электрохимических устройств. М.: Наука, 1990,198 с.
5. Zhu W.Z, Deevi S.C. Development of interconnect materials for solid oxide fuel cells. Materials Science and Engineering, 2003, A348, pp. 227-243.
6. Вассерман И.M. Химическое осаждение из растворов. Л.:Химия, 1980, 208 с.
7. Морозова Л.В., Тихонов П.А., Глушкова В.Б. Процессы совместного осаждения в системах ZrO2-In2O3-Y2O3 и ZrO2-In2O3-Nd2O3. ЖНХ, 1990, т. 34, №5, с. 2980-2983.
8. Панова Т.И., Морозова Л.В., Полякова И.Г. Синтез и исследование свойств нанокристаллических диоксидов циркония и гафния. ФХС, 2011, т. 37, №2. С. 238-249.
9. Морозова Л.В., Тихонов П.А., Глушкова В.Б. Фазовые соотношения в системе ZrO2-In2O3, синтез и физико-химические свойства твердых растворов. ДАН СССР, 1983, т. 273, №I. с. 140-144.
10. Морозова Л.В., Тихонов П.А., Глушкова В.Б. Физико-химические исследования системы In2O3-HfO2 в области, богатой оксидом индия. Известия АН СССР. Неорганические материалы, 1991, т. 27, №2, с. 291-294.
11. Duran P., Villegas М., Capel F. Low - temperature Sintering and Microstructural development of Nanocrystalline Y-TZP Powders. J. Europ.Ceram.Soc., 1996, v. 16, №9, pp. 945-952.
12. Беляков А.В. Проблемы технологии нанокерамики. Техника и технология силикатов, 2003, №3-4. с. 16-28.
13. Химическая энциклопедия. / Под ред. И.Л. Кнунянца. М.: Советская энциклопедия. 1995, т. 4, с. 56.
14. Бокий Г.Б. Кристаллохимия. М.: Наука, 1971, 400 с.
15. Смирнов В.А., Дмитриев B.C., Редькин А.Н. Химия одновалентного индия. М.: Наука, 1986, 127 с.
16. Крёгер Ф. Химия несовершенных кристаллов. М.: Мир, 1969, 246 с.
17. Коттон Ф., Уилкинсон Дж. Современная неорганическая химия, ч. 2. М.:Мир, 1969, 494 с.
18. De Witt J.H.W. The High Temperature Behavior of In2O3. J. Solid State Chem., 1975, v. 3, pp. 192-200.
19. Кофстад П. Отклонение от стехиометрии, диффузия и электропроводность в простых окислах металлов. 1975, М.: Мир, 396 с.
1. Керамический материал для интерконнекторов топливных элементов, отличающийся тем, что он представляет собой твердый раствор на основе оксида индия и легирующую добавку при следующем соотношении компонентов, мол. %:
| оксид индия | 92-98 |
| легирующая добавка | 2-8 |
2. Керамический материал по п. 1, отличающийся тем, что в качестве легирующей добавки использован ZrO2.
3. Керамический материал по п.1, отличающийся тем, что в качестве легирующей добавки использован HfO2.
4. Синтез керамического материала для интерконнекторов топливных элементов по п. 1 осуществляют методом совместного осаждения гидроксидов, при этом в качестве исходных реагентов выбирают соли In(NO3)3·5H2O, ZrO(NO3)2·2H2O, HfOCl2·6H2O, из которых приготавливают разбавленные водные растворы, после чего осаждение проводят гидроксидом аммония при интенсивном перемешивании с введением в раствор аммиака поверхностно-активного вещества, а образовавшиеся гелеобразные осадки отделяют от маточного раствора фильтрованием и подсушивают при 100°C, после чего осуществляют прокаливание полученных порошков при 300°C до их кристаллизации в кубической структуре In2O3, затем полученные компакты из синтезированных порошков прессуют под давлением 150 МПа и спекают на воздухе при температуре 1400°C в течение 2 ч со скоростью нагрева 350-400°C/ч.