Диамиды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот, способ их получения и экстракционная смесь на их основе
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к диамидам 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот, где R представляет собой радикал, выбранный из группы низший алкил или арил, содержащий 6 атомов углерода, а X представляет собой н-пентокси, хлор или фенил. Также изобретение относится к способу получения указанных диамидов дикарбоновых кислот, к промежуточному соединению - 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоте и способу его получения, экстракционной смеси на основе диамидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот. Технический результат: получены новые диамиды дикарбоновых кислот для использования в процессе извлечения и концентрирования радионуклидов. 5 н. и 1 з.п. ф-лы, 3 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к способу синтеза диамидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот и синтезу исходных 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот в качестве компонента экстракционных смесей для выделения актинидов из жидких радиоактивных отходов. Эти соединения получены впервые, и их синтез осуществлен с высокими выходами.
Предпосылки создания изобретения
В современных процессах ядерного топлива образуются радиоактивные отходы различного состава. Одной из наиболее сложных химических задач является отделение минорных актинидов (америций, кюрий) от сопутствующих продуктов деления - редкоземельных металлов (от лантана до тербия) и иттрия.
Один из способов выделения и разделения актинидов из радиоактивных отходов, представляющих высокорадиоактивные азотнокислые растворы, является процесс экстракции. Большинство экстрагентов, которые были предложены для отделения минорных актинидов от лантанидов, являются полиазотсодержащие гетероциклические соединения различной структуры (С. Hill Overview of Recent Advances in An(III)/Ln(III) Separation by Solvent Extraction, in "Ion Exchange and Solvent Extraction: A Series of Advances", V. 19, Editor: B.A. Moyer, pp 119- 193). Недостатком экстракционных систем на основе этих соединений является либо возможность их использования только в области низких концентраций азотной кислоты, либо невысокая химическая устойчивость, либо слабая растворимость в органических разбавителях, либо недостаточная селективность. Указанные недостатки препятствуют применению указанных экстракционных систем в радиохимической технологии.
Известны способы разделения лантанидов(Ш) и актинидов(Ш) с использованием экстрагентов, содержащих кислород амидной группы - диамиды органических соединений фосфора (Schulz, W.W.; Horwitz, Е.Р. TRUEX process and the management of liquid TRU waste. Sep. Sci. Technol. 1988, 23, (12-13), pp 1191-1210), малоновой кислоты (Sprjuth, L.4 Liljenzin J.-O.; Skalberg, M.; Hudson, M.N.; Chan, G. Y.S.; Drew, M.G.В.; Feaviour, M.; Iveson, P.B.; Madie, С. Extraction of actinides and lanthanides from nitric acid solution by malonamides. Radiochim. Acta. 1997, 78, 39-46) и гликолевой кислоты (Ansari. S.A.; Pathak, P.; Mochaparta, P.K.; Manchanda V.K. Chemistry of diglycolamides promising estractants for actinide partitioning. Chem. Rev. 2012, 112, 1751-1772). Они обладают высокими экстракционными характеристиками, но имеют низкие факторы разделения лантанидов и актинидов.
Известны способы получения экстракционных систем на основе диамидов пиридин-2,6-дикарбоновой кислоты, 2,2′-бипиридин-6,6′-дикарбоновой кислоты, моноамида фенантролин-2-карбоновой кислоты - эти системы обладают высокой устойчивостью к действию концентрированных растворов азотной кислоты и к высокоактивным излучениям (Д.О. Кирсанов, Н.Е. Борисова, М.Д. Решетова, А.В. Иванов, Л.А. Коротков, И.И. Елисеев, М.Ю. Аляпишев, И.Г. Спиридонов, А.В. Легин, Ю.Г. Власов, В.А. Бабаин. Известия РАН, 2012, №4, 877-885; M.Yu. Alyapyshev, V.A. Babain, L.I. Tkachenko, A. Paulenova, A.A. Popova, N.E. Borisova. New diamides of 2,2′-dipyridyl-6,6′-dicarboxylic acid for actinide-lanthanide separation. Solvent Extraction and Ion Exchange, 32, 138-152, 2014; Kobayashi, T., Yaita, T., Suzuki, S., Shiwaku, H., Okamoto, Y., Akutsu, K., Nakano, Y., Fujii, Y., 2010. Effect of the Introduction of Amide Oxygen into 1,10-Phenanthroline on the Extraction and Complexation of Trivalent Lanthanide in Acidic Condition. Sep. Sci. Technol. 45, 2431-2436) Экстракционные свойства указанных амидов зависят от заместителей при атоме азота амидной группы (алкила и арила) и от заместителей в фенильном кольце амидной группы. Однако используемые авторами Ο,Ν,Ν-донорные экстрагенты не всегда позволяют добиться достаточно высокой селективности.
Наиболее близким к данному изобретению является экстракционная система на основе диамидов 1,10-фенантролин-2,9-дикарбоновой кислоты, содержащая в качестве разбавителя мета-нитробензотрифторид (M.Yu. Alyapyshev, V.A. Babain, L.I. Tkachenko, A. Paulenova, A.A. Popova, N.E. Borisova. New diamides of 2,2′-dipyridyl-6,6′-dicarboxylic acid for actinide-lanthanide separation. Solvent Extraction and Ion Exchange, 32, 138-152, 2014), и система, содержащая кроме разбавителя мета-нитробензотрифторид в качестве липофильной добавки хлорид дикарболида кобальта
Для повышения селективности процесса экстракции предлагается использование диамидов 1,10-фенантролин-2,9-дикарбоновой кислоты, содержащих заместители в пиридиновых кольцах фенантролина
Сущность изобретения
Целью изобретения является создание диамидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот формулы
где R представляет собой радикал, выбранный из группы низший алкил или арил, содержащий 6 атомов углерода, а X представляет собой н-пентокси, хлор или фенил группы
для выделения актинидов из жидких радиоактивных отходов,
и синтез 4,7-н-пентокси-1,10-фенантролин-2,9-дикарбоновой кислоты для получения N,N′-диэтил-N,N′-дифенил-4,7-дипентокси-1,10-фенантролин-2,9-дикарбоксамида и N,N,N′,N′-тетраэтил-4,7-дипентокси-1,10-фенантролин-2,9-дикарбоксамида.
Кроме того, в изобретении представлен способ получения диамидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот, характеризующихся тем, что дизамещенные 1,10-фенантролин-2,9-дикарбоновые кислоты обрабатывают хлористым тионилом и соответствующими аминами и получают целевые продукты амиды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот.
Также представлен способ получения 1,10-фенантролин-2,9-дикарбоновых кислот, характеризующийся тем, что 4,7-дизамещенные 2,9-диметил-9,10-фенантролины окисляют двуокисью селена во влажном диоксане, а затем азотной кислотой, или хлорированием N-хлорсукцинимидом в присутствии перекиси бензоила.
Экстракционная смесь для выделения актинидов из жидких радиоактивных отходов, содержащая экстрагент в мета-нитробензотрифториде, отличающаяся тем, что в качестве нейтрального экстрагента используют диамиды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот в количестве 0,05-0,15 моль/л, и экстракционная смесь, дополнительно содержащая липофильную добавку хлорированный дикарболид кобальта (ХДК) в количестве 0,01-0,045 моль/л.
Изобретение представляет собой способ получения следующих соединений:
N,N′-диэтил-N,N′-дифенил-4,7-дипентокси-1,10-фенантролин-2,9-дикарбоксамид - формулы C40H46N4O4 и структуры:
N,N′-диэтил-N,N′,4,7-тетрафенил-1,10-фенантролин-2,9-дикарбоксамид - формулы C42H34N4O2 и структуры:
N,N,N′,N′-тетраэтил-4,7-дихлор-1,10-фенантролин-2,9-дикарбоксамид - формулы C22H24Cl2N4O2 и структуры:
N,N,N′,N′-тетраэтил-4,7-дипентокси-1,10-фенантролин-2,9-дикарбоксамид - формулы C32P46N4O4 и структуры:
Кроме того, поставленная цель достигается другим изобретением - получением 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты.
4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты - формулы C24H28N2O4 и структуры:
В способе получения амидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот согласно изобретению 4,7-дизамещенные 2,9-диметил-1,10-фенантролины обрабатывают двуокисью селена во влажном диоксане, а затем азотной кислотой, получают 4,7-дизамещенные 1,10-фенантролин-2,9-дикарбоновые кислоты, которые смешивают с хлористым тионилом, а затем с аминами и получают целевые продукты.
Для синтеза амидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот была предложена следующая схема:
Окислением двуокисью селена 4,7-дипентокси-2,9-диметил-1,10-фенантролинов 1 получен 4,7-ди-н-пентокси-1,10-фенантролин-2,9-дикарбальдегид, который был непосредственно введен в реакцию с азотной кислотой, приводящую к 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоте 2. На основе 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот 2, 3, 4 обработкой хлористым тионилом при кипячении в присутствии каталитических количеств диметилформамида получены хлорангидриды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот, которые были непосредственно введены в реакцию с вторичными аминами в тетрагидрофуране в присутствии триэтиламина, приводящую к ранее не описанным амидам 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот 5. Постадийный метод синтеза амидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот описан ниже.
Синтез 2,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (4, X=Ph). В одногорлую колбу, снабженную магнитной мешалкой и обратным холодильником, поместили 1,86 г (5,16 ммоль) 2,9-диметил-4,7-дифенил-1,10-фенантролина и 2,7 г (0,0243 моль) SeO2. Затем в колбу поместили 69 мл 1,4-диоксана и 3 мл воды. Реакционную массу кипятили в течение 3 часов. После этого растворитель удалили на роторном испарителе. К остатку прибавили 50 мл 46%-ной азотной кислоты, раствор кипятили 3 часа до прекращения выделения оксидов азота, после чего охладили до комнатной температуры и вылили на лед. Образовавшийся желтый осадок отфильтровали, промыли несколько раз водой, после чего высушили на воздухе, а затем в вакуум-эксикаторе над Р2О5. Выход в расчете на исходный 2,9-диметил-4,7-дифенил-1,10-фенантролин 94%. Вещество разлагается выше 300°С. Элементный анализ: вычислено для C26H17N3O7 (%) С 64,60, Н 3,54, N 8,69, найдено (%) С 64,75, Н 3,80, N 8,24. 1H ЯМР (ацетон-d6): δ=8,42 (с., 2Н), 8,11 (с., 2Н), 7,60-7,70 (м., 10Н). 13С ЯМР (ацетон-d6): δ=164,61, 150,77, 146,70, 144,82, 136,55, 129,43, 128,94, 128,68, 125,82, 123,30.
Синтез 2,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты (2). В одногорлую колбу, снабженную магнитной мешалкой и обратным холодильником, поместили 2 г (5,3 ммоль) 2,9-диметил-4,7-дипентокси-1,10-фенантролина и 2,9 г (0,0263 моль) SeO2. После этого в колбу поместили 74 мл 1,4-диоксана и 3 мл воды. Реакционную массу кипятили в течение 3 часов. Затем растворитель удалили на роторном испарителе. К остатку прибавили 50 мл 48%-ной азотной кислоты, раствор кипятили 3 часа до прекращения выделения оксидов азота, после чего охладили до комнатной температуры и вылили на лед. Образовавшийся желтый осадок отфильтровали, промыли несколько раз водой, после чего высушили на воздухе, а затем в вакуум-эксикаторе над Р2О5. Выход 1,19 г, 51% в расчете на исходный 2,9-диметил-4,7-дипентокси-1,10-фенантролин. Вещество разлагается выше 300°С. Элементный анализ: вычислено для C24H29N3O9 (%) С 57,25, Н 5,81, N 8,35, найдено (%) С 57,01 Н 5,80, N 8,12. 1Н NMR (DMSO-d6): δ=7.91 (с., 2Н), 8.32 (с., 2Н), 4.48-4.51 (м., 2Н), 1.44-1.56 (м., 16Н), 0.94-0.97 (м., 6Н). 13С NMR (DMSO-d6): δ=14.30, 22.26, 27.99, 28.31, 31.0, 104.99, 121.23, 122.47, 70.42, 164.24. ИК: 2931-2956 см-1 (δ, -СН2-, ср) 1736 см-1 (ν, С=O, ср) 1593 см-1 (ν, C-N, с) 1383 см-1 (δ, -СН2-, as, с) 708-880 см-1 (δ, С-Н в Ar, ср).
Синтез N,N′-диэтил-N,N′-дифенил диамида 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты (5 X=OC5H11, R=Ph). В одногорлую колбу, снабженную магнитной мешалкой, обратным холодильником и хлоркальциевой трубкой, поместили 1.63 г (3,7 ммоль) 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты (2), 25 мл SOCl2 и две капли сухого диметилформамида. Реакционную массу перемешивали в течение 8 часов, после чего избыток тионил хлорида отогнали в вакууме водоструйного насоса, а остаток высушили досуха. Раствор 8,14 ммоль N-этиланилина и 37 ммоль триэтиламина в 20 мл абсолютного тетрагидрофурана по каплям прибавили к остатку. Реакционную массу перемешивали при комнатной температуре в течение 12 часов. Затем реакционную массу смешали с водой и экстрагировали эфиром. Органические вытяжки промыли водой в делительной воронке, высушили над безводным сульфатом натрия и упарили. Остаток перетерли с петролейным эфиром, эфир декантировали, а осадок высушили в вакууме масляного насоса при температуре водяной бани 90-95°С. Выход 64%. Т.пл. = 65°С. Элементный анализ: вычислено для C40H47N5O7 (%) С 67,68, Н 6,67, N 9,87, найдено (%) С 67,85, Н 6,67, N 10,25. 1Н ЯМР (CDCl3): δ=8,26 (уш. с., 1H), 8,09 (уш. с., 1Н), 6,90-7,55 (м., 12 Н), 4,26 (уш. с., 4Н), 4,06 (уш. ув., 4Н), 1,90 (уш. кв., 4Н), 1,53 (м., 4Н), 1,43 (м., 10Н), 0,95 (уш. кв., 6Н). ИК (KBr): 1653 см-1 (с., ν С=O), 1595 см-1 (ср. с., ν C=N).
Синтез N,N′-диэтил-дифенилдиамида 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, X=R=Ph). В одногорлую колбу, снабженную магнитной мешалкой, обратным холодильником и хлоркальциевой трубкой, поместили 1.55 г (3,7 ммоль) 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (3 X=Ph), 25 мл SOCl2 и две капли сухого диметилформамида. Реакционную массу перемешивали в течение 8 часов, после чего избыток тионил хлорида отогнали в вакууме водоструйного насоса, а остаток высушили досуха. Раствор 8,14 ммоль N-этиланилина и 37 ммоль триэтиламина в 20 мл абсолютного тетрагидрофурана по каплям прибавили к остатку. Реакционную массу перемешивали при комнатной температуре в течение 12 часов. Затем реакционную массу смешали с водой и экстрагировали эфиром. Органические вытяжки промыли водой в делительной воронке, высушили над безводным сульфатом натрия и упарили. Остаток перетерли с петролейным эфиром, эфир декантировали, а осадок высушили в вакууме масляного насоса при температуре водяной бани 90-95°С. Выход 69%. 1Н ЯМР (CDCl3): δ=7,36-7.16 (м., 12Н), 4,14 (уш. кв., 4Н), 1,35 (уш. т., 3Н). 13С ЯМР (CDCl3): δ=12.44, 44.48, 122.65, 123.94, 126.30, 128.05, 128.46, 128.51, 128.89, 129.07, 136.72, 141.93, 145.02, 147.66, 152.97, 167.72
Синтез N,N,N′,N′-тетраэтилдиамида 4.7-дихлор-1,10-фенантролин-2,9-дикарбоновой кислоты (5 Х=Cl, R=Et). В одногорлую колбу, снабженную магнитной мешалкой, обратным холодильником и хлоркальциевой трубкой, поместили 1 г (3 ммоль) 4,7-дихлор-1,10-фенантролин-2,9-дикарбоновой кислоты, 10 мл SOCl2 и две капли сухого диметилформамида. Реакционную массу кипятили в течение 8 часов, после чего избыток тионил хлорида отогнали в вакууме водоструйного насоса, а остаток - черное твердое вещество - высушили досуха. Раствор 6,56 ммоль диэтиламина и 29,7 ммоль триэтиламина в 20 мл абсолютного хлористого метилена по каплям прибавили к черному остатку. Реакционную массу перемешивали при комнатной температуре в течение 12 часов. Затем реакционную массу смешали с водой и экстрагировали эфиром. Органические вытяжки промыли водой в делительной воронке, высушили над безводным сульфатом натрия и упарили. Остаток перетерли с петролейным эфиром, эфир декантировали, а осадок высушили в вакууме масляного насоса при температуре водяной бани 90-95°С. Выход 52%. 1Н ЯМР (CDCl3): δ=8,41 (с., 2Н), 8,13 (с., 2Н), 3,64 (уш. кв., 8Н), 1,33 (уш. т., 6Н).
Предлагаемые примеры иллюстрируют возможности применения экстрагента.
Пример 1
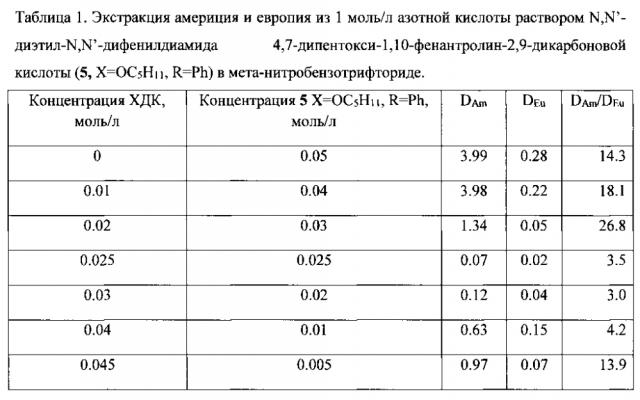
Раствор, содержащий 1 моль/л азотной кислоты, хлорированный дикарболид кобальта (ХДК), 10-4 моль/л нитрата европия и индикаторные количества америция-241 и европия-152, контактируют с раствором N,N′-диэтил-N,N′-дифенилдиамида 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты (5, Х=ОС5Н11, R=Ph) в мета-нитробензотрифториде. Фазы разделяют и определяют коэффициенты распределения металлов. Коэффициенты распределения приведены в таблице 1.
Пример 2
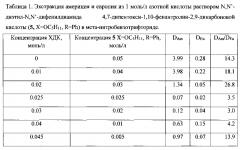
Раствор, содержащий азотную кислоту 10-4 моль/л нитрата европия и индикаторные количества америция-241 и европия -152, контактируют с раствором N,N′-диэтил-N,N′-дифенилдиамида 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, XR=Ph) в мета-нитробензотрифториде. Фазы разделяют и определяют коэффициенты распределения металлов. Коэффициенты распределения приведены в таблице 2.
Таблица 2. Экстракция америция и европия из азотной кислоты раствором N,N′-диэтил-N,N′-дифенилдиамида 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, X=R=Ph) в мета-нитробензотрифториде.
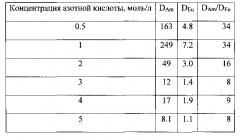
Пример 3
Раствор, содержащий 3 моль/л азотной кислоты, 10-4 моль/л нитрата европия и индикаторные количества америция-241, контактируют с раствором N,N′-диэтил-N,N′-дифенилдиамида 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, X=R=Ph) в мета-нитробензотрифториде. Фазы разделяют и определяют коэффициенты распределения металлов. Коэффициенты распределения приведены в таблице 3.
Таблица 3 - Экстракция америция (III) в зависимости от концентрации N,N′-диэтил-N,N′-дифенилдиамида 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, X=R=Ph). Органическая фаза N,N′-диэтил-N,N′-дифенилдиамид 4,7-дифенил-1,10-фенантролин-2,9-дикарбоновой кислоты (5, X=R=Ph) в мета-нитробензотрифториде
1. Диамиды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот формулы где R представляет собой радикал, выбранный из группы низший алкил или арил, содержащий 6 атомов углерода, а X представляет собой н-пентокси, хлор или фенил.
2. Способ получения диамидов 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот по п.1, характеризующийся тем, что соответствующие 4,7-дизамещенные 1,10-фенантролин-2,9-дикарбоновые кислоты обрабатывают хлористым тионилом и соответствующими аминами.
3. 4,7-Дипентокси-1,10-фенантролин-2,9-дикарбоновая кислота формулы
4. Способ получения 4,7-дипентокси-1,10-фенантролин-2,9-дикарбоновой кислоты по п.3, характеризующийся тем, что 4,7-дипентокси-2,9-диметил-1,10-фенантролин окисляют двуокисью селена во влажном диоксане.
5. Экстракционная смесь для выделения актинидов из жидких радиоактивных отходов, содержащая экстрагент в мета-нитробензотрифториде, отличающаяся тем, что в качестве нейтрального экстрагента используют диамиды 4,7-дизамещенных 1,10-фенантролин-2,9-дикарбоновых кислот по п.1 в количестве 0,05-0,15 моль/л.
6. Экстракционная смесь по п.5, дополнительно содержащая липофильную добавку хлорированный дикарболид кобальта в количестве 0,01-0,045 моль/л.