Способ получения 1-(7-метокси-3,7-диметил-2е-октен-1-ил)-2-метилбензимидазола
Иллюстрации
Показать всеИзобретение относится к способу получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола, включающему взаимодействие мирцена с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемое металлическим натрием, при 50-60°С; метоксилирование метанолом полученного N-геранилдиалкиламина при нагревании в присутствии 1,0-1,2 эквивалента H2SO4 или HClO4; кватернизирование этил- или метилйодидом образовавшегося N-(7-метокси-3,7-диметил-2E-октен-1-ил)диалкиламина и полученным йодидом N-(7-метокси-3,7-диметил-2E-октен-1-илил)триалкиламмония осуществляют аллилирование 2-метилбензимидазола при 68-72°С в присутствии гидрида натрия и палладиевого катализатора, в качестве которого используют Pd(dba)2. Технический результат: разработан экологически безопасный способ получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола. 5 пр.
Реферат
Изобретение относится к химии терпеновых соединений, точнее к способу получения бензимидазолилзамещенных терпенов, конкретно 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола формулы 1 (CAS №82682-53-9), представляющего собой широко применяемый экологически безопасный инсектицид.
Соединение 1 является известным препаратом, который обладает росторегулирующей активностью в отношении насекомых-вредителей и относится к экологически безопасным инсектицидам ювеноидного типа, применяемым для защиты растений. Соединение 1 производится компанией Angene International Limited (Китай).
Известно, что соединение 1 проявляет высокую инсектицидную активность в отношении домашних мух, в том числе линии Daisan Yumenoshima, устойчивой к фосфорорганическим инсектицидам (например, малатиону) (Kuwano Е., Sato N. Insecticidal Benzimidazoles with a Terpenoid Moiety. Agric. Biol. Chem., 1982, 46 (6), 1715-1716), а также в отношении зеленых рисовых цикадок Nephotettix cinticeps (Kuwano Е. Studies on Biologically Active Heterocyclic Compounds. J. Pestic. Sci., 1983, 8 (3), 395-403). Соединение 1 в низких дозах задерживает личиночную линьку В. mori (Kuwano Е. Studies on Biologically Active Heterocyclic Compounds. J. Pestic. Sci., 1983, 8 (3), 395-403). Оно испытывалось также против хлопковой тли (WO 2005108374) и почти полностью ингибировало выход сосновой древесной нематоды Bursaphelenchus xylophilus (одного из наиболее опасных вредителей хвойных) из яиц, тогда как метопрен и экдизон были неэффективны (Shuto Y., Kuwano Е. and Watanabe Н. New hatching test for the pine wood nematode and the inhibitory effect of benzimidazole derivatives. Agric. Biol. Chem., 1989, 53 (6), 1711-1712).
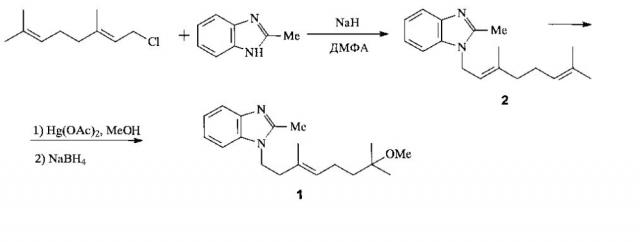
Известен трехстадийный способ получения соединения 1 [JPS 5921671 (A); Kuwano Е., Sato N. Insecticidal Benzimidazoles with a Terpenoid Moiety. Agric. Biol. Chem., 1982, 46 (6), 1715-1716] (схема 1).
Схема 1
Сначала по реакции геранилхлорида с 2-метилбензимидазолом в ДМФА в присутствии NaH получают 1-геранил-2-метилбензимидазол (2). Затем осуществляют метоксимеркурирование удаленной от бензимидазольного фрагмента двойной связи вещества 2 действием Hg(OAc)2 в MeOH. Последующее in situ демеркурирование NaBH4 в щелочном растворе приводит к соединению 1 (заявка JPS 5921671). Этот способ его получения принят в качестве прототипа.
Недостатками прототипа являются использование дорогостоящего геранилхлорида, обладающего сильным слезоточивым и раздражающим кожу и дыхательную систему действием, и высокотоксичного Hg(OAc)2, а также выделение металлической ртути в качестве отходов.
Задачей настоящего изобретения является разработка экологически безопасного технологичного способа получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола (1) из коммерчески доступного сырья.
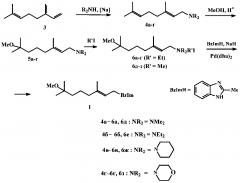
Задача решается предложенным способом получения соединения 1, базирующимся на N-аллилировании 2-метилбензимидазола терпениламмониевыми солями, катализируемом Pd(dba)2 (схема 2).
Схема 2
Заявляемый способ (схема 2) включает:
1) взаимодействие мирцена (3) с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемое металлическим натрием, при 50-60°C;
2) метоксилирование полученного N-(3,7-диметил-6E-октадиен-1-ил)диалкиламина (далее геранилдиалкиламина) 4а-г метанолом в присутствии 1,0-1,2 эквивалентов H2SO4 или HClO4 при нагревании, которое приводит к образованию соответствующего N-(7-метокси-3,7-диметил-2E-октен-1-ил)диалкиламина 5а-г;
3) кватернизацию полученного третичного амина 5а-г этил- или метилйодидом;
4) аллилирование 2-метилбензимидазола полученным йодидом N-(7-метокси-3,7-диметил-2E-октен-1-ил)триалкиламмония 6а-з в присутствии гидрида натрия и палладиевого катализатора, в качестве которого используют Pd(dba)2, при 68-72°C с образованием целевого продукта - 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола 1.
Заявляемый способ основан на использовании коммерчески доступного мирцена в качестве исходного вещества. Мирцен является нетоксичным соединением, которое выделяют из растительного сырья.
1. На первой стадии получают N-геранилдиалкиламины 4а-г реакцией мирцена (3) с диалкиламинами, такими как диметил- и диэтиламин, пиперидин и морфолин, без растворителя при 50-60°C в присутствии катализатора - металлического натрия с выходами 59-75% по описанным методикам [Chalk A.J. and Magennis S.A. A comparison of transition metal and non-transition metal oligomerizations of isoprene for the synthesis of terpenes. Annals New York Academy of Sciences, 1980, 333, 286-301; Takabe K., Katagiri Т., Tanaka J., Fujita Т., Watanabe S., Suga K. Addition of dialkylamines to myrcene: N,N-diethylgeranylamine. Organic Syntheses, 1989, 67, 44-46 (или 1993, Coll. Vol. 8, 188-190)].
2. На второй стадии метоксилированием полученных N-геранилдиалкиламинов 4а-г в метаноле в присутствии 1,0-1,2 эквивалента H2SO4 или HClO4 при 50-60°C в течение 17-27 ч получают: N-(7-метокси-3,7-диметил-2E-октен-1-ил)диметиламин (5а) с выходом 35 (в присутствии H2SO4) или 56% (в присутствии HClO4), N-(7-метокси-3,7-диметил-2E-октен-1-ил)диэтиламин (5б) с выходом 45 или 52% (в присутствии H2SO4 или HClO4 соответственно), N-(7-метокси-3,7-диметил-2E-октен-1-ил)пиперидин (5в) с выходом 18 или 70% (в присутствии H2SO4 или HClO4 соответственно), N-(7-метокси-3,7-диметил-2E-октен-1-ил)морфолин (5г) с выходом 18 или 59% (в присутствии H2SO4 или HClO4 соответственно).
3. На третьей стадии полученные N-(7-метокси-3,7-диметил-2E-октен-1-ил)-диалкиламины 5а-г подвергают кватернизации этил- или метилйодидом при 20-25°C и с практически количественным выходом получают соответствующие йодиды 6а-з.
4. На четвертой стадии проводят аллилирование 2-метилбензимидазола солями 6а-з в присутствии катализатора Pd(dba)2 при 67-72°C и получают с выходом более 90% 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазол (1). Мягкие условия реакции обеспечивают высокую изомерную чистоту целевого продукта.
Общий выход 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола (1) в расчете на исходный мирцен составляет 24-35%.
Техническим результатом изобретения является новый способ получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола (1) из доступного природного сырья (мирцена), исключающий использование токсичных реагентов и образование высокотоксичных отходов (ртути).
Заявляемый способ обладает следующими преимуществами:
- использует коммерчески доступное и экологически безопасное исходное соединение - мирцен, который выделяют из растительного сырья;
- не требует применения токсичных реагентов, таких как геранилхлорид и Hg(OAc)2, которые необходимы для осуществления способа-прототипа;
- при реализации способа не выделяются высокотоксичные отходы (ртуть);
- некоторые стадии можно проводить в отсутствие растворителей;
- все стадии способа осуществляют в мягких условиях - при комнатной температуре или 50-70°C и при атмосферном давлении.
Таким образом, предлагаемый способ получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола (1) является более технологичным, экономичным и безопасным с экологической точки зрения, чем прототип.
Авторы настоящего изобретения исследовали активность соединения 1 в биологических испытаниях на большом мучном хрущаке Tenebrio molitor L. - основном вредителе хлебных запасов в Российской Федерации. Соединение 1 было протестировано на активность ювенильных гормонов на куколках большого мучного хрущака лабораторной разводки Всероссийского научно-исследовательского института химических средств защиты растений. Ювеноидный эффект для каждой особи оценивали в баллах по 9-балльной шкале Шмиалека, отражающей различные степени морфогенетических нарушений в процессе превращения куколок во взрослых жуков. Показано, что соединение 1 обладает высокой ювеноидной активностью в 6,7 балла (относительная ошибка 9,2%).
Газожидкостную хроматографию, используемую для определения чистоты полученных соединений, выполняли на хроматографе ЛХМ-8МД (5) со стальной колонкой 2000×3 мм с 15% СКТФТ-50 на хроматоне N-AW, газ-носитель - гелий. Спектры ПМР регистрировали на приборах Bruker Avance-300 и -400 (растворитель CDCl3, внутренний стандарт ТМС). Хромато-масс-спектрометрический анализ выполняли на приборе Analytical VG 70-70E при 70 eV и температуре ионного источника 150°C.
Заявляемое изобретение иллюстрируется приведенными ниже примерами.
Получение соединения 1
Пример 1
1.1. N-геранилдиэтиламин (4б). Мелконарезанный металлический Na (0,142 г, 6,0 ммоль, 1,8 мол. %) добавляют в диэтиламин (35,5 мл, 0,344 моль) при комнатной температуре при перемешивании. Через 50 мин к полученной смеси прибавляют мирцен (3) (39,1 г, 0,287 моль) и нагревают при 53°C при перемешивании в атмосфере аргона в течение 18 ч. Реакционную смесь выливают в воду, экстрагируют бензолом, затем гексаном. Объединенные органические слои сушат Na2SO4. Растворители удаляют на роторном испарителе. Фракционная перегонка остатка в вакууме дает 36,7 г (61%) амина 4б с т. кип. 118-124°C/10 мм рт.ст.
1.2. N-(7-метокси-3,7-диметил-2E-октен-1-ил)диэтиламин (5б). Растворяют N-геранилдиэтиламин (4б) (40 г, 0,18 моль) в 150 мл MeOH и при 0°C прибавляют 24,5 мл (0,36 моль) 57%-ной HClO4. Реакционную смесь кипятят 7 дней, выливают в водный раствор КОН (pH=8,0-8,5), экстрагируют эфиром, экстракт сушат Na2SO4. Перегонкой в вакууме получают 25,1 г (52%) N-(7-метокси-3,7-диметил-2E-октен-1-ил)диэтиламина (5б) с т. кип. 135-140°C/10 мм рт.ст., n22 D=1,4620. Спектр ПМР, δ, м.д. (J, Гц): 1,03 м (6H, 2NCH3, J=6,8), 1,3 с (6H, 8CH3, 7aCH3), 1,38 м (4H, 5CH2, 6CH2), 1,78 с (3H, 3aCH3), 2,03 м (2H, 4CH2), 2,43 м (4H, 2NCH2, J=6,8), 2,98 д (2H, 1CH2, J=7,1), 3,2 с (3H, OCH3), 5,2 т (1H, 2CH, J=7,1). Найдено, %: C 74,72; H 12,95; N 5,97. C15H31NO. Вычислено, %: C 74,63; H 12,94; N 5,80.
1.3.1. Йодид N-(7-метокси-3,7-диметил-2E-октен-1-ил)диэтилметиламмония (6е). К 3,1 г (12,9 ммоль) амина 5б прибавляют 0,96 мл метилйодида (15,48 ммоль) в атмосфере аргона. Смесь выдерживают при 25°C в темноте 5 дней. Образовавшееся коричневое масло промывают гексаном методом декантации для удаления непрореагировавшего амина и избытка MeI. Получают 4,7 г (95%) соли 6е в виде вязкого масла. Спектр ПМР, δ, м.д. (J, Гц): 1,10 с, 1,11 с (6H, 8CH3, 7aCH3), 1,34-1,46 м (10H, NCH3, 5CH2, 6CH2), 1,85 с (3H, 3aCH3), 2,11 м (2H, 4CH2), 3,13 с (3H, OCH3), 3,14 с (3H, NCH3), 3,43-3,63 м (4H, NCH2), 4,07 д (2H, 1CH2, J=8,33), 5,26 т (1H, 2CH, J=8,33).
1.4. 1-(7-Метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазол (1). К соли 6е (3,8 г, 9,9 ммоль) присыпают 2-метилбензимидазол (1,31 г, 9,9 ммоль) и Pd(dba)2 (0,29 г, 0,50 ммоль, 5 мол. %) в атмосфере аргона. Смесь суспендируют в ТГФ (35 мл), добавляют ДМФА (1 мл) и NaH (0, 26 г, 10,9 ммоль). Гомогенную смесь кипятят в атмосфере аргона при перемешивании 52 ч. В результате получают винно-красный раствор с белым осадком. Раствор упаривают, остаток разбавляют водой и экстрагируют два раза эфиром. Органический слой сушат Na2SO4, упаривают на роторном испарителе, выпавший осадок (0,2 г, т. пл. 150-157°C) отфильтровывают и промывают гексаном. Маточник упаривают и получают оранжевое масло (2,8 г, 94%), которое очищают на колонке с силикагелем, элюент - диэтиловый эфир, чистоту продукта контролируют методом ТСХ. Спектр ПМР, δ, м.д. (J, Гц): 1,16 с (6H, 7aCH3, 8CH3), 1,30-1,45 м (4H, 5CH2, 6CH2), 1,92 с (3H, 3aCH3), 2,06 т (2H, 4CH2, J=6,28), 2,65 с (3H, 2′CH3), 3,19 с (3H, OCH3), 4,76 д (2H, 1CH2, J=6,39), 5,23 т (1H, 2CH, J=6,39), 7,31 м (3H, 3′CH, 4′CH, 5′CH), 7,74 т (1H, 6′CH, J=4,34). Масс-спектр, m/z (I/Imax): 300 (M+, 8,3), 285 (2), 281 (3,4), 268 (8,3), 253 (1,4), 227 (0,7), 212 (14,5), 199 (6,9), 185 (5,5), 157 (1,4), 146 (11,7), 132 (100), 117 (8,3), 105 (9), 95 (6,2), 91 (5,5), 85 (0,7), 81 (34), 77 (4,8), 73 (15,9), 69 (9), 55 (6,9), 44 (8,3), 41 (11,7), 32 (17,2).
1.3.2. Йодид N-(7-метокси-3,7-диметил-2E-октен-1-ил)триэтиламмония (6б). Смешивают 7 г (28,9 ммоль) амина 5б с 10 мл бензола, прибавляют 9 г (57,8 ммоль) этилйодида и оставляют в темноте при комнатной температуре. Через 3 дня образовавшийся белый осадок отфильтровывают, промывают пентаном. Получают 10,4 г (93%) соли 6б. Найдено, %: C 51,43; H 8,90; N 3,62. C17H36NOI. Вычислено, %: C 51,38; H 9,13; N 3,52.
Далее - как в примере 1.4.
Пример 2
2.1. N-геранилдиметиламин (4а) получают аналогично соединению 4б (пример 1, п. 1.1), используя 15,5 г (0,344 моль) диметиламина, конденсированного после отгонки из этанольного раствора. Выход амина 4а 30,7 г (59%), т. кип. 95-102°C/10 мм рт.ст.
2.2. N-(7-метокси-3,7-диметил-2E-октен-1-ил)диметиламин (5а) получают аналогично соединению 5б (пример 1, п. 1.2.), используя 32,6 г (0,18 моль) N-геранилдиметиламина (4а). Выход продукта 5а 21,5 г (56%), т. кип. 112-117°C/10 мм рт.ст. Найдено, %: C 72,99; H 12,67; N 6,95. C13H27NO. Вычислено, %: C 73,18; H 12,76; N 6,56.
2.3. Йодид N-(7-метокси-3,7-диметил-2E-октен-1-ил)триметиламмония (6д) получают, как описано в примере 1 (п. 1.3.1.).
2.4. 1-(7-Метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазол (1) получают из продукта 6д, как описано в примере 1, п. 1.4.
Пример 3
3.1. N-геранилпиперидин (4в) получают аналогично соединению 4б (пример 1, п. 1.1), используя 29,3 г (0,344 моль) пиперидина. Выход амина 4в 45,7 г (72%), т. кип. 112-116°C/1 мм рт.ст.
3.2. N-(7-метокси-3,7-диметил-2E-октен-1-ил)пиперидин (5в) получают аналогично соединению 5б (пример 1, п. 1.2), используя 39,8 г (0,18 моль) N-геранилпиперидина (4в). Выход амина 5в 23,7 г (52%), т. кип. 124-129°C/10 мм рт.ст. Найдено, %: C 75,93; H 12,20. C16H31NO. Вычислено, %: C 75,83; H 12.33.
3.3. Йодид N-(7-метокси-3,7-диметил-2E-октен-1-ил)-N-метилпиперидиния (6ж) получают аналогично соединению 6е, описанному в примере 1, п. 1.3.1.
3.4. 1-(7-Метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазол 1 получают из продукта 6ж, как описано в примере 1, п. 1.4.
Пример 4
4.1. N-геранилморфолин (4г) получают аналогично соединению 4б (пример 1, п. 1.1, используя 30,0 г (0,344 моль) морфолина. Выход амина 4г 48 г (75%), т. кип. 118-123°C/1 мм рт.ст.
4.2. N-(7-метокси-3,7-диметил-2E-октен-1-ил)морфолин (5г) получают аналогично соединению 5б (пример 1, п. 1.2), используя 40,2 г (0,18 моль) N-геранилморфолина (4г). Выход амина 5г 27,1 г (59%), т. кип. 141-147°C/1 мм рт.ст. Найдено, %: C 70,56; H 11,29; N 5,97. C15H29NO2. Вычислено, %: C 70,54; H 11,45; N 5,48.
Целевое соединение 1 получают из амина 5г (стадии 3 и 4) аналогично описанному в примере 1 (пункты 1.3.1 и 1.4).
Пример 5
Определение инсектицидной активности соединения 1. Инсектицидную активность определяли при нанесении на последний сегмент абдомена куколки через 0-6 ч после отрождения 0,3 мкл 1%-ного ацетонового раствора, содержащего 10000 мг соединения 1 в 1 л. Испытания проводили на двух сериях по 20 особей в каждой. Эффект оценивали при отрождении имаго по 9-балльной шкале Шмиалека (Schmialek P.Z. Naturforsch., 1963, Bd. 18B, Nr 7, S. 516). Оценку 0 приписывали куколке, дающей нормальный имаго, оценку 9 - куколке, не дающей имаго и не отличающейся от исходной куколки. Промежуточные оценки соответствовали степени морфогенетических нарушений в превращении куколок в имаго.
После изучения морфологических изменений каждой особи среднюю оценку N в баллах определяли по формуле:
N=(x1·1+x2·2+x3·3+…+xn·n)/A,
где 1, 2, 3, …, n - оценка в баллах от 0 до 9;
x1, x2, x3, …, xn - число куколок, получивших соответствующую оценку;
A - общее число куколок.
Абсолютную ошибку ΔN определяли по формуле:
ΔN=(x1|N-1|+x2|N-2|+…+xn|N-n|)/A.
В результате биологических испытаний соединение 1 в ацетоновом растворе в концентрации 10 г/л получило оценку влияния на активность ювенильного гормона, равную 6,7 балла (из 9 возможных), с относительной ошибкой 9,2%.
Способ получения 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазола, включающий аллилирование 2-метилбензимидазола, отличающийся тем, что:мирцен подвергают взаимодействию с диалкиламином, таким как диметиламин, диэтиламин, пиперидин, морфолин, катализируемому металлическим натрием, при 50-60°С;полученный N-геранилдиалкиламин метоксилируют метанолом при нагревании в присутствии 1,0-1,2 эквивалента H2SO4 или HClO4;образующийся N-(7-метокси-3,7-диметил-2E-октен-1-ил)диалкиламин кватернизируют этил- или метилйодидом;выделенным йодидом N-(7-метокси-3,7-диметил-2E-октен-1-илил)триалкиламмония осуществляют аллилирование 2-метилбензимидазола при 68-72°С в присутствии гидрида натрия и палладиевого катализатора, в качестве которого используют Pd(dba)2, получая целевой 1-(7-метокси-3,7-диметил-2E-октен-1-ил)-2-метилбензимидазол.