Постобработка медицинского устройства для регулирования морфологии и механических свойств
Иллюстрации
Показать всеИзобретение относится к медицине. Описан способ получения медицинского устройства с покрытием, в котором покрытие, содержащее терапевтический агент, диспергированный в полимерной или олигомерной матрице, наносят на внешнюю поверхность медицинского устройства. Затем покрытие подвергают постобработке с обеспечением селективного удаления значительной части полимерной или олигомерной матрицы из покрытия. Затем покрытие, прошедшее указанную последующую постобработку, стерилизуют. Способ осуществляет точную регулировку требуемого количества терапевтического агента, помещаемого на медицинское устройство. 19 з.п. ф-лы, 12 ил., 8 табл., 9 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает преимущество и приоритет на основании предварительной заявки на патент США №61/665758, поданной 28 июня 2012 г, полное содержание которой включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Варианты реализации настоящего изобретения относятся к области доставки медицинского терапевтического агента. Более конкретно, варианты реализации настоящего изобретения относятся к способам и устройствам, применяемым для локальной доставки терапевтических агентов к поверхности нормальных или пораженных просветов тела.
УРОВЕНЬ ТЕХНИКИ
[0003] Существует класс медицинских устройств, вводимых в тело с целью - полностью или частично - доставки терапевтического агента. Задача состоит либо в том, чтобы доставлять терапевтический агент локально по месту введения в тело, либо обеспечивать системное высвобождение терапевтического агента. В одном из вариантов реализации локальной доставки может быть желательно обеспечить быструю доставку терапевтического агента в ткань тела, как в случае с некоторыми терапевтическими агентами (лекарственными средствами) на баллонных катетерах с покрытием. В другом варианте реализации локальной доставки может быть желательно обеспечить замедленную доставку терапевтического агента в ткани тела в течение нескольких недель или месяцев, как в случае стентов, из которых высвобождается лекарственное средство.
[0004] В составах матрицы покрытия часто применяют полимеры или олигомеры, для того чтобы поместить в них лекарственное средство и регулировать перенос лекарственного средства в ткани. В случае профилей с длительным высвобождением лекарственного средства полимер может быть гидрофобным для предотвращения растворения в водной среде организма, и, таким образом, высвобождение лекарственного средства из матрицы с течением времени происходит посредством диффузии, подчиняющейся закону Фика. В случае профилей с кратковременным высвобождением лекарственного средства полимер может иметь гидрофильные свойства для быстрого частичного растворения или набухания в организме с обеспечением таким образом облегчения переноса лекарственного средства в ткань при контакте с физиологическими жидкостями за короткий период времени порядка секунд или минут.
[0005] Матрицу покрытия и лекарственное средство обычно наносят на медицинские устройства при помощи распыления или методом погружения с последующей сушкой. Затем указанное медицинское устройство с покрытием упаковывают и стерилизуют, для того чтобы убить микроорганизмы, которые могли остаться в процессе производства или упаковки.
[0006] Стерилизацию этиленоксидом (EtO) широко применяют для стерилизации медицинских и фармацевтических продуктов, которые не способны выдерживать высокие температуры при обычной стерилизации в автоклаве. Общепринятый трехфазный процесс стерилизации с применением EtO в общих чертах включает стадию предварительной обработки, стадию стерилизации и стадию аэрации. Стадия предварительной обработки обеспечивает условия по температуре и влажности для стимулирования выхода микроорганизмов из состояния покоя. На стадии стерилизации медицинское устройство подвергают действию газа EtO при конкретных температуре и давлении, для того чтобы убить микроорганизмы. На стадии аэрации удаляют газ EtO и позволяют газу EtO десорбироваться.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0007] На ФИГ. 1А-1В представлены виды сбоку в разрезе мандрена, вставленного в просвет проволочного направителя баллонного катетера в соответствии с одним из вариантов реализации настоящего изобретения.
[0008] На ФИГ. 2 представлен вид сбоку в разрезе баллонного катетера для предобработки плазмой в соответствии с одним из вариантов реализации настоящего изобретения.
[0009] На ФИГ. 3-4 представлено сочетание изометрического вида и вида в поперечном разрезе баллонного катетера при нанесении покрытия методом погружения в соответствии с одним из вариантов реализации настоящего изобретения.
[0010] На ФИГ. 5А-5В представлены виды сбоку покрытого оболочкой баллона в соответствии с одним из вариантов реализации настоящего изобретения.
[0011] На ФИГ. 6 представлен вид сверху баллонного катетера в оболочке в упаковке для стерилизации в соответствии с одним из вариантов реализации настоящего изобретения.
[0012] На ФИГ. 7 представлен профиль растворения как функция времени для количества нерастворенного паклитаксела в 50/50 метаноле/воде при 37°C в бане-шейкере в соответствии с одним из вариантов реализации настоящего изобретения.
[0013] На ФИГ. 8 представлено изображение, полученное методом сканирующей электронной микроскопии с энергодисперсионным анализом SEM EDX, иллюстрирующее содержание йода, в соответствии с одним из вариантов реализации настоящего изобретения.
[0014] На ФИГ. 9 представлена плотность лекарственного средства для различных размеров баллонов в соответствии с одним из вариантов реализации настоящего изобретения.
[0015] На ФИГ. 10 представлено массовое процентное отношение вспомогательного вещества для различных размеров баллонов в соответствии с одним из вариантов реализации настоящего изобретения.
[0016] На ФИГ. 11 представлены показатели приемлемости (AV) для однородности дозирования по содержанию в соответствии с USP <905> для различных размеров баллонов в соответствии с одним из вариантов реализации настоящего изобретения.
[0017] На ФИГ. 12А представлен вид сбоку в разрезе нераскрытого баллона баллонного катетера, покрытого втягиваемой оболочкой и введенного в просвет тела в соответствии с одним из вариантов реализации настоящего изобретения.
[0018] На ФИГ. 12В представлен вид сбоку в разрезе нераскрытого баллона баллонного катетера, прилегающего к области очага локальной доставки терапевтического агента в просвете тела в соответствии с одним из вариантов реализации настоящего изобретения.
[0019] На ФИГ. 12С представлен вид сбоку в разрезе раскрытого баллона баллонного катетера в области очага локальной доставки терапевтического агента в просвете тела в соответствии с одним из вариантов реализации настоящего изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0020] В вариантах реализации настоящего изобретения предложен способ получения медицинского устройства с покрытием, в котором покрытие наносят на внешнюю поверхность медицинского устройства и подвергают постобработке с обеспечением селективного удаления значительной части вспомогательного вещества (например, полимерной или олигомерной матрицы) из покрытия относительно терапевтического агента, диспергированного в покрытии. Таким образом, терапевтический агент, вспомогательное вещество и система растворителей с требуемой селективностью к вспомогательному веществу выбраны для точной и воспроизводимой регулировки требуемого количества терапевтического агента, помещаемого на медицинское устройство, при сохранении приемлемых механических характеристик, таким образом, что при клиническом применении функциональность покрытия не теряется.
[0021] Различные варианты реализации описаны в настоящем изобретении со ссылками на чертежи. Однако некоторые варианты реализации можно осуществлять на практике в отсутствии одной или большего количества из этих конкретных деталей или в сочетании с другими известными способами и конфигурациями. В последующем описании изложены многочисленные конкретные детали, например, конкретные конфигурации, составы и способы, и т.д., для обеспечения полного понимания настоящего изобретения. В других случаях хорошо известные способы и технологии производства не описаны в конкретных деталях, чтобы излишне не затруднять понимание настоящего изобретения. Указание в настоящем описании на “один из вариантов реализации” или “вариант реализации” означает, что конкретный признак, конфигурация, состав или характеристика, описанные в связи с вариантом реализации, включены по меньшей мере в один вариант реализации настоящего изобретения. Таким образом, встречающаяся фраза “в одном из вариантов реализации настоящего изобретения” или “вариант реализации” в различных местах настоящего описания не обязательно относится к одному и тому же варианту реализации изобретения. Кроме того, конкретные признаки, конфигурации, составы или характеристики могут быть скомбинированы любым подходящим образом в одном или большем количестве вариантов реализации.
[0022] В одном из вариантов реализации настоящего изобретения способ получения медицинского устройства с покрытием включает нанесение покрытия на внешнюю поверхность медицинского устройства. Данное свеженанесенное покрытие содержит терапевтический агент, диспергированный в матрице полимерного или олигомерного вспомогательного вещества для нанесения покрытия. Свеженанесенное покрытие затем подвергают постобработке с обеспечением селективного удаления значительной части вспомогательного вещества из покрытия относительно терапевтического агента. Затем указанное прошедшее постобработку медицинское устройство с покрытием стерилизуют.
[0023] В одном аспекте вариантов реализации настоящего изобретения описан способ контролируемого получения покрытия, в котором полимерное или олигомерное вспомогательное вещество содержится в растворе для покрытия, для нанесения требуемой дозы лекарственного средства на медицинское устройство при помощи покрытия методом погружения с последующим селективным удалением полимерного или олигомерного вспомогательного вещества в ходе постобработки. Конечное прошедшее постобработку и стерилизацию покрытие обеспечивает однородность дозирования в ткани с плотностью лекарственного средства (в настоящей заявке плотность лекарственного средства при накачивании до номинального внутреннего давления (NIP)) составляет 0,1-10 мкг/мм2 или, более конкретно, 0,7-3,0 мкг/мм2. В одном из вариантов реализации настоящего изобретения для конечного прошедшего постобработку и стерилизацию покрытия плотность лекарственного средства составляет приблизительно 2,0 мкг/мм2 ± 0,2 мкг/мм2.
[0024] В процессе нанесения покрытия полимерное или олигомерное вспомогательное вещество может обеспечивать вязкость раствора, необходимую для получения покрытия и загрузки лекарственного средства в покрытие. Образование влажной пленки или толщины покрытия представляет собой функцию вязкости раствора в степени 2/3. Соответственно, более высокая вязкость раствора обеспечивает большую толщину пленки, которая обеспечивает более высокую дозу лекарственного средства на единицу площади поверхности медицинского устройства. Было обнаружено, что плотность лекарственного средства более примерно 0,7 мкг/мм2 может потребоваться для обеспечения клинической эффективности при таких видах применения, как локальная доставка терапевтического агента для лечения или подавления рестеноза, и что для достижения плотности лекарственного средства в покрытии выше примерно 0,7 мкг/мм2 может потребоваться раствор для покрытия с содержанием более 30% по массе (и даже более 80% по массе) полимеров или олигомеров из нелетучих компонентов (т.е. не включая растворитель и включая лекарственное средство и вспомогательное вещество).
[0025] В одном из вариантов реализации настоящего изобретения постобработка включает погружение медицинского устройства, содержащего покрытие, в раствор на заданное количество времени, при заданной температуре и ориентации для регулирования селективного удаления вспомогательного вещества матрицы покрытия относительно терапевтического агента. В соответствии с вариантами реализации настоящего изобретения селективно удаляют значительно большие количества вспомогательного вещества матрицы покрытия по сравнению с количеством терапевтического агента (измерения проводят по суммарной массе вспомогательного вещества, удаленного в ходе постобработки, разделенной на суммарную массу терапевтического агента, удаленного в ходе постобработки). В одном из вариантов реализации настоящего изобретения селективное удаление составляет по меньшей мере 5 раз по количеству (например, в ходе постобработки удалено общее количество вспомогательных веществ 5 мкг по сравнению с 1 мкг терапевтического агента). В одном из вариантов реализации настоящего изобретения селективное удаление составляет по меньшей мере 10 раз по количеству или, более конкретно, по меньшей мере 20 раз суммарного вспомогательного вещества по сравнению с терапевтическим агентом. В одном из вариантов реализации настоящего изобретения селективное удаление составляет вплоть до 40 раз.
[0026] При увеличении селективности, также после постобработки увеличивается относительная доля терапевтического агента в композиции. В одном из вариантов реализации настоящего изобретения высушенное свеженанесенное покрытие характеризуется массовым отношением (D/E) количества терапевтического агента (лекарственного средства (D)) к общему количеству вспомогательного вещества (Е) от 20% (отношение 1/5) до 100% (отношение 1/1). В настоящем описании D в соотношении D/E включает все лекарственные средства (терапевтические агенты) в покрытии. В настоящем описании Е в соотношении D/E включает все вспомогательные вещества, такие как полимеры, олигомеры, вещества, способствующее проникновению, пластификаторы, воски, поверхностно-активные вещества и/или усилители растворимости лекарственных средств, интегрированные или диспергированные в матрице покрытия. В одном из вариантов реализации настоящего изобретения сухое свеженанесенное покрытие до постобработки содержит менее 50% по массе терапевтического агента, и сухое покрытие, прошедшее постобработку, содержит более 50% по массе терапевтического агента. Таким образом, количество терапевтического агента превращается из наименьшего количества в сухом свеженанесенном покрытии в преобладающее количество в сухом покрытии, прошедшем постобработку. В одном из вариантов реализации настоящего изобретения сухое свеженанесенное покрытие до постобработки содержит 35% или менее по массе терапевтического агента, и сухое покрытие, прошедшее постобработку, содержит 65% или более по массе терапевтического агента. В одном из вариантов реализации настоящего изобретения сухое покрытие, прошедшее постобработку, содержит 65%-75% по массе терапевтического агента и 25%-35% вспомогательного вещества.
[0027] Кроме того, при увеличении селективности количество терапевтического агента, удаленного в ходе постобработки может снижаться. В одном из вариантов реализации настоящего изобретения покрытие, прошедшее постобработку, характеризуется отношением D/E от 100% (отношение 1/1) до 9900% (отношение 99/1 или, более конкретно, от 100% до 600% (отношение 6/1). В одном из вариантов реализации настоящего изобретения в ходе постобработки из покрытия удаляют менее 10% по массе терапевтического агента, содержащегося в сухом свеженанесенном покрытии, при этом в ходе постобработки из покрытия селективно удаляют более 75% по массе вспомогательного вещества, содержащегося в сухом свеженанесенном покрытии. В одном из вариантов реализации настоящего изобретения в ходе постобработки из покрытия удаляют менее 15% по массе терапевтического агента, содержащегося в сухом свеженанесенном покрытии, при этом в ходе постобработки из покрытия селективно удаляют более 90% по массе вспомогательного вещества, содержащегося в сухом свеженанесенном покрытии.
[0028] В одном из вариантов реализации настоящего изобретения высушенное свеженанесенное покрытие характеризуется плотностью терапевтического агента (лекарственного средства) приблизительно 0,1-10,0 мкг/мм2 или, более конкретно, приблизительно 0,7-3,0 мкг/мм2. В одном из вариантов реализации настоящего изобретения прошедшее постобработку и стерилизацию покрытие характеризуется плотностью лекарственного средства 0,1-10 мкг/мм2 или, более конкретно, 0,7-3,0 мкг/мм2. В одном из вариантов реализации настоящего изобретения конечное прошедшее постобработку и стерилизацию покрытие характеризуется плотностью лекарственного средства приблизительно 2,0 мкг/мм2 ± 0,2 мкг/мм2.
[0029] Согласно одному из аспектов, в вариантах реализации настоящего изобретения описан способ контролируемого получения покрытия, в котором в раствор для покрытия включено полимерное или олигомерное вспомогательное вещество с гидрофильным свойствами для загрузки требуемой дозы по существу нерастворимого в воде лекарственного средства на медицинское устройство с последующим селективным удалением полимерного или олигомерного вспомогательного вещества в ходе постобработки с обеспечением сохранения механических свойств покрытия при проведении процедуры стерилизации. Было обнаружено, что на целостность покрытия может влиять цикл стерилизации с применением EtO, включая условия влажности в отношении покрытий, содержащих высокое количество гидрофильного полимерного или олигомерного вспомогательного вещества. Плохая целостность покрытия также наблюдалась в результате пластического разрушения покрытия при нагрузке путем сгибания или накачивания (например, при нанесении покрытия на баллон), что может привести к потере покрывающего материала в виде частиц, и, как следствие, лекарственного средства из устройства с покрытием, нарушая однородность дозирования и потенциальную эффективность. В дополнение к этому, если частицы образуются in vivo во время транспортировки к месту лечения, то это может привести клиническим последствиям, таким как эмболы.
[0030] Не желая ограничиваться какой-либо теорией, авторы полагают, что гидрофильное полимерное или олигомерное вспомогательное вещество абсорбирует влагу при контролируемых условиях температуры и влажности цикла стерилизации с применением EtO, что приводит к расширению гидрофильного полимера или олигомера из-за поглощения влаги. После сушки при последующем процессе стерилизации удаление поглощенной влаги может приводить к появлению пустот или концентрации напряжений в покрытии, ведущих к разложению покрытия и пластическому разрушению. Также предполагают, что при контролируемых условиях температуры и влажности цикла стерилизации с применением EtO некоторое количество полимерного или олигомерного вспомогательного вещества может утечь, и может произойти фазовое разделение по существу нерастворимого в воде лекарственного средства и гидрофильного полимерного или олигомерного вспомогательного вещества.
[0031] В одном из вариантов реализации настоящего изобретения матрицу покрытия, содержащую гидрофильное полимерное или олигомерное вспомогательное вещество и обладающую растворимостью в воде, селективно удаляют в ходе постобработки, при которой сухое свеженанесенное покрытие погружают в водный раствор для того, чтобы уменьшить или устранить уменьшение целостности покрытия, связанного с циклом стерилизации с применением EtO при контролируемых условиях температуры и влажности. Однако полного удаления гидрофильного полимера или олигомера не требуется. В одном из вариантов реализации настоящего изобретения конечное прошедшее постобработку покрытие сохраняет достаточное количество гидрофильного полимерного или олигомерного вспомогательного вещества, таким образом, матрица покрытия по-прежнему способна сохранять плотность лекарственного средства в гидрофильной среде, который может помочь в переносе по существу нерастворимого в воде терапевтического агента через пограничный слой между покрытием медицинского устройства и прилегающими тканями просвета тела in vivo.
[0032] Таким образом, в соответствии с вариантами реализации настоящего изобретения можно подобрать композицию свеженанесенного покрытия, включающую по существу нерастворимого в воде терапевтического агента и вспомогательного вещества, обладающего химическими характеристиками, такими как при выборе подходящей системы растворителей, вспомогательное вещество селективно удаляют с получением покрытия, прошедшего постобработку, содержащего плотность лекарственного средства, которая необходима для обеспечения клинической эффективности и подходящих механических характеристик, таких что функциональность покрытия не теряется во время клинического применения. В соответствии с вариантами реализации настоящего изобретения было показано, что в процессе нанесения покрытия, включая постобработку и стерилизацию, неоднократно получали покрытия с хорошими механическими свойствами с небольшим отслаиванием или без отслаивания и с хорошей однородностью покрытия всей поверхности устройства с точными плотностями лекарственных средств 0,1-10 мкг/мм2 ± 10% номинального значения или, более конкретно, 0,7-3,0 мкг/мм2 ± 10% номинального значения. В одном из вариантов реализации настоящего изобретения конечное прошедшее постобработку и стерилизацию покрытие характеризуется плотностью лекарственного средства приблизительно 2,0 мкг/мм2 ± 0,2 мкг/мм2.
[0033] В конкретных вариантах реализации настоящего изобретения и примерах, описанных в приведенном ниже описании, покрытия, содержащие по существу нерастворимый в воде терапевтический агент и полимерное или олигомерное вспомогательное вещество, обладающее растворимостью в воде, подвергают постобработке путем погружения в водный раствор. Следует понимать, что варианты реализации не ограничены, и что в других вариантах реализации постобработку можно выполнять в неводном растворе (таком как органический растворитель) или смесях воды/растворителей с целью обеспечения необходимых условий для селективного удаления из покрытия вспомогательных веществ по отношению к по существу нерастворимому в воде терапевтическому агенту. В других вариантах реализации постобработку выполняют на покрытии, содержащем растворимый в воде терапевтический агент и по существу нерастворимое в воде полимерное или олигомерное вспомогательное вещество, при этом покрытие погружают в растворитель с обеспечением селективного удаления по существу нерастворимого в воде полимерного или олигомерного вспомогательного вещества. Таким образом, в соответствии с вариантами реализации можно получить различные системы, в которых терапевтический агент, вспомогательное вещество и систему растворителей с требуемой селективностью к вспомогательному веществу выбирают для точного и воспроизводимого селективного удаления вспомогательного вещества и регулировки необходимого количества терапевтического агента, загружаемого на медицинское устройство.
[0034] В одном из вариантов реализации настоящего изобретения сухая свеженанесенная композиция для покрытия до постобработки и стерилизации и конечная композиция для покрытия после постобработки и стерилизации содержат по существу нерастворимый в воде терапевтический агент и одно или большее количество вспомогательных веществ. В одном из вариантов реализации настоящего изобретения по существу нерастворимый в воде терапевтический агент диспергирован в матрице из гидрофильного, все еще растворимого в растворителе, полимерного или олигомерного вспомогательного вещества. В одном из вариантов реализации настоящего изобретения растворимый в растворителе полимер означает, что растворитель или смесь растворителей составляет по меньшей мере 80% по массе органического растворителя, и возможно не более 20% по массе воды. Необязательно, дополнительные вспомогательные вещества могут представлять собой вещества, способствующее проникновению, пластификаторы, воски, поверхностно-активные вещества, и/или усилители растворимости лекарственных средств. В одном из вариантов реализации настоящего изобретения усилитель растворимости лекарственного средства представляет собой йод, который в покрытии ассоциирован с полимером или олигомером, и обеспечивает повышенную растворимость по существу нерастворимого в воде терапевтического агента в биологической среде на водной основе, как описано в патенте США №8128951. Йод может быть нековалентно связан с полимером или олигомером. Например, йод может быть в комплексе с полимером или олигомером.
[0035] В одном из вариантов реализации настоящего изобретения подходящие полимеры и олигомеры, которые можно включать в композицию для покрытия согласно настоящему изобретению, включают гидрофильные, но при этом растворимые в растворителе полимеры и олигомеры, включая, но не ограничиваясь ими, полиэтиленгликоль (ПЭГ), поливинилпирролидон (ПВП), гидроксипропилцеллюлозу (ГПЦ), метилцеллюлозу, гидроксипропилметилцеллюлозу или сополимеры N-винилпирролидона с другими реакционноспособными мономерами, содержащими двойную связь, такими как стирол, акриловая кислота, винилацетат и винилкапролактам. В некоторых вариантах реализации полимер может иметь молекулярную массу менее 20000 дальтон для обеспечения выведения почками.
[0036] В одном из вариантов реализации настоящего изобретения свежевысушенное покрытие содержит приблизительно 71% по массе ПЭГ 8000 дальтон и приблизительно 29% по массе паклитаксела, и указанное свеженанесенное покрытие характеризуется плотностью лекарственного средства 0,1-10 мкг/мм2, и более конкретно приблизительно 2-2,26 мкг/мм2. В одном из вариантов реализации настоящего изобретения свежевысушенное покрытие содержит приблизительно 68% по массе ПЭГ 8000 дальтон, приблизительно 29% по массе паклитаксела, и приблизительно 3% по массе йода, и свеженанесенное покрытие характеризуется плотностью лекарственного средства 0,1-10 мкг/мм2, и более конкретно приблизительно 2-2,26 мкг/мм2.
[0037] В одном из вариантов реализации настоящего изобретения подходящие полимерные и олигомерные вспомогательные вещества, которые можно включать в композицию для покрытия согласно настоящему изобретению, включают биоразлагаемые полимеры, такие как полимолочная кислота (ПМК), полигликолевая кислота (ПГК), сополимер молочной и гликолевой кислоты (PLGA), поликапролактон (ПКЛ) и его сополимеры, полиангидриды, полигидроксибутират, сополимер гидроксибутирата и валерата, полидиоксанон, сополимер гликолевой кислоты и триметиленкарбоната, полиаминокислоты, политриметиленкарбонат, полииминокарбонат, сополимеры простых и сложных эфиров (например, сополимер этиленоксида и гликолиевой кислоты ПЭО/ПГК), полиалкиленоксалаты, полифосфазены, полиортоэфиры и полиэфирамиды.
[0038] В одном из вариантов реализации настоящего изобретения подходящие биополимеры (которые обычно имеют некоторые гидрофильные свойства) включают фибрин, фибриноген, гиалуроновую кислоту, хитин, хитозан, альгинат, сульфатированные полисахариды, такие как гликозаминогликаны хондроитин-4-сульфат, хондроитин-6-сульфат, дерматансульфат, кератансульфат, гепарин, гепарансульфат. Другие примеры представляют собой синдекан, глипикан, крахмал, зеин, коллаген, желатин, гликоген и кератины. Подходящие биополимеры могут также включать производные целлюлозы, такие как метилцеллюлозу, гидроксипропилцеллюлозу (ГПЦ), гидроксипропилметилцеллюлозу (ГПМЦ), карбоксиметилцеллюлозу (КМЦ) и этилцеллюлозу.
[0039] В одном из вариантов реализации настоящего изобретения можно применять синтетические неразлагаемые полимеры, некоторые из которых могут быть гидрофильными или гидрофобными в зависимости от конкретной мономерной композиции, такие как акрилатный полимер/сополимеры, акрилаткарбоксил и/или гидроксил и/или сополимеры сложных эфиров. Например, полиакриловая кислота и полигидроксиэтилметакрилат (ГЭМА) являются гидрофильными, в то время как поли-н-бутилметакрилат (ПБМА) является гидрофобным. Также подходят блоксополимеры, состоящие из ПЭГ-ПЭТ или ПЭГ-ПБТ; чем выше содержание ПЭГ, тем более гидрофильный сополимер. В одном из вариантов реализации настоящего изобретения подходящие гидрофильные полимеры включают поливинилпирролидон (ПВП), поливинилпирролидон/винилацетат сополимер (PVPNA), полиэтиленгликоль, полиэтиленоксид, ПВС (поливиниловый спирт) и поливинилпиридиновые сополимеры. В одном из вариантов реализации настоящего изобретения подходящие гидрофобные полимеры включают сополимер олефина и акриловой кислоты, сополимер этилена и акриловой кислоты, полиамидные полимеры/сополимеры, полиимидные полимеры/сополимеры, сополимер этилена и винилацетата, сополимер этилена и винилового спирта (EVAL), полисульфоны, полиэфирсульфоны, полиуретаны (например, продаваемый под зарегистрированным товарным знаком PELLETHANE, и продаваемый под зарегистрированным товарным знаком TECOFLEX), поликарбонат, сложные полиэфиры, полиэтилентерефталат (ПЭТ), полибутилентерефталат (ПБТ), блоксополимеры, состоящие из ПЭГ-ПЭТ или ПЭГ-ПБТ. Дополнительные гидрофобные синтетические неразлагаемые полимеры включают поливинилхлорид и его сополимеры, ПВА (поливинилацетат), стирол-этилен/бутилен-стирольные блоксополимеры (Kraton G, например, продаваемый под зарегистрированным товарным знаком KRATON), стирол-полидиен-стирольные блоксополимеры (Kraton D, например, продаваемый под зарегистрированным товарным знаком KRATON). Дополнительные гидрофобные синтетические неразлагаемые полимеры включают поливинилиденфторид и его сополимеры (например, продаваемый под зарегистрированным товарным знаком KYNAR, и продаваемый под зарегистрированным товарным знаком SOLEF).
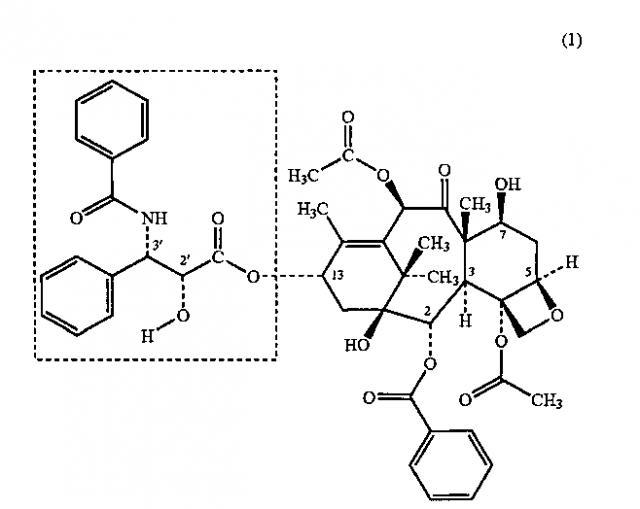
[0040] В одном аспекте вариантов реализации настоящего изобретения предложен по существу нерастворимый в воде терапевтический агент для лечения различных заболеваний, которые возникают в стенках просвета тела. Терапевтические агенты, подходящие для применения в соответствии с настоящим изобретением, можно применять по отдельности или в комбинации. Некоторые варианты реализации настоящего изобретения относятся к способу нанесения композиции покрытия на медицинское устройство, содержащей таксановый терапевтический агент, такой как паклитаксел. Таксаны в целом, и паклитаксел в частности, представляют собой таксановые терапевтические соединения, которые, как полагают, выполняют функцию ингибиторов клеточного цикла, выступая в качестве агента, оказывающего воздействие на микротрубочки, и более конкретно в качестве стабилизатора. В настоящем описании термин “паклитаксел” относится к соединению с химической структурой (1), показанной ниже, состоящей из коровой структуры с четырьмя конденсированными кольцами (“коровая таксановая структура”, затенена на структуре (1)), с несколькими заместителями.
[0041] Другие аналоги таксана или производные соединения характеризуются изменением структуры паклитаксела (1). В предпочтительных аналогах таксана и коровых производных изменяются заместители, присоединенные к коровой таксановой структуре. В одном из вариантов реализации настоящего изобретения терапевтический агент представляет собой аналог таксана или его производное, содержащий коровую таксановую структуру (1) и метил-3-(бензамидо)-2-гидрокси-3-фенилпропаноатный фрагмент (показан на ниже на структуре (2)) в 13 положении углерода (“С13”) коровой таксановой структуры (обведен пунктирной линией на структуре (1)).
[0042] Предполагают, что структура (2) в 13 положении углерода коровой таксановой структуры играет важную роль в биологической активности молекулы как ингибитора клеточного цикла. Примеры терапевтических агентов, имеющих структуру (2), включают паклитаксел (статья справочника Мерк 7117), доцетаксол (TAXOTERE, статья справочника Мерк 3458) и 3′-дезоксифенил-3′-(4-нитрофенил)-N-дебензоил-N-(трет-бутоксикарбонил)-10-деацетилтаксол.
[0043] Типичные примеры производных паклитаксела или аналогов, которые можно применять в качестве терапевтических агентов, включают 7-дезокси-доцетаксол, 7,8-циклопропатаксаны, N-замещенные 2-азетидоны, 6,7-эпоксипаклитакселы, 6,7-модифицированные паклитакселы, 10-дезацетокситаксол, 10-деацетилтаксол (из 10-деацетилбаккатина III), фосфонокси и карбонатные производные таксола, 2',7-ди-натрия 1,2-бензолдикарбоксилат таксола, 10-дезацетокси-11,12-дигидротаксол-10,12(18)-диеновые производные, 10-дезацетокситаксол, Протаксол (2′-и/или 7-О-сложноэфирные производные), 2′-и/или 7-О-карбонатные производные, боковые цепи асимметричного синтеза таксола, фтортаксолы, 9-дезоксотаксан, 13-ацетил-9-дезоксобаккатин III, 9-дезоксотаксол, 7-дезокси-9-дезоксотаксол, 10-дезацетокси-7-дезокси-9-дезоксотаксол, производные, содержащие водород или ацетильную группу и гидрокси и трет-бутоксикарбониламино, сульфированный 2′-акрилоилтаксол и сульфированные 2′-О-ацилированные производные таксола, сукцинилтаксол, 2′-γ-аминобутирилатаксолформиат, 2′-ацетилтаксол, 7-ацетилтаксол, 7-глицинкарбаматтаксол, 2′-ОН-7-ПЭГ (5000) карбаматтаксол, 2′-бензоил и 2′,7-дибензоил производные таксола, другие пролекарства (2′-ацетилтаксол; 2′,7-диацетилтаксол; 2′-сукцинилтаксол; 2′-(бета-аланил)-таксол); 2′-гамма-аминобутирилатаксолформиат; этиленгликолиевые производные 2′-сукцинилтаксола; 2′-глутарилтаксол; 2′-(N,N-диметилглицил)-таксол; 2′-(2-(N,N-диметиламино)пропионил)таксол; 2′-ортокарбоксибензилтаксол; 2′-алифатической карбоновой кислоты производные таксола, пролекарства {2′-(N,N-диэтиламинопропионил)-таксол, 2′-(N,N-диметилглицил)-таксол, 7-(N,N-диметилглицил)-таксол, 2′,7-ди-(N,N-диметилглицил)-таксол, 7-(N,N-диэтиламинопропионил)-таксол, 2′,7-ди-(N,N-диэтиламинопропионил)-таксол, 2′-(L-глицил)-таксол, 7-(L-глицил)-таксол, 2′,7-ди-(L-глицил)-таксол, 2′-(L-аланил)-таксол, 7-(L-аланил)-таксол, 2′,7-ди-(L-аланил)-таксол, 2′-(L-лейцил)таксол, 7-(L-лейцил)таксол, 2′,7-ди-(L-лейцил)таксол, 2′-(L-изолейцил)таксол, 7-(L-изолейцил)таксол, 2′,7-ди-(L-изолейцил)таксол, 2′-(L-валил)таксол, 7-(L-валил)таксол, 2′7-ди-(L-валил)таксол, 2′-(L-фенилаланил)-таксол, 7-(L-фенилаланил)-таксол, 2′,7-ди-(L-фенилаланил)-таксол, 2′-(L-пролил)таксол, 7-(L-пролил)таксол, 2′,7-ди-(L-пролил)таксол, 2′-(L-лизил)таксол, 7-(L-лизил)таксол, 2′,7-ди-(L-лизил)таксол, 2′-(L-глутамил)таксол, 7-(L-глутамил)таксол, 2′,7-ди-(L-глутамил)таксол, 2′-(L-аргинил)таксол, 7-(L-аргинил)таксол, 2′,7-ди-(L-аргинил)таксол}, аналоги таксола с модифицированными фенилизосериновыми боковыми цепями, (N-дебензоил-N-трет-(бутоксикарбонил)-10-деацетилтаксол, и таксаны (например, баккатин III, цефаломаннин, 10-деацетилбаккатин III, бревифолиол (brevifoliol), юнантаксусин (yunantaxusin) и таксусин (taxusin)); и другие аналоги и производные таксана, включая 14-бета-гидрокси-10 деацетибаккатин III, дибензоил-2-ацилпроизводные паклитаксела, бензоатные производные паклитаксела, фосфонокси и карбонатные производные паклитаксела, сульфированный 2'-акрилоилтаксол; сульфированные 2′-O- ацилированные производные паклитаксела, замещенные в 18 положении производные паклитаксела, хлорированные аналоги паклитаксела, С4 метоксиэфирные производные паклитаксела, сульфонамидные производные таксана, бромированные аналоги паклитаксела, производные таксана по Жирару, нитрофенил паклитаксел, 10-деацетилированные замещенные производные паклитаксела, 14-бета-гидрокси-10 деацетилбаккатин III производные таксана, С7 производные таксана, С10 производные таксана, 2-дебензоил-2-ацил производные таксана, 2-дибензоил и -2-ацил производные паклитаксела, аналоги таксана и баккатина III, несущие новые С2 и С4 функциональные группы, n-ацильные аналоги паклитаксела, 10-деацетилбаккатин III и 7-защищенные производные 10-деацетилбаккатина III из 10-деацетилтаксола А, 10-деацетилтаксол В, и 10-деацетилтаксол, бензоатные производные таксола, 2-ароил-4-ацильные аналоги паклитаксела, орто-сложноэфирные аналоги паклитаксела, 2-ароил-4-ацильные аналоги паклитаксела и 1-дезоксипаклитаксел и аналоги 1-дезоксипаклитаксела.
[0044] Композиция, содержащая соединение таксана, может включать составы, пролекарства, аналоги и производные паклитаксела, такие как, например, TAXOL (Bristol Myers Squibb, Нью-Йорк, штат Нью-Йорк), доцетаксел, 10-дезацетильные аналоги паклитаксела и 3′-N-дезбензоил-3′-трет-бутоксикарбонильные аналоги паклитаксела. Паклитаксел имеет молекулярную массу около 853 атомных единиц массы и его можно легко получить с применением способов, известных специалистам в данной области техники (смотри, например, Schiff et al., Nature 277: 665-667, 1979; Long and Fairchild, Cancer Research 54: 4355-4361, 1994; Ringel and Horwitz, J. Nat′l Cancer Inst. 83 (4): 288-291, 1991; Pazdur et al., Cancer Treat. Rev. 19 (4): 351-386, 1993; WO 94/0788